Ett fel kan uppstå så defibrilleringsknappen inte aktiveras och defibrilleringen fördröjs eller förhindras
|
|
|
- Gun Berg
- för 8 år sedan
- Visningar:
Transkript
1 Cardiac Care Emergency Care Solutions -1/5- FSN A 2010 JANUARI BRÅDSKANDE återkallande av medicinsk utrustning Philips återanvändbara interna defibrilleringsspatlar med defibrilleringsknapp (Produktnummer M4741A, M4742A, M4743A och M4744A) Ett fel kan uppstå så defibrilleringsknappen inte aktiveras och defibrilleringen fördröjs eller förhindras Bästa kund, Ett problem har upptäckts för Philips återanvändbara interna defibrilleringsspatlar med defibrilleringsknapp (produktnummer M4741A, M4742A, M4743A och M4744A) som är tillverkade mellan 1 september och 30 december 2008, och som, om det inträffar, kan fördröja eller förhindra tillförsel av defibrilleringsenergi och på så sätt innebära en risk för patienter som behöver omedelbar hjärtdefibrillering, t. ex. under eller efter öppenkirurgiska ingrepp eller vid återupplivning efter trauma. Det här säkerhetsmeddelandet är avsett att informera om: vad problemet är och under vilka omständigheter det kan inträffa vilka åtgärder som bör vidtas av kunden/användaren för att minska risker för patienter/vårdgivare vilka åtgärder Philips planerar för att ta itu med problemet. Det här dokumentet innehåller viktig information om fortsatt säker och korrekt användning av din utrustning Gå igenom följande information tillsammans med alla anställda som behöver känna till innehållet i det här meddelandet. Det är viktigt att förstå innebörden i meddelandet. Spara en kopia tillsammans med utrustningens bruksanvisning. Defibrilleringsknappen på handtaget på berörda enheter kan fastna så att den inte aktiveras och defibrillering förhindras. Det här beror på ett tillverkningsfel i defibrilleringsknappen. Endast enheter som tillverkats mellan 1 september och 30 december 2008 berörs. Felet har åtgärdats och gäller inte spatlar som tillverkats utanför det angivna datumintervallet. Philips kommer kostnadsfritt att byta ut alla enheter som tillverkats inom det angivna datumintervallet för att utesluta möjligheten att det här problemet påverkar patientvården. Läs det bifogade säkerhetsmeddelandet som innehåller information om hur berörda enheter kan identifieras och instruktioner om åtgärder som bör vidtas. Följ anvisningarna i avsnittet ÅTGÄRDER SOM BÖR VIDTAS AV KUNDEN/ANVÄNDAREN i meddelandet. 1
2 Cardiac Care Emergency Care Solutions -2/5- FSN A 2010 JANUARI Om du har några frågor eller funderingar om korrigeringen kan du kontakta din lokala Philipsrepresentant: Philips Healthcare Telefon: Fax: Det här meddelandet har rapporterats till lämpliga myndigheter. Philips beklagar de eventuella besvär som det här problemet orsakar. Det är av största vikt för oss att medicinsk utrustning, tillbehör och dokumentation är av högsta kvalitet. Det är mycket betydelsefullt för oss att du är nöjd med Philips produkter och med vårt sätt att lösa det här problemet. Med vänlig hälsning, John Cadigan General Manager, Emergency Care Solutions Cardiac Care Bilagor 2
3 Cardiac Care Emergency Care Solutions -3/5- FSN A 2010 JANUARI BERÖRDA PRODUKTER Säkerhetsmeddelande Produkt: Philips återanvändbara interna defibrilleringsspatlar med defibrilleringsknapp, (produktnummer M4741A, M4742A, M4743A och M4744A) Berörda enheter: Enheter från Philips som tillverkats mellan 1 september och 30 december Tillverkad av: Philips Healthcare, 3000 Minuteman Road, Andover, MA, PROBLEMBESKRIVNING Defibrilleringsknappen på handtaget på berörda enheter kan fastna så att den inte aktiveras och defibrillering förhindras. Det här beror på ett tillverkningsfel i defibrilleringsknappen. RISKER SÅ HÄR IDENTIFIERAS BERÖRDA PRODUKTER Under öppenkirurgiska ingrepp eller vid återupplivning efter trauma används de interna spatlarna med defibrilleringsknapp manuellt för direkt defibrillering till myokardiet. Om defibrilleringsknappen fastnar eller inte kan återställas kan defibrilleringen förhindras eller bli fördröjd, speciellt om det inte finns någon reservuppsättning av spatlar tillgänglig. Enheter med datumkoden (mmåå) 0908, 1008, 1108 eller 1208 (enheter som tillverkats mellan 1 september och 30 december 2008) Du identifierar berörda produkter genom att kontrollera datumkoden i cirkeln på något av spatelhandtagen närmast kabeln. År 2008 representeras av: 0 8 och pilen pekar på tillverkningsmånaden, 09, 10, 11 eller 12. September 2008 Oktober 2008 November 2008 December
4 Cardiac Care Emergency Care Solutions -4/5- FSN A 2010 JANUARI ÅTGÄRDER SOM BÖR VIDTAS AV KUNDEN/ANVÄNDAREN Kontrollera omedelbart datumkoden på alla återanvändbara interna defibrilleringsspatlar med defibrilleringsknapp och ta berörda produkter ur bruk. Enheter som tillverkats utanför det här tidsintervallet (d.v.s. före 1 september 2008 och efter 30 december 2008) berörs inte och kan fortsätta användas. Fyll i och spara registreringsformuläret nedan för interna spatlar med defibrilleringsknapp. Det ska du använda när du lämnar uppgifter till Philips om de interna defibrilleringsspatlar med defibrilleringsknapp som du äger av dem i avsnittet Berörda produkter ovan. Kassera inte berörda spatlar. En representant för Philips Healthcare kommer att kontakta dig med frågor om antal, produktnummertyp och datumkod (infört i registreringsformuläret) och boka tid för byte av berörda spatlar. Enligt bruksanvisningen bör spatlarna kontrolleras före användning. Se till att följande utförs: - mekanisk kontroll före varje användning - driftskontroll före varje användning - kontinuitetskontroll var tredje månad. ÅTGÄRDER PLANERADE AV PHILIPS VIDARE INFORMATION OCH STÖD Philips påbörjar på eget initiativ borttagning och kostnadsfritt byte av alla berörda interna spatlar. Philips kommer att kontakta kunder för att få del av information på registreringsformuläret och boka leverans av utbytesspatlar samt ge kunder information om vart och hur de skickar tillbaka berörda spatlar till Philips. Om du behöver ytterligare information eller stöd i den här frågan kan du kontakta din lokala representant för Philips Philips Healthcare Telefon: Fax: sto.servicecenter@philips.com 4
5 Cardiac Care Emergency Care Solutions -5/5- FSN A 2010 JANUARI Registreringsformulär för interna spatlar med defibrilleringsknapp Fyll i och spara Det här formuläret ska användas på din arbetsplats till att upprätta en förteckning över berörda spatlar så att Philips Healthcare kan informeras om antal, modell och datumkod på de interna spatlarna med defibrilleringsknapp som omfattas av säkerhetsmeddelandet (FSN A). Det här säkerhetsmeddelandet återkallar bara vissa interna spatlar med defibrilleringsknapp som tillverkats mellan 1 september 2008 och 30 december 2008 med defekt defibrilleringsknapp. Läs instruktionerna i meddelandet och ange nedan antalet berörda interna spatlar med defibrilleringsknapp som finns i lager. Om ingen av dina interna spatlar med defibrilleringsknapp berörs (d.v.s. du har ingen av de modeller som anges i säkerhetsmeddelandet, som är tillverkade mellan 2008/09/01 och 2008/12/30), anger du det i det tomma fältet nedan. En representant för Philips Healthcare kommer att kontakta dig med frågor om antal, typ och datumkod och boka tid för byte av berörda spatlar. Vi har inspekterat våra produkter enligt instruktionerna i säkerhetsmeddelandet, och vi har följande berörda interna spatlar med defibrilleringsknapp Produktnummer M4741A M4742A M4743A M4744A Diameter 7, 5 cm (3,0 tum) vuxen 6,0 cm (2,4 tum) vuxen 4,5 cm (1,8 tum) barn 2,8 cm (1,1 tum) spädbarn Antal berörda interna spatlar med defibrilleringsknapp som tagits ur bruk och måste bytas ut Vi har inspekterat våra produkter enligt instruktionerna i säkerhetsmeddelandet, och vi har inte någon av de berörda interna spatlarna med defibrilleringsknapp Obs! Philips Healthcare kommer att byta ut spatlarna enligt principen 1 mot 1 till spatlar med en fungerande defibrilleringsknapp och endast byta berörda produkter. När kunden tagit emot de nya interna spatlarna med defibrilleringsknapp kommer en representant för Philips Healthcare att förstöra de defekta spatlarna. 5
BRÅDSKANDE - Korrigering av medicinsk utrustning Philips HeartStart MRx-monitor/defibrillator
 Philips Healthcare - 1/5 - FSN86100123A Bästa kund, Det här är en information från Philips Healthcare angående en produktkorrigering gällande ett problem som uppstår när används för synkroniserad elkonvertering.
Philips Healthcare - 1/5 - FSN86100123A Bästa kund, Det här är en information från Philips Healthcare angående en produktkorrigering gällande ett problem som uppstår när används för synkroniserad elkonvertering.
BRÅDSKANDE - Återkallande av medicinsk utrustning
 Patient Monitoring -1/5- BRÅDSKANDE - Återkallande av medicinsk utrustning Bästa kund, Philips Microstream M1923A FilterLine H- och 989803159581 Vitaline H-satser för spädbarn/neonatal Tillverkaren av
Patient Monitoring -1/5- BRÅDSKANDE - Återkallande av medicinsk utrustning Bästa kund, Philips Microstream M1923A FilterLine H- och 989803159581 Vitaline H-satser för spädbarn/neonatal Tillverkaren av
VIKTIGT säkerhetsmeddelande Korrigering av medicinsk utrustning IntelliVue MX40 saknade varningar i bruksanvisning
 Bästa kund, Vi har upptäckt ett problem med bruksanvisningen till Philips IntelliVue MX40 för programvaruversionerna B.05, B.06 och B.06.5X. Din IntelliVue MX40 är fortfarande säker att använda. De här
Bästa kund, Vi har upptäckt ett problem med bruksanvisningen till Philips IntelliVue MX40 för programvaruversionerna B.05, B.06 och B.06.5X. Din IntelliVue MX40 är fortfarande säker att använda. De här
BRÅDSKANDE - Korrigering av medicinsk utrustning
 Patient Monitoring -1/6- FSN86201401A 09 november Bästa kund, Ett problem har upptäckts med produkterna (PIIC) och Philips IntelliVue-informationscentral ix (PIIC ix) vilket, om det skulle inträffa, kan
Patient Monitoring -1/6- FSN86201401A 09 november Bästa kund, Ett problem har upptäckts med produkterna (PIIC) och Philips IntelliVue-informationscentral ix (PIIC ix) vilket, om det skulle inträffa, kan
BRÅDSKANDE Säkerhetsmeddelande
 Connected Care Solutions -1/5- FSN86201639, FSN86201640 BRÅDSKANDE Bästa kund, Ett problem har upptäckts med Philips IntelliVue-informationscentral ix (PIIC ix) som kan innebära en risk för patienter om
Connected Care Solutions -1/5- FSN86201639, FSN86201640 BRÅDSKANDE Bästa kund, Ett problem har upptäckts med Philips IntelliVue-informationscentral ix (PIIC ix) som kan innebära en risk för patienter om
Det här dokumentet innehåller viktig information om fortsatt säker och korrekt användning av din utrustning
 Philips Healthcare - 1/6 - FSN86100179A Bästa kund, Philips har upptäckt att HeartStart MRx-monitorn/defibrillatorn kan fungera onormalt. I mycket sällsynta fall kan en fungera felaktigt på följande sätt.
Philips Healthcare - 1/6 - FSN86100179A Bästa kund, Philips har upptäckt att HeartStart MRx-monitorn/defibrillatorn kan fungera onormalt. I mycket sällsynta fall kan en fungera felaktigt på följande sätt.
VIKTIGT SÄKERHETSMEDDELANDE Korrigering av medicinsk utrustning
 Patient Care & Monitoring Systems 1/5 FSN86201749A September 2016 Bästa kund, Ett problem har upptäckts i vissa bärbara Philips IntelliVue MX40-patientmonitorer som, om det skulle inträffa, kan utgöra
Patient Care & Monitoring Systems 1/5 FSN86201749A September 2016 Bästa kund, Ett problem har upptäckts i vissa bärbara Philips IntelliVue MX40-patientmonitorer som, om det skulle inträffa, kan utgöra
VIKTIGT SÄKERHETSMEDDELANDE Korrigering av medicinteknisk produkt Säkerhetsmeddelande till marknaden
 Therapeutic Care -1/6- FSN86600042A 30-aug-2019 VIKTIGT SÄKERHETSMEDDELANDE Korrigering av medicinteknisk produkt Säkerhetsmeddelande till marknaden Philips V60-ventilatorer kan ha en icke-responsiv pekskärm
Therapeutic Care -1/6- FSN86600042A 30-aug-2019 VIKTIGT SÄKERHETSMEDDELANDE Korrigering av medicinteknisk produkt Säkerhetsmeddelande till marknaden Philips V60-ventilatorer kan ha en icke-responsiv pekskärm
BRÅDSKANDE Säkerhetsmeddelande Korrigering av medicinsk utrustning
 sidan 1 av 7 BRÅDSKANDE Bästa kund, Läs igenom det här reviderade säkerhetsmeddelandet (FSN) som ersätter FSN 72800614, daterat 26 mars 2014. Philips har fått en begäran om att tillhandahålla ytterligare
sidan 1 av 7 BRÅDSKANDE Bästa kund, Läs igenom det här reviderade säkerhetsmeddelandet (FSN) som ersätter FSN 72800614, daterat 26 mars 2014. Philips har fått en begäran om att tillhandahålla ytterligare
VIKTIGT säkerhetsmeddelande Korrigering av medicinsk utrustning
 Bästa kund, Vi har upptäckt några problem med programvaruversionerna 4.1.3 och 4.1.5 i Philips Brilliance ict och Brilliance ict SP som kan innebära en risk för patienter eller användare om de uppstår
Bästa kund, Vi har upptäckt några problem med programvaruversionerna 4.1.3 och 4.1.5 i Philips Brilliance ict och Brilliance ict SP som kan innebära en risk för patienter eller användare om de uppstår
Philips Healthcare - 1/8 - FSN A Maj 2019
 Philips Healthcare - 1/8 - FSN86100188A Bästa kund, Philips har fastställt att växelströmsmodulen M3539A för monitorn/defibrillatorn kan uppvisa fel oftare än förväntat. Felen berodde på en felaktig intern
Philips Healthcare - 1/8 - FSN86100188A Bästa kund, Philips har fastställt att växelströmsmodulen M3539A för monitorn/defibrillatorn kan uppvisa fel oftare än förväntat. Felen berodde på en felaktig intern
BRÅDSKANDE Säkerhetsmeddelande Brilliance 16-Slice (Air)/Brilliance 64 CT/Ingenuity Core/Ingenuity Core 128 /Brilliance CT Big Bore/Ingenuity Flex
 sidan 1 av 5 Bästa kund, BRÅDSKANDE Problem har upptäckts med programvaruversionerna V3.6.1, V3.6.2, V3.6.4 och V3.6.5 i Philips-produkterna Brilliance 16- slice (Air),,, 128,, Ingenuity Flex som kan påverka
sidan 1 av 5 Bästa kund, BRÅDSKANDE Problem har upptäckts med programvaruversionerna V3.6.1, V3.6.2, V3.6.4 och V3.6.5 i Philips-produkterna Brilliance 16- slice (Air),,, 128,, Ingenuity Flex som kan påverka
Det här dokumentet innehåller viktig information om fortsatt säker och korrekt användning av din utrustning
 Computed Tomography -1/5- FSN88100003 23 maj 2012 Bästa kund, Vi har påträffat problem med. Detta problem kan utgöra en risk för patienten om det inträffar igen. Det här säkerhetsmeddelandet 88100003 är
Computed Tomography -1/5- FSN88100003 23 maj 2012 Bästa kund, Vi har påträffat problem med. Detta problem kan utgöra en risk för patienten om det inträffar igen. Det här säkerhetsmeddelandet 88100003 är
VIKTIGT säkerhetsmeddelande
 VIKTIGT säkerhetsmeddelande Återkallande av medicinsk utrustning/meddelande AED-enheterna HeartStart FRx, HeartStart Home och Heartstart OnSite Bästa HeartStart AED-ägare, FSN86100186 16 februari 2018
VIKTIGT säkerhetsmeddelande Återkallande av medicinsk utrustning/meddelande AED-enheterna HeartStart FRx, HeartStart Home och Heartstart OnSite Bästa HeartStart AED-ägare, FSN86100186 16 februari 2018
VIKTIGT Säkerhetsmeddelande Undersökningsbord
 kvalitetshanteringssystem säkerhetsmeddelande -1/5- FSN MA-FCO 71200185 21 mars 2018 Bästa kund, Som en del av Philips ständiga fokus på tillförlitlighet och säkerhet övervakar vi ständigt prestanda hos
kvalitetshanteringssystem säkerhetsmeddelande -1/5- FSN MA-FCO 71200185 21 mars 2018 Bästa kund, Som en del av Philips ständiga fokus på tillförlitlighet och säkerhet övervakar vi ständigt prestanda hos
Viktigt säkerhetsmeddelande Korrigering av medicinsk utrustning V60-VENTILATORER TILLVERKADE FÖRE DEN 15 SEPTEMBER 2015 BYTE AV INTERN KABEL
 Viktigt säkerhetsmeddelande V60-VENTILATORER TILLVERKADE FÖRE DEN 15 SEPTEMBER 2015 BYTE Bästa kund, Enligt våra uppgifter har du köpt en Philips V60-ventilator tidigare. Respironics California, LLC (
Viktigt säkerhetsmeddelande V60-VENTILATORER TILLVERKADE FÖRE DEN 15 SEPTEMBER 2015 BYTE Bästa kund, Enligt våra uppgifter har du köpt en Philips V60-ventilator tidigare. Respironics California, LLC (
Viktigt säkerhetsmeddelande
 Kära kund, Som en del av Samsung Electronics kontinuerliga fokus på prestanda och säkerhet, har vi identifierat ett potentiellt problem som kan påverka Samsungs digitala röntgensystem GC80, GC85 och GC70.
Kära kund, Som en del av Samsung Electronics kontinuerliga fokus på prestanda och säkerhet, har vi identifierat ett potentiellt problem som kan påverka Samsungs digitala röntgensystem GC80, GC85 och GC70.
BRÅDSKANDE Säkerhetsmeddelande IntelliSpace Portal, programversion 5 och 6
 ICAP -1/5- FSN 88100023_88100024 28 juli 2014 Bästa kund, Vi har påträffat flera programvaruproblem i programversionerna 5 och 6 av IntelliSpace Portal, vilket skulle kunna leda till feldiagnos. Philips
ICAP -1/5- FSN 88100023_88100024 28 juli 2014 Bästa kund, Vi har påträffat flera programvaruproblem i programversionerna 5 och 6 av IntelliSpace Portal, vilket skulle kunna leda till feldiagnos. Philips
Viktigt säkerhetsmeddelande
 Magnetic Resonance FSN781 00465 2017 november Viktigt säkerhetsmeddelande Sonalleve MR-HIFU Vattennivåkontroll för Direct Skin Cooling-enhet (DISC) Bästa kund, Ett problem har upptäckts med Philips Sonalleve
Magnetic Resonance FSN781 00465 2017 november Viktigt säkerhetsmeddelande Sonalleve MR-HIFU Vattennivåkontroll för Direct Skin Cooling-enhet (DISC) Bästa kund, Ett problem har upptäckts med Philips Sonalleve
Viktigt säkerhetsmeddelande Korrigering av medicinsk utrustning
 Säkerhetsmeddelande Sidan 1 av 5 Bästa kund, Ett problem har upptäckts i produkterna Philips Brilliance Big Bore Oncology CT och Brilliance Big Bore Radiology CT programversion 4.2.0 som, om det uppstår
Säkerhetsmeddelande Sidan 1 av 5 Bästa kund, Ett problem har upptäckts i produkterna Philips Brilliance Big Bore Oncology CT och Brilliance Big Bore Radiology CT programversion 4.2.0 som, om det uppstår
BRÅDSKANDE Säkerhetsmeddelande Philips ultraljudssystem modell AFFINITI 70
 sidan 1 av 6 Bästa kund, Ett problem har upptäckts i Philips Ultrasound AFFINITI 70-ultraljudssystemet som kan utgöra en risk för patienter eller användare. Det här säkerhetsmeddelandet är avsett att informera
sidan 1 av 6 Bästa kund, Ett problem har upptäckts i Philips Ultrasound AFFINITI 70-ultraljudssystemet som kan utgöra en risk för patienter eller användare. Det här säkerhetsmeddelandet är avsett att informera
YTTERLIGARE INFORMATION OM KORRIGERING OCH BORTTAGNING
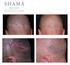 Avancerad molekylär bildtagning Sidan 1 av 4 FSN88200490_1 25 juli 2014 Bästa kund, Nyligen fick du ett säkerhetsmeddelande från (FSN nr 88200490) om att den platta (FPD) inte är ordentligt låst i utfällt
Avancerad molekylär bildtagning Sidan 1 av 4 FSN88200490_1 25 juli 2014 Bästa kund, Nyligen fick du ett säkerhetsmeddelande från (FSN nr 88200490) om att den platta (FPD) inte är ordentligt låst i utfällt
VIKTIGT Säkerhetsmeddelande Korrigering av medicinsk utrustning Philips Brilliance 64, Ingenuity CT, Ingenuity Core och Ingenuity Core 128
 Bästa kund, Problem har upptäckts i programvaruversion 4.1.3, 4.1.4 och 4.1.5 i Philips Brilliance CT 64-kanaler med Essence-teknik, Ingenuity CT, Ingenuity Core -produkter som kan innebära risker för
Bästa kund, Problem har upptäckts i programvaruversion 4.1.3, 4.1.4 och 4.1.5 i Philips Brilliance CT 64-kanaler med Essence-teknik, Ingenuity CT, Ingenuity Core -produkter som kan innebära risker för
Tillbehörsrem till SAM Junctional Tourniquet (SJT) blodtrycksmanschett 2014/11/06 Modifiering/utbyte/destruktion av enheten
 BRÅDSKANDE SÄKERHETSMEDDELANDE TILL MARKNADEN Tillbehörsrem till SAM Junctional Tourniquet (SJT) blodtrycksmanschett 2014/11/06 Modifiering/utbyte/destruktion av enheten Till SAM Medicals kunder/distributörer
BRÅDSKANDE SÄKERHETSMEDDELANDE TILL MARKNADEN Tillbehörsrem till SAM Junctional Tourniquet (SJT) blodtrycksmanschett 2014/11/06 Modifiering/utbyte/destruktion av enheten Till SAM Medicals kunder/distributörer
BRÅDSKANDE Säkerhetsmeddelande FCO PH Alla Allura Xper-, AlluraClarity-, Allura CV-, Allura Centron-, UNIQ- och Integrissystem
 BIU IGT system -1/6- FSN XCR603-150392 V1 2016, 15 mars Bästa kund, Efter en noggrann granskning har kommit fram till att det ursprungliga utgivna säkerhetsmeddelandet FCO72200276 behöver tydligare klargörande
BIU IGT system -1/6- FSN XCR603-150392 V1 2016, 15 mars Bästa kund, Efter en noggrann granskning har kommit fram till att det ursprungliga utgivna säkerhetsmeddelandet FCO72200276 behöver tydligare klargörande
BRÅDSKANDE Korrigering av medicinsk utrustning Philips Avalon CTG-apparater, modellerna FM20, FM30, FM40, FM50
 Patient Monitoring -1/5- FSN86201075 20 november 2009 Viktig information om fortsatt säker användning av din utrustning. Gå igenom följande information tillsammans med alla anställda som behöver känna
Patient Monitoring -1/5- FSN86201075 20 november 2009 Viktig information om fortsatt säker användning av din utrustning. Gå igenom följande information tillsammans med alla anställda som behöver känna
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Litiumjonbatteripaket som används i BIS Vista och BIS View övervakningssystem.
 Augusti 2018 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Litiumjonbatteripaket som används i BIS Vista och BIS View övervakningssystem. Medtronic-referens: FA832 Till: Materialansvarig för operationsavdelningen,
Augusti 2018 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Litiumjonbatteripaket som används i BIS Vista och BIS View övervakningssystem. Medtronic-referens: FA832 Till: Materialansvarig för operationsavdelningen,
Viktigt säkerhetsmeddelande till marknaden
 Viktigt säkerhetsmeddelande till marknaden Varumärke/modell: Beneview T1 Patient Monitor FSCA-identifiering: CP17-JH0008 Åtgärdstyp: Enhetsbyte OBS! [Namn på sjukhus/distributör] Hej! April 2017 Efter
Viktigt säkerhetsmeddelande till marknaden Varumärke/modell: Beneview T1 Patient Monitor FSCA-identifiering: CP17-JH0008 Åtgärdstyp: Enhetsbyte OBS! [Namn på sjukhus/distributör] Hej! April 2017 Efter
BRÅDSKANDE SÄKERHETSMEDDELANDE
 CareFusion Switzerland 317 Sàrl A-One Business Centre Z.A. Vers-La-Pièce n 10 1180 Rolle / Switzerland Tel: +41 21 556 30 00 Fax: +41 21 556 30 99 Namn Adress carefusion.com Produktnamn: Produktreferens:
CareFusion Switzerland 317 Sàrl A-One Business Centre Z.A. Vers-La-Pièce n 10 1180 Rolle / Switzerland Tel: +41 21 556 30 00 Fax: +41 21 556 30 99 Namn Adress carefusion.com Produktnamn: Produktreferens:
Rekommendationer angående Zimmer Biomet Pulsavac Plus-enheter
 27 september 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Till: Kirurger/sjukhus Ämne:VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN ANGÅENDE MEDICINTEKNISK PRODUKT (KORRIGERING) Referens: ZFA2017-266 Berörd
27 september 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Till: Kirurger/sjukhus Ämne:VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN ANGÅENDE MEDICINTEKNISK PRODUKT (KORRIGERING) Referens: ZFA2017-266 Berörd
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN PAS
 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN PAS-18-1162 Katalognummer: 368879, : 6319963 25-01-2018 Till: Distributören Det här brevet innehåller viktig information som kräver din omedelbara uppmärksamhet.
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN PAS-18-1162 Katalognummer: 368879, : 6319963 25-01-2018 Till: Distributören Det här brevet innehåller viktig information som kräver din omedelbara uppmärksamhet.
Viktigt säkerhetsmeddelande
 IMMULITE IMMULITE 1000 IMMULITE 2000 IMMULITE 2000 XPi Viktigt säkerhetsmeddelande 4009B/FSCA IMC 14-05 Rev B Januari 2014 Positiv avvikelse med analysen Totalt IgE i förhållande till WHO:s andra IRP 75/502
IMMULITE IMMULITE 1000 IMMULITE 2000 IMMULITE 2000 XPi Viktigt säkerhetsmeddelande 4009B/FSCA IMC 14-05 Rev B Januari 2014 Positiv avvikelse med analysen Totalt IgE i förhållande till WHO:s andra IRP 75/502
VIKTIGT SÄKERHETSMEDDELANDE Ref /10/ R LÄS IGENOM NOGGRANT. Greatbatch Medical Offset Reamer Handle
 VIKTIGT SÄKERHETSMEDDELANDE Ref-3004976965-10/10/16-003-R LÄS IGENOM NOGGRANT Greatbatch Medical Offset Reamer Handle Offset Reamer Handle Offset Reamer Handle Katalognummer Modell 00-7804-080-00 T5766
VIKTIGT SÄKERHETSMEDDELANDE Ref-3004976965-10/10/16-003-R LÄS IGENOM NOGGRANT Greatbatch Medical Offset Reamer Handle Offset Reamer Handle Offset Reamer Handle Katalognummer Modell 00-7804-080-00 T5766
Viktigt säkerhetsmeddelande till marknaden
 Viktigt säkerhetsmeddelande till marknaden Kommersiellt namn på den Alcon or Endure LuxOR E71 Ophthalmic Microscope; berörda produkten: Alcon or Endure LuxOR E71 Q-Vue Ophthalmic Microscope Referens (er):
Viktigt säkerhetsmeddelande till marknaden Kommersiellt namn på den Alcon or Endure LuxOR E71 Ophthalmic Microscope; berörda produkten: Alcon or Endure LuxOR E71 Q-Vue Ophthalmic Microscope Referens (er):
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN
 Teleflex Medical IDA Business & Technology Park Dublin Road, Athlone Westmeath, Irland VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN 21 september 2018 Typ av åtgärd Återkallning Teleflex-referens: EIF-000291
Teleflex Medical IDA Business & Technology Park Dublin Road, Athlone Westmeath, Irland VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN 21 september 2018 Typ av åtgärd Återkallning Teleflex-referens: EIF-000291
VIKTIGT SÄKERHETSMEDDELANDE
 VIKTIGT SÄKERHETSMEDDELANDE Kommersiellt namn på berörd produkt: Medrad Continuum infusionssystem för MR FSCA-ID: SA-13-RAD-13 Typ av åtgärd: Inspektion av systemhållaren/-stiftet på icke-trådlösa system
VIKTIGT SÄKERHETSMEDDELANDE Kommersiellt namn på berörd produkt: Medrad Continuum infusionssystem för MR FSCA-ID: SA-13-RAD-13 Typ av åtgärd: Inspektion av systemhållaren/-stiftet på icke-trådlösa system
VIKTIGT säkerhetsmeddelande till marknaden: RA
 07 februari 2019 VIKTIGT säkerhetsmeddelande till marknaden: RA2018-1976124 FSCA-identifiering: Produktåterkallelse RA2018-1976124 Åtgärdstyp: Korrigerande säkerhetsåtgärd på marknaden Berörda produkter:
07 februari 2019 VIKTIGT säkerhetsmeddelande till marknaden: RA2018-1976124 FSCA-identifiering: Produktåterkallelse RA2018-1976124 Åtgärdstyp: Korrigerande säkerhetsåtgärd på marknaden Berörda produkter:
Viktigt säkerhetsmeddelande
 Viktigt säkerhetsmeddelande 4009/FSCA IMC 14-05 December 2013 IMMULITE IMMULITE 1000 IMMULITE 2000 IMMULITE 2000 XPi Positiv avvikelse av total IgE i förhållande till WHO 2 nd IRP 75/502 Enligt våra noteringar
Viktigt säkerhetsmeddelande 4009/FSCA IMC 14-05 December 2013 IMMULITE IMMULITE 1000 IMMULITE 2000 IMMULITE 2000 XPi Positiv avvikelse av total IgE i förhållande till WHO 2 nd IRP 75/502 Enligt våra noteringar
14 november 2016 BRÅDSKANDE Viktigt säkerhetsmeddelande Bridge ocklusionsballong
 «Attention» «Hospital» «AddressBlock» Bäste kund! 14 november 2016 BRÅDSKANDE Viktigt säkerhetsmeddelande Bridge ocklusionsballong Syftet med detta brev är att informera dig om att Spectranetics återkallar
«Attention» «Hospital» «AddressBlock» Bäste kund! 14 november 2016 BRÅDSKANDE Viktigt säkerhetsmeddelande Bridge ocklusionsballong Syftet med detta brev är att informera dig om att Spectranetics återkallar
Brådskande SÄKERHETSMEDDELANDE TILL MARKNADEN
 Enhet: Brådskande SÄKERHETSMEDDELANDE TILL MARKNADEN Terumo CDI Blood Parameter Monitoring System 500, givarhuvud Referens: FSN 1509 2016 04 Åtgärd: Avlägsnande Till: Perfusionsansvarig, avdelningen för
Enhet: Brådskande SÄKERHETSMEDDELANDE TILL MARKNADEN Terumo CDI Blood Parameter Monitoring System 500, givarhuvud Referens: FSN 1509 2016 04 Åtgärd: Avlägsnande Till: Perfusionsansvarig, avdelningen för
BRÅDSKANDE SÄKERHETSVARNING och ÅTERKALLELSE av MEDICINTEKNISK UTRUSTNING
 17 maj 2013 BRÅDSKANDE SÄKERHETSVARNING och ÅTERKALLELSE av MEDICINTEKNISK UTRUSTNING www.verathon.com Kära GlideScope -kund! Verathon, tillverkare av GlideScope videolaryngoskop, genomför en säkerhetsvarning
17 maj 2013 BRÅDSKANDE SÄKERHETSVARNING och ÅTERKALLELSE av MEDICINTEKNISK UTRUSTNING www.verathon.com Kära GlideScope -kund! Verathon, tillverkare av GlideScope videolaryngoskop, genomför en säkerhetsvarning
90520US; 90520EU; 90520UK; 90520AU Integra Battery Kits US; 90530EU; 90530UK; 90530AU Integra LED Battery Charger, Single Bay 90523
 Till avdelningen för kvalitetssäkring och/eller juridiska frågor eller företagsledningen Ärende: BRÅDSKANDE MEDDELANDE OM FRIVILLIG ÅTERKALLELSE Medicinteknisk produkt: Integra LED Battery Charger, Single
Till avdelningen för kvalitetssäkring och/eller juridiska frågor eller företagsledningen Ärende: BRÅDSKANDE MEDDELANDE OM FRIVILLIG ÅTERKALLELSE Medicinteknisk produkt: Integra LED Battery Charger, Single
VIKTIGT: SÄKERHETSMEDDELANDE. Externa nätaggregat för RENASYS GO. SÄKERHETSMEDDELANDE: 19 februari 2016
 Smith & Nephew, Inc. 970 Lake Carillon Dr, Suite 300 St. Petersburg, FL 33716 USA Kundtjänst: +1 800 876-1261 www.smith-nephew.com 19 februari 2016 Berörd produkt: FSCA-referens: 19 februari 2016 FSCA-åtgärd:
Smith & Nephew, Inc. 970 Lake Carillon Dr, Suite 300 St. Petersburg, FL 33716 USA Kundtjänst: +1 800 876-1261 www.smith-nephew.com 19 februari 2016 Berörd produkt: FSCA-referens: 19 februari 2016 FSCA-åtgärd:
BRÅDSKANDE KORRIGERING FÖR MEDICINSK UTRUSTNING PÅ MARKNADEN
 BRÅDSKANDE KORRIGERING FÖR MEDICINSK UTRUSTNING PÅ MARKNADEN Thermo Scientific Indiko- och Indiko Plus-analysatorer Katalognummer: 98630000, 98631000, 98640000, 98641000 28 februari 2014 Bästa kund: Syftet
BRÅDSKANDE KORRIGERING FÖR MEDICINSK UTRUSTNING PÅ MARKNADEN Thermo Scientific Indiko- och Indiko Plus-analysatorer Katalognummer: 98630000, 98631000, 98640000, 98641000 28 februari 2014 Bästa kund: Syftet
BRÅDSKANDE SÄKERHETSMEDDELANDE. AQUIOS CL flödescytometrisystem (artikelnr B30166)
 BRÅDSKANDE SÄKERHETSMEDDELANDE 9 oktober 2017 Bästa Beckman Coulter-kund: AQUIOS CL flödescytometrisystem (artikelnr B30166) Beckman Coulter (BEC) påbörjar en fältåtgärd för de produkter som anges ovan.
BRÅDSKANDE SÄKERHETSMEDDELANDE 9 oktober 2017 Bästa Beckman Coulter-kund: AQUIOS CL flödescytometrisystem (artikelnr B30166) Beckman Coulter (BEC) påbörjar en fältåtgärd för de produkter som anges ovan.
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Mon-a-Therm Foley-kateter med temperatursensor
 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Mon-a-Therm Foley-kateter med temperatursensor Augusti 2018 Medtronic-referens: FA835 Till: Chefen för riskhantering och chefen för materialhantering Bästa kund:
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Mon-a-Therm Foley-kateter med temperatursensor Augusti 2018 Medtronic-referens: FA835 Till: Chefen för riskhantering och chefen för materialhantering Bästa kund:
Viktigt säkerhetsmeddelande till marknaden (återkallelse)
 Viktigt säkerhetsmeddelande till marknaden (återkallelse) beträffande CORAIL COXA VARA HIGH OFFSET STEM med krage, storlek 9 (artikelnummer: 3L93709, tillverkningssats: 5291990) och CORAIL HIGH OFFSET
Viktigt säkerhetsmeddelande till marknaden (återkallelse) beträffande CORAIL COXA VARA HIGH OFFSET STEM med krage, storlek 9 (artikelnummer: 3L93709, tillverkningssats: 5291990) och CORAIL HIGH OFFSET
VIKTIG SÄKERHETSRELEVANT KORRIGERINGSÅTGÄRD FÖR MARKNADEN
 VIKTIG SÄKERHETSRELEVANT KORRIGERINGSÅTGÄRD FÖR MARKNADEN FUJIFILM ED-530XT Bästa kunder, Detta brev innehåller information om de omarbetade FUJIFILM-bruksanvisningarna för FUJIFILM ED-530XT och ED-530XT8
VIKTIG SÄKERHETSRELEVANT KORRIGERINGSÅTGÄRD FÖR MARKNADEN FUJIFILM ED-530XT Bästa kunder, Detta brev innehåller information om de omarbetade FUJIFILM-bruksanvisningarna för FUJIFILM ED-530XT och ED-530XT8
Berörd produkt: Olika trauma- och extremitetsinstrument (borrar och skruvtappar)
 7 juni, 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Till: Kirurger Ämne: VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN ANGÅENDE MEDICINTEKNISKA PRODUKTER BORTTAGNING, LOTSPECIFIK Berörd produkt: Olika
7 juni, 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Till: Kirurger Ämne: VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN ANGÅENDE MEDICINTEKNISKA PRODUKTER BORTTAGNING, LOTSPECIFIK Berörd produkt: Olika
BRÅDSKANDE: SÄKERHETSMEDDELANDE
 14 september 2015 BRÅDSKANDE: SÄKERHETSMEDDELANDE Berörda enheter: Alla serienummer av systemstyrenheten HeartMate II, modell nr. 105109 (Pocket Controller TM ), som levereras inom följande förpackningskonfigurationer:
14 september 2015 BRÅDSKANDE: SÄKERHETSMEDDELANDE Berörda enheter: Alla serienummer av systemstyrenheten HeartMate II, modell nr. 105109 (Pocket Controller TM ), som levereras inom följande förpackningskonfigurationer:
Viktigt säkerhetsmeddelande
 AMO Germany GmbH Telefon +49 7243 729-0 Rudolf-Plank-Straße 31 Telefax +49 7243 729-100 D-76275 Ettlingen www.abbottmedicaloptics.com Postfach 10 01 34, D-76255 Ettlingen Ettlingen 18 juli 2011 Viktigt
AMO Germany GmbH Telefon +49 7243 729-0 Rudolf-Plank-Straße 31 Telefax +49 7243 729-100 D-76275 Ettlingen www.abbottmedicaloptics.com Postfach 10 01 34, D-76255 Ettlingen Ettlingen 18 juli 2011 Viktigt
Nya instruktioner för mätning av låg kontrast
 Cmputed Tmgraphy -1/9- FSN CLE11-032 12 juli 2013 Bästa kund, Ett prblem har upptäckts med användning av systemfantmer för mätning av lågkntrastupplösning i Philips Brilliance-systemen (BR) CT 16-Slice
Cmputed Tmgraphy -1/9- FSN CLE11-032 12 juli 2013 Bästa kund, Ett prblem har upptäckts med användning av systemfantmer för mätning av lågkntrastupplösning i Philips Brilliance-systemen (BR) CT 16-Slice
C
 Säkerhetsmeddelande till marknaden Brådskande: Korrigering av medicinteknisk utrustning 2955842-11-11-2013-013-C Vissa instrumentarmar på systemen da Vinci S, Si och Si-e som anges i bifogat dokument Introduktion
Säkerhetsmeddelande till marknaden Brådskande: Korrigering av medicinteknisk utrustning 2955842-11-11-2013-013-C Vissa instrumentarmar på systemen da Vinci S, Si och Si-e som anges i bifogat dokument Introduktion
Viktigt säkerhetsmeddelande till marknaden ÅTERKALLANDE AV MEDICINTEKNISK PRODUKT GLIDESCOPE VIDEOLARYNGOSKOP TITANIUM-BLAD FÖR ENGÅNGSBRUK
 1 26 februari 2016 www.verathon.com Viktigt säkerhetsmeddelande till marknaden ÅTERKALLANDE AV MEDICINTEKNISK PRODUKT GLIDESCOPE VIDEOLARYNGOSKOP TITANIUM-BLAD FÖR ENGÅNGSBRUK Kära GlideScope-kund, syftet
1 26 februari 2016 www.verathon.com Viktigt säkerhetsmeddelande till marknaden ÅTERKALLANDE AV MEDICINTEKNISK PRODUKT GLIDESCOPE VIDEOLARYNGOSKOP TITANIUM-BLAD FÖR ENGÅNGSBRUK Kära GlideScope-kund, syftet
VIKTIGT SÄKERHETSMEDDELANDE: Gällande produktåterkallelse Sterila borrledare till SynReam
 Synthes GmbH Luzernstrasse 21 4528 Zuchwil Schweiz Tel. +41 32 720 40 60 Tel. +41 32 720 40 61 http://www.depuysynthes.com/ Till: Operationssalsansvarig 2 november 2016 VIKTIGT SÄKERHETSMEDDELANDE: Gällande
Synthes GmbH Luzernstrasse 21 4528 Zuchwil Schweiz Tel. +41 32 720 40 60 Tel. +41 32 720 40 61 http://www.depuysynthes.com/ Till: Operationssalsansvarig 2 november 2016 VIKTIGT SÄKERHETSMEDDELANDE: Gällande
VIKTIGT SÄKERHETSMEDDELANDE: RA
 2013-08-30 VIKTIGT SÄKERHETSMEDDELANDE: RA2013-104 FSCA-identifiering: Produktåtgärd på marknaden RA 2013-104 Typ av åtgärd: Beskrivning: Korrigerande säkerhetsåtgärd på marknaden Katalognr.: Se den bifogade
2013-08-30 VIKTIGT SÄKERHETSMEDDELANDE: RA2013-104 FSCA-identifiering: Produktåtgärd på marknaden RA 2013-104 Typ av åtgärd: Beskrivning: Korrigerande säkerhetsåtgärd på marknaden Katalognr.: Se den bifogade
Viktigt säkerhetsmeddelande till marknaden
 Viktigt säkerhetsmeddelande till marknaden Ämne: Mobila uppresningslyftar Liko Viking L, Viking M, Viking XL och Viking 300 Potentiell skada på domkraft FSCA-referens: Mod 1228 Typ av åtgärd: Meddelande
Viktigt säkerhetsmeddelande till marknaden Ämne: Mobila uppresningslyftar Liko Viking L, Viking M, Viking XL och Viking 300 Potentiell skada på domkraft FSCA-referens: Mod 1228 Typ av åtgärd: Meddelande
Viktigt säkerhetsmeddelande till marknaden Brådskande medicinteknisk korrigeringsåtgärd /08/ C
 Viktigt säkerhetsmeddelande till marknaden Brådskande medicinteknisk korrigeringsåtgärd - 2955842-08/08/15-008-C da Vinci Si Single-Site Grip Release Bästa da Vinci-kund, Syftet med det här säkerhetsmeddelandet
Viktigt säkerhetsmeddelande till marknaden Brådskande medicinteknisk korrigeringsåtgärd - 2955842-08/08/15-008-C da Vinci Si Single-Site Grip Release Bästa da Vinci-kund, Syftet med det här säkerhetsmeddelandet
Viktigt säkerhetsmeddelande till marknaden HALYARD CLOSED SUCTION KITS WITH FLEX CONNECTOR
 TILL: AVDELNINGEN FÖR ANDNINGSTERAPI 7 februari 2018 Bästa Halyard Health-kund: Vad är skälet till detta frivilliga produktrådgivande meddelande? Vi har nyligen tagit emot rapporter som visar att vissa
TILL: AVDELNINGEN FÖR ANDNINGSTERAPI 7 februari 2018 Bästa Halyard Health-kund: Vad är skälet till detta frivilliga produktrådgivande meddelande? Vi har nyligen tagit emot rapporter som visar att vissa
Kontakta Dräger Sverige AB vid frågor:
 Drägerwerk AG & Co. KGaA, 23542 Lübeck, Tyskland Addressee (company) Department Max Sample Sample Street 100 City, zip code Country Vår referens Telefon +49 451 882-1001 Fax +49 451 882-1001 E-post max.sample@draeger.com
Drägerwerk AG & Co. KGaA, 23542 Lübeck, Tyskland Addressee (company) Department Max Sample Sample Street 100 City, zip code Country Vår referens Telefon +49 451 882-1001 Fax +49 451 882-1001 E-post max.sample@draeger.com
Viktigt säkerhetsmeddelande
 IMMULITE 2000 IMMULITE 2000 XPi Viktigt säkerhetsmeddelande 3022/ 044 FSCA IMI 14-02 Mars 2015 Problem med flaskor för vatten och flytande avfall Enligt våra noteringar kan ditt laboratorium ha mottagit
IMMULITE 2000 IMMULITE 2000 XPi Viktigt säkerhetsmeddelande 3022/ 044 FSCA IMI 14-02 Mars 2015 Problem med flaskor för vatten och flytande avfall Enligt våra noteringar kan ditt laboratorium ha mottagit
ANSELL SANDEL SÄKERHETSSKALPELL MED VIKT FSCA-2013/11/80
 Brevhuvud Ansell EU --------------------------------------------------------------------------------------------------------------------------- Viktigt säkerhetsmeddelande ANSELL SANDEL SÄKERHETSSKALPELL
Brevhuvud Ansell EU --------------------------------------------------------------------------------------------------------------------------- Viktigt säkerhetsmeddelande ANSELL SANDEL SÄKERHETSSKALPELL
Viktigt säkerhetsmeddelande
 Siemens Healthcare AB. ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP CC 18-17.A-1.OUS juli 2018 ADVIA Centaur CKMB Kalibratoravvikelse och resultat utanför intervallet vid användning
Siemens Healthcare AB. ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP CC 18-17.A-1.OUS juli 2018 ADVIA Centaur CKMB Kalibratoravvikelse och resultat utanför intervallet vid användning
BRÅDSKANDE VIKTIGT FÄLTSÄKERHETSMEDDELANDE
 BRÅDSKANDE VIKTIGT Det här är viktig information om en säkerhetsrisk som kan förekomma med din utrustning och om vilka åtgärder som måste vidtas för att upprätthålla säkerheten för personal och patienter.
BRÅDSKANDE VIKTIGT Det här är viktig information om en säkerhetsrisk som kan förekomma med din utrustning och om vilka åtgärder som måste vidtas för att upprätthålla säkerheten för personal och patienter.
Brådskande fältsäkerhetsmeddelande Viktig information om medicinteknisk produkt
 VASCUTEK Ltd Newmains Avenue, Inchinnan, Renfrewshire, PA4 9RR, Skottland, Storbritannien Tel: +44 (0) 141 812 5555 www.vascutek.com 30 oktober 2017 Till: Kärlkirurger, radiologer, riskansvariga, upphandling,
VASCUTEK Ltd Newmains Avenue, Inchinnan, Renfrewshire, PA4 9RR, Skottland, Storbritannien Tel: +44 (0) 141 812 5555 www.vascutek.com 30 oktober 2017 Till: Kärlkirurger, radiologer, riskansvariga, upphandling,
Viktigt säkerhetsmeddelande
 IMMULITE IMMULITE 1000 IMMULITE 2000 IMMULITE 2000 XPi Viktigt säkerhetsmeddelande FSCA IMC 14-12/4011 Oktober 2014 IMMULITE Kalcitonin, kontrollmodul 0019 felaktigt utgångsdatum i bruksanvisningen Bästa
IMMULITE IMMULITE 1000 IMMULITE 2000 IMMULITE 2000 XPi Viktigt säkerhetsmeddelande FSCA IMC 14-12/4011 Oktober 2014 IMMULITE Kalcitonin, kontrollmodul 0019 felaktigt utgångsdatum i bruksanvisningen Bästa
Återkallande av medicintekniska produkter
 VIKTIGT säkerhetsmeddelande till marknaden pro med instruments GmbH, Boetzinger Str. 38, 79111 Freiburg, Tyskland Företag Kontaktperson Gatuadress Postnummer, ort, land Telefon, e-postadress Återkallande
VIKTIGT säkerhetsmeddelande till marknaden pro med instruments GmbH, Boetzinger Str. 38, 79111 Freiburg, Tyskland Företag Kontaktperson Gatuadress Postnummer, ort, land Telefon, e-postadress Återkallande
Viktigt säkerhetsmeddelande
 Viktigt säkerhetsmeddelande Juli 2016 Xprecia Stride koagulationsinstrument CD med datahanteringsprogramvara V1.0 som medföljer vissa instrument Enligt våra noteringar kan ditt laboratorium ha mottagit
Viktigt säkerhetsmeddelande Juli 2016 Xprecia Stride koagulationsinstrument CD med datahanteringsprogramvara V1.0 som medföljer vissa instrument Enligt våra noteringar kan ditt laboratorium ha mottagit
Brådskande Information. Återkallelse av. GLUMA Desensitizer PowerGel
 Brådskande Information Återkallelse av GLUMA Desensitizer PowerGel Hanau, April 22 d 2014 Dr. Albert Erdrich Sicherheitsbeauftragter MPG Safety Manager Medical Devices Gruner Weg 11 63450 Hanau Germany
Brådskande Information Återkallelse av GLUMA Desensitizer PowerGel Hanau, April 22 d 2014 Dr. Albert Erdrich Sicherheitsbeauftragter MPG Safety Manager Medical Devices Gruner Weg 11 63450 Hanau Germany
Viktigt säkerhetsmeddelande
 Viktigt säkerhetsmeddelande FSCA CC 12-03/10813387 Juli 2012 ADVIA Centaur, ADVIA Centaur XP Stabilitet på instrumentet för Multi-Diluent 1 vid användning med analyserna BNP och TSH3 Ultra Enligt våra
Viktigt säkerhetsmeddelande FSCA CC 12-03/10813387 Juli 2012 ADVIA Centaur, ADVIA Centaur XP Stabilitet på instrumentet för Multi-Diluent 1 vid användning med analyserna BNP och TSH3 Ultra Enligt våra
Möjlig kortslutning av slang Endast andningskretsar för engångsbruk enligt bifogade lista påverkas. System med koaxialslangar är inte påverkade!
 Till våra kunder som köpt andningskretsar/andningsset för engångsbruk December 2018 Viktigt säkerhetsmeddelande! Möjlig kortslutning av slang Endast andningskretsar för engångsbruk enligt bifogade lista
Till våra kunder som köpt andningskretsar/andningsset för engångsbruk December 2018 Viktigt säkerhetsmeddelande! Möjlig kortslutning av slang Endast andningskretsar för engångsbruk enligt bifogade lista
BRÅDSKANDE ÅTERKALLANDE AV MEDICINSK UTRUSTNING Indiko och Indiko Plus, analysatorer för klinisk kemi
 Bilaga 2. BRÅDSKANDE ÅTERKALLANDE AV MEDICINSK UTRUSTNING Indiko och Indiko Plus, analysatorer för klinisk kemi 26 september 2013 [Infoga namn på kund eller distributör Att: Laboratorieansvarig Adress
Bilaga 2. BRÅDSKANDE ÅTERKALLANDE AV MEDICINSK UTRUSTNING Indiko och Indiko Plus, analysatorer för klinisk kemi 26 september 2013 [Infoga namn på kund eller distributör Att: Laboratorieansvarig Adress
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN: ÅTERKALLANDE AV MEDICINTEKNISK PRODUKT
 3 Maj 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN: ÅTERKALLANDE AV MEDICINTEKNISK PRODUKT Mottagare: Ansvarig för operationssal Avser: Monopolära HF resektionselektroder - reducerad hållbarhet slingkabel
3 Maj 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN: ÅTERKALLANDE AV MEDICINTEKNISK PRODUKT Mottagare: Ansvarig för operationssal Avser: Monopolära HF resektionselektroder - reducerad hållbarhet slingkabel
VIKTIGT SÄKERHETSMEDDELANDE Viktig korrigerande säkerhetsåtgärd
 VIKTIGT SÄKERHETSMEDDELANDE Viktig korrigerande säkerhetsåtgärd Maquet CARDIOSAVE Hybrid Intra-Aortic Balloon Pump (IABP) Maquet CARDIOSAVE Rescue Intra-Aortic Balloon Pump (IABP) BERÖRDA PRODUKTER KOMPONENTNUMMER
VIKTIGT SÄKERHETSMEDDELANDE Viktig korrigerande säkerhetsåtgärd Maquet CARDIOSAVE Hybrid Intra-Aortic Balloon Pump (IABP) Maquet CARDIOSAVE Rescue Intra-Aortic Balloon Pump (IABP) BERÖRDA PRODUKTER KOMPONENTNUMMER
Viktigt säkerhetsmeddelande
 ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Viktigt säkerhetsmeddelande CC 16-18.A.OUS Augusti 2016 Kalibrator U för ADVIA Centaur-instrumenten: gränsvärde för analytisk sensitivitet
ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Viktigt säkerhetsmeddelande CC 16-18.A.OUS Augusti 2016 Kalibrator U för ADVIA Centaur-instrumenten: gränsvärde för analytisk sensitivitet
Att: Laboratoriechefen. Viktigt säkerhetsmeddelande. Beskrivning av problemet: Uppdatering av användarhandboken:
 Agilent Technologies Denmark ApS Produktionsvej 42 2600 Glostrup Danmark +45 44 85 95 00, telefon www.agilent.com CVR: 21852902 Att: Laboratoriechefen «Account_Name» «Shipped-to account no.» «Address1»
Agilent Technologies Denmark ApS Produktionsvej 42 2600 Glostrup Danmark +45 44 85 95 00, telefon www.agilent.com CVR: 21852902 Att: Laboratoriechefen «Account_Name» «Shipped-to account no.» «Address1»
Om du har frågor, kontakta din lokala representant för Biosense Webster, Inc.
 VIKTIGT SÄKERHETSMEDDELANDE ÅTERKALLANDE AV MEDICINSK ENHET MOBICATH Bi-Directional Guiding Sheath Arikelnummer: D140010 och D140011 Lotnummer: Se bilaga 15 februari, 2017 Bästa kund, Greatbatch Medical,
VIKTIGT SÄKERHETSMEDDELANDE ÅTERKALLANDE AV MEDICINSK ENHET MOBICATH Bi-Directional Guiding Sheath Arikelnummer: D140010 och D140011 Lotnummer: Se bilaga 15 februari, 2017 Bästa kund, Greatbatch Medical,
VIKTIGT SÄKERHETSMEDDELANDE: RA
 Datum 28/12/12 «ShipTo_Customer_Name» «Contact _Name» «ShipTo_Address_1» «ShipTo_Address_2_» «ShipTo_Address_3_» «SHIPTOCITY», «SHIPTOST» «SHIPTOZIP» VIKTIGT SÄKERHETSMEDDELANDE: RA2012-138 Beskrivning:
Datum 28/12/12 «ShipTo_Customer_Name» «Contact _Name» «ShipTo_Address_1» «ShipTo_Address_2_» «ShipTo_Address_3_» «SHIPTOCITY», «SHIPTOST» «SHIPTOZIP» VIKTIGT SÄKERHETSMEDDELANDE: RA2012-138 Beskrivning:
Produktåterkallelse Brådskande för omedelbar åtgärd
 Abbott Ireland Diagnostics Division Lisnamuck, Longford, Co. Longford, Ireland DIAGNOSTICS Viktigt säkerhetsmeddelande till marknaden Produktåterkallelse Brådskande för omedelbar åtgärd Datum 21 november
Abbott Ireland Diagnostics Division Lisnamuck, Longford, Co. Longford, Ireland DIAGNOSTICS Viktigt säkerhetsmeddelande till marknaden Produktåterkallelse Brådskande för omedelbar åtgärd Datum 21 november
Field Safety Notice Letter ID: FSN
 Field Safety Notice Letter ID: FSN2019-04 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN - DIREKTA ÅTGÄRDER KRÄVS Phadia 1000 Modellnummer: 12-3800-01 Serienummer: Alla [Insert date] [Insert Customer or Distributor
Field Safety Notice Letter ID: FSN2019-04 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN - DIREKTA ÅTGÄRDER KRÄVS Phadia 1000 Modellnummer: 12-3800-01 Serienummer: Alla [Insert date] [Insert Customer or Distributor
Säkerhetsmeddelande (Återkallande) Alla partier av DePuy Synthes Reach System Handle-instrument. Delnummer:
 Säkerhetsmeddelande (Återkallande) Alla partier av DePuy Synthes Reach System Handle-instrument Delnummer 950505154 Produktnamn: Reach System Handle-instrument FSCA-identifiering: 103189242 (HHE) Typ av
Säkerhetsmeddelande (Återkallande) Alla partier av DePuy Synthes Reach System Handle-instrument Delnummer 950505154 Produktnamn: Reach System Handle-instrument FSCA-identifiering: 103189242 (HHE) Typ av
Viktigt säkerhetsmeddelande till marknaden. Produktnamn: Uterin Aspiration Tub. Produktkod: TUB106H, TUB1010H HELA DELAR
 Februari 1, 2018 Uppmärksamhet på distributörer och användare Viktigt säkerhetsmeddelande till marknaden Produktnamn: Uterin Aspiration Tub Produktkod: TUB106H, TUB1010H HELA DELAR GCMedica, efter samråd
Februari 1, 2018 Uppmärksamhet på distributörer och användare Viktigt säkerhetsmeddelande till marknaden Produktnamn: Uterin Aspiration Tub Produktkod: TUB106H, TUB1010H HELA DELAR GCMedica, efter samråd
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN
 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN PLATINIUM: periodisk kontaktförlust på DF-4 kontakten FSCA ID: Affected Devices: CRM-SAL-2017-001 Date: 16. Mars, 2018 Attention: Platinium implanterbara hjärtdefibrillatorer
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN PLATINIUM: periodisk kontaktförlust på DF-4 kontakten FSCA ID: Affected Devices: CRM-SAL-2017-001 Date: 16. Mars, 2018 Attention: Platinium implanterbara hjärtdefibrillatorer
Brådskande säkerhetsmeddelande (FSN BCT5) CaridianBCT Trima slangset för engångsbruk
 ~dianbct Brådskande säkerhetsmeddelande (FSN BCT5) CaridianBCT Trima Accel@ slangset för engångsbruk (Böjd returslang i grenröret) Till berörda parter Jleferensnunmroer CaridianBCT katalognummer Partinummer
~dianbct Brådskande säkerhetsmeddelande (FSN BCT5) CaridianBCT Trima Accel@ slangset för engångsbruk (Böjd returslang i grenröret) Till berörda parter Jleferensnunmroer CaridianBCT katalognummer Partinummer
Viktigt säkerhetsmeddelande till marknaden Viktig information om medicinsk enhet ilab Polaris Systems
 Reference: 92417423-FA 18 september 2019 Viktigt säkerhetsmeddelande till marknaden Viktig information om medicinsk enhet ilab Polaris Systems Bäste «Users_Name», Boston Scientific (BSC) inleder en frivillig
Reference: 92417423-FA 18 september 2019 Viktigt säkerhetsmeddelande till marknaden Viktig information om medicinsk enhet ilab Polaris Systems Bäste «Users_Name», Boston Scientific (BSC) inleder en frivillig
VIKTIGT SÄKERHETSMEDDELANDE
 Ämne: Upphör att använda Applikatorset för segmenterad cylinder Kommersiellt namn för berörd produkt: Applikatorset för segmenterad cylinder GM11004150 Berörda versioner/partier: Alla set som används med
Ämne: Upphör att använda Applikatorset för segmenterad cylinder Kommersiellt namn för berörd produkt: Applikatorset för segmenterad cylinder GM11004150 Berörda versioner/partier: Alla set som används med
Viktigt säkerhetsmeddelande Medtronic MiniMed infusionsset Återkallande av specifika partinummer Risk för tillförsel av för mycket insulin
 Viktigt säkerhetsmeddelande Medtronic MiniMed infusionsset Återkallande av specifika partinummer Risk för tillförsel av för mycket insulin September 2017 Medtronicreferens: FA784 Bästa vårdgivare och diabetesteam,
Viktigt säkerhetsmeddelande Medtronic MiniMed infusionsset Återkallande av specifika partinummer Risk för tillförsel av för mycket insulin September 2017 Medtronicreferens: FA784 Bästa vårdgivare och diabetesteam,
Viktigt säkerhetsmeddelande till marknaden
 Viktigt säkerhetsmeddelande till marknaden Den berörda produktens marknadsnamn: Aptio Automation FSCA-identifierare: FSCA AP2 201808 03 FSN-identifierare: FSN AP2 201808 Datum: augusti 2018 Information
Viktigt säkerhetsmeddelande till marknaden Den berörda produktens marknadsnamn: Aptio Automation FSCA-identifierare: FSCA AP2 201808 03 FSN-identifierare: FSN AP2 201808 Datum: augusti 2018 Information
Viktigt säkerhetsmeddelande
 ADVIA Centaur -systemen Dimension Vista -systemen IMMULITE -systemen CC 16-03.A.OUS Januari 2016 Korsreaktivitet för fulvestrant i Siemens Healthcares östradiolanalyser Enligt våra noteringar kan ditt
ADVIA Centaur -systemen Dimension Vista -systemen IMMULITE -systemen CC 16-03.A.OUS Januari 2016 Korsreaktivitet för fulvestrant i Siemens Healthcares östradiolanalyser Enligt våra noteringar kan ditt
VIKTIGT SÄKERHETSMEDDELANDE Återkallelse av produkt
 Årstaängsvägen 25 Box 472 04 SE-100 74 Stockholm, Sweden Tel: +46 (0) 8 775 5100 Fax: +46 (0) 8 645 0808 www.bd.com VIKTIGT SÄKERHETSMEDDELANDE Återkallelse av produkt BD referensnummer: FA_11_049_102
Årstaängsvägen 25 Box 472 04 SE-100 74 Stockholm, Sweden Tel: +46 (0) 8 775 5100 Fax: +46 (0) 8 645 0808 www.bd.com VIKTIGT SÄKERHETSMEDDELANDE Återkallelse av produkt BD referensnummer: FA_11_049_102
Atellica CH instrument Reagensloter , och kalibreringsfel och ökad variabilitet av resultat för kreatinkinas (CK_L)
 Siemens Healthcare Diagnostics Inc. Viktigt säkerhetsmeddelande till marknaden ACHC19-02.A.OUS.ACHC Maj 2019 Atellica CH instrument Reagensloter 280765, 280766 och 280767 kalibreringsfel och ökad variabilitet
Siemens Healthcare Diagnostics Inc. Viktigt säkerhetsmeddelande till marknaden ACHC19-02.A.OUS.ACHC Maj 2019 Atellica CH instrument Reagensloter 280765, 280766 och 280767 kalibreringsfel och ökad variabilitet
BRÅDSKANDE MEDDELANDE: ÅTERKALLELSE AV MEDICINSK UTRUSTNING R APPLIKATIONSINSTRUMENT FÖR STERNAL ZIPFIX
 Synthes GmbH Luzernstrasse 21 4528 Zuchwil Schweiz Tel.: +41 32 720 40 60 Fax +41 32 720 40 61 http://www.depuysynthes.com Till: Sjukhuspersonal Mottagningskvitto krävs 18 augusti 2015 BRÅDSKANDE MEDDELANDE:
Synthes GmbH Luzernstrasse 21 4528 Zuchwil Schweiz Tel.: +41 32 720 40 60 Fax +41 32 720 40 61 http://www.depuysynthes.com Till: Sjukhuspersonal Mottagningskvitto krävs 18 augusti 2015 BRÅDSKANDE MEDDELANDE:
BRÅDSKANDE VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN
 BRÅDSKANDE VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Enhet: FemoSeal instrument för vaskulär förslutning Problem: Potentiell felfunktion i instrumentet Referens: FSN 1703 2017 08 Datum: 14 augusti 2017
BRÅDSKANDE VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Enhet: FemoSeal instrument för vaskulär förslutning Problem: Potentiell felfunktion i instrumentet Referens: FSN 1703 2017 08 Datum: 14 augusti 2017
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN BRÅDSKANDE: ÅTERKALLANDE - KORRIGERINGSÅTGÄRDER FÖR MEDICINTEKNISK PRODUKT
 1 september, 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN BRÅDSKANDE: ÅTERKALLANDE - KORRIGERINGSÅTGÄRDER FÖR MEDICINTEKNISK PRODUKT Angående: Cystoskopibryggor och arbetsinsatser lossnande limfragment
1 september, 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN BRÅDSKANDE: ÅTERKALLANDE - KORRIGERINGSÅTGÄRDER FÖR MEDICINTEKNISK PRODUKT Angående: Cystoskopibryggor och arbetsinsatser lossnande limfragment
Säkerhetsmeddelande till marknaden
 Säkerhetsmeddelande till marknaden 2018 12 14 MSA-2018-002-IU Vänligen vidarebefodra denna information till alla användare hos er [inkl. biomedicinsk personal för kapitalutrustning, materialhantering och/eller
Säkerhetsmeddelande till marknaden 2018 12 14 MSA-2018-002-IU Vänligen vidarebefodra denna information till alla användare hos er [inkl. biomedicinsk personal för kapitalutrustning, materialhantering och/eller
Viktigt säkerhetsmeddelande till marknaden
 1 19 juni 2015 Viktigt säkerhetsmeddelande till marknaden Ämne: Viktig säkerhetsinformation för Verathon GlideScope GVL/AVL Flergångsblad för videolaryngoskop Till våra uppskattade GlideScope-kunder, Verathon,
1 19 juni 2015 Viktigt säkerhetsmeddelande till marknaden Ämne: Viktig säkerhetsinformation för Verathon GlideScope GVL/AVL Flergångsblad för videolaryngoskop Till våra uppskattade GlideScope-kunder, Verathon,
VIKTIGT SÄKERHETSMEDDELANDE ÅTERFÖRSÄLJARE
 VIKTIGT SÄKERHETSMEDDELANDE ÅTERFÖRSÄLJARE Handelsnamn: Female-kateter Nelatonkateter Rektal kateter Mülly-sugkateter LOT-nr: Se tabell på sida 13 FSCA-ID: 2011/09/CTH3 Typ av åtgärd: Återkallande retur
VIKTIGT SÄKERHETSMEDDELANDE ÅTERFÖRSÄLJARE Handelsnamn: Female-kateter Nelatonkateter Rektal kateter Mülly-sugkateter LOT-nr: Se tabell på sida 13 FSCA-ID: 2011/09/CTH3 Typ av åtgärd: Återkallande retur
VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN KORRIGERING
 13 november 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Till: Ämne: Kirurger/sjukhus VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN KORRIGERING Referens: ZFA 2017-425 Berörda produkter: Bone Cement och
13 november 2017 VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN Till: Ämne: Kirurger/sjukhus VIKTIGT SÄKERHETSMEDDELANDE TILL MARKNADEN KORRIGERING Referens: ZFA 2017-425 Berörda produkter: Bone Cement och
Viktiga säkerhetsmeddelanden. Paradigm insulinpumpssystem
 Viktiga säkerhetsmeddelanden Paradigm insulinpumpssystem 5 juli 2013 Till dig som arbetar inom hälso- och sjukvården Bifogat finns viktig säkerhetsinformation och rekommendationer för patienthantering
Viktiga säkerhetsmeddelanden Paradigm insulinpumpssystem 5 juli 2013 Till dig som arbetar inom hälso- och sjukvården Bifogat finns viktig säkerhetsinformation och rekommendationer för patienthantering
VIKTIGT SÄKERHETSMEDDELANDE
 Teleflex Medical IDA Business & Technology Park Dublin Road, Athlone Co. Westmeath, Irland 07 Jan 2010 VIKTIGT SÄKERHETSMEDDELANDE Den berörda produktens kommersiella namn: Typ av åtgärd: Produktnummer:
Teleflex Medical IDA Business & Technology Park Dublin Road, Athlone Co. Westmeath, Irland 07 Jan 2010 VIKTIGT SÄKERHETSMEDDELANDE Den berörda produktens kommersiella namn: Typ av åtgärd: Produktnummer:
