Information från från
|
|
|
- Daniel Danielsson
- för 9 år sedan
- Visningar:
Transkript
1 Information från från Läkemedelsverket Årgång 24 supplement Årgång 26 september nummer oktober 2015 sid 18 Handläggning av RSV-infektioner behandlingsrekommendation Respiratoriskt syncytialvirus (RSV) är en vanlig luftvägspatogen som kan orsaka allvarlig nedre luftvägssjukdom hos spädbarn, immunsupprimerade och äldre individer. Behandlingen är i första hand symtomatisk och understödjande. Profylaktiskt är åtgärder för att undvika smitta av största vikt. Palivizumab är godkänt som profylax mot RSV-infektion hos vissa högriskbarn och har för dem visats ha effekt på behov av sjukhusvård men inte på mortalitet. Tidigare rekommendation förordade en mer restriktiv hållning jämfört med godkänd indikation. Nya data talar för en fortsatt restriktiv hållning. sid 5 Antipsykotiska läkemedel kan ge akuta diabeteskomplikationer Det är väl känt att behandling med antipsykotika kan öka risken för utveckling av typ 2-diabetes. Mindre känt är att behandling också kan leda till akuta diabeteskomplikationer. Hyperglykemiskt hyperosmolärt syndrom och diabetisk ketoacidos är två sällsynta akuta metabola störningar som kan uppstå vid behandling med antipsykotiska läkemedel. sid 7 Rapportera negativa händelser och tillbud med diabetesprodukter Det är viktigt att vårdpersonal uppmärksammar och rapporterar negativa händelser och tillbud med medicintekniska produkter som används av personer med diabetes. Rapporteringar är en stor hjälp för att identifiera områden där förbättringsbehov finns och minska riskerna med produkterna. sid 8 Så godkänns biosimilarer En biosimilar är ett biologiskt läkemedel som innehåller den aktiva substans som finns i ett redan godkänt biologiskt originalläkemedel. Den kemiska strukturen hos aktiva substanser i biologiska läkemedel är vanligen komplex och därför krävs innan en biosimilar godkänns en omfattande karakterisering av biofarmaceutisk och biologisk likhet med referensprodukten. sid 49 Läkemedelsmonografier ellaone (ulipristalacetat) receptfrihet Hemangiol (propranolol) Moventig (naloxegol) Translarna (ataluren) Xultophy (insulin degludek/liraglutid) sid 67 TLV informerar approvals authorisation clinical trials communication competence cosmetics dialogue directiv efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics informati inspection laboratory analysis market surveillance medicinal products medical devic narcotics public health quality registration regulations reliability risk/benefit safety scientific standardisati transparency vigilance approvals authorisation clinical trials communication competence cosmetics dialog directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathi information inspection laboratory analysis market surveillance medicinal products medical devices narcotics
2 LEDARSIDA Tillsynsarbetet fyller en viktig roll för folkhälsan Årets sommar bjöd på regn och rusk som avslutades av en period med sol och värme. Mellan dessa väderomslag hann jag bland annat med att besöka Almedalen där jag deltog i ett seminarium om e-hälsa, en fråga som diskuterades flitigt under årets vecka. Läkemedelsverket har flera olika roller i det arbetet, bland annat som informationsgivare och tillsynsmyndighet, och det är värdefullt att vi är med i diskussionerna. Läkemedelsverket var också representerat genom två medarbetare från Enheten för kontroll av läkemedelsprodukter och narkotika i seminarier om e-cigaretter respektive piratkopierade läkemedel, frågor som är aktuella och intresserar många medborgare. Här spelar Läkemedelsverkets tillsynsarbete en viktig roll för den svenska folkhälsan. I takt med att näthandeln med läkemedel växer medför den ökande handeln tyvärr att även den olagliga handeln med läkemedel och piratkopierade läkemedel ökar. Läkemedelsverket behöver din hjälp Läkemedelsverket arbetar ständigt med att förbättra och utveckla tillsynsarbetet inom sina ansvarsområden. Idag är vår tillsyn selektiv och vi är beroende av att hälso- och sjukvården, organisationer, andra myndigheter och allmänheten hör av sig till oss om man har drabbats av eller uppmärksammat någon form av biverkning av ett läkemedel, eller tror sig ha kommit i kontakt med olagliga läkemedel av något slag. Är du ute och surfar på nätet, ser eller kommer i kontakt med en webbplats som verkar oseriös och säljer läkemedel, bantningsmedel eller kosmetika, där produkten verkar vara för bra för att vara sann eller säljs alldeles för billigt, hör av dig till oss på registrator@mpa.se. Vi behöver din hjälp för att göra ett så bra jobb som möjligt. Ny EU-gemensam symbol För att göra det enklare för konsumenter att veta att de handlar läkemedel säkert på nätet har en ny EU-gemensam symbol tagits fram av EU-kommissionen som visar vilka som har tillstånd att sälja läkemedel på internet. Du kan läsa mer om detta i det här numret. Pandemrix och narkolepsi I det här numret hittar du ett sammandrag av en nyligen publicerad vetenskaplig översiktsartikel som sammanfattar den forskning om narkolepsi och Pandemrix som Läkemedelsverket samordnat, och som gjorts i samverkan med Karolinska Institutet och Folkhälsomyndigheten. Du kan också läsa Läkemedelsverkets nya behandlingsrekommendation om infektioner med respiratoriskt syncytialvirus (RSV). RSV är en vanlig luftvägspatogen som kan orsaka allvarlig luftvägssjukdom hos bland annat spädbarn. Vi redovisar också två regeringsuppdrag som vi presenterade för regeringen under sommaren. Det ena handlar om hur vi ska minska manipuleringen för särskilda recept. Där föreslår Läkemedelsverket bland annat att alla särskilda läkemedel, exempelvis narkotiska läkemedel och anabola steroider, som huvudregel bara ska få förskrivas elektroniskt. Det andra regeringsuppdraget handlar om restnoterade läkemedel. Där föreslår Läkemedelsverket bland annat att alla restnoteringar av läkemedel ska rapporteras till myndigheten och att information om restnoteringar kontinuerligt ska publiceras på vår webbplats. Välkommen till en ny och intressant läshöst med Information från Läkemedelsverket. Inger Andersson Tillförordnad generaldirektör Foto: Sveriges lantbruksuniversitet (SLU). Ansvarig utgivare: Catarina Andersson Forsman Information från Läkemedelsverket Box 26, Uppsala Telefon Telefax E-post: tidningsredaktionen@mpa.se Redaktion: Kristina Bergström, Christina Hambn, Ulrika Jonsson, Helén Liljeqvist och Sophia Persson Käll. Ytterligare exemplar kan rekvireras från: Medicinsk information ISSN Tryck: Taberg Media AB, 2015 Har du ändrat adress? Vill du ha tidningen till en ny adress ber vi dig skicka både din nya och gamla adress till oss via e-post eller brev. 2 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
3 INNEHÅLL Innehåll Nyheter och rapporter Ny EU-gemensam symbol för internethandel med läkemedel... 4 Biverkningsrapportering hur gör man?... 5 Antipsykotiska läkemedel och akuta diabeteskomplikationer... 5 Rapportera negativa händelser och tillbud med diabetesprodukter... 7 Principer för bedömning vid godkännande av biosimilarer... 8 Förslag för att minska manipulering av recept för särskilda läkemedel Förslag om att alla restnoteringar av läkemedel rapporteras Rättelse i behandlingsrekommendationen Läkemedelsbehandling vid astma Kroniskt obstruktiv lungsjukdom (KOL) behandlingsrekommendation webbpubliceras Läkemedelsverket sammanfattar svensk forskning om narkolepsi och Pandemrix i vetenskaplig artikel Granskning av diabetesläkemedel av typen SGLT2-hämmare inledd Medicintekniska fokusområden Problem med näs-, mun- och halssprayer Säkerhetsprofilen för vaccin mot humant papillomvirus (HPV) ska klargöras ytterligare av EMA Långvarig restnotering för Zovirax 3 % ögonsalva Calcium-Sandoz injektionsvätska försvinner från marknaden Handläggning av RSV-infektioner Behandlingsrekommendation Bakgrundsdokumentation Respiratoriskt syncytialvirus bakgrund Virologi, diagnostik och smittspridning Profylax mot RSV-infektion till barn som är födda extremt prematurt, barn med lungsjukdom eller vissa andra tillstånd Profylax mot RSV-infektion till hjärtsjuka barn Behandling vid RSV-infektion RSV-infektion vid immunsuppression samt hos vuxna och äldre Läkemedelsmonografier ellaone (ulipristalacetat) receptfrihet Hemangiol (propranolol) Moventig (naloxegol) Translarna (ataluren) Xultophy (insulin degludek/liraglutid) Tandvårds- och läkemedelsförmånsverket informerar TLV informerar Frågor till Läkemedelsverket Frågor till Läkemedelsverket Biverkningsblanketter Uppgift om biverkningar hos djur Biverkningsrapport från sjukvården Informationsblad om patientsäkerhet för medicintekniska produkter Tidigare utgivna nummer Tidigare utgivna nummer INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015 3
4 NYHETER OCH RAPPORTER Nyheter och rapporter Söker du nyheter om bristsituationer, indragningar eller säkerhetsfrågor? På vår webbplats, publicerar vi löpande information om detta, men även om större utredningar, lagändringar och mycket annat. Här följer artiklar om aktuella frågor vi vill informera om. Ny EU-gemensam symbol för internethandel med läkemedel Nu införs en ny EU-gemensam symbol för internethandel med läkemedel. Alla som har tillstånd att sälja läkemedel på distans via internet ska ha symbolen på sina webbplatser. Syftet är att konsumenten enklare ska kunna hitta de lagliga aktörerna. Figur 2. Den nationella symbolen för apotek som infördes Den EU-gemensamma symbolen (se Figur 1) visar vilka som lagligt får sälja läkemedel på internet. Konsumenten ska genom att klicka på symbolen snabbt kunna se om den aktuella webbplatsen har anmält webbhandel med läkemedel och i vilket land. Varje lands läkemedelsmyndighet ansvarar för en lista med registrerade webbhandlare som man länkas till när man klickar på symbolen. På Läkemedelsverkets webbplats finns en lista över alla aktörer i Sverige som har anmält webbhandel med läkemedel. Syftet med symbolen är att konsumenten enkelt ska kunna avgöra om handeln är laglig. Svenska apotek ska också visa den nationella apotekssymbolen (se Figur 2). Figur 1. Den nya EU-symbolen för webbhandel med läkemedel. Faktaruta 1. Olagliga läkemedel. Olagliga läkemedel är ett allvarligt problem för sjukvården i många länder med dålig regulatorisk kontroll. I EU har ökad internethandel medfört att konsumenter allt oftare kommer i kontakt med olagliga läkemedel. Olagliga läkemedel är läkemedel som inte är godkända och som kan vara piratkopior eller vara av dålig kvalitet kan sakna aktiv substans eller innehålla fel mängder kan innehålla ämnen som är hälsofarliga, till exempel läkemedelssubstanser som inte angivits på förpackningen. Det enda sättet att skydda sig mot olagliga läkemedel är att handla från apotek och handlare med tillstånd att sälja läkemedel! Samtliga nummer av Information från Läkemedelsverket finns på 4 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
5 Biverkningsrapportering hur gör man? Den 25 juni 2015 publicerade Läkemedelsverket en e- utbildning angående biverkningsrapportering. Utbildningen är framtagen i samverkan med regionala biverkningscentra inom universitetslandstingen och genomförs som en självstudie. Materialet finns tillgängligt via Läkemedelsverkets webbplats och är främst tänkt att användas vid olika utbildningar av hälso- och sjukvårdspersonal inom både grund- och fortbildning. NYHETER OCH RAPPORTER Utbildningsmaterialet förklarar och besvarar frågor kring varför, vad, hur och vem som kan eller ska biverkningsrapportera och innehåller även olika fallexempel. Det belyser rapporteringens betydelse för läkemedelssäkerheten och regelverk som styr denna verksamhet. Den rapportering av biverkningar som hälso- och sjukvårdspersonal lämnar in fyller en viktig funktion i det löpande säkerhetsarbetet med godkända läkemedel. Även biverkningsrapporter från konsumenter utgör sedan 2008 en del i säkerhetsarbetet med läkemedel. Du hittar materialet på Läkemedelsverkets webbplats ( Öppna gärna utbildningen i presentationsvy för bästa funktionalitet av länkarna. Antipsykotiska läkemedel och akuta diabeteskomplikationer Det är väl känt att antipsykotiska läkemedel kan öka risken för typ 2-diabetes. Läkemedelsverket vill nu även uppmärksamma att det förekommer akuta diabeteskomplikationer. I vår svenska biverkningsdatabas finns 87 rapporter om antipsykotiska läkemedel där den rapporterade reaktionen varit hyperglykemi/diabetes. De flesta rapporter berör ett potentiellt samband mellan behandling med antipsykotiska läkemedel och utveckling av typ 2-diabetes, alternativt ett försämrat blodsockerläge vid känd diabetes. Det finns också ett fåtal rapporter som beskriver situationer med akuta metabola störningar såsom hyperglykemiskt hyperosmolärt syndrom eller diabetisk ketoacidos. Ett par sådana rapporter presenteras nedan. Ökad risk för diabetes vid schizofreni Risken för att utveckla diabetes är tre till fyra gånger förhöjd hos personer med schizofreni. En del av diabetesrisken sammanhänger med övervikt, vilken i sin tur kan vara betingad av exempelvis inaktiv livsstil, ohälsosamma kostvanor och/ eller läkemedelsbehandling. En känd biverkning vid behandling med de flesta antipsykotiska läkemedel är viktökning. Den är särskilt uttalad för olanzapin, klozapin och quetiapin och ses i mindre grad med risperidon och första generationens antipsykotika. Viktökningen ses som regel tidigt i behandlingen (inom de första sex veckorna) för att sedan plana ut. Totalt kan den uppgå till kg. Viktuppgång är därför en tidig parameter som kan indicera en senare utveckling av metabolt syndrom, som i sin tur ökar risken för typ 2-diabetes och hjärtkärlkomplikationer (1). Det är även känt att behandling med antipsykotika kan öka risken för diabetes utan relation till viktuppgång (1). Risken är förhöjd framför allt för olanzapin och i något lägre grad för klozapin. Patologiskt fasteglukos är vanligen ett sent tecken på metabol påverkan. För flera antipsykotiska preparat finns dock enstaka fall beskrivna med en hastigt utvecklad diabetes tidigt efter insättande av antipsykotisk behandling (2). Diabetesrisken är tre till fyra gånger förhöjd hos personer med schizofreni Akuta komplikationer Grav metabol störning i samband med typ 2-diabetes kan antingen resultera i diabetisk ketoacidos eller ett hyperglykemiskt hyperosmolärt syndrom (HHS, benämns även hyperosmolärt non-ketotiskt syndrom [HNKS]). Den kliniska bilden vid de båda tillstånden liknar varandra och laboratoriediagnostik krävs för att skilja dem åt. Utlösande faktorer är ofta infektioner eller andra akuta sjukdomar såsom hjärtinfarkt, stroke eller trauma. Avgörande för om en inkompenserad diabetes utvecklas till diabetisk ketoacidos eller HHS anses framför allt vara INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015 5
6 NYHETER OCH RAPPORTER balansen mellan insulin och insulin-antagonistiska hormoner. Insulinbrist samt höga nivåer av katekolaminer och glukagon leder till ökad ketonkroppsproduktion och främjar utvecklingen av diabetisk ketoacidos. Vid HHS kan istället insulinresistens vara det dominerande problemet och svår hyperglykemi kan uppstå utan samtidig ketoacidos. Vid HHS är den cirkulerande mängden insulin låg men tillräcklig för att förebygga lipolys, vilket är orsaken till att ketoacidos inte utvecklas (3). Hyperglykemiskt hyperosmolärt syndrom Hyperglykemiskt hyperosmolärt syndrom är en sällsynt komplikation som oftast drabbar äldre patienter (60 75 år) med känd eller nydebuterad typ 2-diabetes. Mortaliteten är hög (30 60 %) (3). Den svåra dehydrering som uppstår till följd av hyperglykemi och osmotisk diures är ofta huvudproblemet. I laboratoriestatus saknas ketoacidos. Vanligen är B-glukos > 33 mmol/l (referensvärde [ref] för icke fastande < 10) och S-osmolalitet > 320 mosmol/kg (ref ). S-osmolalitet kan uppskattas med formeln: 2 S-Na + B-glukos + S-urea (3). Hyperglykemiskt hyperosmolärt syndrom är en sällsynt komplikation Diabetisk ketoacidos Diabetisk ketoacidos är en akut komplikation som vanligen förknippas med typ 1-diabetes, men ketoacidos förekommer även vid typ-2 diabetes. Hos patienter med typ 2-diabetes och ketoacidos är B-glukos vanligen > 20 mmol/l (ref för icke fastande < 10), ph < 7,30 (ref 7,35 7,45) och/eller standardbikarbonat < 17 mmol/l (ref 22 27). Dessutom är ketoner i blod klart förhöjda (4). Fall 1 Kvinna i 70-årsåldern med paranoid schizofreni och upprepade aspirationspneumonier. Hon behandlas med klozapin 300 mg till natten, övrig medicinering består av levomepromazin 25 mg vid behov, levotyroxin, alprazolam, zopiklon, alimemazin, esomeprazol, paracetamol, och terbutalin. P-glukos cirka 10 mmol/l två månader före insjuknandet, men helt normalt ytterligare två månader tillbaka i tiden. Från gruppboendet rapporteras feber sedan ett dygn tillbaka och glukossticka med high-high. I ambulansen är patienten medvetandesänkt (RLS 3), blodtryck 70/40 mmhg och temperatur 38,8 grader. Behandling med intravenös vätska påbörjas omgående. Vid ankomst till sjukhus har blodtrycket stigit till 90/50 mmhg. Patienten är fortsatt medvetandesänkt, men ej nackstel. Babinskis tecken saknas. P-glukos 86,7 mmol/l (senare värden sjunkande: 67, 59 etc.), S-Na 161 mmol/l (ref ), S-Kalium 4,0 mmol/l (ref 3,6 4,6), S-kreatinin 209 µmol/l (ref 50 90), S-osmolalitet 457 mosmol/kg (ref ), ph 7,27 (ref 7,35 7,45). Datortomografi av thorax visar litet infiltrat. Fortsatt behandling med vätska, insulin, antibiotika etc. utan att situationen stabiliseras och patienten avlider påföljande dag. Fall 2 Drygt 80-årig kvinna med mångårig psykossjukdom som vårdas på ett äldreboende. Medicinerar med risperidon 3 mg/dag (sedan sex månader tillbaka), samt litium, karbamazepin, diazepam, oxazepam, zopiklon, simvastatin, furosemid och hydroxizin. Hon hittas okontaktbar i sängen och ambulans tillkallas. Vid ankomst till sjukhus är p-glukos 80,7 mmol/l, S-Na 139 mmol/l (ref ), S-kreatinin 341 µmol/l (ref 45 90), S-urea 22,6 mmol/l (ref 3 10). Blodgas med ph 7,05 (ref 7,35 7,45) och BE -25 mmol/l (ref 3 till 3). (Uppgift om S-osmolalitet saknas, men kan skattas till 380 mosmol/kg; ref ). Datortomografi av hjärnan visar inte något anmärkningsvärt. Hon behandlas på IVA. All tidigare medicinering seponeras. Under de första dagarna är hon ej kontaktbar, men vaknar successivt till. Inom fyra dygn har blodproverna, förutom blodsocker, i stort normaliserats. Fortsätter med insulin en till två månader som därefter kan seponeras och patienten klarar sig med enbart kostbehandling. Litium återinsätts. Fall 3 En knappt 50 år gammal man med bipolär sjukdom, hypertoni och obesitas (vikt 110 kg). HbA1c fyra månader före insjuknandet på 5,5 % (ref < 5,0 %). Behandling med olanzapin 20 mg/dag påbörjas på grund av maniskt skov. Därutöver sedan tidigare medicinering med levomepromazin, klorpromazin, zuklopentixol, valproinsyra, zopiklon och metoprolol. Sex dagar efter behandlingsstart med olanzapin blir patienten medvetandesänkt och inkommer till sjukhus med P-glukos 84 mmol/l, S-Na 151 mmol/l (ref ), S-K 4,8 mmol/l (ref 3,6 4,6), S-kreatinin 332 µmol/l (ref ), S-osmolalitet 475 mosmol/kg (ref ), ph 7,17 (ref 7,35 7,45). HbA1c 16 % (ref < 5,0 %). Datortomografi av buken visar lätt till måttlig pankreatit. Amylas 7,7 13 µkat/l (ref 0,4 2,0). Patienten vårdas på IVA och tillfrisknar. Sammanfattning Sammanfattningsvis ökar antipsykotiska läkemedel risken för att insjukna i typ 2-diabetes. Det är känt att man även kan insjukna relativt hastigt i en akut komplikation, till exempel hyperglykemiskt hyperosmolärt syndrom, som har en mycket allvarlig prognos. Läkemedelsverket framhåller vikten av en adekvat uppföljning vid behandling med antipsykotiska läkemedel. Referenser 1. Läkemedelsbehandling vid schizofreni behandlingsrekommendation. Information från Läkemedelsverket 2013;24(5): Gothefors D. Kliniska riktlinjer att förebygga och handlägga metabol risk hos patienter med allvarlig psykisk sjukdom Attvall S. Hyperosmolärt non-ketotiskt syndrom (HNKS). Internetmedicin Elvanides H, Eriksson JW. Ketoacidos förekommer även vid typ 2-diabetes. Läkartidningen 1999;96(34): INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
7 NYHETER OCH RAPPORTER Rapportera negativa händelser och tillbud med diabetesprodukter Det är viktigt att personal i diabetesvården uppmärksammar och rapporterar negativa händelser och tillbud med de medicintekniska produkter som används av personer med diabetes. Läkemedelsverket har under 2013 och 2014 fått in endast tio rapporter från vården där anmälan gäller en diabetesprodukt. Under samma period inkom 170 (2013) respektive 540 (2014) rapporter från tillverkare. De rapporterade händelserna handlade om insulinpumpar, insulinpennor och engångsprodukter som används vid behandling av diabetes. Vad gäller blodsockermätare, blodsockerstickor och sensorer rapporterade tillverkarna totalt 15 händelser under de två aktuella åren. Användarna av diabetesprodukter har numera ofta direktkontakt med leverantörer även när det uppstår problem. Detta kan vara en av anledningarna till att vårdpersonalen inte alltid får kännedom om de problemsituationer som har uppstått vid användning av produkter. Den stora skillnaden mellan antalet rapporter från tillverkare, i förhållande till antalet rapporter från vården, kan även till viss del förklaras av skillnader i bedömningen av rapporteringskriterier. För att kunna upptäcka alla förekommande fel och brister med produkter behöver vårdpersonalen arbeta mer proaktivt och ställa frågor till diabetespatienter om hur deras produkter fungerar samt rapportera eventuella händelser, både till berörda tillverkare och till ansvariga myndigheter. Vårdpersonal har en viktig roll i det förebyggande arbetet kring patientsäkerheten Viktigt att rapportera Vårdpersonalen har en viktig roll i det förebyggande arbetet kring patientsäkerheten. Att uppmärksamma negativa händelser och tillbud och rapportera dessa utgör en grund för arbetet med att minimera risken för liknande situationer som kan leda till att patienter/användare riskerar att skadas och måste uppsöka sjukvården. En rapportering till tillverkare och myndigheter ska ses som ett tecken på att verksamheten har fungerande rutiner i sitt säkerhetsarbete kring patienter och användare av diabetesprodukter. Rapporteringar är en stor hjälp för att identifiera områden där förbättringsbehov finns och för att minska riskerna med produkterna. Vården kan därmed vara aktivt delaktig i den framtida utvecklingen av säkrare och mer ändamålsenliga diabetesprodukter. Negativ händelse och tillbud medicinteknik Rapporteringsplikten beskrivs i Socialstyrelsens föreskrifter (SOSFS 2008:1) om användning av medicintekniska produkter i hälso- och sjukvården. Inom varje verksamhet ska det finnas en anmälningsansvarig utsedd av verksamhetschefen och en rutin ska finnas för att anmäla dessa händelser. Till en negativ händelse eller tillbud räknas funktionsfel och försämring av en produkts egenskaper eller prestanda, felaktigheter och brister i märkningen eller bruksanvisningen, som kan leda till eller har lett till en patients, en användares eller någon annan persons död eller en allvarlig försämring i hälsotillståndet. Läkemedelsverket vill understryka vikten av rapporteringar vid negativ händelse och tillbud med diabetesprodukter. Om en patient eller användare fått eller riskerar att få en påverkan på sitt hälsotillstånd gäller rapporteringsplikten. Händelsen kan till exempel handla om knappar på en insulinpump som har slutat att fungera, en infusionsslang som läcker, en nål som har gått av eller en bruksanvisning som är felaktig. Även en svårhantering produkt eller en bristfällig alternativt missvisande bruksanvisning kan behöva rapporteras för att förhindra framtida negativa händelser och tillbud. En aktiv rapportering från diabetesvården kan på sikt även bidra till ökad kunskap om oönskade effekter med diabetesprodukter, samt bidra till ökad forskning och utveckling inom området. Rapportering Rapporteringsblanketten kan hämtas både från Läkemedelsverkets och IVO:s (Inspektionen för vård och omsorg) webbplatser, se respektive Rapporten skickas till tillverkaren av produkten med en kopia till Läkemedelsverket. Läkemedelsverket övervakar därefter tillverkarens utredning av händelsen samt att tillverkaren vidtar de åtgärder som krävs. Läkemedelssäkerhet, regeländringar, medicinteknik eller något annat vad vill du läsa om i Information från Läkemedelsverket? Tipsa redaktionen via tidningsredaktionen@mpa.se INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015 7
8 NYHETER OCH RAPPORTER Principer för bedömning vid godkännande av biosimilarer En biosimilar är ett biologiskt läkemedel som innehåller den aktiva substans som finns i ett redan godkänt biologiskt originalläkemedel (så kallad referensprodukt). För att biologiska läkemedel ska godkännas som biosimilara fordras en omfattande karakterisering av biofarmaceutisk och biologisk likhet med referensprodukten. Om likhet i dessa avseenden övertygande visats kan kunskapen om den kliniska effekt- och säkerhetsprofilen för referensprodukten i stor utstäckning extrapoleras till det nya läkemedlet, och därmed minskar behovet av klinisk dokumentation för ett regulatoriskt godkännande. Denna artikel beskriver de grundläggande principerna för den regulatoriska värderingen av biosimilarer. Bakgrund och definitioner I takt med att fler biosimilarer blir godkända ökar intresset för frågan om deras förväntade effekt- och säkerhetsprofiler i relation till referensprodukten. Vi har numera en tämligen lång och gynnsam erfarenhet av biosimilarer (epoetin, filgrastim, tillväxthormon) där de första godkändes Med början 2013 har monoklonala antikroppar, som till sin struktur är mer komplexa, godkänts som biosimilarer, och fler ansökningar för godkännande är att vänta de närmaste åren. Avsikten är här att kort beskriva den dokumentation som krävs för att godkänna en biosimilar. De flesta biosimilarer godkänns i den centrala regulatoriska proceduren, det vill säga att värderingen görs gemensamt av alla EU-länder. De definitioner av generika och biosimilarer som ges i läkemedelslagstiftningen är likartade. För båda gäller att definitionerna baseras på likhet med substansen som den föreligger i referensprodukten och att det ska finnas lång erfarenhet av referensprodukten (> 10 år på EU-marknaden). Normalt har biosimilarer, liksom generika, samma läkemedelsform och samma styrka som referenspreparatet. Godkännandet omfattar också i normalfallet referensproduktens alla indikationer. Dokumentationskrav Den kemiska strukturen hos aktiva substanser i generika är mindre komplexa än hos biologiska läkemedel och kan fullständigt karakteriseras. Den kliniska dokumentationen kan då inskränkas till ekvivalensstudier som måste visa att upptaget av generikaformuleringen uppfyller strikta kriterier för likhet med referensprodukten. För biologiska läkemedel såsom terapeutiska proteiner, med deras större komplexitet jämfört med generiska små molekyler, kan strukturell likhet inte fullständigt visas med fysikalkemiska metoder; det vill säga att kliniskt relevanta skillnader mot referensprodukten inte kan uteslutas endast genom karaktärisering av molekylen. Därför krävs i allmänhet, förutom att likhet i struktur demonstreras, studier av farmakokinetik och farmakodynamik för att ytterligare bekräfta att inga kliniskt relevanta skillnader missats vid den fysikalkemiska karaktäriseringen. Behovet av kliniska studier styrs av hur pass övertygande likhet som har visats i termer av struktur, farmakokinetik och farmakodynamik. Om övertygande likhet visas i dessa avseenden minskar behovet av omfattande kliniska studier som dessutom ofta är mer okänsliga för att detektera skillnader. Strukturell likhet kan inte fullständigt visas med fysikalkemiska metoder Fysikalkemisk och biologisk karakterisering Förutom omfattande studier för att visa jämförbara fysikalkemiska egenskaper krävs biokemiska karakteriseringsstudier för att säkerställa att biosimilar och referensprodukt uppträder på samma sätt i såväl bindningsstudier som i studier av biologisk aktivitet in vitro. Den dokumentation som krävs är jämförbar med de krav som ställs för godkännande av en ändring i tillverkningsprocessen hos ett redan godkänt biologiskt läkemedel. För alla läkemedel finns en viss variation mellan olika satser men variationen är generellt större för biologiska läkemedel. Denna variation måste hålla sig inom givna specifikationsgränser. Värderingen av biosimilaritet tar hänsyn till sådan variation för såväl referensprodukten som för biosimilaren. I den fysikalkemiska karakteriseringen av den aktiva substansen ingår givetvis att kartlägga det aktiva proteinets molekylvikt och aminosyrasekvens, dess glykosyleringsmönster, dess sekundära och tertiära struktur, men också att dokumentera vilka strukturella varianter av proteinet som förekommer och i vilka relativa mängder de föreligger. Värdcellsproteiner eller andra rester från den cellinje som använts i produktionen måste kvantifieras. Vidare behöver den slutliga läkemedelsformuleringens lämplighet (exempelvis ph, osmolalitet) och stabilitet (eventuell tendens till aggregat och partikelbildning, andra nedbrytningsprocesser) studeras. När det gäller bindningsstudier och mått på biologisk aktivitet kan karakteriseringen exemplifieras med vad som kan krävas för monoklonala antikroppar riktade mot TNFα, se Tabell I. I studier av bindning och biologisk aktivitet är det viktigt att metoderna är tillräckligt känsliga för att detektera så små skillnader mellan referens- och biosimilarprodukt att de rimligen saknar klinisk betydelse. 8 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
9 NYHETER OCH RAPPORTER Tabell I. Karakterisering av biologisk aktivitet in vitro (anti-tnfɑ-antikroppar). Bindningsstudier TNFɑ binding FcyRIa binding FcyRIIa binding FcyRIIb/c binding FcyRIIIa binding FcyRIIIb binding FcRn C1q receptor binding Biologisk aktivitet Inhibition of TNFɑ induced cytotoxicity assay NFkB Reporter Gene Assay ADCC CDC Prekliniska och kliniska dokumentationskrav Prekliniska djurmodeller har i allmänhet en mycket begränsad plats i värderingen av biosimilaritet då adekvata modeller oftast saknas. Farmakokinetik Som en del av det kliniska programmet ingår farmakokinetiska studier där man jämför referens- och biosimilarprodukt. För att biosimilaren ska kunna accepteras krävs det att produkterna visar likhet i relevanta kinetikparametrar (AUC och C max ) i dessa studier. Då produkterna som jämförs inte innehåller identisk aktiv substans, till skillnad från situationen med ett generikum, ställs också krav på likhet i parametrar som beskriver eliminationsfasen (clearance eller halveringstid) av koncentrationstidskurvan (kinetikprofilen). Ett problem kan vara att publika data för referenspreparatet många gånger är begränsade Farmakodynamiska och kliniska studier Som för all annan dokumentation som syftar till att visa likhet mellan biosimilar och original utgörs de kliniska effektoch säkerhetsstudierna av ekvivalensstudier. De syftar således inte till att oberoende dokumentera effekten av biosimilaren, utan görs för att komplettera den övriga karaktäriseringen av likhet med referensprodukten. För att renodla möjligheterna att detektera eventuella skillnader är det önskvärt att om möjligt studera läkemedlen i monoterapi, helst i en så homogen population som möjligt och på ett indikationsområde där originalet visat hög aktivitet. Därutöver tenderar farmakodynamiska utfallsmått att vara känsligare än mer kliniskt relevanta utfall vad gäller att påvisa eventuella skillnader mellan biosimilar och original. Den kliniska dosen av läkemedel är ofta högre än den dos som behövs för att uppnå maximal effekt på gruppnivå. Detta minskar möjligheterna att påvisa skillnader mellan biosimilar och original, varför en jämförelse av lägre doser, där relationen mellan koncentration och effekt är skarpare, ofta är att föredra. Av sådana skäl skiljer sig ofta den kliniska studiedesignen i ett biosimilarprogram från det vanliga när en ny produkt utvecklas. När det gäller kliniska studier finns för vissa typer av produkter accepterade farmakodynamiska markörer såsom stegring av neutrofila leukocyter inducerat av filgrastim, eller glukosbehov vid kontrollerad infusion av insulin. Här kan man värdera likhet i uppnådd effekt mellan referens och test på olika dosnivåer, och i friska försökspersoner. I princip kan farmakodynamikstudier även utföras med biomarkörer som saknar uppenbart samband med klinisk effekt, under förutsättningen att underliggande farmakologi är välkarakteriserad och att tydligt samband mellan dos/exponering och aktivitet kan visas i studier med två eller flera doser. När det gäller säkerhetsprofilen är grundprincipen densamma, det vill säga skillnader mot referensprodukten accepteras inte. Dock kan biosimilaren i vissa avseenden tillåtas uppvisa fördelar, till exempel om mängden värdcellsproteiner eller andra föroreningar är lägre eller om en lägre immunogenicitet eller färre infusionsreaktioner kan förväntas. Eftersom tillverkningsprocessen kan skilja sig mellan biosimilar och referensprodukt måste processrelaterade föroreningar kvalificeras avseende toxicitet oberoende av referensproduktens dokumentation. Just kartläggning av eventuellt annorlunda immunogenicitet än hos referensprodukten är en av de mest betydelsefulla aspekterna av säkerhetsdokumentationen för en ny biosimilar. Syftet med de kliniska effekt- och säkerhetsstudierna är således att ytterligare stödja att den likhet som visats i den övriga dokumentationen leder till likhet också i detta avseende. Däremot kan påvisade olikheter, till exempel avseende farmakokinetik, inte kompenseras av likhet i effekt och säkerhet. Detta på grund av den lägre förmågan att detektera skillnader i sådana studier. Ett problem för företag som söker godkännande för en biosimilar kan vara att publika data för referenspreparatet många gånger är begränsade. Mer dokumentation finns då ofta hos de regulatoriska myndigheterna vilket ökar möjligheterna att identifiera eventuella behov av klarlägganden eller förtydliganden. En vanlig fråga när referensprodukten är godkänd för flera indikationer är om klinisk dokumentation bör krävas för biosimilaren för fler än en av de givna indikationerna. Mot bakgrund av den omfattande dokumentation som krävs vad avser kvalitet, biologisk aktivitet och farmakokinetik kan man, framför allt i de fall där farmakodynamisk ekvivalens vistats på ett övertygande sätt, godkänna biosimilaren för originalets samtliga indikationer trots att effekt och säkerhet dokumenterats endast för en indikation. Farmakodynamisk ekvivalens förutsätter att minst två dosnivåer undersökts och att det finns känsliga utfallsmått. Om inte farmakodynamisk ekvivalens övertygande kan visas kan bryggande studier mellan olika terapiområden krävas. INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015 9
10 NYHETER OCH RAPPORTER Säkerhetsuppföljning efter godkännande För alla nya läkemedel ska en riskhanteringsplan (Risk Management Plan, RMP) ingå i godkännandet som beskriver viktiga risker, hur dessa ska minimeras och följas upp efter marknadsintroduktion. I planen ingår en säkerhetsspecifikation, det vill säga en beskrivning av säkerhetsprofilen med viktiga identifierade risker, viktiga potentiella risker och eventuella brister i kunskapen. Vidare finns en farmakovigilansplan som beskriver hur de olika riskerna följs upp; dels som en del av den rutinmässiga uppföljningen (till exempel periodisk säkerhetsuppföljning), dels i vissa fall genom ytterligare åtgärder som exempelvis via olika former av ickeinterventionsstudier. I en riskminimeringsplan anges vilka försiktighetsåtgärder som implementeras via produktinformationen (kontraindikationer, varningar och försiktighet med flera) och om åtgärder utöver detta krävs, som exempelvis utbildningsprogram och patientkort. Säkerhetsspecifikationen och riskminimeringsplanen för referensprodukten och biosimilaren är i allmänhet lika. I farmakovigilansplanen ingår för vissa biosimilarer ytterligare karakterisering av immunogenicitet, eller sådan uppföljning i icke-interventionsstudier som redan krävts för referensprodukten. Det kan förväntas att sjukvården i vissa fall tar initiativ till att följa effekt och säkerhetsaspekter nationellt efter introduktion av en biosimilar, i till exempel befintliga kvalitetsregister. Detta i tillägg till den uppföljning som företaget åtagit sig att göra i samband med godkännandet. Minst lika angeläget bör det vara att följa upp helt nya biologiska läkemedel på liknande sätt. Sådana initiativ välkomnas av Läkemedelsverket som gärna också bistår med vetenskaplig rådgivning i samband med upprättande av protokoll för den typen av uppföljning. För analys av eventuella säkerhetsproblem är spårbarheten av produkten viktig. Den underlättas av att biosimilara läkemedel har ett annat kommersiellt namn än referensprodukten. Det finns legala krav på att det ska vara möjligt att spåra distributionen av en enskild tillverkningssats av en biologisk produkt ner på patientnivå. Dessa krav ska tillgodoses på nationell nivå och formerna för detta ingår alltså inte i det EU-centrala godkännandet. Någon generell teknisk lösning för att säkra spårbarhet ner till patientnivå finns ännu inte i Sverige, utan tills vidare ska batchnummer dokumenteras i patientjournal och/eller på annat sätt, exempelvis i befintliga patientregister. För produkter där patienten själv administrerar läkemedlet måste särskilda lösningar skapas. Utbytbarhet Möjligheter till utbytbarhet på apotek är något som beslutas nationellt och Läkemedelsverkets inställning är hittills att utbytbarhet på apotek inte accepteras. Läkemedelsverket bedömer det rimligt att undvika täta produktbyten eftersom det då kan vara svårare att relatera vissa typer av biverkningar, till exempel immunologiska sådana, till en specifik produkt. De positiva erfarenheter som finns från användningen av biosimilarer har dock lett till en diskussion i vissa EU-länder om en begränsad utbytbarhet baserad på samtycke hos patient och förskrivare. Läkemedelsverket följer dessa diskussioner samt de studier som pågår runt frågeställningen. För analys av eventuella säkerhetsproblem är spårbarheten av produkten viktig Sammanfattning Godkännande av biologiska läkemedel som biosimilara syftar till att ställa relevanta krav på dokumentation av likhet för en produkt där betydande effekt- och säkerhetserfarenhet finns för referensprodukten. Förhoppningen är att konceptet, i likhet med generikalagstiftningen, ska ge möjlighet till minskade utvecklingskostnader, priskonkurrens och i slutändan billigare läkemedel och därmed möjlighet att ge fler patienter tillgång till effektiv behandling. Från kliniskt håll möts ibland biosimilarer med viss skepsis; man är förtrogen och trygg med referensprodukterna och fokuserar inte sällan på att klinikdokumentationen är begränsad. Man ska dock vara medveten om att kraven för att dokumentera likhet i fysikalkemiska karakteristika och biologiska effekter är omfattande, och att det mot den bakgrunden inte ter sig rimligt att begära nya stora kliniska studier för biosimilarer för att återigen dokumentera den effekt- och säkerhetsprofil som är väl känd för referensprodukten. Syftet med de kliniska studierna är snarare att komplettera den fysikalkemiska karaktäriseringen av likhet med originalprodukten. Vid större förändringar i tillverkningen av etablerade biologiska läkemedel har sedan en längre tid samma principer tillämpats för att visa att de inte leder till förändringar som skulle kunna påverka klinisk effekt och säkerhet. Det finns därför en betydande erfarenhet hos de regulatoriska myndigheterna att värdera likhet mellan biologiska produkter, ett arbete för vilket också alltmer raffinerade metoder står till förfogande. Samtliga nummer av Information från Läkemedelsverket finns på 10 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
11 NYHETER OCH RAPPORTER Förslag för att minska manipulering av recept för särskilda läkemedel Alla särskilda läkemedel ska som huvudregel bara få förskrivas elektroniskt. Detta har Läkemedelsverket och Socialstyrelsen föreslagit i en utredning till regeringen. Syftet är att försvåra möjligheterna att manipulera och förfalska recept. Regeringen gav under 2014 Läkemedelsverket i uppdrag att tillsammans med Socialstyrelsen utreda möjligheterna att minska, alternativt helt upphöra med, förskrivning av narkotiska läkemedel via särskilda receptblanketter. Den särskilda receptblanketten används vid förskrivning av alla läkemedel som klassas som särskilda läkemedel enligt bilaga 8 till Läkemedelsverkets föreskrifter (LVFS 2009:13), till exempel narkotiska läkemedel och anabola steroider. Syftet är att försvåra möjligheterna att manipulera och förfalska recept Inte ovanligt med manipulering av särskilda receptblanketter En liten del av alla recept på särskilda läkemedel, cirka i månaden, skrivs fortfarande ut på pappersblanketter. Trots att pappersrecepten har speciella säkerhetsdetaljer är det inte ovanligt att de manipuleras eller förfalskas. En vanlig form av manipulering är att den etikett som klistras på receptet vid en expediering rivs bort så att det ser ut som om receptet inte är expedierat. Det förekommer även att patienten ändrar volymen förskrivna läkemedel. Branchorganisationen Svensk Apoteksförening har uppmärksammat uppemot hundra fall av manipulering under en halvårsperiod, men troligtvis finns ett mörkertal. Elektronisk förskrivning som huvudregel För att komma tillrätta med problemet föreslår Läkemedelsverket och Socialstyrelsen skärpta krav på att alla särskilda läkemedel i huvudsak ska förskrivas elektroniskt. Det kan dock börja gälla först när samtliga förskrivare, även de som inte arbetar åt ett landsting eller en annan vårdgivare, har tillgång till elektroniskt förskrivarstöd. Möjligheten att skriva ut särskilda läkemedel på andra sätt än elektroniskt föreslås finnas kvar endast i undantags- och brådskande fall. Det gäller till exempel vid strömavbrott, driftstörningar eller vid förskrivning till personer som saknar svenskt personnummer. Förslag att förvara recept på apotek Fram till dess att ett webbaserat ordinationsverktyg är tillgängligt för alla förskrivare föreslår Läkemedelsverket och Socialstyrelsen att alla pappersrecept på särskilda läkemedel måste förvaras på apoteket efter det första uttaget, vilket innebär att patienten måste återkomma till samma apotek för att hämta ut eventuellt resterande uttag. Begränsningen gäller inte om patienten väljer att omvandla pappersreceptet till ett e-recept. Vidare föreslås att färdigexpedierade recept, det vill säga när det inte finns några fler uttag av läkemedel kvar eller om giltighetstiden har passerat, inte ska få återlämnas till patienten utan behålls av öppenvårdsapoteket. Förslagen hanteras nu av regeringen och i nuläget går det inte att ange om eller när det kan bli aktuellt att införa dessa bestämmelser. Läkemedelssäkerhet, regeländringar, medicinteknik eller något annat vad vill du läsa om i Information från Läkemedelsverket? Tipsa redaktionen via tidningsredaktionen@mpa.se INFORMATION FRÅN LÄKEMEDELSVERKET 5:
12 NYHETER OCH RAPPORTER Förslag om att alla restnoteringar av läkemedel rapporteras Läkemedelsverket föreslår i en ny utredning att läkemedelsföretagen ska bli skyldiga att anmäla alla restnoteringar av läkemedel till myndigheten. Vidare föreslås att inkommen information om restnoteringar kontinuerligt publiceras på Läkemedelsverkets webbplats. Läkemedelsverket vill införa sanktionsmöjligheter mot företag som inte följer rapporteringsplikten. Med restnotering menas en läkemedelsbrist som uppstår då en tillverkare av olika skäl inte kan leverera ett läkemedel till en partihandlare, och vidare till apotek. Detta kan bland annat resultera i att apoteken inte kan lämna ut det förskrivna läkemedlet till patienter. Kvalitetsdefekter och oväntat stor efterfrågan Ett femtiotal restnoteringar anmäls årligen till Läkemedelsverket. De vanligaste orsakerna är kvalitetsdefekter, brist på aktiv substans, ändring i produktionsprocess, felbedömning i produktionsplanering, transportskador samt oväntat stor efterfrågan. De mest frekventa restnoteringarna har på senare år gällt antibakteriella medel för systemiskt bruk, medel mot ögonsjukdomar och vacciner. Underrapportering skapar problem Det föreligger en underrapportering av restnoteringar från läkemedelsföretagen. Detta gör det svårt för både apotek och sjukvård att i tid kunna hitta ersättningsbehandlingar, vilket i värsta fall kan innebära risker för patienten. Problemet med restnoteringar är inte begränsat till den svenska marknaden, utan är en fråga som uppmärksammats på både europeisk och global nivå de senaste åren. Anmälningsskyldighet och tillgängliggörande av information föreslås Läkemedelsverket fick i april 2014 i uppdrag av regeringen att fortsätta kartlägga omfattningen av restnoteringar med utgångspunkt från den rapport som myndigheten överlämnade 2013, samt att analysera hur information om restnoteringar på ett mer systematiskt sätt kan göras tillgänglig. Utredningens fokus har varit på läkemedelsdistribution, det vill säga kedjan från tillverkare till partihandel. De förslag som presenteras i utredningen är i huvudsak: Lagstadgad skyldighet för läkemedelsföretag att anmäla restnoteringar till Läkemedelsverket. Läkemedelsverket tillgängliggör kontinuerligt information om anmälda restnoteringar. För att förslagen ska kunna genomföras bör sekretessbrytande bestämmelser införas, liksom sanktionsmöjligheter riktade mot aktörer som underlåter att anmäla restsituationer. Syftet med förslagen är att sjukvården, apotek och ansvariga myndigheter snabbt får tillgång till aktuell information, vilket är en förutsättning för att så snabbt som möjligt hitta andra lösningar för patienterna. Det bidrar också till ett förbättrat kunskapsläge kring hur restsituationer uppstår och hur de kan hanteras på bästa möjliga sätt. Förslagen hanteras av regeringen och det går inte i nuläget att ange om eller när det kan bli aktuellt att införa dessa bestämmelser. Utredningen i sin helhet finns att läsa på: Rättelse i behandlingsrekommendationen Läkemedelsbehandling vid astma Ett ord har blivit felaktigt i behandlingsrekommendationen Läkemedelsbehandling vid astma publicerad i Information från Läkemedelsverket 3:2015 samt på vår webbplats. På sidan 28 under rubriken Övriga icke-farmakologiska behandlingar i stycket om temperaturreglerat laminärt luftflöde (TLA) har bokstaven o fallit bort från ordet säsongsoberoende. Korrekt mening lyder Behandlingen kan vara ett alternativ som tilläggsbehandling till patienter med säsongsoberoende svår allergisk astma. Korrigerad version av behandlingsrekommendationen finns nu publicerad på webbplatsen 12 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
13 NYHETER OCH RAPPORTER Kroniskt obstruktiv lungsjukdom (KOL) behandlingsrekommendation webbpubliceras Uppdaterade rekommendationer för läkemedelsbehandling av KOL publiceras på Läkemedelsverkets webbplats den 16 oktober Det har funnits behov av att uppdatera behandlingsrekommendationerna för astma och KOL. Därför arrangerade Läkemedelsverket ett tvådagars expertmöte i november Uppdaterade behandlingsrekommendationer för astma publicerades i Information från Läkemedelsverket 3:2015. Av utrymmesskäl framflyttades publiceringen av behandlingsrekommendationerna för KOL. De nya rekommendationerna för läkemedelsbehandling av KOL baseras på de bakgrundsdokument som publiceras tillsammans med behandlingsrekommendationen samt på de vetenskapliga underlag om läkemedelsbehandling av KOL som tagits fram av Socialstyrelsen i samband med arbetet med de nya nationella riktlinjerna för astma och KOL. Uppdaterade rekommendationer för läkemedelsbehandling av KOL och tillhörande bakgrundsdokumentation publiceras på Läkemedelsverkets webbplats den 16 oktober Läkemedelsverket sammanfattar svensk forskning om narkolepsi och Pandemrix i vetenskaplig artikel Efter de första rapporterna om samband mellan narkolepsi och vaccination med Pandemrix initierades ett antal forskningsprojekt i samverkan mellan Läkemedelsverket, Karolinska Institutet och Folkhälsomyndigheten (tidigare Smittskyddsinstitutet). Resultaten från de olika studierna har nu sammanfattats i en artikel i Journal of Internal Medicine. Som svar på influensapandemin , A(H1N1) pdm09, genomfördes ett program för massvaccination i Sverige med vaccinet Pandemrix. Ett antal fall av narkolepsi bland vaccinerade barn och ungdomar rapporterades, vilket var oväntat. I en nyligen publicerad vetenskaplig översiktsartikel (1) i tidskriften Journal of Internal Medicine beskriver några av Läkemedelsverkets experter tillsammans med forskare från Karolinska Institutet och Folkhälsomyndigheten (dåvarande Smittskyddsinstitutet) de forskningsprojekt som bedrivits i syfte att undersöka signalen från den spontana biverkningsrapporteringen, att bedöma risker och bättre förstå möjliga orsakssamband. Några av resultaten En stor epidemiologisk studie visade 3 4 gånger ökad risk för narkolepsi hos vaccinerade barn och ungdomar. Ett viktigt fynd var att ingen ökad risk sågs för de andra neurologiska och autoimmuna sjukdomar som studerades. Genetiska studier bekräftade en association med allelen HLA-DQB1*06:02 vilken sedan tidigare har ett känt samband med narkolepsi. Ett antal studier med cellulära och molekylära experimentella metoder undersökte också möjliga samband mellan influensavaccination och narkolepsi. Serumanalyser visade att personer som vaccinerats med Pandemrix uppvisade en annorlunda immunologisk reaktivitet mot neuraminidas och hemagglutinin jämfört med dem som blivit infekterade av A(H1N1)-influensan. Patienter med narkolepsi hade också högre interferon gamma-produktion som svar på streptokockassocierade antigen. Ingen ökad risk sågs för de andra neurologiska och autoimmuna sjukdomar som studerades Kommunikation med drabbade och media Beskrivningar av drabbade patienter liksom redovisade forskningsresultat har fått stor uppmärksamhet i media. I artikeln beskrivs hur viktigt det är att myndigheter använder öppen kommunikation och samarbetar med patientrepresentanter om allmänhetens förtroende för att vaccinationsprogram ska kunna behållas. Referenser 1. Feltelius N, Persson I, Ahlqvist-Rastad J, et al. A coordinated crossdisciplinary research initiative to address an increased incidence of narcolepsy following the Pandemrix vaccination programme in Sweden. (Review Symposium). J Intern Med 2015;278(4): INFORMATION FRÅN LÄKEMEDELSVERKET 5:
14 NYHETER OCH RAPPORTER Granskning av diabetesläkemedel av typen SGLT2- hämmare inledd Den europeiska läkemedelsmyndigheten EMA inledde i juni en granskning av kanagliflozin, dapagliflozin och empagliflozin, även kända som SGLT2-hämmare, som används för att behandla typ 2-diabetes. Syftet med granskningen är att utvärdera risken för diabetesketoacidos, ett allvarligt tillstånd som kan utvecklas då insulinnivåerna är för låga. Diabetesketoacidos är vanligast hos personer med typ 1-diabetes, men förekommer även vid typ 2-diabetes. Granskningen inleddes i juni till följd av rapporter om diabetesketoacidos hos patienter som behandlas med SGLT2- hämmare mot typ 2-diabetes. Samtliga fall var allvarliga och några krävde sjukhusvård. Vid diabetesketoacidos är vanligtvis blodsockervärdena höga men i ett antal av dessa rapporter var blodsockervärdena endast måttligt förhöjda, något som skulle kunna försena diagnos och behandling. Alla tillgängliga data om risken för diabetesketoacidos med SGLT2-hämmare kommer att granskas för att se om förändrade rekommendationer behövs för hur dessa läkemedel ska användas inom EU. Sjukvården har fått skriftlig information om risken för diabetesketoacidos och om hur man kan hantera den. Patienter som har frågor kring sina diabetesläkemedel bör rådgöra med sin läkare eller farmaceut. Det är viktigt att patienter med diabetes fortsätter att ta sin ordinerade behandling och inte slutar med den utan att först ha diskuterat med sin läkare. Följande SGLT2-hämmare är godkända i Sverige: Forxiga (dapagliflozin), Invokana (kanagliflozin), Jardiance (empagliflozin), Synjardy (empagliflozin/metformin), Vokanamet (kanagliflozin/metformin) och Xigduo (dapagliflozin/ metformin). Medicintekniska fokusområden Läkemedelsverket fokuserar 2015 inom området medicinteknik på tillsyn inom diabetesområdet, programvaror med medicinskt syfte och omsteriliseringsbara medicintekniska produkter. Myndigheten kommer att fortsatt bevaka inkomna rapporter om olyckor och tillbud. Under 2014 har infusionspumpar och fordon anpassade för rörelsehindrade varit två stora tillsynsprojekt som publicerats. Under 2014 publicerades även en rapport om kondomer som var ett tillsynsprojekt under Uppföljning av inkomna rapporter om olyckor och tillbud 2014 visade också, som tidigare, att problemen med programvaror med medicinskt syfte fortsätter att vara stort. Planen för 2015 är därför att fokusera på informationsspridning om regelverket som gäller för programvaror med medicinskt syfte. Under 2015 initieras även ett flerårigt projekt där Läkemedelsverket deltar i EU-gemensam marknadstillsyn av omsteriliseringsbara medicintekniska produkter. Projektet är ett led i de krav som EU-kommissionen ställde med anledning av skandalen med PIP-bröstimplantaten. Ett av kraven är ökad samverkan mellan medlemsländer vid marknadskontroll. För att tillgodose kravet på samverkan mellan medlemsländerna genomför Läkemedelsverket en förstudie under 2015 för att definiera vilka problem som föreligger inom produktområdet insulinpumpar och infusionsset. Användarna är många och konsekvenserna när produkterna inte fungerar är ofta mycket allvarliga. Förstudien kommer att användas som underlag för tillsynsplan Tillverkarnas rapporter saknar många gånger grundorsak, riskvärderingar och korrigerande åtgärder, säger Brita Liljestrand, utredare och projektledare för förstudien inom diabetesområdet. Uppföljning av inkomna rapporter om olyckor och tillbud visade att insulinpumpar och infusionsset är produktområden som behöver ses över. Fokusområden 2015 I planeringen av tillsynsprojekt för 2015 har Läkemedelsverket utgått från den omvärldsanalys Läkemedelsverket löpande gör samt den upprättade tillsynsplanen för I omvärldsanalysen har hänsyn tagits till trender som uppmärksammas i samband med uppföljning av inkomna rapporter om olyckor och tillbud, frågor som uppmärksammats av branschföreningar, enskilda företag, enskilda personer, nationella och internationella myndigheter. Inkomna rapporter om olyckor och tillbud är en viktig källa för att identifiera fokusområden och därför kommer Läkemedelsverkets process för att hantera inkomna rapporter om olyckor och tillbud att ses över under Målet är att Läkemedelsverkets tillsyn ska fokusera på de företag som inte har fungerande system för att rapportera olyckor och tillbud. Se även fliken Publikationer/ Rapporter samt Tillsynsplaner. 14 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
15 NYHETER OCH RAPPORTER Problem med näs-, mun- och halssprayer Läkemedelsverket har fått rapporter om att användare av näs-, mun- och halssprayer har fått allergiliknande reaktioner eller överkänslighetsreaktioner. Det är viktigt att användare av CE-märkta produkter läser och följer medföljande bruksanvisningar. Om det ändå uppstår någon typ av problem eller reaktioner och det är fråga om en medicinteknisk produkt bör tillverkaren kontaktas. Läkemedelsverket har tagit emot ett flertal anmälningar och rapporter om problem som har uppstått vid användning av olika typer av näs-, mun- och halssprayer. Problemen har handlat om allergiliknande reaktioner eller överkänslighetsreaktioner med både klåda, hosta och svullnad i slemhinnan. Inga reaktioner med allvarliga konsekvenser har rapporterats. Anmälningarna har rört produkter som används vid förkylning och som inte är läkemedel utan medicintekniska produkter. Både näs-, mun- och halssprayer är exempel på förkylningsprodukter som kan vara medicintekniska produkter och som i så fall omfattas av den medicintekniska lagstiftningens krav på säkerhet (CE-märkta enligt denna lagstiftning). Läkemedelsverket vill understryka vikten av att användaren av den här typen av produkter läser och följer de instruktioner som tillverkaren har försett produkterna med. Att läsa innehållsförteckningen rekommenderas särskilt för den som sedan tidigare har välkända allergier eller överkänslighet mot specifika ämnen. Användare som får någon form av reaktion eller problem vid användning av den här typen av produkt bör vända sig till tillverkaren och/eller försäljningsstället. Kontaktuppgifter till tillverkaren finns på produktförpackningen och i bruksanvisningen. Säkerhetsprofilen för vaccin mot humant papillomvirus (HPV) ska klargöras ytterligare av EMA Den europeiska läkemedelsmyndigheten (EMA) har inlett en översyn av HPV-vacciner för att ytterligare klargöra aspekter gällande deras säkerhetsprofil. De HPVvacciner som är godkända i Sverige är Gardasil/Silgard, Gardasil 9 och Cervarix. Att nyttan med HPV-vacciner överväger riskerna ifrågasätts inte, och under pågående översyn är rekommendationerna för användningen av vaccinerna oförändrade. HPV-vacciner har givits till cirka 72 miljoner människor över hela världen och användningen förväntas förebygga många fall av livmoderhalscancer samt ett antal andra cancerformer och tillstånd som orsakas av HPV. Livmoderhalscancer är den fjärde vanligaste orsaken till död i cancer hos kvinnor världen över med tiotusentals dödsfall i Europa varje år, detta trots de screeningprogram som finns för att tidigt upptäcka cancern. EMA:s översyn ifrågasätter inte att nyttan med HPV-vacciner överväger riskerna. Liksom för alla godkända läkemedel övervakas säkerheten för dessa vacciner av den europeiska läkemedelsmyndighetens säkerhetskommitté, PRAC. Den pågående översynen kommer att värdera tillgängliga data med fokus på sällsynta rapporter rörande två tillstånd: komplext regionalt smärtsyndrom (CRPS, ett kroniskt smärttillstånd som drabbar armar och ben) och posturalt ortostatiskt takykardiskt syndrom (POTS, ett tillstånd som ger en onormal ökning av hjärtfrekvensen när man sätter eller ställer sig upp och orsakar symtom som yrsel och svimning, liksom huvudvärk, bröstsmärta och svaghet). Rapporter om CRPS och POTS hos unga kvinnor som har fått HPV-vaccin har värderats i samband med PRAC:s rutinmässiga säkerhetsövervakning. Ett orsakssamband mellan dessa tillstånd och vaccinering har inte kunnat fastställas. Båda tillstånden kan förekomma hos icke-vaccinerade individer och det anses angeläget att ytterligare se över om antalet fall som har rapporterats i samband med HPV-vaccinering är större än vad som kan förväntas. Vid översynen kommer PR AC att bedöma aktuell vetenskaplig kunskap och forskning som kan bidra till att klargöra antalet fall av CRPS och POTS efter vaccination och identifiera om det finns ett orsakssamband mellan HPV-vaccination och de två tillstånden. Utifrån denna utvärdering kommer PRAC att besluta om det finns behov av förändringar i produktinformationen för HPV-vaccinerna för att förbättra information till patienter och hälso- och sjukvårdspersonal. Under pågående översyn är rekommendationerna för användningen av vaccinerna oförändrade. När utredningen är klar överlämnas PR AC:s rekommendationer till EMA:s vetenskapliga kommitté (CHMP), som kommer att avge ett slutgiltigt utlåtande. INFORMATION FRÅN LÄKEMEDELSVERKET 5:
16 NYHETER OCH RAPPORTER Långvarig restnotering för Zovirax 3 % ögonsalva En långvarig restsituation har uppstått för Zovirax ögonsalva. Tänkbara behandlingsalternativ är licensläkemedel innehållande substanserna aciklovir eller ganciklovir. En restsituation har uppstått för Zovirax 3 % ögonsalva. Marknadsförande företag har meddelat Läkemedelsverket att de har globala leveransproblem och att de inte räknar med att kunna leverera Zovirax ögonsalva igen förrän tidigast i mars Andra beredningsformer av Zovirax är fortsatt tillgängliga. Zovirax 3 % ögonsalva, som innehåller den aktiva substansen aciklovir, är indicerad för behandling av keratit (hornhinneinflammation) orsakad av herpes simplex-virus. Det finns inget annat godkänt läkemedel i form av ögonsalva som innehåller aciklovir. Alternativ till behandling med Zovirax är licensförskrivning av ögonsalva/gel innehållande aciklovir eller den likvärdiga substansen ganciklovir. För att få information om vilka läkemedel som går att anskaffa hänvisar vi till apotek. Det bör också noteras att det finns godkända orala läkemedel innehållande valaciklovir med indikationen behandling och suppression av recidiverande okulära HSVinfektioner. Se även fliken Hälso-& sjukvård/ Förskrivning/Licens. Calcium-Sandoz injektionsvätska försvinner från marknaden Marknadsförande företag för Calcium-Sandoz, injektionsvätska, lösning 9 mg/ml, har meddelat Läkemedelsverket att produkten inte längre kommer att vara tillgänglig på den svenska marknaden. Calcium-Sandoz, injektionsvätska, lösning 9 mg/ml används främst vid akuta sjukhussituationer och är indicerat för kalciumbrist vid försämrad resorption och rubbningar i ämnesomsättningen: tetanus, spasmofili, rakitis, osteoporos samt hypokalcemi vid njurinsufficiens. Produkten används också vid vissa förgiftningstillstånd. Någon motsvarande godkänd produkt till Calcium-Sandoz, injektionsvätska, lösning 9 mg/ml finns för närvarande inte att tillgå på den svenska marknaden. Det går att ansöka om licens för läkemedel godkänt i annat land eller att använda extempore-beredning av liknande produkt. Vid förskrivning av licens- och extempore-preparat bör det observeras att kalciumkoncentrationen kan skilja sig från den i Calcium-Sandoz injektionsvätska, vilket måste beaktas vid doseringen. Samtliga nummer av Information från Läkemedelsverket finns på 16 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
17 FRÅGOR TILL LÄKEMEDELSVERKET? Frågor till Läkemedelsverket Läkemedelsverket tar emot och besvarar frågor som rör våra ansvarsområden. Här tar vi upp några frågor och svar som vi tror att fler än frågeställaren kan vara intresserade av. Frågorna på denna sida har besvarats av farmaceut och vid behov kvalitetssäkrats av kliniker inom området. De besvaras framför allt med utgångspunkt från godkänd produktinformation eller andra dokument som Läkemedelsverket och EMA, den europeiska läkemedelsmyndigheten, står bakom. Har du en fråga? Vi nås via e-post eller telefon Växeln är öppen helgfria vardagar Allmänheten kan ringa direkt till Läkemedelsupplysningen på telefon , helgfria vardagar Jag är glutenintolerant och det är därför viktigt för mig att veta om ett läkemedel innehåller gluten. Står det i innehållsförteckningen om det ingår? I ett läkemedels bipacksedel och produktresumé finns alla innehållsämnen angivna, såväl verksamma substanser som hjälpämnen. Just ordet gluten skrivs inte ut eftersom det varken förekommer som hjälpämne eller aktiv substans. Det du istället ska vara observant på är om det står stärkelse i förteckningen över innehållsämnen. Stärkelse är ett godkänt hjälpämne som ingår i många läkemedel som till exempel bindemedel eller fyllnadsmedel. Det finns olika typer av stärkelse, såsom majs-, ris-, potatisoch vetestärkelse. Vetestärkelse kan innehålla gluten och ingår i några få läkemedel. För att vetestärkelse ska få användas vid tillverkning av läkemedel ska proteinhalten vara lika låg som den är hos livsmedel som får kallas glutenfria. Läkemedel innehåller dessutom bara små mängder stärkelse jämfört med livsmedel. Därför kan även patienter med glutenintolerans i allmänhet äta dessa läkemedel utan besvär. Det ska framgå av bipacksedeln och produktresumén för ett läkemedel om det innehåller stärkelse och i så fall av vilken typ. Läkemedel som innehåller vetestärkelse ska enligt regelverket vara försedda med en särskild varning. I hjälpämnet pregelatiniserad stärkelse får endast stärkelse från majs, ris eller potatis användas vid tillverkningen, men inte stärkelse från vete. Därför är det helt fritt från gluten. I läkemedlets bipacksedel står det längst ner innehavare av godkännande för försäljning och därefter lokal företrädare. Vad är skillnaden? Innehavaren av godkännande för försäljning är det företag som har marknadsföringstillståndet för produkten. Om detta företag är utländskt är det vanligt att de utser en lokal företrädare i Sverige som fungerar som kontakt utåt i landet och företräder företaget som har marknadsföringstillståndet. Ibland står det istället lokalt ombud i bipacksedeln och det är detsamma som lokal företrädare. Är det verkligen värt besväret att som konsument rapportera biverkningar till er? Jag fick ingen återkoppling när jag skickade in min rapport. Alla biverkningsrapporter som inkommer till Läkemedelsverket tas om hand och bedöms. Rapporterna analyseras och syftet är att identifiera mönster och tendenser bland biverkningsrapporterna och på så sätt få ny kunskap om läkemedlens biverkningar. Läkemedelsverket gör ingen utredning av den enskilda patienten i samband med att en biverkningsrapport kommer in, det är i första hand en fråga för sjukvården. Trots att du inte får någon personlig återkoppling på en inskickad biverkningsrapport är den en mycket viktig del i säkerhetsuppföljningen av läkemedel som kan leda till olika åtgärder och bidra till en säkrare läkemedelsanvändning. Biverkningar kan rapporteras för ett läkemedel oavsett om det har använts enligt vad som anges i den godkända produktinformationen eller inte. Kan jag som läkare förskriva isotretinoin för eget bruk trots att jag inte är dermatolog? Enligt Läkemedelsverkets föreskrifter (LVFS 2013:9) om förordnande och utlämnande av läkemedel som innehåller isotretinoin får ett läkemedel som innehåller isotretinoin utlämnas från apotek endast om det har förskrivits av en läkare med specialistkompetens i dermatologi. Dessa regler gäller även vid förskrivning för eget bruk. Läkare som inte är specialister inom dermatologi kan söka dispens hos Läkemedelsverket. Kompetensen ska vara relevant för den indikation som ansökan avser och ansvarig dermatolog eller verksamhetschef ska tillstyrka ansökan och försäkra att vårdorganisationen garanterar en säker användning av läkemedlet. En dispens är ett tillstånd knutet till en förskrivare och en arbetsplats. INFORMATION FRÅN LÄKEMEDELSVERKET 5:
18 BEHANDLINGSREKOMMENDATION Handläggning av RSV-infektioner behandlingsrekommendation Sammanfattning Humant respiratoriskt syncytialvirus (RSV) är en vanlig luftvägspatogen som kan orsaka allvarlig nedre luftvägssjukdom hos spädbarn, immunsupprimerade och äldre individer. Behandlingen av sjukdomen är i första hand symtomatisk och understödjande. Profylaktiskt är allmänna åtgärder för att undvika smitta av största vikt. Inhalationsbehandling med ribavirin mot RSVbronkiolit hos spädbarn har i praktiken helt upphört efter att en systematisk översikt visat på tveksamt terapeutiskt värde. Palivizumab (Synagis), en monoklonal humaniserad IgG 1K -antikropp, godkändes 1999 som profylax mot RSV-infektion hos högriskbarn yngre än två år. Palivizumab har visats minska behovet av sjukhusvård på grund av RSV hos vissa högriskgrupper, men har inte visats ha någon effekt på mortalitet. Nya data talar för en fortsatt mer restriktiv hållning än vad de godkända indikationerna anger. Bakgrund Efter att palivizumab godkänts publicerade Läkemedelsverket år 2000, i samarbete med Referensgruppen för antiviral terapi (RAV), en rekommendation för handläggning av RSV-infektioner. Denna rekommendation kompletterades 2004 med rekommendationer för barn med hjärtsjukdom. Rekommendationerna innebar en mer restriktiv hållning till profylaktisk behandling med palivizumab i Sverige än vad den godkända indikationen omfattar. Sedan dess har mer data och kunskap genererats och Läkemedelsverket anordnade därför, inom regeringsuppdraget Utvidga kunskapen om barns läkemedel och deras användning, ett expertmöte januari 2015, med medverkan från RAV och Folkhälsomyndigheten samt experter med kunskap från olika specialiteter och patientgrupper. Kunskapssammanställningen och rekommendationerna har framtagits gemensamt av experterna och bygger på konsensus i gruppen. Som stöd för behandlingsrekommendationen finns bakgrundsdokument med mer detaljerad information, som respektive författare ansvarar för. I bakgrundsdokumenten finns även referenser. lämpligt mål för terapeutisk intervention. G-proteinet, som är mer variabelt och utgör grunden för subgruppsindelningen, medierar virusbindning till specifika cellreceptorer. Smittspridning RSV är ett av våra vanligaste luftvägsvirus. Nästan alla barn infekteras under de två första levnadsåren, majoriteten före ett års ålder. RSV överförs genom direkt och indirekt kontaktsmitta och genom droppsmitta, medan luftburen smitta (aerosol) inte anses vara av betydelse. Närkontakt med infekterad individ, exempelvis sjukt syskon, innebär mycket hög smittrisk. Virus kan förbli infektiöst upp till sex timmar på hårda ytor. Basal vårdhygien är den viktigaste åtgärden för att förhindra smittspridning på sjukhus. God handhygien är nödvändig för att begränsa smittspridning i samhället. Inkubationstiden är 3 5 dygn. Utsöndringstiden för RSV är vanligen begränsad till en vecka men kan vara väsentligt längre, till exempel hos immunsupprimerade. Genomgången infektion ger inte bestående skydd. Smitta från relativt asymtomatisk vårdpersonal eller anhörig kan innebära en risk för immunsupprimerade patienter. Nästan alla barn infekteras med RSV under de två första levnadsåren Epidemiologi RSV uppträder varje år som epidemier, i tempererade områden främst under vintersäsongen. I Sverige startar epidemin vanligen under tidig vinter och pågår i flera månader. Vartannat år har man sett en tidig hög topp (februari) och vartannat år en senare lägre topp (mars). Lokala variationer över landet är vanligt förekommande. En förklaring till dessa fenomen är troligen varierande förekomst av antikroppar i populationen. Det är viktigt att varje enskild region följer sin lokala epidemiutveckling (se avsnittet Epidemiologisk övervakning). Epidemiologi, klinik och diagnostik Virologi Respiratoriskt syncytialvirus (RSV) är ett höljeförsett RNAvirus som infekterar luftvägsepitel. Det finns två subgrupper, A och B, men det föreligger inga säkra kliniska skillnader mellan dessa. Två ytantigen, glykoproteinerna F och G, är viktiga immunogener. F-proteinet, som åstadkommer fusion mellan virus och cellmembran, är relativt stabilt mellan stammar och utgör därför ett RSV-infektionens naturalförlopp Sjukdomsbilden varierar från förkylning till obstruktiva andningsbesvär (bronkiolit) och pneumonit. Förstagångsinsjuknande hos spädbarn kan ge en allvarlig och långdragen nedre luftvägsinfektion, dock med låg mortalitet. Reinfekterade äldre barn och vuxna får i regel lindrigare symtom. 18 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
19 BEHANDLINGSREKOMMENDATION Foto: Shutterstock. Spädbarn (0 1 år) Sjukdomen debuterar med subfebrilitet och snuva, och senare tillkommer ofta mer eller mindre uttalade andningsbesvär följt av besvärande hosta. Barn under ett år drabbas ofta av symtom från nedre luftvägarna. En till två procent av RSV-infekterade spädbarn behöver sjukhusvårdas på grund av andningsproblem som hos % av dessa kan kräva intensivvård. Hos svårt sjuka barn som kräver intensivvård förekommer sekundär bakteriell pneumoni hos %. Maternella antikroppar skyddar inte mot insjuknande men kan möjligen mildra sjukdomsförloppet hos spädbarn. Ökad risk för allvarligt sjukdomsförlopp (se Faktaruta 1) vid förstagångsinsjuknande föreligger främst vid låg ålder (< 2 månader), underburenhet, vissa hjärt- och lungsjukdomar och vid neuromuskulära sjukdomar som ger symtom i spädbarnsperioden. I enstaka fall kan apnéer vara ett tidigt och allvarligt symtom. Barn och vuxna Alla individer får återkommande infektioner med RSV som oftast är av lindrigare karaktär. I hög ålder, särskilt hos individer med samsjuklighet som till exempel KOL, ökar risken för nedre luftvägsinfektion med en sjukdomsbild som kan likna en bakteriell pneumoni. Dessutom förekommer sekundär bakteriell pneumoni hos cirka 10 % av RSV-infekterade, sjukhusvårdkrävande äldre personer. Gravt immunsupprimerade patienter, särskilt de som är allogent stamcellstransplanterade, har hög risk för komplikationer med pneumoni och livshotande förlopp. Barn under ett år drabbas ofta av symtom från nedre luftvägarna Faktaruta 1. Kliniska fynd och symtom som indikerar ökad risk för allvarligt sjukdomsförlopp vid RSV-infektion. Snabb, ytlig andning och hypoxi tidigt i sjukdomsförloppet Slöhet och apnéattacker Dåligt näringsintag och dehydrering Diagnostik Diagnostik för RSV utförs på prov från luftvägarna, vanligen nasofarynxprov (aspirat eller pinnprov). Ett flertal diagnostiska metoder, med olika för- och nackdelar, finns tillgängliga (se Tabell I). INFORMATION FRÅN LÄKEMEDELSVERKET 5:
20 BEHANDLINGSREKOMMENDATION Tabell I. Diagnostiska metoder. Metod Fördelar Nackdelar Nukleinsyrapåvisning, PCR Antigendetektion med immunofluorescens (IF) Antigendetektion med immunkromatografi Mycket känslig Specifik Känslig Specifik Snabb Kan utföras patientnära Kräver kontinuerlig övervakning av PCR-systemen på grund av variabelt virus Kan endast utföras av laboratorium Kan endast utföras av laboratorium Känsligheten och specificiteten är sämre än IF och PCR För adekvat handläggning av patienter behövs diagnostik med hög sensitivitet som kan ge svar samma dag. Nya PCRmetoder kan idag ge analyssvar inom två timmar. Patientnära snabbtester i form av immunkromatografi har begränsningar i både känslighet och specificitet, vilket medför att de bara bör användas under högsäsong och då endast för patienter med hög virusutsöndring, exempelvis barn. Så kallade escape-mutationer kan medföra att en RS-virusstam inte neutraliseras av palivizumab, men sådana mutationer har påvisats i endast 5 % av genombrottsinfektioner under pågående profylax. Möjlighet till analys avseende escape-mutationer finns inte i Sverige. Resistens mot ribavirin finns inte beskriven vid RSVinfektioner. Epidemiologisk övervakning Epidemiologisk övervakning av infektionsläget är viktigt för planering av vårdplatser vid RSV-infektioner. Tidigt på säsongen är generös provtagning angelägen för att visa när epidemin startar. Sjukdomen är inte anmälningspliktig men laboratorier som identifierar RSV gör frivillig laboratorierapportering till Folkhälsomyndigheten, som under aktuell säsong sammanställer och publicerar infektionsläget veckovis på sin webbplats ( Specifik profylax med palivizumab Specifik profylax med palivizumab endast indicerat till särskilda riskgrupper (se nedan): Profylax med palivizumab bör påbörjas när RSV etablerats lokalt. Palivizumab ges intramuskulärt i dosen 15 mg/kg kroppsvikt en gång i månaden i upp till fem månader. Profylax med palivizumab avbryts hos barn som redan insjuknat med RSV under pågående säsong. (Rekommendationsgrad A) Palivizumab interagerar inte med vaccin inom det allmänna barnvaccinationsprogrammet eller med influensavaccination. Palivizumab har ingen effekt vid etablerad RSVinfektion. Effektivitet av profylax Det är inte klarlagt i vetenskapliga studier att palivizumab minskar mortaliteten i RSV-infektion. Däremot har palivizumab visats minska risken för inläggning på sjukhus på grund av RSV-infektion med cirka 50 % hos vissa högriskgrupper. Profylax mot RSV Allmänprofylaktiska åtgärder Allmänprofylaktiska åtgärder för det späda barnet i familjen: Informera föräldrar om allmän infektionsprofylax inför hemgång från neonatalavdelning och BB samt på BVC. Ge barnet en rökfri miljö. Sträva efter bröstmjölksuppfödning. Noggrann handhygien särskilt vid egna eller syskons symtom på luftvägsinfektion. Undvik under vintersäsongen, så långt möjligt, nära kontakt mellan de yngsta spädbarnen och småbarn som vistas i större barngrupper. (Rekommendationsgrad B) Allmänprofylaktiska åtgärder på sjukhus: God följsamhet till basala hygienrutiner. Besöksrestriktioner på avdelning där spädbarn vårdas under RSV-säsong. När enskilt rum inte är tillgängligt kan kohortvård på sjukhus vara ett sätt att förhindra smittspridning av RSV. (Rekommendationsgrad A) Indikationer för specifik profylax med palivizumab Förekomst av multipla riskfaktorer påverkar behovet av profylax. Bedömningen av behov av profylax för det enskilda barnet bör centreras till enstaka specialiserade mottagningar med särskild kompetens, inom respektive sjukhus. Studier har inte kunnat visa att palivizumab minskar mortaliteten i RSV-infektion Bronkopulmonell dysplasi Profylax med palivizumab mot RSV-infektion rekommenderas till barn yngre än 12 månader kronologisk ålder med måttlig eller svår bronkopulmonell dysplasi (BPD), som har pågående syrgasbehandling eller har avslutat denna under 20 INFORMATION FRÅN LÄKEMEDELSVERKET 5:2015
Biosimilarer Vad är det?
 Biosimilarer Vad är det? Biosimilarer Vad är det? Introduktion Läkemedel är en viktig del av en god hälso- och sjukvård. Traditionellt har läkemedel tillverkats på kemisk väg men under de senaste decennierna
Biosimilarer Vad är det? Biosimilarer Vad är det? Introduktion Läkemedel är en viktig del av en god hälso- och sjukvård. Traditionellt har läkemedel tillverkats på kemisk väg men under de senaste decennierna
Regeringsuppdrag på LV - Restnoteringar - Särskilda receptblanketten. Lena Björk
 Regeringsuppdrag på LV - Restnoteringar - Särskilda receptblanketten Lena Björk UPPDRAG OM ATT FORTSÄTTA UTREDA RESTNOTERINGAR Dels fortsätta kartlägga restnoteringar samt, analysera vad de beror på, dels
Regeringsuppdrag på LV - Restnoteringar - Särskilda receptblanketten Lena Björk UPPDRAG OM ATT FORTSÄTTA UTREDA RESTNOTERINGAR Dels fortsätta kartlägga restnoteringar samt, analysera vad de beror på, dels
Användning av medicintekniska produkter inom Hälsooch sjukvården på Gotland
 (6) produkter inom Hälsooch sjukvården Med medicinteknisk produkt avses en produkt som enligt tillverkarens uppgift skall användas för att hos människor enbart eller i huvudsak. påvisa, förebygga, övervaka,
(6) produkter inom Hälsooch sjukvården Med medicinteknisk produkt avses en produkt som enligt tillverkarens uppgift skall användas för att hos människor enbart eller i huvudsak. påvisa, förebygga, övervaka,
Köp av receptbelagda läkemedel från osäkra källor på internet Läkemedelsverket i samarbete med TNS Sifo
 Köp av receptbelagda läkemedel från osäkra källor på internet Läkemedelsverket i samarbete med TNS Sifo Mars 2015 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting
Köp av receptbelagda läkemedel från osäkra källor på internet Läkemedelsverket i samarbete med TNS Sifo Mars 2015 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting
Läkemedelsverket, tillsyn och tillstånd
 Läkemedelsverket, tillsyn och tillstånd Maria Ingevaldsson, läkemedelsinspektör Bengt Persson, farmaceutisk utredare SFNM:s vårmöte 2013-05-16, Kalmar 1 En statlig, i huvudsak avgiftsfinansierad, myndighet
Läkemedelsverket, tillsyn och tillstånd Maria Ingevaldsson, läkemedelsinspektör Bengt Persson, farmaceutisk utredare SFNM:s vårmöte 2013-05-16, Kalmar 1 En statlig, i huvudsak avgiftsfinansierad, myndighet
ÅR: Område: Godkända läkemedelsprodukter. Tillsynsplan från Läkemedelsverket. Dnr:
 ÅR: 2014 Tillsynsplan från Läkemedelsverket Område: Godkända läkemedelsprodukter Dnr: 6.2.11-2014-018866 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
ÅR: 2014 Tillsynsplan från Läkemedelsverket Område: Godkända läkemedelsprodukter Dnr: 6.2.11-2014-018866 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Särskilda receptblanketten
 Särskilda receptblanketten Rapport från Läkemedelsverket Dnr: 1.1-2016-005868 Datum: 2016-12-29 Citera gärna Läkemedelsverkets rapporter, men glöm inte att uppge källa: Rapportens namn, år och Läkemedelsverket.
Särskilda receptblanketten Rapport från Läkemedelsverket Dnr: 1.1-2016-005868 Datum: 2016-12-29 Citera gärna Läkemedelsverkets rapporter, men glöm inte att uppge källa: Rapportens namn, år och Läkemedelsverket.
Nytt från Läkemedelsverket SRFs Registerdag 24 januari Nils Feltelius Reumatolog, Senior vetenskaplig rådgivare Enheten för Vetenskapligt stöd
 Nytt från Läkemedelsverket SRFs Registerdag 24 januari 2018 Nils Feltelius Reumatolog, Senior vetenskaplig rådgivare Enheten för Vetenskapligt stöd Nyheter från Läkemedelsverket Biosimilar - kunskapsdokument
Nytt från Läkemedelsverket SRFs Registerdag 24 januari 2018 Nils Feltelius Reumatolog, Senior vetenskaplig rådgivare Enheten för Vetenskapligt stöd Nyheter från Läkemedelsverket Biosimilar - kunskapsdokument
Säkrare användning av läkemedel till barn. Ett kunskapsmaterial för vårdnadshavare läkemedel till barn steg för steg
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Ska du ut och resa? Glöm inte din medicin!
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Olyckor och tillbud med produkter i diabetesvården
 Olyckor och tillbud med produkter i diabetesvården SFSD 2015-04-17 Brita Liljestrand utredare Karin Hampus utredare Enheten för Medicinteknik Tillsyn är enhetens huvudsakliga uppgift Övrigt Tillsyn Enheten
Olyckor och tillbud med produkter i diabetesvården SFSD 2015-04-17 Brita Liljestrand utredare Karin Hampus utredare Enheten för Medicinteknik Tillsyn är enhetens huvudsakliga uppgift Övrigt Tillsyn Enheten
I tillämpningsområdet ingår även hantering av medicintekniska produkter, t.ex. underhåll och transporter.
 Detta är den senaste internetversionen av författningen. Här presenteras föreskrifter och allmänna råd i konsoliderad form, det vill säga med alla gällande bestämmelser och rekommendationer från grundförfattningen
Detta är den senaste internetversionen av författningen. Här presenteras föreskrifter och allmänna råd i konsoliderad form, det vill säga med alla gällande bestämmelser och rekommendationer från grundförfattningen
Tema kliniska prövningar och licenser: När godkända läkemedel inte räcker till
 Tema kliniska prövningar och licenser: När godkända läkemedel inte räcker till Enligt lagstiftningen måste ett läkemedel som ska ges till en patient i Sverige vara godkänt för försäljning i vårt land.
Tema kliniska prövningar och licenser: När godkända läkemedel inte räcker till Enligt lagstiftningen måste ett läkemedel som ska ges till en patient i Sverige vara godkänt för försäljning i vårt land.
Förfalskade läkemedel ett hot mot folkhälsan
 Förfalskade läkemedel ett hot mot folkhälsan Eva Flodman Engblom Apotekare/Utredare Inspektionsenheten Vad är ett läkemedel? Läkemedelsdefinitionen Enligt 1 läkemedelslagen avses med läkemedel varje substans
Förfalskade läkemedel ett hot mot folkhälsan Eva Flodman Engblom Apotekare/Utredare Inspektionsenheten Vad är ett läkemedel? Läkemedelsdefinitionen Enligt 1 läkemedelslagen avses med läkemedel varje substans
Kliniska prövningar Vad du bör tänka på. Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser
 Kliniska prövningar Vad du bör tänka på Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser Utveckling av nytt läkemedel Lab.försök & djurtester Tester på människor Kemi, biokemi Preklinisk
Kliniska prövningar Vad du bör tänka på Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser Utveckling av nytt läkemedel Lab.försök & djurtester Tester på människor Kemi, biokemi Preklinisk
Biverkningsrapportering i teori och praktik Ebba Hallberg Gruppchef Biverkningsgruppen Enheten för läkemedelssäkerhet
 Biverkningsrapportering i teori och praktik 2016-03-18 Ebba Hallberg Gruppchef Biverkningsgruppen Enheten för läkemedelssäkerhet Varför ny organisation? Ny farmakovigilanslagstiftning 1 juli 2012 initierad
Biverkningsrapportering i teori och praktik 2016-03-18 Ebba Hallberg Gruppchef Biverkningsgruppen Enheten för läkemedelssäkerhet Varför ny organisation? Ny farmakovigilanslagstiftning 1 juli 2012 initierad
Restnoteringar av läkemedel Remiss från Socialdepartementet Remisstid den 15 april 2016
 PM 2016:73 RVI (Dnr 110-55/2016) Restnoteringar av läkemedel Remiss från Socialdepartementet Remisstid den 15 april 2016 Borgarrådsberedningen föreslår att kommunstyrelsen beslutar följande. 1. Som svar
PM 2016:73 RVI (Dnr 110-55/2016) Restnoteringar av läkemedel Remiss från Socialdepartementet Remisstid den 15 april 2016 Borgarrådsberedningen föreslår att kommunstyrelsen beslutar följande. 1. Som svar
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Hälso- och sjukvårdsnämnden
 Hälso- och sjukvårdsnämnden Åsa Bondesson Apotekare 040-675 36 99 Asa.C.Bondesson@skane.se YTTRANDE Datum 2016-08-26 Dnr 1602223 1 (5) Socialstyrelsen Dnr: 4.1.1-14967/2016 Yttrande om Remiss avseende
Hälso- och sjukvårdsnämnden Åsa Bondesson Apotekare 040-675 36 99 Asa.C.Bondesson@skane.se YTTRANDE Datum 2016-08-26 Dnr 1602223 1 (5) Socialstyrelsen Dnr: 4.1.1-14967/2016 Yttrande om Remiss avseende
Stort inflöde av olagliga läkemedel Fördjupad information från Pangea VI
 Stort inflöde av olagliga läkemedel Fördjupad information från Pangea VI 2013-12-12 Pangea är en internationell Internet Week of Action mot olaglig läkemedelsförsäljning som samordnas av Interpol. Det
Stort inflöde av olagliga läkemedel Fördjupad information från Pangea VI 2013-12-12 Pangea är en internationell Internet Week of Action mot olaglig läkemedelsförsäljning som samordnas av Interpol. Det
Restnoterade läkemedel vilket ansvar har de olika aktörerna på marknaden?
 Restnoterade läkemedel vilket ansvar har de olika aktörerna på marknaden? 2010-06-24 Detta dokument syftar till att beskriva vilket ansvar de olika aktörerna på läkemedelsmarknaden har för att undvika
Restnoterade läkemedel vilket ansvar har de olika aktörerna på marknaden? 2010-06-24 Detta dokument syftar till att beskriva vilket ansvar de olika aktörerna på läkemedelsmarknaden har för att undvika
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2005:11) om märkning och bipacksedlar
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2005:11) om märkning och bipacksedlar
RIKTLINJE FÖR BEDÖMNING AV STÅTRÄNING GÄLLANDE DELEGERAD OCH ORDINERAD INSATS ELLER EGENVÅRD
 RIKTLINJE FÖR BEDÖMNING AV STÅTRÄNING GÄLLANDE DELEGERAD OCH ORDINERAD INSATS ELLER EGENVÅRD KARLSTADS KOMMUN Beslutad i: Vård- och omsorgsförvaltningen Ansvarig samt giltighetstid: Medicinskt ansvarig
RIKTLINJE FÖR BEDÖMNING AV STÅTRÄNING GÄLLANDE DELEGERAD OCH ORDINERAD INSATS ELLER EGENVÅRD KARLSTADS KOMMUN Beslutad i: Vård- och omsorgsförvaltningen Ansvarig samt giltighetstid: Medicinskt ansvarig
Detta brev skickas ut i överenskommelse med den europeiska läkemedelsmyndigheten (EMA) och Läkemedelsverket för att informera om följande:
 FÖRFALSKADE PRODUKTER MÄRKTA SOM HERCEPTIN (trastuzumab) Injektionsflaska innehållandes pulver till koncentrat till infusionsvätska, lösning 150 mg Batchnummer: H4105B01, H4136B02, H4196B01, H4143B01,
FÖRFALSKADE PRODUKTER MÄRKTA SOM HERCEPTIN (trastuzumab) Injektionsflaska innehållandes pulver till koncentrat till infusionsvätska, lösning 150 mg Batchnummer: H4105B01, H4136B02, H4196B01, H4143B01,
2013-10-04. Regelverk för öppenvårdsapotek Helena Calles 2 oktober 2013 TILLÄMPNING AV LÄKEMEDELSFÖRMÅNEN PÅ APOTEK
 Regelverk för öppenvårdsapotek Helena Calles 2 oktober 2013 TILLÄMPNING AV LÄKEMEDELSFÖRMÅNEN PÅ APOTEK 1 Läkemedelsförmånen Samhället subventionerar kostnader för läkemedel och vissa andra varor på recept,
Regelverk för öppenvårdsapotek Helena Calles 2 oktober 2013 TILLÄMPNING AV LÄKEMEDELSFÖRMÅNEN PÅ APOTEK 1 Läkemedelsförmånen Samhället subventionerar kostnader för läkemedel och vissa andra varor på recept,
Kunskapscentrum för läkemedel i miljön Verksamhetsplan
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2003:11) om medicintekniska produkter;
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2003:11) om medicintekniska produkter;
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Riktlinjer och rutiner för Hälso- och sjukvårds avvikelser och riskhantering inom LSS
 Riktlinje 2/ Avvikelser LSS Rev. 2017-06-22 Socialkontoret Annicka Pantzar Medicinskt ansvarig sjuksköterska Riktlinjer och rutiner för Hälso- och sjukvårds avvikelser och riskhantering inom LSS Författningar
Riktlinje 2/ Avvikelser LSS Rev. 2017-06-22 Socialkontoret Annicka Pantzar Medicinskt ansvarig sjuksköterska Riktlinjer och rutiner för Hälso- och sjukvårds avvikelser och riskhantering inom LSS Författningar
När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ
 1408 När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ Ann Marie Janson Lang, Uppsala Inledning Det finns möjlighet att behandla patienter i Sverige med läkemedel även om
1408 När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ Ann Marie Janson Lang, Uppsala Inledning Det finns möjlighet att behandla patienter i Sverige med läkemedel även om
Integrationshandledning Läkemedel inom förmånssystemet och periodens vara
 Läkemedel inom förmånssystemet och periodens Innehållsförteckning Syfte... 2 Terminologi... 2 Bakgrund... 2 Innehåll... 4 Integration & presentation... 4 Teknisk dokumentation... 4 Sid 1/5 Syfte Information
Läkemedel inom förmånssystemet och periodens Innehållsförteckning Syfte... 2 Terminologi... 2 Bakgrund... 2 Innehåll... 4 Integration & presentation... 4 Teknisk dokumentation... 4 Sid 1/5 Syfte Information
Avvikelsehantering för medicintekniska produkter
 Styrande dokument Regeldokument Anvisning Kvalitetshandbok för medicintekniska produkter och tjänster Del 1 Sida 1 (6) Avvikelsehantering för medicintekniska produkter Inom Norrbottens läns landsting finns
Styrande dokument Regeldokument Anvisning Kvalitetshandbok för medicintekniska produkter och tjänster Del 1 Sida 1 (6) Avvikelsehantering för medicintekniska produkter Inom Norrbottens läns landsting finns
Frågor och svar om NT-rådet
 Frågor och svar om NT-rådet NT-RÅDET Vad är NT-rådet? Rådet för nya terapier, NT-rådet, är en expertgrupp med representanter för Sveriges landsting och regioner. NT-rådet har mandat att ge rekommendationer
Frågor och svar om NT-rådet NT-RÅDET Vad är NT-rådet? Rådet för nya terapier, NT-rådet, är en expertgrupp med representanter för Sveriges landsting och regioner. NT-rådet har mandat att ge rekommendationer
Rutiner för avvikelsehantering och riskhantering
 Riktlinje 3/Avvikelser Rev. 2018-07-03 Socialkontoret Annicka Pantzar Medicinskt ansvarig sjuksköterska Rutiner för avvikelsehantering och riskhantering Författningar Patientsäkerhetslagen (2010: 659)
Riktlinje 3/Avvikelser Rev. 2018-07-03 Socialkontoret Annicka Pantzar Medicinskt ansvarig sjuksköterska Rutiner för avvikelsehantering och riskhantering Författningar Patientsäkerhetslagen (2010: 659)
Parenterala läkemedel inom periodens varautbytet
 Parenterala läkemedel inom periodens varautbytet TANDVÅRDS- OCH LÄKEMEDELSFÖRMÅNSVERKET Box 22520 [Fleminggatan 18], 104 22 Stockholm Telefon: 08 568 420 50, Fax: 08 568 420 99, registrator@tlv.se, www.tlv.se
Parenterala läkemedel inom periodens varautbytet TANDVÅRDS- OCH LÄKEMEDELSFÖRMÅNSVERKET Box 22520 [Fleminggatan 18], 104 22 Stockholm Telefon: 08 568 420 50, Fax: 08 568 420 99, registrator@tlv.se, www.tlv.se
Detaljhandel med nikotinläkemedel
 Detaljhandel med nikotinläkemedel Vägledning till Läkemedelsverkets föreskrifter (LVFS 2008:2) om detaljhandel med nikotinläkemedel; för verksamhetsutövare (version 3, juni 2009) Postadress/Postal address:
Detaljhandel med nikotinläkemedel Vägledning till Läkemedelsverkets föreskrifter (LVFS 2008:2) om detaljhandel med nikotinläkemedel; för verksamhetsutövare (version 3, juni 2009) Postadress/Postal address:
Riktlinje för avvikelsehantering i hälso- och sjukvården samt anmälningsskyldighet enl. Lex Maria inom Socialförvaltningen Klippans kommun
 Riktlinje för avvikelsehantering i hälso- och sjukvården samt anmälningsskyldighet enl. Lex Maria inom Socialförvaltningen Klippans kommun Antagen i socialnämnden 2006-12-05 138 Riktlinjen grundar sig
Riktlinje för avvikelsehantering i hälso- och sjukvården samt anmälningsskyldighet enl. Lex Maria inom Socialförvaltningen Klippans kommun Antagen i socialnämnden 2006-12-05 138 Riktlinjen grundar sig
Föreskrift 1/2010 1/(8)
 Föreskrift 1/2010 1/(8) Anmälan, som bör göras av tillverkaren vid risksituationer berörande hälso- och sjukvårdsprodukter och -utrustning Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning
Föreskrift 1/2010 1/(8) Anmälan, som bör göras av tillverkaren vid risksituationer berörande hälso- och sjukvårdsprodukter och -utrustning Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning
ÅR: 2014. Område: Marknadsföring av humanläkemedel. Tillsynsplan från Läkemedelsverket. Dnr: 6.2.9-2014-016259
 ÅR: 2014 Tillsynsplan från Läkemedelsverket Område: Marknadsföring av humanläkemedel Dnr: 6.2.9-2014-016259 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
ÅR: 2014 Tillsynsplan från Läkemedelsverket Område: Marknadsföring av humanläkemedel Dnr: 6.2.9-2014-016259 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Generiska läkemedel. Same same different name
 Generiska läkemedel Same same different name Vad är generika? de 5 miljarder som samhället sparar årligen på generika motsvarar 11 000 sjuksköterskor* *(inkl. sociala avgifter) En del patienter som står
Generiska läkemedel Same same different name Vad är generika? de 5 miljarder som samhället sparar årligen på generika motsvarar 11 000 sjuksköterskor* *(inkl. sociala avgifter) En del patienter som står
Dnr /2016. Marknadskontrollplan. Egentillverkade medicintekniska produkter
 Dnr 10.4 7583/2016 Marknadskontrollplan 2016 Egentillverkade medicintekniska produkter Inspektionen för vård och omsorg (IVO) sid 2(7) Sammanfattning IVO har tillsynsansvaret för de egentillverkade medicintekniska
Dnr 10.4 7583/2016 Marknadskontrollplan 2016 Egentillverkade medicintekniska produkter Inspektionen för vård och omsorg (IVO) sid 2(7) Sammanfattning IVO har tillsynsansvaret för de egentillverkade medicintekniska
BRYSSEL 2016 Biologiskt / Biosimilar
 BRYSSEL 2016 Biologiskt / Biosimilar Bryssel den 16 november 2016 Tidiane Diao Bakgrund: Mellan 2015 och 2020 går dem flesta patenten på biologiska läkemedel (inom reumatologin) ut och i samband med detta
BRYSSEL 2016 Biologiskt / Biosimilar Bryssel den 16 november 2016 Tidiane Diao Bakgrund: Mellan 2015 och 2020 går dem flesta patenten på biologiska läkemedel (inom reumatologin) ut och i samband med detta
Växtbaserade egenvårdsprodukter får jag rekommendera och biverkningsrapportera?
 Växtbaserade egenvårdsprodukter får jag rekommendera och biverkningsrapportera? Erika Svedlund, Enheten för växtbaserade Växtbaserade Naturmedel Natur Traditionella växtbaserade 1978 1993 2006 Kosttillskott/naturprodukter/hälsokost,etc
Växtbaserade egenvårdsprodukter får jag rekommendera och biverkningsrapportera? Erika Svedlund, Enheten för växtbaserade Växtbaserade Naturmedel Natur Traditionella växtbaserade 1978 1993 2006 Kosttillskott/naturprodukter/hälsokost,etc
Landstingsstyrelsens förslag till beslut
 FÖRSLAG 2007:37 1 (5) Landstingsstyrelsens förslag till beslut Motion 2004:17 av Andres Käärik och Maria Wallhager (fp) om försök med utökad förskrivningsrätt för distriktssköterskor Föredragande landstingsråd:
FÖRSLAG 2007:37 1 (5) Landstingsstyrelsens förslag till beslut Motion 2004:17 av Andres Käärik och Maria Wallhager (fp) om försök med utökad förskrivningsrätt för distriktssköterskor Föredragande landstingsråd:
Rutin vid avvikelsehantering gällande hälso- och sjukvård
 Rutin vid avvikelsehantering gällande hälso- och sjukvård Skapad av: MAS MAR Beslutad av: Gäller från: 2004-04-04 Reviderad den: 2011-11-30 Diarienummer: Inledning Hälso- och sjukvårdslagen ställer krav
Rutin vid avvikelsehantering gällande hälso- och sjukvård Skapad av: MAS MAR Beslutad av: Gäller från: 2004-04-04 Reviderad den: 2011-11-30 Diarienummer: Inledning Hälso- och sjukvårdslagen ställer krav
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården
 Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården Ikraftträdande 1 januari 2018 Läkemedelsenheten 2018-05-25 Innebörd för
Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården Ikraftträdande 1 januari 2018 Läkemedelsenheten 2018-05-25 Innebörd för
1(7) Medicintekniska produkter. Styrdokument
 1(7) Styrdokument 2(7) Styrdokument Dokumenttyp Beslutad av Kommunstyrelsen 2015-06-02 113 Dokumentansvarig Medicinskt ansvarig sjuksköterska Reviderad Upprättad 2013-10-08 Reviderad 2014-06-26, 2015-05-04
1(7) Styrdokument 2(7) Styrdokument Dokumenttyp Beslutad av Kommunstyrelsen 2015-06-02 113 Dokumentansvarig Medicinskt ansvarig sjuksköterska Reviderad Upprättad 2013-10-08 Reviderad 2014-06-26, 2015-05-04
Särläkemedel. Viktiga läkemedel för sällsynta sjukdomar
 Särläkemedel Viktiga läkemedel för sällsynta sjukdomar 1 Förord LIF är branschorganisationen för forskande läkemedelsföretag verksamma i Sverige. LIF har drygt 75 medlemsföretag vilka står som tillverkare
Särläkemedel Viktiga läkemedel för sällsynta sjukdomar 1 Förord LIF är branschorganisationen för forskande läkemedelsföretag verksamma i Sverige. LIF har drygt 75 medlemsföretag vilka står som tillverkare
Rutiner för avvikelsehantering och riskhantering
 Riktlinje 3/Avvikelser Rev. 2014-12-22 Nämndkontor Social Annicka Pantzar Medicinskt ansvarig sjuksköterska Rutiner för avvikelsehantering och riskhantering Författningar Patientsäkerhetslagen (SFS 2010:
Riktlinje 3/Avvikelser Rev. 2014-12-22 Nämndkontor Social Annicka Pantzar Medicinskt ansvarig sjuksköterska Rutiner för avvikelsehantering och riskhantering Författningar Patientsäkerhetslagen (SFS 2010:
Socialstyrelsens författningssamling. Ändring i föreskrifterna och allmänna råden (SOSFS 2005:28) om anmälningsskyldighet enligt lex Maria
 SOSFS 2010:4 (M) Föreskrifter Ändring i föreskrifterna och allmänna råden (SOSFS 2005:28) om anmälningsskyldighet enligt lex Maria Socialstyrelsens författningssamling I Socialstyrelsens författningssamling
SOSFS 2010:4 (M) Föreskrifter Ändring i föreskrifterna och allmänna råden (SOSFS 2005:28) om anmälningsskyldighet enligt lex Maria Socialstyrelsens författningssamling I Socialstyrelsens författningssamling
Läkemedelsinstruktion för elevhälsans medicinska insats
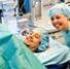 Läkemedelsinstruktion för elevhälsans medicinska insats Allmänt Socialstyrelsens föreskrifter och allmänna råd om läkemedelshantering i hälso- och sjukvården (SOSFS 2000:1) med ändringsföreskrifter reglerar
Läkemedelsinstruktion för elevhälsans medicinska insats Allmänt Socialstyrelsens föreskrifter och allmänna råd om läkemedelshantering i hälso- och sjukvården (SOSFS 2000:1) med ändringsföreskrifter reglerar
REGEL FÖR HÄLSO OCH SJUKVÅRD I SÄRSKILT BOENDE OCH DAGLIG VERKSAMHET ENLIGT LSS. AVVIKELSERAPPORTERING I HÄLSO- OCH SJUKVÅRDEN OCH LEX MARIA
 Region Stockholm Innerstad Sida 1 (5) 2014-05-05 Sjuksköterskor REGEL FÖR HÄLSO OCH SJUKVÅRD I SÄRSKILT BOENDE OCH DAGLIG VERKSAMHET ENLIGT LSS. AVVIKELSERAPPORTERING I HÄLSO- OCH SJUKVÅRDEN OCH LEX MARIA
Region Stockholm Innerstad Sida 1 (5) 2014-05-05 Sjuksköterskor REGEL FÖR HÄLSO OCH SJUKVÅRD I SÄRSKILT BOENDE OCH DAGLIG VERKSAMHET ENLIGT LSS. AVVIKELSERAPPORTERING I HÄLSO- OCH SJUKVÅRDEN OCH LEX MARIA
Information om. Hulio. (adalimumab) För dig med psoriasis
 Information om Hulio (adalimumab) För dig med psoriasis Hulio Ett bra alternativ för behandling av din plackpsoriasis Hulio är ett biologiskt läkemedel som kan hjälpa till att minska symptomen vid psoriasis.
Information om Hulio (adalimumab) För dig med psoriasis Hulio Ett bra alternativ för behandling av din plackpsoriasis Hulio är ett biologiskt läkemedel som kan hjälpa till att minska symptomen vid psoriasis.
Nationella riktlinjer för antipsykotisk läkemedelsbehandling vid schizofreni och schizofreniliknande tillstånd
 Nationella riktlinjer för antipsykotisk läkemedelsbehandling vid schizofreni och schizofreniliknande tillstånd Vetenskapligt underlag Bilaga Slutlig version Förord Socialstyrelsen har i detta dokument
Nationella riktlinjer för antipsykotisk läkemedelsbehandling vid schizofreni och schizofreniliknande tillstånd Vetenskapligt underlag Bilaga Slutlig version Förord Socialstyrelsen har i detta dokument
VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER RIKTLINJE FÖR VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER
 VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER RIKTLINJE FÖR VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER KARLSTADS KOMMUN Beslutad i: Vård- och omsorgsförvaltningen Ansvarig: Medicinskt ansvarig sjuksköterska
VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER RIKTLINJE FÖR VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER KARLSTADS KOMMUN Beslutad i: Vård- och omsorgsförvaltningen Ansvarig: Medicinskt ansvarig sjuksköterska
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande
SOSFS 2005:12 (M) Ledningssystem för kvalitet och patientsäkerhet i hälso- och sjukvården. Socialstyrelsens författningssamling
 SOSFS (M) frfattningssam lingföreskrifter Ledningssystem för kvalitet och patientsäkerhet i hälso- och sjukvården Socialstyrelsens författningssamling I Socialstyrelsens författningssamling (SOSFS) publiceras
SOSFS (M) frfattningssam lingföreskrifter Ledningssystem för kvalitet och patientsäkerhet i hälso- och sjukvården Socialstyrelsens författningssamling I Socialstyrelsens författningssamling (SOSFS) publiceras
ÅR: 2014. Område: Öppenvårdsapotek. Tillsynsplan från Läkemedelsverket. Dnr: 6.2.4-2014-016253
 ÅR: 2014 Tillsynsplan från Läkemedelsverket Område: Öppenvårdsapotek Dnr: 6.2.4-2014-016253 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds
ÅR: 2014 Tillsynsplan från Läkemedelsverket Område: Öppenvårdsapotek Dnr: 6.2.4-2014-016253 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518059HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518059HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Telmisartan/Hydrochlorothiazide ratiopharm 4.12.2014, Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
Telmisartan/Hydrochlorothiazide ratiopharm 4.12.2014, Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
Riktlinje för kontakt med legitimerad hälso- och sjukvårdspersonal
 Diarienummer NHO-2014-0254 ALN-2014-0436 Riktlinje för kontakt med legitimerad hälso- och sjukvårdspersonal Utgår från övergripande styrdokument för hälso- och sjukvård i Uppsala kommun omfattande nämndernas
Diarienummer NHO-2014-0254 ALN-2014-0436 Riktlinje för kontakt med legitimerad hälso- och sjukvårdspersonal Utgår från övergripande styrdokument för hälso- och sjukvård i Uppsala kommun omfattande nämndernas
Bilaga 3 Nuvarande termer och definitioner i termbanken för ordinationsorsak och angränsande begrepp
 1(8) Termer och definitioner så som de ser ut i termbanken idag (före revidering) indikation omständighet som utgör skäl för att vidta en viss åtgärd I läkemedelssammanhang avses med indikation omständighet
1(8) Termer och definitioner så som de ser ut i termbanken idag (före revidering) indikation omständighet som utgör skäl för att vidta en viss åtgärd I läkemedelssammanhang avses med indikation omständighet
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om handel med vissa receptfria läkemedel LVFS 2009:20
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om handel med vissa receptfria läkemedel LVFS 2009:20
Råd och tips vid ansökan om klinisk läkemedelsprövning
 Råd och tips vid ansökan om klinisk läkemedelsprövning Cecilia Ahlin, Med Dr, specialistläkare onkologi och gynekologisk onkologi Enheten för Kliniska Prövningar och Licenser Läkemedelsverket, Uppsala
Råd och tips vid ansökan om klinisk läkemedelsprövning Cecilia Ahlin, Med Dr, specialistläkare onkologi och gynekologisk onkologi Enheten för Kliniska Prövningar och Licenser Läkemedelsverket, Uppsala
att anta Riktlinje för kontakt med legitimerad hälso- och sjukvårdspersonal
 Uppsala * "KOMMUN KONTORET FÖR HÄLSA, VÅRD OCH OMSORG Handläggare Datum Eva Andersson 2014-11-14 Diarienummer ALN-2014-0436.37 Äldrenämnden Riktlinje för kontakt med legitimerad hälso- och sjukvårdspersonal
Uppsala * "KOMMUN KONTORET FÖR HÄLSA, VÅRD OCH OMSORG Handläggare Datum Eva Andersson 2014-11-14 Diarienummer ALN-2014-0436.37 Äldrenämnden Riktlinje för kontakt med legitimerad hälso- och sjukvårdspersonal
Yttrande på: Restnoteringar av läkemedel fortsatt utredning Rapport från Läkemedelsverket
 YTTRANDE 2016-04-11 S2015/04035/FS Socialdepartementet 103 33 STOCKHOLM s.registrator@regeringskansliet.se s.fs@regeringskansliet.se Yttrande på: Restnoteringar av läkemedel fortsatt utredning Rapport
YTTRANDE 2016-04-11 S2015/04035/FS Socialdepartementet 103 33 STOCKHOLM s.registrator@regeringskansliet.se s.fs@regeringskansliet.se Yttrande på: Restnoteringar av läkemedel fortsatt utredning Rapport
Kommunens ansvar för hälso- och sjukvård
 SOCIALFÖRVALTNINGEN Annika Nilsson, 0554-191 56 annika.nilsson@kil.se 2013-12-06 Kommunens ansvar för hälso- och sjukvård HÄLSO- OCH SJUKVÅRDSANSVAR Enligt hälso- och sjukvårdslagen (SFS 1982:763) och
SOCIALFÖRVALTNINGEN Annika Nilsson, 0554-191 56 annika.nilsson@kil.se 2013-12-06 Kommunens ansvar för hälso- och sjukvård HÄLSO- OCH SJUKVÅRDSANSVAR Enligt hälso- och sjukvårdslagen (SFS 1982:763) och
Rutin för rapportering och anmälan enligt lex Maria
 RUTINER HÄLSO- OCH SJUKVÅRD Sid 1 (5) Rutin för rapportering och anmälan enligt lex Maria Begrepp För att öka kännedom om den kommunala hälso- och ens ansvarförhållanden i samband med lex Maria-anmälningar,
RUTINER HÄLSO- OCH SJUKVÅRD Sid 1 (5) Rutin för rapportering och anmälan enligt lex Maria Begrepp För att öka kännedom om den kommunala hälso- och ens ansvarförhållanden i samband med lex Maria-anmälningar,
Läkemedelsverket, en introduktion
 Läkemedelsverket, en introduktion En statlig, i huvudsak avgiftsfinansierad, myndighet under Socialdepartementet Med uppdrag att främja folk- och djurhälsan Drygt 700 anställda, många farmacevter och läkare
Läkemedelsverket, en introduktion En statlig, i huvudsak avgiftsfinansierad, myndighet under Socialdepartementet Med uppdrag att främja folk- och djurhälsan Drygt 700 anställda, många farmacevter och läkare
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516050 Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516050 Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ;
 Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver
Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver
Sömnstörningar hos barn. Bruno Hägglöf Barn och ungdomspsykiatri Umeå universitet
 Sömnstörningar hos barn Bruno Hägglöf Barn och ungdomspsykiatri Umeå universitet Kunskapsdokument från Läkemedelsverket 2014, under tryckning Arbetsgrupp med barnläkare, allmänläkare, barnpsykiatriker,
Sömnstörningar hos barn Bruno Hägglöf Barn och ungdomspsykiatri Umeå universitet Kunskapsdokument från Läkemedelsverket 2014, under tryckning Arbetsgrupp med barnläkare, allmänläkare, barnpsykiatriker,
Sekretesspolicy för farmakovigilansdata
 Sekretesspolicy för farmakovigilansdata Bayer tar produktsäkerheten och din integritet på allvar Bayer AB, Box 606, SE-169 26 Solna, Sverige (hädanefter "Bayer", "oss", "vår" and "vi") utvecklar och marknadsför
Sekretesspolicy för farmakovigilansdata Bayer tar produktsäkerheten och din integritet på allvar Bayer AB, Box 606, SE-169 26 Solna, Sverige (hädanefter "Bayer", "oss", "vår" and "vi") utvecklar och marknadsför
Anmälan och utredning enligt Lex Maria
 SOCIALFÖRVALTNINGEN RIKTLINJE Annika Nilsson, annika.nilsson@kil.se 2017-09-11 Beslutad av SN 2017-09-27 109 Anmälan och utredning enligt Lex Maria BAKGRUND Lex Maria innebär att vårdgivaren enligt lag
SOCIALFÖRVALTNINGEN RIKTLINJE Annika Nilsson, annika.nilsson@kil.se 2017-09-11 Beslutad av SN 2017-09-27 109 Anmälan och utredning enligt Lex Maria BAKGRUND Lex Maria innebär att vårdgivaren enligt lag
Integrationshandledning Läkemedel inom förmånssystemet och periodens vara
 Läkemedel inom förmånssystemet och periodens Innehållsförteckning Syfte... 2 Terminologi... 2 Bakgrund... 2 Innehåll... 4 Krav... 4 Rekommendation... 4 Teknisk dokumentation... 5 Version Datum Författare
Läkemedel inom förmånssystemet och periodens Innehållsförteckning Syfte... 2 Terminologi... 2 Bakgrund... 2 Innehåll... 4 Krav... 4 Rekommendation... 4 Teknisk dokumentation... 5 Version Datum Författare
Remiss - förslag till föreskrifter om anmälan av allvarliga vårdskador (lex Maria)
 2015-09-28 Dnr 2.8-19505/2015 1(1) Avdelningen för verksamhetsstöd och styrning Marie Hansson marie.hansson@ivo.se Enligt sändlista Remiss - förslag till föreskrifter om anmälan av allvarliga vårdskador
2015-09-28 Dnr 2.8-19505/2015 1(1) Avdelningen för verksamhetsstöd och styrning Marie Hansson marie.hansson@ivo.se Enligt sändlista Remiss - förslag till föreskrifter om anmälan av allvarliga vårdskador
www.potenslinjen.se Frågor och svar för dig som har fått ett recept på VIAGRA (sildenafil) Pfizer AB 191 90 Sollentuna Tel 08-550 520 00 www.pfizer.
 VIA20140116PSE02 www.potenslinjen.se Pfizer AB 191 90 Sollentuna Tel 08-550 520 00 www.pfizer.se Frågor och svar för dig som har fått ett recept på VIAGRA (sildenafil) Du har fått ett recept på Viagra,
VIA20140116PSE02 www.potenslinjen.se Pfizer AB 191 90 Sollentuna Tel 08-550 520 00 www.pfizer.se Frågor och svar för dig som har fått ett recept på VIAGRA (sildenafil) Du har fått ett recept på Viagra,
Vägledning om tillämpning av EUförordning 2016/161 om säkerhetsdetaljer på läkemedelsförpackningar. Dnr: Datum:
 Vägledning om tillämpning av EUförordning 2016/161 om säkerhetsdetaljer på läkemedelsförpackningar Dnr: 3.2-2018-019782 Datum: 2019-02-08 Citera gärna Läkemedelsverkets rapporter, men glöm inte att uppge
Vägledning om tillämpning av EUförordning 2016/161 om säkerhetsdetaljer på läkemedelsförpackningar Dnr: 3.2-2018-019782 Datum: 2019-02-08 Citera gärna Läkemedelsverkets rapporter, men glöm inte att uppge
Socialstyrelsens föreskrifter och allmänna råd om lex Maria;
 Socialstyrelsens författningssamling Ansvarig utgivare: Chefsjurist Eleonore Källstrand Nord SOSFS 2012:X (M) Utkom från trycket Den x månad 2012 Socialstyrelsens föreskrifter och allmänna råd om lex Maria;
Socialstyrelsens författningssamling Ansvarig utgivare: Chefsjurist Eleonore Källstrand Nord SOSFS 2012:X (M) Utkom från trycket Den x månad 2012 Socialstyrelsens föreskrifter och allmänna råd om lex Maria;
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516093HSLFS Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516093HSLFS Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Föreskrifter
Namn på försäljningsstället: Gatuadress: Postadress: Telefonnummer, inkl. riktnummer: E-post: Ägarens firmanamn (AB/HB/enskild firma etc.
 Egenkontrollprogram handel med vissa receptfria läkemedel Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Lag (2009:730) om handel med vissa receptfria läkemedel
Egenkontrollprogram handel med vissa receptfria läkemedel Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Lag (2009:730) om handel med vissa receptfria läkemedel
RUTIN FÖR HANDLÄGGNING AV UPPRÄTTAD HÄLSO- OCH SJUKVÅRDSAVVIKELSE
 Utfärdad av: Antagen av: Giltig från: Reviderad: Kvalitetsutvecklare och MAS Socialnämnden 2018-SN-83 181001 Socialförvaltningen RUTIN FÖR HANDLÄGGNING AV UPPRÄTTAD HÄLSO- OCH SJUKVÅRDSAVVIKELSE När något
Utfärdad av: Antagen av: Giltig från: Reviderad: Kvalitetsutvecklare och MAS Socialnämnden 2018-SN-83 181001 Socialförvaltningen RUTIN FÖR HANDLÄGGNING AV UPPRÄTTAD HÄLSO- OCH SJUKVÅRDSAVVIKELSE När något
Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel
 Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Till dig som får behandling med Trulicity (dulaglutid)
 Till dig som får behandling med Trulicity (dulaglutid) Komma igång med Trulicity Diabetes är en sjukdom som kan förändras med tiden. Ibland kan du behöva byta till en behandling som fungerar bättre för
Till dig som får behandling med Trulicity (dulaglutid) Komma igång med Trulicity Diabetes är en sjukdom som kan förändras med tiden. Ibland kan du behöva byta till en behandling som fungerar bättre för
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter och allmänna råd om tillverkares skyldighet att rapportera olyckor och
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter och allmänna råd om tillverkares skyldighet att rapportera olyckor och
Herman Pettersson Inspektör / Jurist. Karin Dahlberg Inspektör / Nationell ämnessamordnare för elevhälsa på IVO
 Herman Pettersson Inspektör / Jurist Karin Dahlberg Inspektör / Nationell ämnessamordnare för elevhälsa på IVO De viktigaste lagarna som berör medicinska insatsen Det går inte att välja vilka lagar som
Herman Pettersson Inspektör / Jurist Karin Dahlberg Inspektör / Nationell ämnessamordnare för elevhälsa på IVO De viktigaste lagarna som berör medicinska insatsen Det går inte att välja vilka lagar som
Remissvar avseende Framtidens biobanker (SOU 2018:4), dnr S2018/00641/FS
 2018-06-27 Dnr 10.1-10747/2018-2 1(5) Avdelning öst Caroline Sundholm caroline.sundholm@ivo.se s.remissvar@regerinskansliet.se ss.fs@regerinskansliet.se Remissvar avseende Framtidens biobanker (SOU 2018:4),
2018-06-27 Dnr 10.1-10747/2018-2 1(5) Avdelning öst Caroline Sundholm caroline.sundholm@ivo.se s.remissvar@regerinskansliet.se ss.fs@regerinskansliet.se Remissvar avseende Framtidens biobanker (SOU 2018:4),
Överenskommelse om rutin för samordnad habilitering och rehabilitering mellan Landstinget Halland och kommunerna i Halland. enligt
 Överenskommelse om rutin för samordnad habilitering och rehabilitering mellan Landstinget Halland och kommunerna i Halland enligt Socialstyrelsens föreskrift SOSFS 2008:20 Slutversion 2009-06 2 Bakgrund
Överenskommelse om rutin för samordnad habilitering och rehabilitering mellan Landstinget Halland och kommunerna i Halland enligt Socialstyrelsens föreskrift SOSFS 2008:20 Slutversion 2009-06 2 Bakgrund
SAKEN BESLUT 1 (5) BioPhausia AB Blasieholmsgatan 2 111 48 Stockholm SÖKANDE. Ansökan inom läkemedelsförmånerna
 2013-07-22 1 (5) Vår beteckning SÖKANDE BioPhausia AB Blasieholmsgatan 2 111 48 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, bifaller ansökan om
2013-07-22 1 (5) Vår beteckning SÖKANDE BioPhausia AB Blasieholmsgatan 2 111 48 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, bifaller ansökan om
När du har svarat på alla frågorna i enkäten klickar du på Klar. Klicka på "Svarsöversikt" för att kontrollera och eventuellt korrigera dina svar.
 Bilaga 2 ENKÄT OM DEN SÄRSKILDA RECEPTBLANKETTEN Läkemedelverket har fått i uppdrag av regeringen att tillsammans med Socialstyrelsen utreda möjligheterna att minska, alternativt helt upphöra, med förskrivningen
Bilaga 2 ENKÄT OM DEN SÄRSKILDA RECEPTBLANKETTEN Läkemedelverket har fått i uppdrag av regeringen att tillsammans med Socialstyrelsen utreda möjligheterna att minska, alternativt helt upphöra, med förskrivningen
Angående delredovisning av uppnådda besparingar inom ramen för 15-årsregeln
 Datum Diarienummer 1 (5) 2013-12-10 3669/2013 Till berörda företag Angående delredovisning av uppnådda besparingar inom ramen för 15-årsregeln TLV publicerar nu en lista över för vilka prissänkningar som
Datum Diarienummer 1 (5) 2013-12-10 3669/2013 Till berörda företag Angående delredovisning av uppnådda besparingar inom ramen för 15-årsregeln TLV publicerar nu en lista över för vilka prissänkningar som
Socialstyrelsens uppdrag att utveckla en nationell källa för ordinationsorsak
 Socialstyrelsens uppdrag att utveckla en nationell källa för ordinationsorsak Socialstyrelsens råd för e-hälsa och gemensam informationsstruktur Karin Ahlzén 2015-02-24 Nationell källa för ordinationsorsak
Socialstyrelsens uppdrag att utveckla en nationell källa för ordinationsorsak Socialstyrelsens råd för e-hälsa och gemensam informationsstruktur Karin Ahlzén 2015-02-24 Nationell källa för ordinationsorsak
Delredovisning: elektronisk rapportering av läkemedelsbiverkningar
 Delredovisning: elektronisk rapportering av läkemedelsbiverkningar Rapport från Läkemedelsverket 2013-11-30 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Delredovisning: elektronisk rapportering av läkemedelsbiverkningar Rapport från Läkemedelsverket 2013-11-30 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Riktlinjer för systematiskt patientsäkerhetsarbete
 RIKTLINJER HÄLSO- OCH SJUKVÅRD Sid 1 (5) Riktlinjer för systematiskt sarbete Övergripande styrdokument Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:40) om vårdgivares systematiska sarbete
RIKTLINJER HÄLSO- OCH SJUKVÅRD Sid 1 (5) Riktlinjer för systematiskt sarbete Övergripande styrdokument Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:40) om vårdgivares systematiska sarbete
维 市 华 人 协 会 健 康 讲 座 2009-11-14 19:00-20:00 甲 流 概 况 及 疫 苗 注 射 主 讲 : 方 静 中 文 注 释 ; 曾 义 根,( 如 有 错 误, 请 以 瑞 典 文 为 准 )
 维 市 华 人 协 会 健 康 讲 座 2009-11-14 19:00-20:00 甲 流 概 况 及 疫 苗 注 射 主 讲 : 方 静 中 文 注 释 ; 曾 义 根,( 如 有 错 误, 请 以 瑞 典 文 为 准 ) 甲 流 病 毒 图 片 Vad är speciellt med den nya influensan? 甲 流 的 特 点 Den nya influensan A (H1N1)
维 市 华 人 协 会 健 康 讲 座 2009-11-14 19:00-20:00 甲 流 概 况 及 疫 苗 注 射 主 讲 : 方 静 中 文 注 释 ; 曾 义 根,( 如 有 错 误, 请 以 瑞 典 文 为 准 ) 甲 流 病 毒 图 片 Vad är speciellt med den nya influensan? 甲 流 的 特 点 Den nya influensan A (H1N1)
SOSFS 2005:28 (M) Föreskrifter och allmänna råd. Anmälningsskyldighet enligt Lex Maria. Socialstyrelsens författningssamling
 SOSFS 2005:28 (M) och allmänna råd Anmälningsskyldighet enligt Lex Maria Socialstyrelsens författningssamling I Socialstyrelsens författningssamling (SOSFS) publiceras verkets föreskrifter och allmänna
SOSFS 2005:28 (M) och allmänna råd Anmälningsskyldighet enligt Lex Maria Socialstyrelsens författningssamling I Socialstyrelsens författningssamling (SOSFS) publiceras verkets föreskrifter och allmänna
Dnr /2016. Marknadskontrollplan. Egentillverkade medicintekniska produkter
 Dnr 10.4-41764/2016 Marknadskontrollplan 2017 Egentillverkade medicintekniska produkter Inspektionen för vård och omsorg (IVO) sid 2(8) Sammanfattning IVO har tillsynsansvaret för de egentillverkade medicintekniska
Dnr 10.4-41764/2016 Marknadskontrollplan 2017 Egentillverkade medicintekniska produkter Inspektionen för vård och omsorg (IVO) sid 2(8) Sammanfattning IVO har tillsynsansvaret för de egentillverkade medicintekniska
ANMÄLAN OCH UTREDNING ENLIGT LEX MARIA RIKTLINJE GÄLLANDE ANMÄLAN OCH UTREDNING ENLIGT LEX MARIA
 ANMÄLAN OCH UTREDNING ENLIGT LEX MARIA RIKTLINJE GÄLLANDE ANMÄLAN OCH UTREDNING ENLIGT LEX MARIA KARLSTADS KOMMUN Beslutad i: VoF Ansvarig samt giltighetstid: Medicinskt ansvarig sjuksköterska Medicinskt
ANMÄLAN OCH UTREDNING ENLIGT LEX MARIA RIKTLINJE GÄLLANDE ANMÄLAN OCH UTREDNING ENLIGT LEX MARIA KARLSTADS KOMMUN Beslutad i: VoF Ansvarig samt giltighetstid: Medicinskt ansvarig sjuksköterska Medicinskt
