När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ
|
|
|
- Jörgen Hedlund
- för 9 år sedan
- Visningar:
Transkript
1 1408 När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ Ann Marie Janson Lang, Uppsala Inledning Det finns möjlighet att behandla patienter i Sverige med läkemedel även om de inte är godkända och marknadsförs i vårt land. Reglerna för hur dessa produkter ges tillstånd att försäljas, och i vissa fall tillverkas och användas, kan vara svåra att överblicka. Eftersom förändringar genomförs inom detta område, bl a som en närmare anpassning till vad som gäller inom hela EU, bör uppgifterna i kapitlet kontrolleras med information på s webbplats,. Förskrivningsmöjligheterna, som beskrivs kortfattat i detta kapitel, rör behandling av enskilda patienter när i Sverige godkända läkemedel inte räcker till. Genom licenssystemet kan patienter, efter bedömning av, få tillgång till läkemedel som är godkända utomlands. Licensförskrivning är dock inte avsedd för forskning eller annan systematisk utvärdering av läkemedel. För produkter som fortfarande är under utveckling och saknar godkännande både i Sverige och utomlands (se avsnittet, s 1409), bör patientens läkare i första hand kontakta tillverkaren. Om det är möjligt för patienten att delta i en klinisk läkemedelsprövning bidrar patienten till ytterligare kunskap om läkemedlet som utvecklas. Om utvecklingen kommit långt, t ex då ansökan om godkännande inom EU inlämnats, kan behandling enligt s k compassionate use-program vara aktuell. Licensförskrivning Den vanligaste förskrivningen av icke-godkända läkemedel i Sverige sker som licensläkemedel, t ex av en produkt som är godkänd i EU för samma indikation som förskrivningen avser eller som avregistrerats i Sverige pga låg omsättning. beviljade 2012 drygt licenser, varav ungefär 80% var läkemedel till patienter i sjukvården och resten framför allt gällde produkter för veterinärmedicinskt bruk. Eftersom beviljad licens är ett tillstånd att sälja produkten görs alltid ansökan av ett apotek till. Information och elektronisk licensmotiveringsblankett finns på s webbplats (1). Enskild eller generell licens Förskrivaren behöver i sin licensmotivering förtydliga vilka omständigheter som motiverar förskrivningen. Som orsak kan exempelvis anges att terapi med godkänt läkemedel saknas för en viss indikation. Andra medicinska skäl kan ligga bakom att ett godkänt läkemedel inte kan användas, t ex om det haft otillräcklig effekt eller inte tolererats. Det bör även motiveras varför licensförskrivning av läkemedel föredras framför användning av andra typer av produkter, t ex medicinteknisk produkt, kosttillskott eller annan terapi. Vanligen söks enskild licens, som gäller för en namngiven patient. Om behovet inte kan tillfredsställas med enskild licens för en viss patient, kan i stället en klinik beviljas gene-
2 1409 rell licens. Tidigare krävdes särskilda omständigheter, t ex att läkemedlet behövs ges akut. Det är nu även möjligt att förskriva läkemedel på generell licens genom rekvisition till klinik för att tillgodose sjukvårdens behov, exempelvis läkemedelsförsörjning för inneliggande patienter (2). Generell licens kan dock inte användas vid förskrivning på recept till enskilda patienter. Då en licens beviljas, gäller den endast för de villkor som beskrivs i ansökan, dvs för en namngiven patient (enskild licens) eller i vissa fall för en bestämd klinik (generell licens), för en viss indikation och för en viss produkt. Produktens tillståndsinnehavare (s k MAH, marketing authorisation holder denna är inte alltid identisk med tillverkaren), beredningsform och styrka ska anges. När licens behövs för en längre tid än ett år ska en ny ansökan göras och även motiveringen förnyas. I vissa fall kan licens beviljas under kortare tid än ett år och med särskilda villkor, t ex med krav på rapport av behandlingsresultat vid fortsatt licensförskrivning. Ansvarsfördelning förskrivande läkare, apotek och Ansvarsfördelningen mellan förskrivande läkare, apotek och kan vara viktig att förtydliga för bl a patienter och anhöriga, som ibland missuppfattar handläggningen och kontaktar direkt i ett enskilt licensärende. Förskrivande läkare/tandläkare Förskrivande läkare/tandläkare ansvarar för bedömningen att patienten inte kan behandlas tillfredsställande med i Sverige godkända läkemedel eller andra tillgängliga produkter (kosttillskott eller medicintekniska produkter) och väljer i samråd med patienten vilket apotek som ska göra ansökan. Förskrivaren ansvarar även för motivering av valet av licenspreparat samt för att produktresumé och i vissa fall bilagor till motiveringen skickas in till. Hanteringen av ansökan går fortast om sådan bilaga skickas med direkt då ansökan görs via apoteket. Om dokument saknas brukar kommunicera direkt till förskrivaren och begära komplettering. Förskrivaren har också ansvar för att doseringen är medicinskt ändamålsenlig, för att information till patienten ges samt för att behandlingen följs upp på lämpligt sätt och att eventuella biverkningar rapporteras till enligt nedan. För vissa läkemedel gäller särskilda villkor, som då anges i s beslut. För läkemedel under utveckling bör motiveringen tydligt ange om förskrivaren utrett om patienten har möjlighet att delta i klinisk läkemedelsprövning eller s k compassionate use-program (se nedan). Apotek Apoteket ansvarar för att kontrollera tillgången på produkten och för att den tas in för försäljning och expedieras. Apoteket ansöker om licens till. Om licensen avslås, är det apoteket som överklagar beslutet. Apoteket är skyldigt att föra anteckningar över alla expeditioner för varje licens. utgår från inkomna handlingar och bedömer ändamålsenligheten vid den sökta indikationen. I den nya licensföreskriften har en rangordning mellan licensläkemedel gjorts som ska styra val av produkt: I första hand ska läkemedel som är godkända inom det europeiska ekonomiska samarbetsområdet användas enligt aktuell produkresumé. I andra hand beviljas licens för läkemedel som är godkända i ett land utanför detta samarbete och som omfattas av avtal med Sverige, s k ICH-land (3), eller MRA-land (4). I tredje hand ska läkemedel som inte omfattas av godkännande i länder med samarbetsavtal enligt ovan användas. Om ett preparat inte är godkänt någonstans och motsvarande läkemedel finns tillgängligt inom Sverige som s k rikslicens (se avsnittet Extemporeläkemedel, lagerberedning och rikslicens, s 1410), har sådan rikslicens företräde. Beslut fattas om licensansökan beviljas eller avslås. För produkter som inte kräver
3 1410 kompletterande utredning avgörs ärendet vanligen inom 7 vardagar. Principen är alltid att ändamålsenligheten bedöms utifrån produktens effekt och säkerhet vid den sökta indikationen. Nytta risk-balansen måste värderas som övervägande positiv med rimlig rational för den enskilda patienten. Myndigheten bedömer även om licensläkemedlet kan ersättas av läkemedel som marknadsförs i Sverige samt om annat känt läkemedel via licens enligt rangordningslistan ovan bör användas i stället. Beviljad rikslicens prioriteras före produkt som saknar godkännande. Stor restriktivitet tillämpas för läkemedel som saknar godkännande eller där godkännandet dragits in genom myndighetsbeslut. Läkemedel som ännu ej godkänts bör i första hand ges till patienter i en klinisk läkemedelsprövning. För att så snabbt som möjligt kunna erbjuda läkemedel under utveckling till patientgrupper med vissa allvarliga sjukdomar som saknar tillfredsställande behandlingsalternativ, har ett s k compassionate use-program (se nedan) införts i Sverige. En förutsättning för ett sådant program är att produktens effekt och säkerhet på ett tillfredsställande sätt dokumenterats vetenskapligt i kliniska läkemedelsprövningar. Detta medför att ett compassionate use-program oftast blir aktuellt först efter avslutade fas-iii-studier. Extemporeläkemedel, lagerberedning och rikslicens När en produkt tillverkas av apotek för en enskild patient som en skräddarsydd terapi kan den i de flesta fall betraktas som ett extemporeläkemedel. En vanlig anledning till att använda ett sådant individanpassat läkemedel kan vara att lämplig styrka och/ eller beredningsform saknas bland godkända läkemedel. Extemporeläkemedel omfattar även vissa läkemedel där hållbarheten är så kort att produkten måste färdigställas i anslutning till användningen. Notera att extemporeläkemedel inte omfattar icke-godkända radioaktiva läkemedel eller individanpassade terapier som består av celler respektive vävnader och vävnadstekniska produkter. De senare är avancerade terapiläkemedel som omfattas av regeln om sjukhusundantagstillverkning (se avsnittet Läkemedel som omfattas av bestämmelse om sjukhusundantag, s 1411). Om det rör sig om en standardiserad tillverkning på apotek är produkten i stället en lagerberedning. Vid stora volymer (> förpackningar/år) behöver det extemporeapotek som tillverkar lagerberedningen ansöka till om en s k rikslicens för produkten. Om myndigheten beviljar rikslicens är beslutet giltigt i 5 år om inte annat anges. Därefter måste ansökan om förnyelse göras. Om avsikten är att systematiskt utvärdera effekten hos patienter som behandlas med extemporeläkemedel, lagerberedningar eller produkter som beviljats rikslicens, ska en klinisk läkemedelsprövning genomföras. Rikslicens beviljas normalt inte om produkten kan ersättas av befintligt godkänt läkemedel, eller av ett läkemedel som är godkänt i ett annat land och som finns tillgängligt på licens. Om rikslicensansökan avslås, får läkemedlet inte tillhandahållas som lagerberedning utan endast extemporetillverkning är då tillåten. När behöver en klinisk läkemedelsprövning beviljas tillstånd av? Om man vill genomföra en klinisk studie, där ett eller flera läkemedel ingår, kan ett tillstånd från behöva inhämtas i förväg (5). Detta gäller också om det inte finns någon avsikt att söka godkännande för en ny produkt. En klinisk läkemedelsprövning kan behöva tillstånd även om bara godkända läkemedel ingår, t ex om en ny indikation ska studeras, om användningen avser en annan patientgrupp än den som undersökts i tidigare kliniska läkemedelsprövningar, vid dosering som är högre eller lägre jämfört med den som är godkänd, eller om administrationssätt eller beredningsform ändrats. Endast s k icke-interventionsstudier får genomföras utan tillstånd från. Dessa studier kan beskrivas som observationsstudier där godkända läkemedel används på det sätt som beskrivs i produktresumén. Varken lottning till olika behandlingsalternativ genom randomisering eller extra undersökningar
4 1411 utanför klinisk praxis kan ingå i sådana icke-interventionsstudier. Ibland kan det vara svårt att avgöra om en produkt är ett läkemedel eller inte, särskilt i fall där gränserna för vad som är livsmedel eller läkemedel skiljer sig mellan olika länder. Vid oklarhet bör alltid tillfrågas. Grundregeln inom EU är att en och samma produkt inte kan klassificeras på mer än ett sätt, dvs det är antingen ett läkemedel, ett livsmedel (kosttillskott) eller en kosmetisk eller medicinteknisk produkt. Inom de närmaste åren kommer en förordning om läkemedelsprövningar inom EU att ersätta det direktiv som gäller idag (6). När Europeiska rådet samt Europaparlamentet beslutat införa den nya förordningen, gäller den som lag i samtliga medlemsstater i EU. Syftet med s granskning av läkemedelsprövningar är både att bedöma om de har förutsättningar att leda till resultat som kan utvärderas och om de kommer att genomföras på ett sätt som är tillräckligt säkert för medverkande försökspersoner, dvs om nyttan överväger riskerna. Riktlinjer om läkemedelsprövningar där försökspersoner medverkar ska följas, t ex ska de vara i linje med principerna i Helsingforsdeklarationen. Prövningsläkemedlen måste också ha godtagbar farmaceutisk kvalitet. Tidigare studieresultat och säkerhetsunderlag bedöms både kliniskt och prekliniskt. Såväl företag som forskare och innovatörer kan få översiktlig information om olika typer av läkemedel på s webbplats (7). När prövningsansökan beviljats publiceras den automatiskt (utom för fas I-prövning där endast vuxna försökspersoner ingår) i en internationell, offentlig databas, som är ett primärt register knutet till WHO. Detta uppfyller de förhandspubliceringskrav som ställs av medicinska tidskrifter då resultaten publiceras. Någon förhandsanmälan till behöver då inte göras. Compassionate use -program Vid vissa allvarliga sjukdomar kan patienter inte medverka i en klinisk läkemedelsprövning samtidigt som behandlingsalternativ saknas med godkända läkemedel. Patienterna kan då erbjudas tillgång till nya läkemedel, som ännu inte finns tillgängliga för försäljning, genom s k compassionate use-program. Ansökan till görs av det företag som tillverkar eller söker marknadsgodkännande för produkten, exempelvis i nära anslutning till att ansökan om marknadsgodkännande inom EU lämnas in. Företaget ansvarar för att tillhandahålla läkemedlet till en på förhand definierad patientgrupp enligt programmet till dess att produkten finns tillgänglig för försäljning i Sverige. Ett beviljat tillstånd innefattar även godkänd distribution. Förutsättningen är att det finns tillfredsställande vetenskaplig dokumentation från kliniska läkemedelsprövningar med uppgifter om läkemedlets effekt och säkerhet, där nytta risk-balansen bedöms som övervägande positiv för en definierad patientgrupp. Läkare som önskar inkludera en patient i ett program, som även ska följa medverkande patienters säkerhet, gör detta genom att fråga företaget direkt om medverkan ryms inom beviljat tillstånd. Detaljerad information finns på s webbplats (8). Läkemedel som omfattas av bestämmelsen om sjukhusundantag Genterapi, somatisk cellterapi eller vävnadsteknisk produkt kan enligt regler som är gemensamma för hela EU bedömas som läkemedel med den gemensamma benämningen avancerad terapi. Dessa omfattar celler och vävnader som genomgått omfattande bearbetning eller som används vid indikationer som avviker från den biologiska produktens ursprungliga funktion. När produkten avser att användas vid behandling inom Sverige, av enstaka patienter under förskrivande läkares exklusiva ansvar, kan särskilt tillverkningstillstånd beviljas (9). Om avsikten är att systematiskt utvärdera dessa läkemedels effekt och säkerhet vid viss en indikation, räcker det inte med ett sådant beviljat tillverkningstillstånd. Då krävs, enligt europeiska kommissionen, en beviljad ansökan om tillstånd för klinisk läkemedelsprövning från (se ovan) och godkännande av en etikprövningsnämnd.
5 1412 Sammanfattande råd om förskrivning och krav på anmälan av misstänkta biverkningar Det finns flera olika alternativ när godkända läkemedel inte räcker till. Den övergripande principen är att kraven på tillverkning av produkten ökar då förskrivningen flyttas från individanpassad terapi med extemporeläkemedel eller avancerade terapiläkemedel som omfattas av bestämmelsen om sjukhusundantag till standardiserade produkter med omfattande produktion. Godkända läkemedel ska generellt sett ha prövats innan förskrivning av licensläkemedel beviljas. För licensläkemedel gäller att läkemedel som är godkända inom europeiska ekonomiska samarbetsområdet har företräde framför preparat som är godkända utanför detta område. Läkemedel som beviljats rikslicens ska prioriteras framför licensförskrivning av preparat som helt saknar godkännande. I vissa fall kan patienter med allvarliga sjukdomar, där godkända behandlingsalternativ saknas, få tillgång till produkter som saknar godkännande genom tillverkarens s k compassionate use-program, som beviljas av. För samtliga läkemedel gäller grundregeln att utvärdering av effekt och säkerhet ska genomföras som kliniska läkemedelsprövningar med beviljat tillstånd från och godkännande från Etikprövningsnämnd. Ifall det är oklart om ett forskningsprojekt är en klinisk läkemedelsprövning eller inte, bör alltid frågan ställas till (använd e-postadressen registrator@mpa.se) i god tid innan projektet startar. Bifoga dokument som kortfattat beskriver studien, t ex detaljer om studieläkemedlet och projektets syfte. Biverkningar av i Sverige godkända samt icke-godkända läkemedel ska anmälas (10). Vid kliniska läkemedelsprövningar gäller särskilda regler (5). Referenser 1. Licenser.. 2. Reviderad licensföreskrift. LVFS 2008:1 reviderad och omtryckt genom LVFS 2012: International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. ICH guidelines Euopean Medicines Agency, Inspections (u d). Mutual Recognition Agreements Kliniska Prövningar LVFS 2011:19, s föreskrifter om kliniska läkemedelsprövningar på människor samt vägledning till föreskriften. 6. Riktlinjer om kliniska läkemedelsprövningar. Eudralex volume 10 Clinical Trials Guidelines. Europeiska kommissionen Läkemedel för människa. SME-guiden.. 8. Compassionate use-program.. 9. Läkemedel som omfattas av bestämmelse om sjukhusundantag.. 10.Rapportera biverkningar..
RAPPORT. Kliniska riktlinjer för användning av obeprövade behandlingsmetoder på allvarligt sjuka patienter
 RAPPORT Kliniska riktlinjer för användning av obeprövade behandlingsmetoder på allvarligt sjuka patienter Förslag från arbetsgrupp: Olle Lindvall, Kungl. Vetenskapsakademien Ingemar Engström, Svenska Läkaresällskapet
RAPPORT Kliniska riktlinjer för användning av obeprövade behandlingsmetoder på allvarligt sjuka patienter Förslag från arbetsgrupp: Olle Lindvall, Kungl. Vetenskapsakademien Ingemar Engström, Svenska Läkaresällskapet
Tema kliniska prövningar och licenser: När godkända läkemedel inte räcker till
 Tema kliniska prövningar och licenser: När godkända läkemedel inte räcker till Enligt lagstiftningen måste ett läkemedel som ska ges till en patient i Sverige vara godkänt för försäljning i vårt land.
Tema kliniska prövningar och licenser: När godkända läkemedel inte räcker till Enligt lagstiftningen måste ett läkemedel som ska ges till en patient i Sverige vara godkänt för försäljning i vårt land.
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter)
 Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter) Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter) Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Författningar för farmaceutisk behörighet
 Författningar för farmaceutisk behörighet Höstterminen 2012 Ida Bergström ida.bergstrom@farmaci.uu.se Innehåll Läkemedel Genomgång av kurshandledningen 1 Innehåll Läkemedel Läkemedel - definition Avsedd
Författningar för farmaceutisk behörighet Höstterminen 2012 Ida Bergström ida.bergstrom@farmaci.uu.se Innehåll Läkemedel Genomgång av kurshandledningen 1 Innehåll Läkemedel Läkemedel - definition Avsedd
Licens Behandlingsalternativ när godkända läkemedel inte räcker till
 Licens Behandlingsalternativ när godkända läkemedel inte räcker till Läkemedelsverket 2017-11-09 Maria Jafner Kliniska Prövningar och Licenser Gunilla Andrew-Nielsen Enhetschef Enhetsadministratör Malika
Licens Behandlingsalternativ när godkända läkemedel inte räcker till Läkemedelsverket 2017-11-09 Maria Jafner Kliniska Prövningar och Licenser Gunilla Andrew-Nielsen Enhetschef Enhetsadministratör Malika
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Författningar. Allmänt om författningar. Innehåll. Författningshierarki: Receptarieprogrammet HT-10
 Författningar Receptarieprogrammet HT-10 Pernilla Jonsson Leg. apotekare och doktorand Samhällsfarmaci/ Socialmedicin Sahlgrenska akademin vid Göteborgs universitet 1 Innehåll Läkemedel Handel och import
Författningar Receptarieprogrammet HT-10 Pernilla Jonsson Leg. apotekare och doktorand Samhällsfarmaci/ Socialmedicin Sahlgrenska akademin vid Göteborgs universitet 1 Innehåll Läkemedel Handel och import
ÅR: 2013 Tillsynsrapport från Läkemedelsverket
 ÅR: 2013 Tillsynsrapport från Läkemedelsverket Område: GMP Sjukvård Dnr: 6.2.2-2014-030251 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds
ÅR: 2013 Tillsynsrapport från Läkemedelsverket Område: GMP Sjukvård Dnr: 6.2.2-2014-030251 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter och allmänna råd (LVFS 1995:7) om tillstånd
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter och allmänna råd (LVFS 1995:7) om tillstånd
Lagrådsremiss. Genomförande av EG-direktivet om kliniska prövningar. Lagrådsremissens huvudsakliga innehåll
 Lagrådsremiss Genomförande av EG-direktivet om kliniska prövningar Regeringen överlämnar denna remiss till Lagrådet. Stockholm den 18 september 2003 Lars Engqvist Björn Reuterstrand (Socialdepartementet)
Lagrådsremiss Genomförande av EG-direktivet om kliniska prövningar Regeringen överlämnar denna remiss till Lagrådet. Stockholm den 18 september 2003 Lars Engqvist Björn Reuterstrand (Socialdepartementet)
Kliniska prövningar av läkemedel dagens regler och den nya förordningen. Margareta Svensson Team Leader Drug Safety TFS, Sweden
 Kliniska prövningar av läkemedel dagens regler och den nya förordningen Margareta Svensson Team Leader Drug Safety TFS, Sweden Bakgrund Kliniska prövningar minskat i EU med 25% 2007-2011 - ekonomiska konsekvenser
Kliniska prövningar av läkemedel dagens regler och den nya förordningen Margareta Svensson Team Leader Drug Safety TFS, Sweden Bakgrund Kliniska prövningar minskat i EU med 25% 2007-2011 - ekonomiska konsekvenser
Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ;
 Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver
Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver
Information om säkerhet och nytta med läkemedel INGÅR I EN SERIE SKRIFTER FRÅN RIKSFÖRBUNDET HJÄRTLUNG
 Information om säkerhet och nytta med läkemedel INGÅR I EN SERIE SKRIFTER FRÅN RIKSFÖRBUNDET HJÄRTLUNG Läkemedlen har en dokumenterad nytta Alla läkemedel har godkänts av läkemedelsmyndigheterna och har
Information om säkerhet och nytta med läkemedel INGÅR I EN SERIE SKRIFTER FRÅN RIKSFÖRBUNDET HJÄRTLUNG Läkemedlen har en dokumenterad nytta Alla läkemedel har godkänts av läkemedelsmyndigheterna och har
\~~1A. Ändringar Hela instruktionen anpassad till införandet av KLAS, Kommunikationslösning för licensansöknmgar.
 .. "f'"~ VÄSTRA GÖTALANDSREGONEN Licenshantering - läkemede l som distribueras av RG L Dokumentansvarig Fredrik Vonclracek, Kvali tetsansvarig äpotekare, Sjukhusäpoteket VG R _\_~~~J:;-~ -- - -- \~~1A
.. "f'"~ VÄSTRA GÖTALANDSREGONEN Licenshantering - läkemede l som distribueras av RG L Dokumentansvarig Fredrik Vonclracek, Kvali tetsansvarig äpotekare, Sjukhusäpoteket VG R _\_~~~J:;-~ -- - -- \~~1A
Svensk författningssamling
 Svensk författningssamling Förordning om ändring i förordningen (2010:1167) om avgifter för den statliga kontrollen av läkemedel; SFS 2015:465 Utkom från trycket den 7 juli 2015 utfärdad den 25 juni 2015.
Svensk författningssamling Förordning om ändring i förordningen (2010:1167) om avgifter för den statliga kontrollen av läkemedel; SFS 2015:465 Utkom från trycket den 7 juli 2015 utfärdad den 25 juni 2015.
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter);
 Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter); Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter); Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Inledning... 3. Bedömning av utbytbarhet för den enskilde patienten... 4. Allmänt om utbytbarhet... 3. Utbyte på apotek... 4
 UTKAST Vägledning till 5 kap. 8 a Läkemedelverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit farmaceuts möjlighet att motsätta sig utbyte av läkemedel Postadress/Postal
UTKAST Vägledning till 5 kap. 8 a Läkemedelverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit farmaceuts möjlighet att motsätta sig utbyte av läkemedel Postadress/Postal
Verksamhetsstöd för cellterapi
 Dokumentnamn Verksamhetsstöd för cellterapi Tillstånd vid hantering av vävnader och Datum 2014-12-16 Sida 1 (8) Rådet för organ, vävnader, celler och blod - Vävnadsrådet Framtagen av Vävnadsområdesgrupp
Dokumentnamn Verksamhetsstöd för cellterapi Tillstånd vid hantering av vävnader och Datum 2014-12-16 Sida 1 (8) Rådet för organ, vävnader, celler och blod - Vävnadsrådet Framtagen av Vävnadsområdesgrupp
6 Genomförande av direktiv 2004/24/EG om ändring, avseende traditionella växtbaserade
 6 Genomförande av direktiv 2004/24/EG om ändring, avseende traditionella växtbaserade läkemedel, av direktiv 2001/83/EG om upprättande av gemenskapsregler för humanläkemedel 6.1 Definitioner och tillämpningsområde
6 Genomförande av direktiv 2004/24/EG om ändring, avseende traditionella växtbaserade läkemedel, av direktiv 2001/83/EG om upprättande av gemenskapsregler för humanläkemedel 6.1 Definitioner och tillämpningsområde
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter);
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter);
Att få ett läkemedel godkänt. Christin Olofsson Regulatoriska enheten
 Att få ett läkemedel godkänt Christin Olofsson Regulatoriska enheten 1 Att få ett läkemedel godkänt Processen framåt Regulatoriska enheten, Läkemedelsverket 2 Kritiska frågor när man påbörjar läkemedelsutveckling
Att få ett läkemedel godkänt Christin Olofsson Regulatoriska enheten 1 Att få ett läkemedel godkänt Processen framåt Regulatoriska enheten, Läkemedelsverket 2 Kritiska frågor när man påbörjar läkemedelsutveckling
Receptlära och läkemedels- förmånerna
 Receptlära och läkemedels- förmånerna Marie-Louise Ovesjö öl, med dr Klinisk farmakologi, Södersjukhuset AB marie-louise.hakansson-ovesjo@sodersjukhuset.se Vem får förskriva läkemedel? Behöriga förskrivare
Receptlära och läkemedels- förmånerna Marie-Louise Ovesjö öl, med dr Klinisk farmakologi, Södersjukhuset AB marie-louise.hakansson-ovesjo@sodersjukhuset.se Vem får förskriva läkemedel? Behöriga förskrivare
Angående remiss avseende Insatser för att förbättra patientsäkerheten vid generiskt utbyte med LV dnr 1.1-2014-05-04-105666
 Registrator vid Läkemedelsverket Box 26 751 03 Uppsala Angående remiss avseende Insatser för att förbättra patientsäkerheten vid generiskt utbyte med LV dnr 1.1-2014-05-04-105666 Stiftelsen NEPI välkomnar
Registrator vid Läkemedelsverket Box 26 751 03 Uppsala Angående remiss avseende Insatser för att förbättra patientsäkerheten vid generiskt utbyte med LV dnr 1.1-2014-05-04-105666 Stiftelsen NEPI välkomnar
EUROPEISKA KOMMISSIONEN GENERALDIREKTORATET FÖR NÄRINGSLIV
 EUROPEISKA KOMMISSIONEN GENERALDIREKTORATET FÖR NÄRINGSLIV Konsumtionsvaror Farmaceutiska produkter Bryssel den 9/1/2008 ENTR NR D(2007) Offentlig inbjudan till intresseanmälan till Europeiska läkemedelsmyndighetens
EUROPEISKA KOMMISSIONEN GENERALDIREKTORATET FÖR NÄRINGSLIV Konsumtionsvaror Farmaceutiska produkter Bryssel den 9/1/2008 ENTR NR D(2007) Offentlig inbjudan till intresseanmälan till Europeiska läkemedelsmyndighetens
Europeiska unionens officiella tidning. (Lagstiftningsakter) FÖRORDNINGAR
 27.5.2014 L 158/1 I (Lagstiftningsakter) FÖRORDNINGAR EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING (EU) nr 536/2014 av den 16 april 2014 om kliniska prövningar av humanläkemedel och om upphävande av direktiv
27.5.2014 L 158/1 I (Lagstiftningsakter) FÖRORDNINGAR EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING (EU) nr 536/2014 av den 16 april 2014 om kliniska prövningar av humanläkemedel och om upphävande av direktiv
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518026HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518026HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL
 Regeringens proposition till Riksdagen med förslag till lag om ändring av läkemedelslagen 292715 PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I denna proposition föreslås att läkemedelslagen ändras. Genom de föreslagna
Regeringens proposition till Riksdagen med förslag till lag om ändring av läkemedelslagen 292715 PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I denna proposition föreslås att läkemedelslagen ändras. Genom de föreslagna
ÅR: 2015. Tillsynsplan från Läkemedelsverket. Område: Inspektion av Industri och Sjukvård. Dnr: 1.1-2015-030856
 ÅR: 2015 Tillsynsplan från Läkemedelsverket Område: Inspektion av Industri och Sjukvård Dnr: 1.1-2015-030856 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
ÅR: 2015 Tillsynsplan från Läkemedelsverket Område: Inspektion av Industri och Sjukvård Dnr: 1.1-2015-030856 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Särläkemedel. Viktiga läkemedel för sällsynta sjukdomar
 Särläkemedel Viktiga läkemedel för sällsynta sjukdomar 1 Förord LIF är branschorganisationen för forskande läkemedelsföretag verksamma i Sverige. LIF har drygt 75 medlemsföretag vilka står som tillverkare
Särläkemedel Viktiga läkemedel för sällsynta sjukdomar 1 Förord LIF är branschorganisationen för forskande läkemedelsföretag verksamma i Sverige. LIF har drygt 75 medlemsföretag vilka står som tillverkare
Med stöd av 21 förordningen (2002:687) om läkemedelsförmåner m.m. föreskrivs följande.
 Konsoliderad föreskrift TLVFS 2008:2 1 Konsoliderad föreskrift TLVFS 2008:2 Tandvårds- och läkemedelsförmånsverkets föreskrifter och allmänna råd (TLVFS 2008:2) om ansökan och beslut om läkemedel och varor
Konsoliderad föreskrift TLVFS 2008:2 1 Konsoliderad föreskrift TLVFS 2008:2 Tandvårds- och läkemedelsförmånsverkets föreskrifter och allmänna råd (TLVFS 2008:2) om ansökan och beslut om läkemedel och varor
Sjukhusens läkemedelsförsörjning
 Sjukhusens läkemedelsförsörjning Vägledning till Läkemedelsverkets föreskrifter (LVFS 2012:8) om sjukhusens läkemedelsförsörjning (Version 1, juli 2012) Postadress/Postal address: P.O. Box 26, SE-751 03
Sjukhusens läkemedelsförsörjning Vägledning till Läkemedelsverkets föreskrifter (LVFS 2012:8) om sjukhusens läkemedelsförsörjning (Version 1, juli 2012) Postadress/Postal address: P.O. Box 26, SE-751 03
Riktlinje. för läkemedelshantering inom kommunal hälso- och sjukvård
 Malmö stad Fastställd: 2000-05-11 Medicinskt ansvarig sjuksköterska Reviderad: 2009-06-18 Riktlinje för läkemedelshantering inom kommunal hälso- och sjukvård INNEHÅLLSFÖRTECKNING Riktlinjer för läkemedelshantering...3
Malmö stad Fastställd: 2000-05-11 Medicinskt ansvarig sjuksköterska Reviderad: 2009-06-18 Riktlinje för läkemedelshantering inom kommunal hälso- och sjukvård INNEHÅLLSFÖRTECKNING Riktlinjer för läkemedelshantering...3
Utvecklad takprismodell för vissa äldre läkemedel och krav på laga kraft av beslut om sanktionsavgifter
 Promemoria Utvecklad takprismodell för vissa äldre läkemedel och krav på laga kraft av beslut om sanktionsavgifter I juni 2011 fick en utredare i uppdrag att se över vissa frågor om prissättning, tillgänglighet
Promemoria Utvecklad takprismodell för vissa äldre läkemedel och krav på laga kraft av beslut om sanktionsavgifter I juni 2011 fick en utredare i uppdrag att se över vissa frågor om prissättning, tillgänglighet
Läkemedelsordination på recept Receptskrivningens ABC. Carl-Olav Stiller Överläkare, Docent Klinisk farmakologi Institutionen för Medicin Solna
 Läkemedelsordination på recept Receptskrivningens ABC Carl-Olav Stiller Överläkare, Docent Klinisk farmakologi Institutionen för Medicin Solna Information om läkemedel www.fass.se Produktmonografi SPC
Läkemedelsordination på recept Receptskrivningens ABC Carl-Olav Stiller Överläkare, Docent Klinisk farmakologi Institutionen för Medicin Solna Information om läkemedel www.fass.se Produktmonografi SPC
RAPPORT FRÅN KOMMISSIONEN TILL EUROPAPARLAMENTET OCH RÅDET
 EUROPEISKA KOMMISSIONEN Bryssel den 30.3.2015 COM(2015) 138 final RAPPORT FRÅN KOMMISSIONEN TILL EUROPAPARLAMENTET OCH RÅDET om utövande av delegering av befogenheter till kommissionen i enlighet med Europaparlamentets
EUROPEISKA KOMMISSIONEN Bryssel den 30.3.2015 COM(2015) 138 final RAPPORT FRÅN KOMMISSIONEN TILL EUROPAPARLAMENTET OCH RÅDET om utövande av delegering av befogenheter till kommissionen i enlighet med Europaparlamentets
Utkast till föreskrift x/2011
 Utkast till föreskrift x/2011 1 (6) x.x.2011 Dnr 6187/03.01.01/2010 Serviceställen för apotek Bemyndiganden Målgrupp Giltighetstid Läkemedelslagen (395/1987) 52 a 4 mom. och 57 3 mom. såsom den lyder i
Utkast till föreskrift x/2011 1 (6) x.x.2011 Dnr 6187/03.01.01/2010 Serviceställen för apotek Bemyndiganden Målgrupp Giltighetstid Läkemedelslagen (395/1987) 52 a 4 mom. och 57 3 mom. såsom den lyder i
KLOKA FRÅGOR OM ÄLDRES LÄKEMEDELSBEHANDLING ATT STÄLLA I SJUKVÅRDEN
 KLOKA FRÅGOR OM ÄLDRES LÄKEMEDELSBEHANDLING ATT STÄLLA I SJUKVÅRDEN Kloka frågor vänder sig till dig som är äldre och som använder läkemedel. Med stigande ålder blir det vanligare att man behöver läkemedel.
KLOKA FRÅGOR OM ÄLDRES LÄKEMEDELSBEHANDLING ATT STÄLLA I SJUKVÅRDEN Kloka frågor vänder sig till dig som är äldre och som använder läkemedel. Med stigande ålder blir det vanligare att man behöver läkemedel.
Kraftig kostnadsökning under 1990-talet. Vad gör TLV? -Hur vårt uppdrag påverkar apoteksfarmaceutens vardag. Är hälso- och sjukvård en rättighet?
 Vad gör TLV? -Hur vårt uppdrag påverkar apoteksfarmaceutens vardag Camilla Berglund, leg. Apotekare Är hälso- och sjukvård en rättighet? Kraftig kostnadsökning under 1990-talet 2002 bildas myndigheten
Vad gör TLV? -Hur vårt uppdrag påverkar apoteksfarmaceutens vardag Camilla Berglund, leg. Apotekare Är hälso- och sjukvård en rättighet? Kraftig kostnadsökning under 1990-talet 2002 bildas myndigheten
APL Preferred CDMO. Development, analysis and manufacturing for clinical trials Company presentation Magnus Strömberg Production Manager
 APL Preferred CDMO Development, analysis and manufacturing for clinical trials Company presentation Magnus Strömberg Production Manager 1 APL i korthet Lång erfarenhet av utveckling och tillverkning av
APL Preferred CDMO Development, analysis and manufacturing for clinical trials Company presentation Magnus Strömberg Production Manager 1 APL i korthet Lång erfarenhet av utveckling och tillverkning av
Att fylla i blankett för licensansökan via webb
 Ev dokumenttitel Datum: ÅÅÅÅ-MM-DD Att fylla i blankett för licensansökan via webb Lathund 2012-01-20 Fastställare: Postadress/Postal address: P.O. Box 26, SE-751 Gäller 03 Uppsala, fr.o.m.: SWEDEN 1(1)
Ev dokumenttitel Datum: ÅÅÅÅ-MM-DD Att fylla i blankett för licensansökan via webb Lathund 2012-01-20 Fastställare: Postadress/Postal address: P.O. Box 26, SE-751 Gäller 03 Uppsala, fr.o.m.: SWEDEN 1(1)
REGERINGSRÄTTENS DOM
 REGERINGSRÄTTENS DOM 1 (10) 960-08 och 3047-08 meddelad i Stockholm den 24 juni 2010 KLAGANDE OCH MOTPARTER 1. Läkemedelsverket Box 26 751 03 Uppsala 2. Navamedic ASA Ombud: Advokat Elisabeth Legnerfält
REGERINGSRÄTTENS DOM 1 (10) 960-08 och 3047-08 meddelad i Stockholm den 24 juni 2010 KLAGANDE OCH MOTPARTER 1. Läkemedelsverket Box 26 751 03 Uppsala 2. Navamedic ASA Ombud: Advokat Elisabeth Legnerfält
Riktlinjer för anstånd med studiestart och studieuppehåll
 1 (5) Riktlinjer för anstånd med studiestart och studieuppehåll Giltighet och ändringar Fastställd av Försvarshögskolans vicerektor på uppdrag av rektor den 28 juni 2012. Reviderad 2015-05-19 att gälla
1 (5) Riktlinjer för anstånd med studiestart och studieuppehåll Giltighet och ändringar Fastställd av Försvarshögskolans vicerektor på uppdrag av rektor den 28 juni 2012. Reviderad 2015-05-19 att gälla
Kliniska prövningar Vad du bör tänka på. Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser
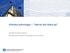 Kliniska prövningar Vad du bör tänka på Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser Utveckling av nytt läkemedel Lab.försök & djurtester Tester på människor Kemi, biokemi Preklinisk
Kliniska prövningar Vad du bör tänka på Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser Utveckling av nytt läkemedel Lab.försök & djurtester Tester på människor Kemi, biokemi Preklinisk
STUDIEHANDLEDNING. Farmakoterapi 13,5 hp
 STUDIEHANDLEDNING Farmakoterapi 13,5 hp Receptarieutbildningen vid Umeå Universitet Välkommen till Farmakoterapi 13,5 hp Vi heter Sofia Mattsson och Maria Sjölander och är lärare på kursen i farmakoterapi.
STUDIEHANDLEDNING Farmakoterapi 13,5 hp Receptarieutbildningen vid Umeå Universitet Välkommen till Farmakoterapi 13,5 hp Vi heter Sofia Mattsson och Maria Sjölander och är lärare på kursen i farmakoterapi.
Riktlinje och rutin för delegering av läkemedelshantering
 Riktlinje och rutin för delegering av läkemedelshantering 1 INNEHÅLLSFÖRTECKNING Riktlinje och rutin för delegering av läkemedelshantering 3 Grundutbildning läkemedelshantering och diabetes 4 Delegering
Riktlinje och rutin för delegering av läkemedelshantering 1 INNEHÅLLSFÖRTECKNING Riktlinje och rutin för delegering av läkemedelshantering 3 Grundutbildning läkemedelshantering och diabetes 4 Delegering
SAKEN BESLUT. ViroPharma SPRL Rue Montoyer 47 1000 Brussels SÖKANDE. Ansökan inom läkemedelsförmånerna
 2013-09-05 1 (5) Vår beteckning SÖKANDE ViroPharma SPRL Rue Montoyer 47 1000 Brussels SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, beslutar att nedanstående
2013-09-05 1 (5) Vår beteckning SÖKANDE ViroPharma SPRL Rue Montoyer 47 1000 Brussels SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, beslutar att nedanstående
Anvisningar till Stockholms läns läkemedelskommittés expertråd för upprättande av Kloka Listan 2016 rekommenderade läkemedel i SLL
 Dokumentbeteckning: Anvisningar till Stockholms läns läkemedelskommittés expertråd för upprättande av Kloka Listan 2016 Datum: 2015-06-10 Anvisningar till Stockholms läns läkemedelskommittés expertråd
Dokumentbeteckning: Anvisningar till Stockholms läns läkemedelskommittés expertråd för upprättande av Kloka Listan 2016 Datum: 2015-06-10 Anvisningar till Stockholms läns läkemedelskommittés expertråd
Övertagande av patient från annan enhet
 Övertagande av patient från annan enhet Formulär för manuell registrering Version 6.3 Formulär C Ifyllande enhet: Gäller from Revideras senast 150201 Ersätter version 6.2 160201 Inledning Formuläret består
Övertagande av patient från annan enhet Formulär för manuell registrering Version 6.3 Formulär C Ifyllande enhet: Gäller from Revideras senast 150201 Ersätter version 6.2 160201 Inledning Formuläret består
Licens. Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens. (Version 1, september 2018)
 Licens Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens (Version 1, september 2018) Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Licens Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens (Version 1, september 2018) Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Apotekarsocietetens policyprogram för läkemedelsområdet
 Apotekarsocietetens policyprogram för läkemedelsområdet Antaget av föreningens fullmäktige 24 maj 2014 Apotekarsocietetens policyprogram för läkemedelsområdet Apotekarsocieteten (APS) är en ideell förening
Apotekarsocietetens policyprogram för läkemedelsområdet Antaget av föreningens fullmäktige 24 maj 2014 Apotekarsocietetens policyprogram för läkemedelsområdet Apotekarsocieteten (APS) är en ideell förening
Avdelning I Inledande bestämmelser
 Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den
Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den
Avdelning I Inledande bestämmelser
 Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den
Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den
Nyheter om dispenser och licenser. Informationsdagar för läkemedelsansvariga Mars 2018
 Nyheter om dispenser och licenser Informationsdagar för läkemedelsansvariga Mars 2018 Agenda Dispenser Ny dispenslösning Ny dispensföreskrift Licenser Generell information Nytt i KLAS Frågor Ny dispenslösning
Nyheter om dispenser och licenser Informationsdagar för läkemedelsansvariga Mars 2018 Agenda Dispenser Ny dispenslösning Ny dispensföreskrift Licenser Generell information Nytt i KLAS Frågor Ny dispenslösning
Bilaga 6. Kartläggning av receptfria läkemedel: Samtal till Giftinformationscentralen om tillbud och förgiftningar
 Bilaga 6. Kartläggning av receptfria läkemedel: Samtal till Giftinformationscentralen om tillbud och förgiftningar Dnr 4.3.1-2014-104307 2015-05-22 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala,
Bilaga 6. Kartläggning av receptfria läkemedel: Samtal till Giftinformationscentralen om tillbud och förgiftningar Dnr 4.3.1-2014-104307 2015-05-22 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala,
Europeiska förklaringar om sjukhusfarmaci
 Europeiska förklaringar om sjukhusfarmaci Följande sidor innehåller de europeiska förklaringarna om sjukhusfarmaci. Förklaringarna utgör gemensamt överenskomna uttalanden om vad varje europeiskt hälso-
Europeiska förklaringar om sjukhusfarmaci Följande sidor innehåller de europeiska förklaringarna om sjukhusfarmaci. Förklaringarna utgör gemensamt överenskomna uttalanden om vad varje europeiskt hälso-
Delårsrapport för tiden 2015-01-01 till 2015-09-30
 Delårsrapport för tiden 2015-01-01 till 2015-09-30 Perioden i sammandrag: Nettoomsättning uppgick till 174 tsek. Resultatet efter finansiella poster uppgick till -1 404 tkr. Resultaten per aktie uppgick
Delårsrapport för tiden 2015-01-01 till 2015-09-30 Perioden i sammandrag: Nettoomsättning uppgick till 174 tsek. Resultatet efter finansiella poster uppgick till -1 404 tkr. Resultaten per aktie uppgick
Mål för att minska miljöpåverkan från Västra Götalandsregionens
 Bilaga 1 2009-04-14 Handlingsplan för att minska miljöpåverkan från Västra Götalandsregionens läkemedelsanvändning Vision Västra Götalandsregionen skall, utan att påverka patientnyttan, minimera miljöbelastningen
Bilaga 1 2009-04-14 Handlingsplan för att minska miljöpåverkan från Västra Götalandsregionens läkemedelsanvändning Vision Västra Götalandsregionen skall, utan att påverka patientnyttan, minimera miljöbelastningen
Information för tillverkare - 6 steg till godkänd icke-automatisk våg
 Information för tillverkare - 6 steg till godkänd icke-automatisk våg 1. Regler om vågar i EU 2009/23/EG om icke-automatiska vågar Direktivet för icke-automatiska vågar/nawi Direktivet är genomfört i Sverige
Information för tillverkare - 6 steg till godkänd icke-automatisk våg 1. Regler om vågar i EU 2009/23/EG om icke-automatiska vågar Direktivet för icke-automatiska vågar/nawi Direktivet är genomfört i Sverige
Yttrande över Arbetsmiljöverkets föreskrifter om hygieniska gränsvärden
 Regelrådet är ett särskilt beslutsorgan inom Tillväxtverket vars ledamöter utses av regeringen. Regelrådet ansvarar för sina egna beslut. Regelrådets uppgifter är att granska och yttra sig över kvaliteten
Regelrådet är ett särskilt beslutsorgan inom Tillväxtverket vars ledamöter utses av regeringen. Regelrådet ansvarar för sina egna beslut. Regelrådets uppgifter är att granska och yttra sig över kvaliteten
Redovisning av tillsyn av arbetsskadeförsäkringen
 Sida 1 av 8 Redovisning av tillsyn av arbetsskadeförsäkringen RIKSFÖRSÄKRINGSVERKET RAPPORT 1999-05-27 RIKSFÖRSÄKRINGSVERKET RAPPORT 1999-05-27 SAMMANFATTNING 1. INLEDNING 2. BEDÖMNINGSINSTRUMENTET 3.
Sida 1 av 8 Redovisning av tillsyn av arbetsskadeförsäkringen RIKSFÖRSÄKRINGSVERKET RAPPORT 1999-05-27 RIKSFÖRSÄKRINGSVERKET RAPPORT 1999-05-27 SAMMANFATTNING 1. INLEDNING 2. BEDÖMNINGSINSTRUMENTET 3.
Implementering av ny EU-förordning om kliniska prövningar på humanläkemedel
 Implementering av ny EU-förordning om kliniska prövningar på humanläkemedel Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser, Läkemedelsverket Ny EU-förordning om kliniska läkemedelsprövningar
Implementering av ny EU-förordning om kliniska prövningar på humanläkemedel Gunilla Andrew-Nielsen Enhetschef Kliniska Prövningar och Licenser, Läkemedelsverket Ny EU-förordning om kliniska läkemedelsprövningar
Detta dokument är endast avsett som dokumentationshjälpmedel och institutionerna ansvarar inte för innehållet
 2001L0018 SV 21.03.2008 003.001 1 Detta dokument är endast avsett som dokumentationshjälpmedel och institutionerna ansvarar inte för innehållet B EUROPAPARLAMENTETS OCH RÅDETS DIREKTIV 2001/18/EG av den
2001L0018 SV 21.03.2008 003.001 1 Detta dokument är endast avsett som dokumentationshjälpmedel och institutionerna ansvarar inte för innehållet B EUROPAPARLAMENTETS OCH RÅDETS DIREKTIV 2001/18/EG av den
UNDERLAG FÖR KVALITETSBEDÖMNING
 UNDERLAG FÖR KVALITETSBEDÖMNING Denna utgåva är en provisorisk anpassning till den revidering som beslutades vid SPUREX den 2014-01-23. INLEDNING Inspektionen gäller dels strukturen (resurserna för utbildning),
UNDERLAG FÖR KVALITETSBEDÖMNING Denna utgåva är en provisorisk anpassning till den revidering som beslutades vid SPUREX den 2014-01-23. INLEDNING Inspektionen gäller dels strukturen (resurserna för utbildning),
Så jobbar Läkemedelsverket och TLV med utbytbara läkemedel och periodens vara. Apoteksmässan, 6 september 2012
 Så jobbar Läkemedelsverket och TLV med utbytbara läkemedel och periodens vara Apoteksmässan, 6 september 2012 Anna Hillgren, LV Apotekare och PhD Åsa Tormod, TLV Apotekare Utbytbarhet - Riksdagsbeslut
Så jobbar Läkemedelsverket och TLV med utbytbara läkemedel och periodens vara Apoteksmässan, 6 september 2012 Anna Hillgren, LV Apotekare och PhD Åsa Tormod, TLV Apotekare Utbytbarhet - Riksdagsbeslut
När ditt konto är klart att använda kommer du att få din PIN-kod och anvisningar från företaget SysTeam som är landstingets samarbetspartner.
 Ett eget Vårdkonto Det finns många patienter som i lugn och ro skulle vilja ta del av sina egna data som finns lagrade inom Hälso- och sjukvården. Orsakerna kan vara flera: - Man har glömt vad man fick
Ett eget Vårdkonto Det finns många patienter som i lugn och ro skulle vilja ta del av sina egna data som finns lagrade inom Hälso- och sjukvården. Orsakerna kan vara flera: - Man har glömt vad man fick
UPPHÄVANDE AV STÖDRÄTTIGHETER
 UPPHÄVANDE AV STÖDRÄTTIGHETER Kimito 6.4 och Pargas 8.4.2016 NTM-centralen i Egentliga Finland 13.4.2016 Överloppsstödrättigheter upphävs på grund av Finlands val att behålla de befintliga stödrättigheterna
UPPHÄVANDE AV STÖDRÄTTIGHETER Kimito 6.4 och Pargas 8.4.2016 NTM-centralen i Egentliga Finland 13.4.2016 Överloppsstödrättigheter upphävs på grund av Finlands val att behålla de befintliga stödrättigheterna
Löpande granskning av intern kontroll Läkemedelshantering (PM3)
 Revisionsrapport Löpande granskning av intern kontroll Läkemedelshantering (PM3) Landstinget Gävleborg Lars-Åke Ullström Hanna Franck Emil Ring Februari 2012 Innehållsförteckning Sammanfattning... 3 1.
Revisionsrapport Löpande granskning av intern kontroll Läkemedelshantering (PM3) Landstinget Gävleborg Lars-Åke Ullström Hanna Franck Emil Ring Februari 2012 Innehållsförteckning Sammanfattning... 3 1.
Svenska palliativregistret (2009)
 vid hjärtsvikt ett europeiskt och globalt perspektiv enligt WHO (2002) : Lindrar smärta och andra plågsamma symtom. Bekräftar livet och betraktar döendet som en normal process. Syftar inte till att varken
vid hjärtsvikt ett europeiskt och globalt perspektiv enligt WHO (2002) : Lindrar smärta och andra plågsamma symtom. Bekräftar livet och betraktar döendet som en normal process. Syftar inte till att varken
Tillsyn patientens rätt till spärr enligt 4 kap. 4 och 6 kap. 2 patientdatalagen
 Datum Diarienr 2012-06-15 724-2011 Hälso- och sjukvårdnämnden Region Gotland 621 81 Visby Tillsyn patientens rätt till spärr enligt 4 kap. 4 och 6 kap. 2 patientdatalagen Datainspektionens beslut Datainspektionen
Datum Diarienr 2012-06-15 724-2011 Hälso- och sjukvårdnämnden Region Gotland 621 81 Visby Tillsyn patientens rätt till spärr enligt 4 kap. 4 och 6 kap. 2 patientdatalagen Datainspektionens beslut Datainspektionen
Tillsyn patientens rätt till spärr enligt 4 kap. 4 och 6 kap. 2 patientdatalagen
 Datum Diarienr 2012-06-15 738-2011 Landstingsstyrelsen Norrbottens läns landsting 971 89 Luleå Tillsyn patientens rätt till spärr enligt 4 kap. 4 och 6 kap. 2 patientdatalagen Datainspektionens beslut
Datum Diarienr 2012-06-15 738-2011 Landstingsstyrelsen Norrbottens läns landsting 971 89 Luleå Tillsyn patientens rätt till spärr enligt 4 kap. 4 och 6 kap. 2 patientdatalagen Datainspektionens beslut
Reach. Registration, Evaluation, Authorisation and Restriction of CHemicals. November 2015 Lisa Ekstig & Elisabeth Kihlberg
 Reach Registration, Evaluation, Authorisation and Restriction of CHemicals November 2015 Lisa Ekstig & Elisabeth Kihlberg REACH EU-lagstiftning för kemikalier.. Lagstiftning för kemikalier inom EU EU-förordning
Reach Registration, Evaluation, Authorisation and Restriction of CHemicals November 2015 Lisa Ekstig & Elisabeth Kihlberg REACH EU-lagstiftning för kemikalier.. Lagstiftning för kemikalier inom EU EU-förordning
Svensk författningssamling
 Svensk författningssamling Förordning om ändring i patientsäkerhetsförordningen (2010:1369); SFS 2016:161 Utkom från trycket den 15 mars 2016 utfärdad den 3 mars 2016. Regeringen föreskriver 1 i fråga
Svensk författningssamling Förordning om ändring i patientsäkerhetsförordningen (2010:1369); SFS 2016:161 Utkom från trycket den 15 mars 2016 utfärdad den 3 mars 2016. Regeringen föreskriver 1 i fråga
Regel för Hälso- och sjukvård i särskilt boende och daglig verksamhet enligt LSS: Läkemedelshantering. Region Stockholm Innerstad Sida 1 (9)
 Region Stockholm Innerstad Sida 1 (9) 2013-04-30 Sjuksköterskor Regel för Hälso- och sjukvård i särskilt boende och daglig verksamhet enligt LSS: shantering Sida 2 (9) Innehåll REGEL FÖR HÄLSO- OCH SJUKVÅRD
Region Stockholm Innerstad Sida 1 (9) 2013-04-30 Sjuksköterskor Regel för Hälso- och sjukvård i särskilt boende och daglig verksamhet enligt LSS: shantering Sida 2 (9) Innehåll REGEL FÖR HÄLSO- OCH SJUKVÅRD
Ansökan om tillstånd att bedriva öppenvårdsapotek
 Ansökan om tillstånd att bedriva öppenvårdsapotek Vägledning till Läkemedelsverkets föreskrifter (LVFS 2009:8) om ansökan om tillstånd att bedriva öppenvårdsapotek (version 3, juli 2010) Inledning Enligt
Ansökan om tillstånd att bedriva öppenvårdsapotek Vägledning till Läkemedelsverkets föreskrifter (LVFS 2009:8) om ansökan om tillstånd att bedriva öppenvårdsapotek (version 3, juli 2010) Inledning Enligt
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2003:11) om medicintekniska produkter;
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2003:11) om medicintekniska produkter;
Kommunikationslösning för licensansökningar (KLAS)
 Kommunikationslösning för licensansökningar (KLAS) Introduktion Samma process som tidigare Förskrivaren skapar en motivering Apoteket ansöker om licens Läkemedelsverket beslutar om licens Apoteket meddelas
Kommunikationslösning för licensansökningar (KLAS) Introduktion Samma process som tidigare Förskrivaren skapar en motivering Apoteket ansöker om licens Läkemedelsverket beslutar om licens Apoteket meddelas
Antagen i socialnämnden 2009-04-07 46. Riktlinje för läkemedelshantering
 Antagen i socialnämnden 2009-04-07 46 Riktlinje för läkemedelshantering Rutinerna grundas på Lag (1998:531) LYHS; Förordning (1998:1513) FYHS; Läkemedelslagen (1992:859); Lag om läkemedelsförmåner (2002:160);
Antagen i socialnämnden 2009-04-07 46 Riktlinje för läkemedelshantering Rutinerna grundas på Lag (1998:531) LYHS; Förordning (1998:1513) FYHS; Läkemedelslagen (1992:859); Lag om läkemedelsförmåner (2002:160);
Regionala riktlinjer för peroral trombocythämning vid akut kranskärlsjukdom i Region Skåne
 Läkemedelsrådet Dokumentet reviderat av Läkemedelsrådet 2014-01-16 Riktlinjerna giltiga t o m 2014-12-31 Regionala riktlinjer för peroral trombocythämning vid akut kranskärlsjukdom i Region Skåne Uppdrag
Läkemedelsrådet Dokumentet reviderat av Läkemedelsrådet 2014-01-16 Riktlinjerna giltiga t o m 2014-12-31 Regionala riktlinjer för peroral trombocythämning vid akut kranskärlsjukdom i Region Skåne Uppdrag
Konsekvensutredning - Transportstyrelsens föreskrifter om riskutbildning för behörighet B
 Konsekvensutredning 1 (10) Datum Dnr/Beteckning Handläggare Henrik Julin Väg- och järnvägsavdelningen Enhet behörigheter Sektion regler Konsekvensutredning - Transportstyrelsens föreskrifter om riskutbildning
Konsekvensutredning 1 (10) Datum Dnr/Beteckning Handläggare Henrik Julin Väg- och järnvägsavdelningen Enhet behörigheter Sektion regler Konsekvensutredning - Transportstyrelsens föreskrifter om riskutbildning
Läkemedelsförsäljningen i Sverige 2011
 1/25 Läkemedelsförsäljningen i Sverige 211 Version januari - december 211 sida Titel Sektion 1 - Läkemedel till människor, övergripande ekonomiska mått 3 Tabell 1:1 Försäljningsvärden 4 Tabell 1:2 Historisk
1/25 Läkemedelsförsäljningen i Sverige 211 Version januari - december 211 sida Titel Sektion 1 - Läkemedel till människor, övergripande ekonomiska mått 3 Tabell 1:1 Försäljningsvärden 4 Tabell 1:2 Historisk
FAKTABLAD REACH - Registration, Evaluation and Authorisation of Chemicals 2013-04-11. WSP Natlikan
 FAKTABLAD REACH - Registration, Evaluation and Authorisation of Chemicals 2013-04-11 WSP Natlikan Om WSP Natlikan Lösningar för ett resultatinriktat hållbarhetsarbete WSP Natlikan har affärsmässiga lösningar
FAKTABLAD REACH - Registration, Evaluation and Authorisation of Chemicals 2013-04-11 WSP Natlikan Om WSP Natlikan Lösningar för ett resultatinriktat hållbarhetsarbete WSP Natlikan har affärsmässiga lösningar
Överenskommelse mellan Försäkringskassan och Tryggingastofnun om administrativa rutiner för arbetslivsinriktad rehabilitering i gränsöverskridande
 Överenskommelse mellan Försäkringskassan och Tryggingastofnun om administrativa rutiner för arbetslivsinriktad rehabilitering i gränsöverskridande situationer. Inledning Denna överenskommelse omfattar
Överenskommelse mellan Försäkringskassan och Tryggingastofnun om administrativa rutiner för arbetslivsinriktad rehabilitering i gränsöverskridande situationer. Inledning Denna överenskommelse omfattar
Riktlinjer för medföljare vid semesterresa
 1 (12) Riktlinjer för medföljare vid semesterresa Antagna av KS april 2000, reviderade av KF xxx 2016 stockholm.se 2 (12) 3 (12) Riktlinjer för medföljare vid semesterresa Antagna i KS april 2000, reviderade
1 (12) Riktlinjer för medföljare vid semesterresa Antagna av KS april 2000, reviderade av KF xxx 2016 stockholm.se 2 (12) 3 (12) Riktlinjer för medföljare vid semesterresa Antagna i KS april 2000, reviderade
Integrationshandledning APLs produktresuméer
 Innehållsförteckning Syfte... 3 Bakgrund... 3 Terminologi... 3 Innehåll... 4 Integration... 5 Uppdatering... 5 Teknisk dokumentation... 5 Sid 2/5 Syfte Syftet med denna integrationshandledning är att redogöra
Innehållsförteckning Syfte... 3 Bakgrund... 3 Terminologi... 3 Innehåll... 4 Integration... 5 Uppdatering... 5 Teknisk dokumentation... 5 Sid 2/5 Syfte Syftet med denna integrationshandledning är att redogöra
Det här underlaget beskriver hur vi anser att lagstiftning och andra insatser bör utformas när det gäller e-cigaretter. 1. Bakgrund och utgångspunkter
 April 2016 Sida 1 E-cigaretter och andra elektroniska produkter för inhalering vilka regler och åtgärder behövs? Elektroniska cigaretter har länge sålts i vårt land utan någon särskild lagreglering. Det
April 2016 Sida 1 E-cigaretter och andra elektroniska produkter för inhalering vilka regler och åtgärder behövs? Elektroniska cigaretter har länge sålts i vårt land utan någon särskild lagreglering. Det
Läkemedelsverket, en introduktion
 Läkemedelsverket, en introduktion En statlig, i huvudsak avgiftsfinansierad, myndighet under Socialdepartementet Med uppdrag att främja folk- och djurhälsan Drygt 700 anställda, många farmacevter och läkare
Läkemedelsverket, en introduktion En statlig, i huvudsak avgiftsfinansierad, myndighet under Socialdepartementet Med uppdrag att främja folk- och djurhälsan Drygt 700 anställda, många farmacevter och läkare
Styrelsen för utbildning 2014-09-24
 Förslag till beslut Dnr: 1-493/2013 Sid: 1 / 1 Universitetsförvaltningen Avdelningen för styrelsestöd och internationella relationer Philip Malmgren, handläggare Pierre Lafolie, Universitetslektor, överläkare
Förslag till beslut Dnr: 1-493/2013 Sid: 1 / 1 Universitetsförvaltningen Avdelningen för styrelsestöd och internationella relationer Philip Malmgren, handläggare Pierre Lafolie, Universitetslektor, överläkare
Riktlinje för läkemedelshantering
 Dokumenttyp: Riktlinje Dokumentnamn: Upprättad: 2015-02-03 Övergripande läkemedelshantering Upprättad av: Medicinskt ansvarig sjuksköterska, Kristina Nyckelgård Förankrad i: Ledningsgrupper VoÄ och AoS
Dokumenttyp: Riktlinje Dokumentnamn: Upprättad: 2015-02-03 Övergripande läkemedelshantering Upprättad av: Medicinskt ansvarig sjuksköterska, Kristina Nyckelgård Förankrad i: Ledningsgrupper VoÄ och AoS
5. Nytta av hörapparat
 5. Nytta av hörapparat Sammanfattning Den systematiska litteraturöversikt som genomförts visar att man i de flesta studierna jämfört två eller tre hörapparater avsedda för personer med lätt till svår hörselnedsättning
5. Nytta av hörapparat Sammanfattning Den systematiska litteraturöversikt som genomförts visar att man i de flesta studierna jämfört två eller tre hörapparater avsedda för personer med lätt till svår hörselnedsättning
Datum 2013-06-20. Namn Form Styrka Förp. Varunr AIP (SEK) AUP (SEK) Pargitan Tablett 5 mg Plastburk, 100 534909 70,00 115,50.
 1 (5) Datum 2013-06-20 Vår beteckning SÖKANDE Nevada Pharma AB Torsgatan 4 111 23 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, bifaller ansökan
1 (5) Datum 2013-06-20 Vår beteckning SÖKANDE Nevada Pharma AB Torsgatan 4 111 23 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, bifaller ansökan
Patientdatalag (2008:355)
 Patientdatalag (2008:355) SFS nr: 2008:355 Departement/myndighet: Socialdepartementet Utfärdad: 2008-05-29 Ändrad: t.o.m. SFS 2013:1024 Tryckt version: pdf, utan ändringar (Lagrummet) Ändringsregister:
Patientdatalag (2008:355) SFS nr: 2008:355 Departement/myndighet: Socialdepartementet Utfärdad: 2008-05-29 Ändrad: t.o.m. SFS 2013:1024 Tryckt version: pdf, utan ändringar (Lagrummet) Ändringsregister:
Läkemedelsförteckningen
 Läkemedelsförteckningen till privatpraktiserande förskrivare Sammanställning Anna-Lena Nilsson [7-6-1] ehälsoinstitutet, Högskolan i Kalmar www.ehalsoinstitutet.se 1. Sammanfattning För att främja användningen
Läkemedelsförteckningen till privatpraktiserande förskrivare Sammanställning Anna-Lena Nilsson [7-6-1] ehälsoinstitutet, Högskolan i Kalmar www.ehalsoinstitutet.se 1. Sammanfattning För att främja användningen
AUP (SEK) Solvezink Brustablett 45 mg Zn 2+ Plaströr, 4 x 25 tabl 382747 221,59 285,00. Namn Form Styrka Förp. Varunr. AIP (SEK)
 2013-09-06 1 (5) Vår beteckning SÖKANDE BioPhausia AB Blasieholmsgatan 2 111 48 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, bifaller ansökan om
2013-09-06 1 (5) Vår beteckning SÖKANDE BioPhausia AB Blasieholmsgatan 2 111 48 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, bifaller ansökan om
Ansökan om tillstånd att bedriva öppenvårdsapotek
 Ansökan om tillstånd att bedriva öppenvårdsapotek Vägledning till Läkemedelsverkets föreskrifter (LVFS 29:8) om ansökan om tillstånd att bedriva öppenvårdsapotek (Version 4, juni 215) Bilaga 1 - Exempel
Ansökan om tillstånd att bedriva öppenvårdsapotek Vägledning till Läkemedelsverkets föreskrifter (LVFS 29:8) om ansökan om tillstånd att bedriva öppenvårdsapotek (Version 4, juni 215) Bilaga 1 - Exempel
Utbildningsmaterial: Utbildningsmaterial om delegering riktat till personal som kommer att delegeras hälso- och sjukvårdsuppgifter
 Utbildningsmaterial: Utbildningsmaterial om delegering riktat till personal som kommer att delegeras hälso- och sjukvårdsuppgifter Arbetsgrupp: Agneta Blomkvist, MAS Liljeholmens SDF Eeva Eriksson, MAS
Utbildningsmaterial: Utbildningsmaterial om delegering riktat till personal som kommer att delegeras hälso- och sjukvårdsuppgifter Arbetsgrupp: Agneta Blomkvist, MAS Liljeholmens SDF Eeva Eriksson, MAS
Resultat av remiss för begrepp kring ordinationsorsak
 Dnr 17769/2011 1(17) Resultat av remiss för begrepp kring ordinationsorsak Begreppen i denna sammanställning är resultatet från det terminologiarbete som är en del av projektet Ordinationsorsak. Begreppen
Dnr 17769/2011 1(17) Resultat av remiss för begrepp kring ordinationsorsak Begreppen i denna sammanställning är resultatet från det terminologiarbete som är en del av projektet Ordinationsorsak. Begreppen
Statskontorets enkät till organisationer för patientgrupper, pensionärer och personer med funktionsnedsättningar
 Bilaga 8 Bilaga 8 1 (8) Statskontorets enkät till organisationer för patientgrupper, pensionärer och personer med funktionsnedsättningar 1 Uppgifter om Er organisation 1. Namnet på Er organisation: 2.
Bilaga 8 Bilaga 8 1 (8) Statskontorets enkät till organisationer för patientgrupper, pensionärer och personer med funktionsnedsättningar 1 Uppgifter om Er organisation 1. Namnet på Er organisation: 2.
SBU:s sammanfattning och slutsatser
 SBU:s sammanfattning och slutsatser Mätningar av blodglukos med hjälp av teststickor är diabetespatientens verktyg för att få insikt i glukosnivåerna i blodet. Systematiska egna mätningar av blodglukos
SBU:s sammanfattning och slutsatser Mätningar av blodglukos med hjälp av teststickor är diabetespatientens verktyg för att få insikt i glukosnivåerna i blodet. Systematiska egna mätningar av blodglukos
LVFS 2003:11 Bilaga 1 VÄSENTLIGA KRAV I. Allmänna krav 1. Produkterna skall konstrueras och tillverkas på ett sådant sätt att de inte äventyrar
 LVFS 2003:11 Bilaga 1 VÄSENTLIGA KRAV I. Allmänna krav 1. Produkterna skall konstrueras och tillverkas på ett sådant sätt att de inte äventyrar patienternas kliniska tillstånd eller säkerhet, användarnas
LVFS 2003:11 Bilaga 1 VÄSENTLIGA KRAV I. Allmänna krav 1. Produkterna skall konstrueras och tillverkas på ett sådant sätt att de inte äventyrar patienternas kliniska tillstånd eller säkerhet, användarnas
