Namnge och rita organiska föreningar - del 5
|
|
|
- Lisbeth Nyström
- för 6 år sedan
- Visningar:
Transkript
1 Namnge och rita organiska föreningar - del 5 Etrar, aldehyder, ketoner, tioler, fenoler, nitroföreningar, aminer, amider Niklas Dahrén
2 Etrar Etrar har en etergrupp: Vid namngivning lägger man till ändelsen -eter: Dietyleter
3 Namnge etrar 1. Del 1 av namnet: Ta reda på vilka alkylgrupper som sitter till vänster resp. till höger om syreatomen. Första delen av namnet består av dessa alkylgruppers namn (i bokstavsordning). 2. Del 2 av namnet: Andra delen av namnet är alltid eter.
4 Aldehyder Aldehyder har en aldehydgrupp: Vid namngivning lägger man till ändelsen -al efter stamkolvätet: Etanal Butanal
5 Namnge aldehyder Aldehyders rationella namn bildas genom att man lägger ändelsen -al till namnet på motsvarande kolväte. Aldehydgruppens kolatom är första kolet i stamkolvätets.
6 Ketoner Ketogrupp: Ketoner kännetecknas av att de innehåller en karbonylgrupp (C=O) som binder till 2 kolvätekedjor. Detta kallas för en ketogrupp. Namnges: Ketoner namnges genom att ändelsen -on läggs till namnet på stamkolvätet. Ketogrupp
7 Aceton är en keton som bildas i kroppen Aceton är en keton (kallas ibland för ketonkropp) som bildas i kroppen vid låga insulinnivåer i blodet (svält, fasta och vid sjukdomen diabetes typ 1). Vid låga insulinnivåer utsöndras en stor mängd fettsyror från fettvävnanden. Dessa fettsyror transporteras till levern där dessa görs om till s.k. ketonkroppar. Aceton är en av dessa ketonkroppar. De andra 2 ketonkropparna (som dock egentligen är karboxylsyror) är acetoacetat och beta-hydroxibutyrat. Ketonkropparna fungerar som nödbränsle under framförallt fasta och vid svält då det råder kolhydratbrist i kroppen. Hjärnan är speciellt beroende av ketonkroppar vid dessa tillstånd eftersom hjärnan inte kan använda fett eller proteiner som energikälla. Propanon (aceton) Vid fasta och svält så kan vi känna att vår andedräkt luktar aceton.
8 Namnge ketoner Ketoners rationella namn bildas genom att man lägger ändelsen -on till namnet på motsvarande kolväte. Om stamkolvätet innehåller fler än tre kolatomer måste ketogruppens placering anges. Man numrerar då stamkolvätets kolatomer så att ketogruppens kolatom får lägsta möjliga nummer.
9 Namnge ketoner Om substituenter ingår i ketonen så ska även dessa anges i namnet. 2-metyl-3-pentanon 5-metyl-2-hexanon
10 Tioler Tioler (eller merkaptaner) har en tiolgrupp: Luktar illa: Tioler har i regel en motbjudande lukt. Den enklaste tiolen, metantiol, CH 3 SH, bildas bland annat vid sulfatmassaframställning och bidrar till den lukt som kan upplevas vid pappersbruk. Den illaluktande vätska som skunken utsöndrar består bland annat av olika tioler. Vid namngivning lägger man till ändelsen -tiol: Metantiol Etantiol
11 Fenoler Fenoler är föreningar som har minst en hydroxylgrupp bunden direkt till en eller flera bensenringar. Fenoler liknar till viss del alkoholer eftersom de har minst en hydroxylgrupp (OH-grupp), men när hydroxylgruppen är bunden direkt till en bensenring så får föreningen helt andra egenskaper jämfört med alkoholer. T.ex. så fungerar fenoler som svaga syror tack vare att OH-gruppen är bunden direkt till bensenringen. Fenol 1-naftol 2-naftol 3-metylfenol
12 Fenoler är svaga syror Tack vare bensenringen kan fenoler protolyseras (avge en vätejon, H + ) och fungerar därmed som syror (dock svaga syror). Alkoholer kan däremot inte protolyseras och fungerar alltså inte som syror. Anledningen att fenoler fungerar som syror är att fenolatjonen (som bildas när protonen avges) är väldigt stabil tack vare bensenringen. Den negativa laddningen (elektronerna) på syret kan fördelas/spridas över hela bensenringen och därmed blir inte någon del särskilt negativt laddad. Det minskar risken för att molekylen ska ta tillbaka den positiva vätejonen. Om alkoholer skulle protolyseras så skulle den negativa laddningen vara koncentrerad till syreatomen och då skulle vätejonen plockas tillbaka på en gång. + H + Fenol Fenolatjon
13 Nitroföreningar Nitroföreningar innehåller nitrogrupper: Nitroföreningar är organiska ämnen som innehåller en eller flera nitrogrupper (-NO 2 ). Nitroföreningar är explosiva: Nitroföreningar är ofta explosiva, speciellt om de innehåller flera nitrogrupper. Nitroföreningar innehåller syre som är ett mycket effektivt oxidationsmedel. Nitroföreningar är instabila och kan lätt sönderfalla och ger då upphov till fri syrgas. Syrgasen kan sedan oxidera bränslet (framförallt kolatomerna i nitroföreningen) vilket leder till att det bildas en stor mängd gasmolekyler samtidigt som mycket värme frisätts. Detta leder tillsammans till ett högt gastryck och slutligen en explosion.
14 Exempel på nitroförening: TNT Fakta: TNT är ett av de vanligaste sprängämnena inom industrin och inom militären, delvis beroende på att det är relativt stabilt (jämfört med många andra sprängämnen) och reagerar inte med vatten på något sätt (kan därför användas i fuktiga förhållanden). TNT började användas i stor skala i bomber under 2:a världskriget. Namnet: Förkortningen TNT står för trinitrotoluen men namnet trotyl används ofta. Det riktiga namnet är dock 2,4,6-trinitrotoluen (alternativt; 2-metyl-1,3,5-trinitrobensen). Kemisk beteckning: C 6 H 2 (NO 2 ) 3 CH 3.
15 Aminer Aminer: Aminer är organiska ämnen som innehåller minst 1 kväveatom. De härstammar från eller liknar ammoniak (NH 3 ). Skillnaden är att en eller flera av de väteatomer som binder kväveatomen har bytts ut mot R-grupper (ofta kolvätegrupper). Molekyler som har en kväveatom bunden till en karbonylgrupp kallas däremot för amider och har andra egenskaper jämfört med aminer. Olika aminer: Beroende på hur många R-grupper (atomgrupp som innehåller minst 1 kolatom) som binder till kväveatomen så delar man in aminer i primära, sekundära, tertiära och kvartära aminer. Primära aminer: RNH 2 Kväveatomen binder 1 kolatom. Sekundära aminer: R 2 NH Kväveatomen binder 2 kolatomer. Tertiära aminer: R 3 N Kväveatomen binder 3 kolatomer. Kvartära aminer: R 4 N + Kväveatomen binder 4 kolatomer. Aminer är svaga baser: Kväveatomen har ett fritt elektronpar som kan attrahera och binda 1 proton. Definitionen av baser är att de kan uppta protoner och därför räknas aminer som baser (dock ganska svaga baser). Primär amin Sekundär amin Tertiär amin Kvartär amin
16 Uppgift 1: Vilka typer av aminer syns på nedanstående bilder? a) b) Svar: a) Primär amin b) Sekundär amin
17 Metylamin Metylamin är den enklaste primära aminen. Den tillverkas genom en reaktion mellan ammoniak (NH 3 ) och metanol (CH 3 OH). Produktion och försäljning av metylamin är reglerat i många länder eftersom metylamin kan användas för att tillverka metamfetamin. Syntes av metylamin Metylamin (2S)-N-metyl-1-fenylpropan-2-amin (metamfetamin)
18 Namngivning av primära aminer Primära aminer kan sägas bestå av en amingrupp och en alkylgrupp som är kopplad till amingruppen. Prima ra aminer namnges med alkylgruppen fo ljt av ordet amin. Övriga substituenter namnges på samma sätt som i andra organiska föreningar. Kolet närmast amingruppen är kol nr. 1. Metylamin Pentylamin
19 Uppgift 2: Namnge den primära aminen på nedanstående bild Svar: 3-metylbutylamin (kolet närmast amingruppen är kol nr. 1).
20 Namngivning av sekundära och tertiära aminer Sekundära och tertiära aminer namnges genom att den alkylgrupp som är mest komplex (flest kol) utgör ämnets basnamn. Övriga alkylgrupper som är bundna till kvävet behandlas som substituenter med prefixet N- (bokstaven N betyder att de är bundna till kväveatomen). Om flera alkylgrupper som är bundna till kväveatomen är identiska så förenklas namngivningen genom att namnet föregås av t.ex. di eller tri. N,N-dimetylbutylamin N-etyl-N-metylpropylamin
21 Amider Amider: Amider är föreningar som har en kväveatom bunden till en karbonylgrupp. Dessa har andra egenskaper jämfört med aminer. Olika amider: Beroende på hur många kolatomer som binder till kväveatomen (varje R-grupp består av minst 1 kolatom), så delar man in aminer i primära, sekundära och tertiära amider. Primära amider: Kväveatomen binder 1 kolatom. Sekundära amider: Kväveatomen binder 2 kolatomer. Tertiära amider: Kväveatomen binder 3 kolatomer. Amider är svaga baser: Kväveatomen har ett fritt elektronpar som kan attrahera och binda 1 proton. Definitionen av baser är att de kan uppta protoner och därför räknas aminer som baser (dock ganska svaga baser). Karbonylgrupp Kväveatom Allmän formel av en tertiär amid
22 Namnge primära amider Första delen av namnet: Namnet börjar med stamkolvätet. Andelen av namnet: Namnet avslutas med ändelsen -amid. Metanamid Etanamid
23 Uppgift 2: a) Vilken ämnesklass tillhör nedanstående ämnen? b) Ange det systematiska namnet på nedanstående ämnen 1) 2) 3) 4) Svar: 1. a) Tiol b) Metantiol 2. a) Aldehyd b) Propanal 3. a) Fenoler b) Fenol 4. a) Eter b) Dimetyleter 5. a) Primär amin b) Pentylamin 6. a) Keton b) 2-metyl-3-pentanon 5) 6)
24 Se gärna fler filmer av Niklas Dahrén:
Organiska föreningar del 6: Rita och namnge etrar, aldehyder, ketoner, tioler och disulfider. Niklas Dahrén
 Organiska föreningar del 6: Rita och namnge etrar, aldehyder, ketoner, tioler och disulfider Niklas Dahrén Etrar Etrar har en etergrupp (eterbindning): R-grupperna är två identiska eller två olika kolvätegrupper/kolvätekedjor
Organiska föreningar del 6: Rita och namnge etrar, aldehyder, ketoner, tioler och disulfider Niklas Dahrén Etrar Etrar har en etergrupp (eterbindning): R-grupperna är två identiska eller två olika kolvätegrupper/kolvätekedjor
Organiska föreningar del 7: Rita och namnge fenoler, nitroföreningar och aminer. Niklas Dahrén
 Organiska föreningar del 7: Rita och namnge fenoler, nitroföreningar och aminer Niklas Dahrén Fenoler Fenoler är föreningar som har minst en OH-grupp (hydroxylgrupp/hydroxigrupp) bunden direkt till en
Organiska föreningar del 7: Rita och namnge fenoler, nitroföreningar och aminer Niklas Dahrén Fenoler Fenoler är föreningar som har minst en OH-grupp (hydroxylgrupp/hydroxigrupp) bunden direkt till en
Namngivning av organiska föreningar del 2. Niklas Dahrén
 Namngivning av organiska föreningar del 2 Niklas Dahrén Namnge alkoholer 4 3 2 1 1. Ta reda på stamkolvätet: Leta upp molekylens längsta kolkedja 3ll vilken hydroxylgruppen är bunden. Antalet kolatomer
Namngivning av organiska föreningar del 2 Niklas Dahrén Namnge alkoholer 4 3 2 1 1. Ta reda på stamkolvätet: Leta upp molekylens längsta kolkedja 3ll vilken hydroxylgruppen är bunden. Antalet kolatomer
Organiska föreningar del 1: Introduktion till organiska föreningar. Niklas Dahrén
 Organiska föreningar del 1: Introduktion till organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi och organiska föreningar: Organisk kemi är vetenskapen om kolföreningarnas
Organiska föreningar del 1: Introduktion till organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi och organiska föreningar: Organisk kemi är vetenskapen om kolföreningarnas
Namnge och rita organiska föreningar - del 4 Alkoholer, karboxylsyror och estrar. Niklas Dahrén
 Namnge och rita organiska föreningar - del 4 Alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är kolväten med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Om man byter ut en av
Namnge och rita organiska föreningar - del 4 Alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är kolväten med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Om man byter ut en av
Organiska föreningar del 5: Rita och namnge alkoholer, karboxylsyror och estrar. Niklas Dahrén
 Organiska föreningar del 5: Rita och namnge alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är organiska ämnen med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Alkoholer är organiska
Organiska föreningar del 5: Rita och namnge alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är organiska ämnen med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Alkoholer är organiska
Namnge och rita organiska föreningar - del 1-3. Niklas Dahrén
 Namnge och rita organiska föreningar - del 1-3 Niklas Dahrén Namnge och rita organiska föreningar - del 1 Niklas Dahrén Innehåll Del 1: Introduktion till organisk kemi och organiska föreningar Tabeller
Namnge och rita organiska föreningar - del 1-3 Niklas Dahrén Namnge och rita organiska föreningar - del 1 Niklas Dahrén Innehåll Del 1: Introduktion till organisk kemi och organiska föreningar Tabeller
Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer. Niklas Dahrén
 Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Substitutionsreaktioner 2. Additionsreaktioner 3. Eliminationsreaktioner 4. Kondensationsreaktioner
Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Substitutionsreaktioner 2. Additionsreaktioner 3. Eliminationsreaktioner 4. Kondensationsreaktioner
Namnge och rita organiska föreningar - del 2 Alkaner, alkener, alkyner. Niklas Dahrén
 Namnge och rita organiska föreningar - del 2 Alkaner, alkener, alkyner Niklas Dahrén Alkaner Alkaner är s.k. mättade kolväten vilket betyder att de har fullt med väteatomer (och därför enbart enkelbindningar).
Namnge och rita organiska föreningar - del 2 Alkaner, alkener, alkyner Niklas Dahrén Alkaner Alkaner är s.k. mättade kolväten vilket betyder att de har fullt med väteatomer (och därför enbart enkelbindningar).
Organiska ämnen (2) s
 Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Organiska ämnen (2) s
 Organiska ämnen (2) s126-154 Organiska stamträdet Ämnesklasser- reaktionstyper/reaktionsvägar) Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar
Organiska ämnen (2) s126-154 Organiska stamträdet Ämnesklasser- reaktionstyper/reaktionsvägar) Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar
Namnge och rita organiska föreningar - del 1 Introduktion till att rita och namnge organiska föreningar. Niklas Dahrén
 Namnge och rita organiska föreningar - del 1 Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi: Organisk kemi är vetenskapen
Namnge och rita organiska föreningar - del 1 Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi: Organisk kemi är vetenskapen
Organiska föreningar del 2: Introduktion till att rita och namnge organiska föreningar. Niklas Dahrén
 Organiska föreningar del 2: Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Rita organiska föreningar Rita elektronformler och strukturformler Elektronformel: En elektronformel
Organiska föreningar del 2: Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Rita organiska föreningar Rita elektronformler och strukturformler Elektronformel: En elektronformel
Namnge och rita organiska föreningar - del 3 Halogenalkaner, cykliska kolväten och arener. Niklas Dahrén
 Namnge och rita organiska föreningar - del 3 Halogenalkaner, cykliska kolväten och arener Niklas Dahrén Halogenalkaner (alkylhalogenider) En halogenalkan är en alkan där en eller flera av väteatomerna
Namnge och rita organiska föreningar - del 3 Halogenalkaner, cykliska kolväten och arener Niklas Dahrén Halogenalkaner (alkylhalogenider) En halogenalkan är en alkan där en eller flera av väteatomerna
Syror, baser och ph-värde. Niklas Dahrén
 Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Vätebindningar och Hydro-FON-regeln. Niklas Dahrén
 Vätebindningar och Hydro-FON-regeln Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Vätebindningar och Hydro-FON-regeln Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Organiska föreningar Indelning, struktur och egenskaper. Niklas Dahrén
 Organiska föreningar Indelning, struktur och egenskaper Niklas Dahrén Organisk kemi= kolföreningarnas kemi Organisk kemi är vetenskapen om kolföreningarnas kemi. Organiska föreningar innehåller all7d kol
Organiska föreningar Indelning, struktur och egenskaper Niklas Dahrén Organisk kemi= kolföreningarnas kemi Organisk kemi är vetenskapen om kolföreningarnas kemi. Organiska föreningar innehåller all7d kol
Organiska ämnen (2) s
 Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Oxidationstal. Niklas Dahrén
 Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Kolföreningar. Oändliga variationsmöjligheter
 Kolföreningar Oändliga variationsmöjligheter 1 Mål med avsnittet När vi är färdiga med detta avsnitt skall du kunna: Förklara följande begrepp: alkaner, alkener, alkyner, cykloalkaner, arenor, substituenter
Kolföreningar Oändliga variationsmöjligheter 1 Mål med avsnittet När vi är färdiga med detta avsnitt skall du kunna: Förklara följande begrepp: alkaner, alkener, alkyner, cykloalkaner, arenor, substituenter
http://www.naturvetenskap.org/index.php?option=com_content&view=article&id=226&itemi d=236
 http://sv.wikipedia.org/wiki/petroleum http://www.naturvetenskap.org/index.php?option=com_content&view=article&id=226&itemi d=236 Alkaner C n H 2n+2 metan etan propan butan pentan hexan heptan oktan nonan
http://sv.wikipedia.org/wiki/petroleum http://www.naturvetenskap.org/index.php?option=com_content&view=article&id=226&itemi d=236 Alkaner C n H 2n+2 metan etan propan butan pentan hexan heptan oktan nonan
Valenselektroner = elektronerna i yttersta skalet visas nedan för några element ur grupperna
 Kapitel 9 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 9 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Reaktionsmekanismer. Kap 6
 Reaktionsmekanismer Kap 6 Karbokatjoner är elektrofila intermediärer Innehåll Kvalitativa resonemang hur och varför kemiska reaktioner sker Exempel på energiomsättningar vid olika slags organiska reaktioner.
Reaktionsmekanismer Kap 6 Karbokatjoner är elektrofila intermediärer Innehåll Kvalitativa resonemang hur och varför kemiska reaktioner sker Exempel på energiomsättningar vid olika slags organiska reaktioner.
Organiska föreningar del 3: Rita och namnge alkaner, alkener och alkyner. Niklas Dahrén
 Organiska föreningar del 3: Rita och namnge alkaner, alkener och alkyner Niklas Dahrén Alkaner, alkener och alkyner Alkaner (enbart enkelbindningar) Alkener (minst 1 dubbelbindning) Alkyner (minst 1 trippelbindning)
Organiska föreningar del 3: Rita och namnge alkaner, alkener och alkyner Niklas Dahrén Alkaner, alkener och alkyner Alkaner (enbart enkelbindningar) Alkener (minst 1 dubbelbindning) Alkyner (minst 1 trippelbindning)
SAMMANFATTNING AV NOMENKLATUR
 SAMMAFATTG AV MEKLATUR REGLER FÖR SYSTEMATSK AMGVG: Kolvätekedjan: 1. Längsta kolkedjan bildar basnamn. 2. Kolatomerna numreras från den ände ssom ger lägst nummer åt första substituenten. 3. Substituent
SAMMAFATTG AV MEKLATUR REGLER FÖR SYSTEMATSK AMGVG: Kolvätekedjan: 1. Längsta kolkedjan bildar basnamn. 2. Kolatomerna numreras från den ände ssom ger lägst nummer åt första substituenten. 3. Substituent
FUNKTIONELLA GRUPPER (Ämnesklasser) Fö
 FUNKTINELLA GUPPE (Ämnesklasser) Fö 3 2010 Ex. 32-l + 2 32- + l Kloretan Etanol Generellt: -l - = - Z = generell kolvätekedja (alkyl) Z= Funktionell grupp, Ex. -l, -, -, -N2 m.fl. 1. Föreningars egenskaper
FUNKTINELLA GUPPE (Ämnesklasser) Fö 3 2010 Ex. 32-l + 2 32- + l Kloretan Etanol Generellt: -l - = - Z = generell kolvätekedja (alkyl) Z= Funktionell grupp, Ex. -l, -, -, -N2 m.fl. 1. Föreningars egenskaper
Reaktionsmekanismer. Niklas Dahrén
 Reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Subs'tu'onsreak'oner 2. Addi'onsreak'oner 3. Elimina'onsreak'oner 4. Syra-bas-reak'oner 5. Kondensa'onsreak'oner 6. Hydrolysreak'oner 7. Redoxreak'oner
Reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Subs'tu'onsreak'oner 2. Addi'onsreak'oner 3. Elimina'onsreak'oner 4. Syra-bas-reak'oner 5. Kondensa'onsreak'oner 6. Hydrolysreak'oner 7. Redoxreak'oner
CH 3 N. metylamin dimetylamin trimetylamin tetrametylammonium jon primär sekundär!!!!!!!!!!!!! tertiär!!!!!!!!!!!kvartenär
 Funktionella grp med kväve, Fö 7-2010 AMIE - 2 amnges med alkyl följt av ordet amin. Indelning: metylamin dimetylamin trimetylamin tetrametylammonium jon primär sekundär!!!!!!!!!!!!! tertiär!!!!!!!!!!!kvartenär
Funktionella grp med kväve, Fö 7-2010 AMIE - 2 amnges med alkyl följt av ordet amin. Indelning: metylamin dimetylamin trimetylamin tetrametylammonium jon primär sekundär!!!!!!!!!!!!! tertiär!!!!!!!!!!!kvartenär
ALDEHYDER och KETONER Del D-2007
 ALDEYDE och KETNE Del D-2007 Karbonyl grupp: -# +# dipol, sp 2, 120 o vinkel Aldehyd ändelse: - al metanal formaldehyd 3 etanal acetaldehyd 3 2 propanal propionaldehyd bensaldehyd akrolein mrering av kolkedja:
ALDEYDE och KETNE Del D-2007 Karbonyl grupp: -# +# dipol, sp 2, 120 o vinkel Aldehyd ändelse: - al metanal formaldehyd 3 etanal acetaldehyd 3 2 propanal propionaldehyd bensaldehyd akrolein mrering av kolkedja:
Det organiska stamträdet. funktionella grupper avgör egenskaperna
 Det organiska stamträdet funktionella grupper avgör egenskaperna 1 Mål med avsnittet När vi är färdiga med detta avsnitt skall du kunna: Förklara följande funktionella grupper: en-, tvåoch trevärda alkoholer,
Det organiska stamträdet funktionella grupper avgör egenskaperna 1 Mål med avsnittet När vi är färdiga med detta avsnitt skall du kunna: Förklara följande funktionella grupper: en-, tvåoch trevärda alkoholer,
Polära och opolära ämnen, lösningsmedel och löslighet. Niklas Dahrén
 Polära och opolära ämnen, lösningsmedel och löslighet Niklas Dahrén Polära och opolära ämnen Polära ämnen/molekyler (dipoler): Polära ämnen är (i de flesta fall) dipoler, vilket innebär att en sida/del
Polära och opolära ämnen, lösningsmedel och löslighet Niklas Dahrén Polära och opolära ämnen Polära ämnen/molekyler (dipoler): Polära ämnen är (i de flesta fall) dipoler, vilket innebär att en sida/del
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
Isomerer. Samma molekylformel men olika strukturformel. Detta kallas isomeri. Båda har molekylformeln C 4 H 10
 Isomerer Samma molekylformel men olika strukturformel. Detta kallas isomeri Båda har molekylformeln C 4 10 rganiska syror Alla organiska syror innehåller en karboxylgrupp (C) C = m man oxiderar en alkohol
Isomerer Samma molekylformel men olika strukturformel. Detta kallas isomeri Båda har molekylformeln C 4 10 rganiska syror Alla organiska syror innehåller en karboxylgrupp (C) C = m man oxiderar en alkohol
Kovalenta bindningar, elektronegativitet och elektronformler. Niklas Dahrén
 Kovalenta bindningar, elektronegativitet och elektronformler Niklas Dahrén Innehåll ü Opolära kovalenta bindningar ü Polära kovalenta bindningar ü Elektronegativitet ü Paulingskalan ü Elektronformler ü
Kovalenta bindningar, elektronegativitet och elektronformler Niklas Dahrén Innehåll ü Opolära kovalenta bindningar ü Polära kovalenta bindningar ü Elektronegativitet ü Paulingskalan ü Elektronformler ü
ALKOHOLER Del C Metanol. Etanol. 2-propanol isopropanol
 ALKLE Del C-2007 - Funktionell grupp - (alifatisk bunden) Derivat av kolväte där - byts ut mot - amnges genom att -ol läggs till motsvarande kolväte (-an -anol) C 3 Metanol C 3 C 2 C 3 C C 3 Etanol 2-propanol
ALKLE Del C-2007 - Funktionell grupp - (alifatisk bunden) Derivat av kolväte där - byts ut mot - amnges genom att -ol läggs till motsvarande kolväte (-an -anol) C 3 Metanol C 3 C 2 C 3 C C 3 Etanol 2-propanol
Reaktionsmekanismer. Kap 6
 Reaktionsmekanismer Kap 6 Rep. Kemiska reaktioner https://laughingsquid.com/a-ted-ed-animation-explaining-howall-sorts-of-different-chemical-reactions-are-triggered/ Karbokatjoner är elektrofila intermediärer
Reaktionsmekanismer Kap 6 Rep. Kemiska reaktioner https://laughingsquid.com/a-ted-ed-animation-explaining-howall-sorts-of-different-chemical-reactions-are-triggered/ Karbokatjoner är elektrofila intermediärer
Olika typer av kolväten
 INTDUKTIN TILL GANISK KEMI KABNYLGUPPSKEMI Föreläsning v16 Nina Kann lika typer av kolväten alifatiska - alkaner - alkener - alkyner aromatiska 1 Funktionella grupper alken alkohol l alkylhalid S tiol
INTDUKTIN TILL GANISK KEMI KABNYLGUPPSKEMI Föreläsning v16 Nina Kann lika typer av kolväten alifatiska - alkaner - alkener - alkyner aromatiska 1 Funktionella grupper alken alkohol l alkylhalid S tiol
Molekyler och molekylmodeller. En modell av strukturen hos is, fruset vatten
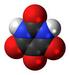 Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Vad är det som gör att vi lever? Finns det en gud som har skapat livet?
 Organisk kemi 1 Vad är det som gör att vi lever? Finns det en gud som har skapat livet? Sant: ett atomslag är viktigare än alla andra för att bygga liv vilket? Kolatomen är nödvändig för liv! Viktig byggsten
Organisk kemi 1 Vad är det som gör att vi lever? Finns det en gud som har skapat livet? Sant: ett atomslag är viktigare än alla andra för att bygga liv vilket? Kolatomen är nödvändig för liv! Viktig byggsten
FUNKTIONELLA GRUPPER (Ämnesklasser)
 FUKTIELLA GUPPE (Ämnesklasser) Fö2-2011/EMM Ex. 32-l + 2 32- + l Kloretan Etanol Generellt: -l - = - Z = generell kolvätekedja (alkyl) eller Ar = aromat Z= Funktionell grupp, Ex. -l, -, -, -2 m.fl. 1.
FUKTIELLA GUPPE (Ämnesklasser) Fö2-2011/EMM Ex. 32-l + 2 32- + l Kloretan Etanol Generellt: -l - = - Z = generell kolvätekedja (alkyl) eller Ar = aromat Z= Funktionell grupp, Ex. -l, -, -, -2 m.fl. 1.
Organiska föreningar Kokpunkt och löslighet. Niklas Dahrén
 Organiska föreningar Kokpunkt och löslighet Niklas Dahrén Uppgift 1: Rangordna nedanstående ämnen efter stigande kokpunkt Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas polaritet Molekylernas
Organiska föreningar Kokpunkt och löslighet Niklas Dahrén Uppgift 1: Rangordna nedanstående ämnen efter stigande kokpunkt Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas polaritet Molekylernas
TK061B Tillämpad bioteknik, antagna 2012, Inga hjälpmedel är tillåtna. 100 poäng
 Organisk kemi Provmoment: Ladokkod: Tentamen ges för: TK061B Tillämpad bioteknik, antagna 2012, 2013 7,5 högskolepoäng TentamensKod: Tentamensdatum: 11 Januari, 2016 Tid: 9:00-13:00 jälpmedel: Inga hjälpmedel
Organisk kemi Provmoment: Ladokkod: Tentamen ges för: TK061B Tillämpad bioteknik, antagna 2012, 2013 7,5 högskolepoäng TentamensKod: Tentamensdatum: 11 Januari, 2016 Tid: 9:00-13:00 jälpmedel: Inga hjälpmedel
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Cellens metabolism (ämnesomsättning)
 Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken: Enzymer: s223-230 Metabolism: s230-232, 243-261 (prio pdf) samf. s264, (262-263) Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande)
Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken: Enzymer: s223-230 Metabolism: s230-232, 243-261 (prio pdf) samf. s264, (262-263) Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande)
4. Organiska föreningars struktur
 4. Organiska föreningars struktur Organisk kemi Alla föreningar i den levande naturen är uppbyggda av kol (C). Många innehåller dessutom väte (H), syre (O), kväve (N), fosfor (P) och svavel (S). Den levande
4. Organiska föreningars struktur Organisk kemi Alla föreningar i den levande naturen är uppbyggda av kol (C). Många innehåller dessutom väte (H), syre (O), kväve (N), fosfor (P) och svavel (S). Den levande
Oxidation, reduktion och redoxreaktioner. Niklas Dahrén
 Oxidation, reduktion och redoxreaktioner Niklas Dahrén Vad innebär oxidation och reduktion? Oxida'on: Ämnet får e* elektronundersko* genom a* elektroner avges helt eller delvis (oxida8onstalet ökar). Reduk'on:
Oxidation, reduktion och redoxreaktioner Niklas Dahrén Vad innebär oxidation och reduktion? Oxida'on: Ämnet får e* elektronundersko* genom a* elektroner avges helt eller delvis (oxida8onstalet ökar). Reduk'on:
Organiska föreningar del 10: Vad bestämmer kokpunkten hos en förening? Niklas Dahrén
 Organiska föreningar del 10: Vad bestämmer kokpunkten hos en förening? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet
Organiska föreningar del 10: Vad bestämmer kokpunkten hos en förening? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet
Exoterma och endoterma reaktioner. Niklas Dahrén
 Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reaktioner: Reaktioner som avger energi till omgivningen (ofta värmeenergi). Exempel: Alla förbränningar, inklusive
Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reaktioner: Reaktioner som avger energi till omgivningen (ofta värmeenergi). Exempel: Alla förbränningar, inklusive
Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken Enzymer: Metabolism: , , ,257,
 Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken Enzymer: 223-230 Metabolism: 230-232, 243-249,252-253,257,259-261 Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande) Katabola
Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken Enzymer: 223-230 Metabolism: 230-232, 243-249,252-253,257,259-261 Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande) Katabola
NOMENKLATUR (kort version)
 1 IFM/Kemi 050821 MEKLATU (kort version) ALKAE mättade alifatiska kolväten Acykliska: n2n+2 amn Molekylformel amn Molekylformel Metan 4 Etan 2 6 Propan 3 8 Butan 4 10 Pentan 5 12 exan 6 14 eptan 7 16 ktan
1 IFM/Kemi 050821 MEKLATU (kort version) ALKAE mättade alifatiska kolväten Acykliska: n2n+2 amn Molekylformel amn Molekylformel Metan 4 Etan 2 6 Propan 3 8 Butan 4 10 Pentan 5 12 exan 6 14 eptan 7 16 ktan
Föreläsning 2. Kolväten Kapitel 3 och delar av 4. 1) Introduktion 2) Mättade kolväten 3) Omättade kolväten 4) Aromatiska föreningar
 Föreläsning 2 Kolväten Kapitel 3 och delar av 4 1) Introduktion 2) Mättade kolväten 3) mättade kolväten 4) Aromatiska föreningar 1. Introduktion Varför är olivolja flytande medan margarin är fast? Frågor:
Föreläsning 2 Kolväten Kapitel 3 och delar av 4 1) Introduktion 2) Mättade kolväten 3) mättade kolväten 4) Aromatiska föreningar 1. Introduktion Varför är olivolja flytande medan margarin är fast? Frågor:
Kap 2 McMurry Viktiga Begrepp
 Kap 2 McMurry Viktiga Begrepp Funktionella grupper Alkaner Isomerer Nomenklatur Konformerer Sågbocks- och Newmanprojektioner Cykloalkaner Cis- och trans- Axiell och ekvatoriell Funktionella grupper En
Kap 2 McMurry Viktiga Begrepp Funktionella grupper Alkaner Isomerer Nomenklatur Konformerer Sågbocks- och Newmanprojektioner Cykloalkaner Cis- och trans- Axiell och ekvatoriell Funktionella grupper En
Namngivningsschema. Lunds universitet / LTH / Brandingenjörsprogrammet / Allmän kemi. Vad vill du namnge? Grundämne Jon. Komplex -förening.
 Allmän kemi för BI Namngivningsschema Vad vill du namnge? Grundämne Jon Förening Komplex -förening Formel Namn Enkel jonl Samman -satt jon Binär förening Ickebinär förening Neutralt komplex Positivt komplex
Allmän kemi för BI Namngivningsschema Vad vill du namnge? Grundämne Jon Förening Komplex -förening Formel Namn Enkel jonl Samman -satt jon Binär förening Ickebinär förening Neutralt komplex Positivt komplex
Alla papper, även kladdpapper lämnas tillbaka.
 Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Introduktion till det periodiska systemet. Niklas Dahrén
 Introduktion till det periodiska systemet Niklas Dahrén Det periodiska systemet Vad är det periodiska systemet?: Det periodiska systemet är en tabell där alla kända grundämnen och atomslag ingår. Hur är
Introduktion till det periodiska systemet Niklas Dahrén Det periodiska systemet Vad är det periodiska systemet?: Det periodiska systemet är en tabell där alla kända grundämnen och atomslag ingår. Hur är
Den elektrokemiska spänningsserien. Niklas Dahrén
 Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel Metaller fungerar ofta som reduktionsmedel: Metaller fungerar ofta som reduktionsmedel eftersom de avger sina valenselektroner
Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel Metaller fungerar ofta som reduktionsmedel: Metaller fungerar ofta som reduktionsmedel eftersom de avger sina valenselektroner
Atomen och periodiska systemet
 Atomen och periodiska systemet Ringa in rätt svar 1. Exempel på elementarpartiklar är: joner protoner molekyler atomer elektroner 2. Atomen i sin helhet är: elektriskt neutral positivt laddad negativt
Atomen och periodiska systemet Ringa in rätt svar 1. Exempel på elementarpartiklar är: joner protoner molekyler atomer elektroner 2. Atomen i sin helhet är: elektriskt neutral positivt laddad negativt
Jonföreningar och jonbindningar del 1. Niklas Dahrén
 Jonföreningar och jonbindningar del 1 Niklas Dahrén Del 1: Innehåll o Introduktion till jonföreningar och jonbindningar. o Jämförelse mellan jonföreningar och molekylföreningar. o Hur jonföreningar är
Jonföreningar och jonbindningar del 1 Niklas Dahrén Del 1: Innehåll o Introduktion till jonföreningar och jonbindningar. o Jämförelse mellan jonföreningar och molekylföreningar. o Hur jonföreningar är
Periodiska systemet. Namn:
 Periodiska systemet Namn: Planering Vecka Aktivitet Viktigt 4 Repetition kemiska begrepp 5 Repetition kemiska begrepp + Periodiska systemet 6 Periodiska systemet + balansering av formler 7 Repetition +
Periodiska systemet Namn: Planering Vecka Aktivitet Viktigt 4 Repetition kemiska begrepp 5 Repetition kemiska begrepp + Periodiska systemet 6 Periodiska systemet + balansering av formler 7 Repetition +
Tentamen i Organisk kemi, 7.5 hp (KO3003) FACIT
 Tentamen i rganisk kemi, 7.5 hp (K3003) 1. (10 p) a) Ange om molekylerna 1 och/eller 2 är aromatiska. (1 p) b) Namnge föreningarna 1 och 2. (1 p) c) Vilken förening är starkast bas av 3 och 4? (2 p) d)
Tentamen i rganisk kemi, 7.5 hp (K3003) 1. (10 p) a) Ange om molekylerna 1 och/eller 2 är aromatiska. (1 p) b) Namnge föreningarna 1 och 2. (1 p) c) Vilken förening är starkast bas av 3 och 4? (2 p) d)
ATOMENS BYGGNAD. En atom består av : Kärna ( hela massan finns i kärnan) Positiva Protoner Neutrala Neutroner. Runt om Negativa Elektroner
 periodiska systemet ATOMENS BYGGNAD En atom består av : Kärna ( hela massan finns i kärnan) Positiva Protoner Neutrala Neutroner Runt om Negativa Elektroner En Elektron har en negativt laddning. Och elektronerna
periodiska systemet ATOMENS BYGGNAD En atom består av : Kärna ( hela massan finns i kärnan) Positiva Protoner Neutrala Neutroner Runt om Negativa Elektroner En Elektron har en negativt laddning. Och elektronerna
Den elektrokemiska spänningsserien. Niklas Dahrén
 Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel ü Metaller avger gärna sina valenselektroner till andra ämnen p.g.a. låg elektronegativitet och eftersom de metalljoner som
Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel ü Metaller avger gärna sina valenselektroner till andra ämnen p.g.a. låg elektronegativitet och eftersom de metalljoner som
Inga hjälpmedel är tillåtna. 100 poäng
 rganisk kemi Provmoment: Tentamen Ladokkod: A100TG Tentamen ges för: Kemiingenjör, tillämpad bioteknik 7,5 högskolepoäng TentamensKod: Tentamensdatum: 12 Januari, 2017 Tid: 9:00-13:00 Hjälpmedel: Inga
rganisk kemi Provmoment: Tentamen Ladokkod: A100TG Tentamen ges för: Kemiingenjör, tillämpad bioteknik 7,5 högskolepoäng TentamensKod: Tentamensdatum: 12 Januari, 2017 Tid: 9:00-13:00 Hjälpmedel: Inga
Dipoler och dipol-dipolbindningar Del 2. Niklas Dahrén
 Dipoler och dipol-dipolbindningar Del 2 Niklas Dahrén Uppgift 1: Är nedanstående molekyler dipoler? På bild a) är det ganska tydligt att vi får en negativ sida där -atomerna sitter och en positiv sida
Dipoler och dipol-dipolbindningar Del 2 Niklas Dahrén Uppgift 1: Är nedanstående molekyler dipoler? På bild a) är det ganska tydligt att vi får en negativ sida där -atomerna sitter och en positiv sida
C Dessa atomer är kolets isotoper. Isotoper har: olika A samma Z samma antal e likadana kemiska egenskaper
 2.1 Materiens uppbyggnad Materia 2.2 Atomen t. ex. en litiumatom (Li) omogent ämne eterogen blandning t. ex. en suspension Rent ämne omogen blandning grundämne kan inte sönderdelas kemisk Ca Ag kemisk
2.1 Materiens uppbyggnad Materia 2.2 Atomen t. ex. en litiumatom (Li) omogent ämne eterogen blandning t. ex. en suspension Rent ämne omogen blandning grundämne kan inte sönderdelas kemisk Ca Ag kemisk
Buffertlösningar. Niklas Dahrén
 Buffertlösningar Niklas Dahrén Syror, baser och ph-värde Syror: Syror avger vätejoner (protoner) och ger i va4enlösningar upphov 9ll oxoniumjoner (H 3 O + ) e@ersom va4enmolekyler plockar upp vätejoner.
Buffertlösningar Niklas Dahrén Syror, baser och ph-värde Syror: Syror avger vätejoner (protoner) och ger i va4enlösningar upphov 9ll oxoniumjoner (H 3 O + ) e@ersom va4enmolekyler plockar upp vätejoner.
Vad bestämmer ett ämnes kokpunkt? Niklas Dahrén
 Vad bestämmer ett ämnes kokpunkt? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet ü Molekylernas storlek har betydelse
Vad bestämmer ett ämnes kokpunkt? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet ü Molekylernas storlek har betydelse
H 3 C. 5. Förklara varför fenol (se ovan) är en starkare syra än cyklohexanol (pk a =18).
 Linköping 12-08-15 IFM/Kemi Linköpings universitet TFKE06/GAN-ss Efterarbete av föreläsningar inom rganisk kemi 2 Uppgifter kap. 1-3 1. Rita resonansformler för N,N-dimetyl-3-aminopropenal! 3 3 N 2. Ange
Linköping 12-08-15 IFM/Kemi Linköpings universitet TFKE06/GAN-ss Efterarbete av föreläsningar inom rganisk kemi 2 Uppgifter kap. 1-3 1. Rita resonansformler för N,N-dimetyl-3-aminopropenal! 3 3 N 2. Ange
FUNKTIONELLA GRUPPER (Ämnesklasser)
 FUKTIELLA GUPPE (Ämnesklasser) Fö13-14-2013/EMM Funktionella grupper och egenskaper Vanliga funktionella grupper i organisk kemi Ämnesklass Funktionell grupp amn på funk.grp Exempel Ex. 32-l + 2!" 32-
FUKTIELLA GUPPE (Ämnesklasser) Fö13-14-2013/EMM Funktionella grupper och egenskaper Vanliga funktionella grupper i organisk kemi Ämnesklass Funktionell grupp amn på funk.grp Exempel Ex. 32-l + 2!" 32-
Föreläsning 16. Karbonylkolets kemi I Kapitel 16 F16
 Föreläsning 16 Karbonylkolets kemi I Kapitel 16 1) Introduktion 2) Addition av nukleofiler till karbonylgrupper A) Addition av hydridjoner B) Addition av metallorganiska reagens C) Addition av alkoholer
Föreläsning 16 Karbonylkolets kemi I Kapitel 16 1) Introduktion 2) Addition av nukleofiler till karbonylgrupper A) Addition av hydridjoner B) Addition av metallorganiska reagens C) Addition av alkoholer
Kapitel 2. Kovalent bindning
 Kapitel 2. Kovalent bindning 2.1 Instuderingsfrågor 2.1.1 Rangordna kväve, fluor, syre, kol och väte efter stigande elektronegativitet. 2.1.2 Vad menas med induktiv effekt? 2.1.3 Vad menas med dipolmoment?
Kapitel 2. Kovalent bindning 2.1 Instuderingsfrågor 2.1.1 Rangordna kväve, fluor, syre, kol och väte efter stigande elektronegativitet. 2.1.2 Vad menas med induktiv effekt? 2.1.3 Vad menas med dipolmoment?
Lösning till Tentamen i Kemi (TFKE16),
 Lösning till Tentamen i Kemi (TFKE16), 091017. 1. a) KN Mn 2 b) krom(iii)sulfat alt. dikromtrisulfat (mindre bra) triarsenikpentanitrid alt. arsenik(v)nitrid c) +II +V +III +II 3 Fe 2+ + N 3 - + 4 + 3
Lösning till Tentamen i Kemi (TFKE16), 091017. 1. a) KN Mn 2 b) krom(iii)sulfat alt. dikromtrisulfat (mindre bra) triarsenikpentanitrid alt. arsenik(v)nitrid c) +II +V +III +II 3 Fe 2+ + N 3 - + 4 + 3
FUNKTIONELLA GRUPPER (Ämnesklasser)
 FUKTIELLA GUPPE (Ämnesklasser) Fö2-2010/EMM Vanliga funktionella grupper i organisk kemi Ämnesklass Funktionell grupp amn på funk.grp Exempel Ex. 32-l + 2!" 32- + l Kloretan Etanol Generellt: -l - = -
FUKTIELLA GUPPE (Ämnesklasser) Fö2-2010/EMM Vanliga funktionella grupper i organisk kemi Ämnesklass Funktionell grupp amn på funk.grp Exempel Ex. 32-l + 2!" 32- + l Kloretan Etanol Generellt: -l - = -
Inga hjälpmedel är tillåtna. 100 poäng
 rganisk kemi Provmoment: Ladokkod: Tentamen ges för: Tentamen A100TG Tillämpad bioteknik 7,5 högskolepoäng TentamensKod: Tentamensdatum: 15 Januari, 2016 Tid: 9:00-13:00 jälpmedel: Inga hjälpmedel är tillåtna
rganisk kemi Provmoment: Ladokkod: Tentamen ges för: Tentamen A100TG Tillämpad bioteknik 7,5 högskolepoäng TentamensKod: Tentamensdatum: 15 Januari, 2016 Tid: 9:00-13:00 jälpmedel: Inga hjälpmedel är tillåtna
Nästan alla ämnen kan förekomma i tillstånden fast, flytande och gas. Exempelvis vatten kan finnas i flytande form, fast form (is) och gas (ånga).
 Nästan alla ämnen kan förekomma i tillstånden fast, flytande och gas. Exempelvis vatten kan finnas i flytande form, fast form (is) och gas (ånga). I alla tre formerna är vatten fortfarande samma ämne och
Nästan alla ämnen kan förekomma i tillstånden fast, flytande och gas. Exempelvis vatten kan finnas i flytande form, fast form (is) och gas (ånga). I alla tre formerna är vatten fortfarande samma ämne och
Materien. Vad är materia? Atomer. Grundämnen. Molekyler
 Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Det finns alltså tre isomera pentaner. Dessa har olika fysikaliska egenskaper, t.ex. kokpunkt.
 1 IFM/Kemi 071021 MEKLATU (kort version) ALKAE mättade alifatiska kolväten Acykliska: n2n+2 amn Molekylformel amn Molekylformel Metan 4 exan 6 14 Etan 2 6 eptan 7 16 Propan 3 8 ktan 8 18 Butan 4 10 onan
1 IFM/Kemi 071021 MEKLATU (kort version) ALKAE mättade alifatiska kolväten Acykliska: n2n+2 amn Molekylformel amn Molekylformel Metan 4 exan 6 14 Etan 2 6 eptan 7 16 Propan 3 8 ktan 8 18 Butan 4 10 onan
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2
 UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
Naftalen Antracen Fenantren Benspyren
 rg Kemi kompendiedel Aromatiska kolväten 2006-11-06 Bensen - den enklaste aromaten Plan sp 2 -hybridiserad ring elektronerna är delokaliserade runt i ringen vilket kan beskrivas med resonansstrukturer
rg Kemi kompendiedel Aromatiska kolväten 2006-11-06 Bensen - den enklaste aromaten Plan sp 2 -hybridiserad ring elektronerna är delokaliserade runt i ringen vilket kan beskrivas med resonansstrukturer
Framkalla fingeravtryck med superlim. Niklas Dahrén
 Framkalla fingeravtryck med superlim Niklas Dahrén Innehållet i denna undervisningsfilm: Kemin bakom framkallning med superlim inklusive betydelsen av atomernas elektronega6vitet Vanligt superlim kan framkalla
Framkalla fingeravtryck med superlim Niklas Dahrén Innehållet i denna undervisningsfilm: Kemin bakom framkallning med superlim inklusive betydelsen av atomernas elektronega6vitet Vanligt superlim kan framkalla
Grundläggande Kemi 1
 Grundläggande Kemi 1 Det mesta är blandningar Allt det vi ser runt omkring oss består av olika ämnen ex vatten, socker, salt, syre och guld. Det är sällan man träffar på rena ämnen. Det allra mesta är
Grundläggande Kemi 1 Det mesta är blandningar Allt det vi ser runt omkring oss består av olika ämnen ex vatten, socker, salt, syre och guld. Det är sällan man träffar på rena ämnen. Det allra mesta är
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Exoterma och endoterma reaktioner. Niklas Dahrén
 Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reak+oner: Reak%oner som avger energi %ll omgivningen (o1a värmeenergi). Exempel: Alla förbränningar, inklusive
Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reak+oner: Reak%oner som avger energi %ll omgivningen (o1a värmeenergi). Exempel: Alla förbränningar, inklusive
Att skriva och balansera reaktionsformler. Niklas Dahrén
 Att skriva och balansera reaktionsformler Niklas Dahrén Innehållet i denna undervisningsfilm: Kemiska reak*oner och reak*onsformler Hur skrivs en reak*onsformel? Hur balanseras en reak*onsformel? Kemiska
Att skriva och balansera reaktionsformler Niklas Dahrén Innehållet i denna undervisningsfilm: Kemiska reak*oner och reak*onsformler Hur skrivs en reak*onsformel? Hur balanseras en reak*onsformel? Kemiska
Dipol-dipolbindning. Niklas Dahrén
 Dipol-dipolbindning Niklas Dahrén Dipol-dipolbindning är en intermolekylär bindning Kovalent bindning Intramolekylära bindningar Polär kovalent bindning Jonbindning Kemisk bindning Dipol- dipolbindning
Dipol-dipolbindning Niklas Dahrén Dipol-dipolbindning är en intermolekylär bindning Kovalent bindning Intramolekylära bindningar Polär kovalent bindning Jonbindning Kemisk bindning Dipol- dipolbindning
Oxidation, reduktion och redoxreaktioner. Niklas Dahrén
 Oxidatin, reduktin ch redxreaktiner Niklas Dahrén Vad innebär xidatin ch reduktin? Oxidatin: Ämnet får ett elektrnundersktt genm att elektrner avges helt eller delvis (xidatinstalet ökar). Reduktin: Ämnet
Oxidatin, reduktin ch redxreaktiner Niklas Dahrén Vad innebär xidatin ch reduktin? Oxidatin: Ämnet får ett elektrnundersktt genm att elektrner avges helt eller delvis (xidatinstalet ökar). Reduktin: Ämnet
Jonföreningar och jonbindningar del 2. Niklas Dahrén
 Jonföreningar och jonbindningar del 2 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Jonföreningar och jonbindningar del 2 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Lärare: Jimmy Pettersson. Kol och kolföreningar
 Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Jonföreningar och jonbindningar del 1. Niklas Dahrén
 Jonföreningar och jonbindningar del 1 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Jonföreningar och jonbindningar del 1 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Olika kovalenta bindningar. Niklas Dahrén
 Olika kovalenta bindningar Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar (intramolekylära)
Olika kovalenta bindningar Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar (intramolekylära)
8. Organisk kemi Man kan enkelt visa strukturen för ett kolväte med en s.k. streckformel. För 3-metylhexan,
 8. rganisk kemi 8.1. ur ändras alkanernas kokpunkt med ökat antal kolatomer i kedjan ökad förgrening av kolkedjan (totala antalet kolatomer är konstant)? 8.2. Vad menas med en substituent en alkylgrupp
8. rganisk kemi 8.1. ur ändras alkanernas kokpunkt med ökat antal kolatomer i kedjan ökad förgrening av kolkedjan (totala antalet kolatomer är konstant)? 8.2. Vad menas med en substituent en alkylgrupp
Periodiska systemet. Atomens delar och kemiska bindningar
 Periodiska systemet Atomens delar och kemiska bindningar Atomens delar I mitten av atomen finns atomkärnan där protonerna finns. Protoner är positivt laddade partiklar Det är antalet protoner som avgör
Periodiska systemet Atomens delar och kemiska bindningar Atomens delar I mitten av atomen finns atomkärnan där protonerna finns. Protoner är positivt laddade partiklar Det är antalet protoner som avgör
Joner Syror och baser 2 Salter. Kemi direkt sid. 162-175
 Joner Syror och baser 2 Salter Kemi direkt sid. 162-175 Efter att du läst sidorna ska du kunna: Joner Förklara skillnaden mellan en atom och en jon. Beskriva hur en jon bildas och ge exempel på vanliga
Joner Syror och baser 2 Salter Kemi direkt sid. 162-175 Efter att du läst sidorna ska du kunna: Joner Förklara skillnaden mellan en atom och en jon. Beskriva hur en jon bildas och ge exempel på vanliga
O O EtOAc. anilin bensoesyraanhydrid N-fenylbensamid bensoesyra
 Linköping 2009-10-25 IFM/Kemi Linköpings universitet För NKEA07 ht2009 SS Syntes av N-fenylbensamid Inledning: Amider, som tillhör gruppen karboxylsyraderivat, kan framställas från aminer och syraanhydrider.
Linköping 2009-10-25 IFM/Kemi Linköpings universitet För NKEA07 ht2009 SS Syntes av N-fenylbensamid Inledning: Amider, som tillhör gruppen karboxylsyraderivat, kan framställas från aminer och syraanhydrider.
Oxidation, reduktion och redoxreaktioner. Niklas Dahrén
 Oxidatin, reduktin ch redxreaktiner Niklas Dahrén Vad innebär xidatin ch reduktin? Oxidatin: Ett ämne (atm eller jn) får ett elektrnundersktt genm att elektrner avges fullständigt eller till viss del (partiellt).
Oxidatin, reduktin ch redxreaktiner Niklas Dahrén Vad innebär xidatin ch reduktin? Oxidatin: Ett ämne (atm eller jn) får ett elektrnundersktt genm att elektrner avges fullständigt eller till viss del (partiellt).
Materia och aggregationsformer. Niklas Dahrén
 Materia och aggregationsformer Niklas Dahrén Vad är materia? Materia är egentligen allting som vi ser omkring oss! Allt som är uppbyggt av atomer kallas för materia. Materia kännetecknas av att det har
Materia och aggregationsformer Niklas Dahrén Vad är materia? Materia är egentligen allting som vi ser omkring oss! Allt som är uppbyggt av atomer kallas för materia. Materia kännetecknas av att det har
Rättningstiden är i normalfall tre veckor, annars är det detta datum som gäller: Efter överenskommelse med studenterna är rättningstiden fem veckor.
 Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Dipoler och dipol-dipolbindningar Del 1. Niklas Dahrén
 Dipoler och dipoldipolbindningar Del 1 Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar
Dipoler och dipoldipolbindningar Del 1 Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar
KARBOKATJON KARBANJON
 EAKTINE: Generella typer : 1. Addition Fö D-2010 (rowe Kap 17-18) 2. Substitution 3. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME Z MLYS + Z ADIKALE Z ETELYS KABKATJN + Z Vanligast + Z KABANJN
EAKTINE: Generella typer : 1. Addition Fö D-2010 (rowe Kap 17-18) 2. Substitution 3. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME Z MLYS + Z ADIKALE Z ETELYS KABKATJN + Z Vanligast + Z KABANJN
