Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer. Niklas Dahrén
|
|
|
- Olof Hellström
- för 6 år sedan
- Visningar:
Transkript
1 Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer Niklas Dahrén
2 7 olika reaktionstyper 1. Substitutionsreaktioner 2. Additionsreaktioner 3. Eliminationsreaktioner 4. Kondensationsreaktioner 5. Hydrolysreaktioner 6. Syra-bas-reaktioner 7. Redoxreaktioner
3 Reaktionstyper Substitutionsreaktion: Vid en substitutionsreaktion byts en atom eller en atomgrupp i en molekyl ut mot en annan atom eller atomgrupp. OH - + CH 3 Br CH 3 OH + Br - Additionsreaktion: Vid en additionsreaktion adderas en molekyl till en annan molekyl som från början har en eller flera dubbel- eller trippelbindningar. CH 2 =CH 2 + Br 2 CH 2 BrCH 2 Br Eliminationsreaktion: Vid en eliminationsreaktion avskiljs två atomer eller atomgrupper från en molekyl vilket ger upphov till en dubbel- eller trippelbindning. CH 3 CH 3 CH 2 =CH 2 + H 2
4 Reaktionstyper Kondensationsreaktion: Vid en kondensationsreaktion binds två molekyler samman under avspjälkning av en vattenmolekyl. CH 3 CH 2 OH + CH 3 COOH CH 3 COOCH 2 CH 3 + H 2 O Hydrolysreaktion: Vid en hydrolysreaktion sönderdelas ett ämne under upptagning av vatten. CH 3 COOCH 2 CH 3 + H 2 O CH 3 CH 2 OH + CH 3 COOH Syra-basreaktioner (protolysreaktioner): Vid en syra-basreaktion överförs minst en vätejon (proton, H + ) från ett ämne (en syra) till ett annat ämne (en bas). CH 3 COOH + H 2 O CH 3 COO - + H 3 O + Redoxreaktioner: Vid en redoxreaktion överförs minst en elektron, fullständigt eller partiellt, från ett ämne till ett annat ämne. CH 4 + 2O 2 CO 2 + H 2 O
5 3 viktiga begrepp för att förstå reaktionsmekanismer Nukleofiler Elektrofiler Karbokatjoner
6 Nukleofiler Nukleofiler: Nukleofiler är molekyler/joner (eller egentligen specifika delar av dessa) som är mer eller mindre negativt laddade och därför attraheras av och attackerar positivt laddade delar av andra molekyler/joner och på det sättet startar en reaktion (t.ex. startar en substitutionsreaktion). Exempel på nukleofiler: OH - (syreatomen) H 2 O (syreatomen) NH 3 (kväveatomen) Br - Varför är syret i vattenmolekylen en nukleofil?: Syreatomen har 2 par fria elektroner. Dessa fria elektroner är negativt laddade och ingår inte i någon bindning. Dessa elektroner kan därför attraheras av och attackera positiv laddning, t.ex. en proton (vätejon, H + ). Nukleofil substitutionsreaktion: När en nukleofil gör så att en atom eller en atomgrupp i en molekyl byts ut mot en annan så kallas det för en nukleofil substitutionsreaktion. Hur stark en nukleofil är mäts efter hur bra den är på att byta ut en annan grupp. Det har inte bara att göra med hur negativt laddad den är utan också hur lätt den kommer åt att attackera.
7 Elektrofiler Elektrofiler: Elektrofiler fungerar på samma sätt som nukleofiler fast tvärt om. De har mer eller mindre positiv laddning och attraheras därför av negativa delar av andra molekyler/joner. Exempel på elektrofiler: HBr (vätet) CS 2 (kolet) H + Varför är kolet i CS 2 en elektrofil: Kolatomen har lägre elektronegativitet jämfört med svavelatomerna och kommer därför bli positivt laddat. Elektrofil substitutionsreaktion: När elektrofiler attackerar en molekyl och byter ut en atom eller atomgrupp kallas det för elektrofil substitutionsreaktion.
8 Karbokatjoner En karbokatjon är en positivt laddad jon med laddningen koncentrerad vid en kolatom. Karbokatjoner uppkommer som intermediärer (övergångsprodukter/mellansteg) i organiska reaktioner. De är mycket reaktiva p.g.a. den starka positiva laddningen och har därför väldigt kort livstid. + Cl - Karbokatjon
9 Substitutionsreaktioner
10 Substitutionsreaktioner Vad menas med en substitutionsreaktion?: Vid en substitutionsreaktion byts en atom eller en atomgrupp i en molekyl ut mot en annan atom eller atomgrupp. En alkan reagerar med klorgas och bildar en en halogenalkan: CH 3 CH 2 CH 3 + Cl 2 CH 3 CH 2 CH 2 Cl + HCl Propan Klorpropan En halogenalkan reagerar med en hydroxidjon och bildar en alkohol: OH - + CH 3 Br CH 3 OH + Br - Brommetan Metanol
11 Reaktionsmekanismen bakom substitutionsreaktionen mellan CH 3 Br och OH - Positiv kolatom: Bromatomen i CH 3 Br är lite mer elektronegativ än kolatomen i samma molekyl och drar därför åt sig bindningselektronerna litegrann, vilket leder till att kolet blir lite partiellt positivt laddat. Nukleofil attack: OH - fungerar som en nukleofil och attraheras av den partiellt positiva laddningen på kolatomen. OH - utför en nukleofil attack på kolatomen vilket leder till att det skapas en polär kovalent bindning mellan syret i OH - och kolatomen. Brom knuffas iväg: När detta sker blir det för mycket elektroner runt kolatomen (många negativa laddningar som repellerar varandra) vilket leder till att bromatomen (inkl. bindningselektronerna) knuffas iväg och lämnar i form av en bromidjon, Br -. Aktiverat komplex/ Övergångstillstånd Brommetan Metanol
12 Syra-basreaktioner (protolysreaktioner)
13 Syra-basreaktioner (protolysreaktioner) En syra-basreaktion (protolysreaktion) är en kemisk reaktion som innebär att protoner (H + ) avges respektive upptas (en protonöverföring sker alltså). Det ämne som avger protonen fungerar som en syra, medan det ämne som upptar protonen fungerar som en bas. När en syra har avgett sin proton (eller protoner) säger man att den är protolyserad. Syra HCl + H 2 O Cl - + H 3 O + Bas H + Bas Syra NH 3 + H 2 O NH OH - Vatten kan fungera som både en svag syra resp. svag bas, beroende på vilket ämne den reagerar med. Bas OH - Syra + HCl H 2 O + Cl -
14 Reaktionsmekanismen bakom syrabasreaktioner (liknar substitutionsreaktioner) Reaktion: OH - + HCl H 2 O + Cl - Förutsättningar: Elektronrik, nukleofil Elektronfattig, elektrofil Cl är elektronegativ och drar i bindningselektronerna till vätet. Detta gör att vätet blir partiellt positivt laddat och kloratomen partiellt negativt laddat. På syreatomen finns fria elektronpar som attraheras av vätets positiva laddning. Reaktionsmekanism: 1. Ett av syrets elektronpar gör en nukleofil attack på protonen, en bindning börjar skapas Cl lämnar i form av en kloridjon och en vattenmolekyl bildas. 2. När syret binder blir det för mycket elektroner runt vätet. Bindningselektronerna mellan H och Cl repelleras och förskjuts fullständigt till Cl.
15 Reaktionsmekanismen bakom additionsreaktioner
16 Additionsreaktioner Vad menas med en additionsreaktion?: Vid en additionsreaktion adderas en molekyl till en annan molekyl som från början har en eller flera dubbel- eller trippelbindningar. Polyaddition innebär att många omättade molekyler länkas samman till stora molekyler (polymerer). En alken reagerar med bromgas och bildar en halogenalkan: CH 2 =CH 2 + Br 2 CH 2 BrCH 2 Br eten 1,2-dibrometan En alken reagerar med vatten och bildar en alkohol: CH 2 =CH 2 + H 2 O CH 3 CH 2 OH eten etanol
17 Reaktionsmekanismen för additionsreaktionen mellan eten och vatten Steg 1: En stark syra används som katalysator. Den starka syran avger en vätejon (proton). Etenmolekylen attraheras av den positiva vätejonen och därmed sätts hela reaktionen igång. Den starka syran fungerar därmed som en katalysator. Eten fungerar som en nukleofil eftersom eten har elektroner i dubbelbindningen som attraheras av den positivt laddade protonen, och därmed attackerar och skapar en bindning till denna. En kolatom förlorar då två elektroner och får en positiv laddning. Kolatomen blir alltså en karbokatjon. Syran har därmed fungerat som en katalysator eftersom den har brutit en gammal bindning, aktiverat reaktanten och därmed möjliggjort att additionsreaktionen kan ske. Utan syran skulle reaktionen gå mycket långsamt eller överhuvudtaget aldrig ske. Eten Vätejon (proton) Karbokatjon
18 Reaktionsmekanismen för additionsreaktionen mellan eten och vatten Steg 2: En vattenmolekyl fungerar sedan som en nukleofil eftersom syreatomen har ett fritt elektronpar som attraheras av, attackerar och binder till karbokatjonen. Syret förlorar då en av sina egna valenselektroner till kolet och blir därmed lite positivt laddad och drar därför till sig elektronerna från den ena väteatomen lite extra. Det leder till att vätet lossnar från syret och försvinner iväg som en proton (ingen elektron följer med). Vi har då bildat etanol samtidigt som syran har fått tillbaka sin proton och därmed återbildats. Karbokatjon Etanol
19 Reaktionsmekanismen för additionsreaktionen mellan eten och brom Reaktionen: CH 2 =CH 2 + Br 2 CH 2 BrCH 2 Br Reaktionsmekanism: 1. När Br 2 närmar sig eten så kommer elektronerna i dubbelbindningen göra så att den närmsta bromatomen i Br 2 blir partiellt positivt laddad medan den bakre bromatomen blir partiellt negativt laddad (genom att valenselektronerna repelleras bakåt mot den andra bromatomen). Sedan kommer elektroner i dubbelbindningen göra en nukleofil attack på den positiva bromatomen. En bindning skapas och en karbokatjon uppstår eftersom den ena kolatomen blir av med valenselektroner. Samtidigt lämnar den bakre bromatomen i form av en bromidjon ,2-dibromidetan har bildats Bromidjonen attackerar karbokatjonen och en bindning skapas. 1,2-dibrometan 2. Bromidjonen attackerat
20 Alkener och alkyner är mer reaktionsbenägna än alkaner Alkener och alkyner har dubbel- resp. trippelbindningar vilket gör att dessa är mer reaktionsbenägna i jämförelse med alkaner som enbart har enkelbindningar. Alkener och alkyner har dubbel- resp. trippelbindningar eftersom de är omättade kolväten (saknar väteatomer). De kan därför binda ytterligare atomer genom att det extra elektronparet i dubbelbindningen utnyttjas. T.ex. kan halogenerna klor och brom adderas mycket lätt till alkener men inte så lätt till alkaner. Reaktionerna sker spontant utan att det behövs särskilt mycket aktiveringsenergi (hög värme eller UV-strålning). I en dubbelbindning eller trippelbindning finns det alltid ett resp. två elektronpar som är över och som därför kan binda till andra atomer. Elektronerna i dessa elektronpar påverkas inte heller så mycket av atomkärnorna (elektronerna befinner sig inte riktigt emellan kärnorna) och därför kan de lättare reagera med andra ämnen. Propan Propen Propyn
21 Kondensationsreaktioner
22 Etrar kan bildas i en kondensationsreaktion mellan alkoholer Kondensationsreaktion: Vid en kondensationsreaktion slås två molekyler samman och bildar en större molekyl, samtidigt som vatten spjälkas av. Vid kondensation mellan två alkoholer bildas vatten och en eter. Här ser vi kondensationsreaktionen mellan två etanolmolekyler. Produkten som bildas är en eter med namnet dietyleter. CH 3 -CH 2 -OH + HO-CH 2 -CH 3 CH 3 -CH 2 -O-CH 2 -CH 3 + H 2 O Etanol Etanol Dietyleter
23 Exempel på en kondensationsreaktion: Syrakatalyserad reaktion mellan en alkohol och karboxylsyra för att bilda en ester + + Karboxylsyra (etansyra) Alkohol (metanol) Ester (metyletanoat) Vatten I ovanstående reaktion binds en karboxylsyra och en alkohol ihop med varandra och bildar då en ester. I reaktionen bildas även en vattenmolekyl. För att reaktionen ska kunna ske krävs det att vi har en katalysator i form av en stark syra. Syran avger vätejoner/protoner och det är dessa som katalyserar reaktionen. Katalysatorns uppgift är att bryta en gammal bindning i karboxylsyran och göra karboxylsyran mottaglig för alkoholen så att en ny bindning kan skapas mellan karboxylsyran och alkoholen.
24 Reaktionsmekanismen - Steg 1: Nukleofil attack : : Karboxylsyra (etansyra) Karboxylsyran gör en nukleofil attack på en proton (vätejon) som den starka syran har avgivit: Det fria elektronparet på syreatomen attraheras av protonen från den starka syran, attackerar och skapar en bindning till denna genom en nukleofil attack. När protonen fäster till syreatomen blir syreatomen positivt laddat eftersom syreatomen nu endast har 5 egna valenselektroner (eftersom den har lånat ut en elektron till väteatomen). Den formella laddningen är +1. Säger man partiellt positivt laddat när den
25 Reaktionsmekanismen - Steg 2: :: H + Karbokatjon En karbokatjon bildas: Det partiellt positiva syret kommer nu attrahera 2 bindningselektroner från dubbelbindningen med kolatomen. Detta leder till att kolatomen förlorar elektroner och istället blir positivt laddat. Den formella laddningen på kolatomen är +1. Karboxylsyran har då omvandlats till en s.k. karbokatjon (jon med en positiv laddning på en kolatom). Karbokatjonen är väldigt reaktiv och därför säger vi nu att reaktanten är aktiverad. Den starka syran har alltså fått karboxylsyran aktiverad och redo för att reagera med alkoholen! Säger man partiellt positivt laddat när den
26 Reaktionsmekanismen - Steg 3: Karbokatjon från karboxylsyran Alkohol (metanol) Alkoholmolekylen gör en nukleofil attack på karbokatjonen: I detta steg kommer en alkoholmolekyl (etanol i det här exemplet) binda till karbokatjonen. Det sker genom att ett fritt elektronpar på syreatomen i OH-gruppen attraheras av den positiva kolatomen, attackerar och skapar en bindning till denna. Denna typ av reaktion kallas för en nukleofil attack. Nu blir dock syreatomen positivt laddad eftersom den bara har 5 egna valenselektroner (eftersom den har lånat ut en elektron till kolatomen). Den formella laddningen på syreatomen är +1. Säger man partiellt positivt laddat när den
27 Reaktionsmekanismen - Steg 4: Protonöverflyttning: I detta steg sker en protonöverflyttning från en syreatom till en annan. Det positiva syret drar åt sig elektronerna från protonen vilket försvagar bindningen till protonen och gör att protonen ganska enkelt kan lossna. Det andra syret kommer sedan attraheras av protonen och skapa en bindning till denna. Säger man partiellt positivt laddat när den
28 Reaktionsmekanismen - Steg 5: Karbokatjon En vattenmolekyl avspjälkas: När syret tar upp protonen blir syret positivt laddat eftersom den nu endast har 5 egna valenselektroner. Den formella laddningen på syreatomen är +1. Den positiva laddningen på syret kommer dra åt sig bindningselektronerna som sitter mellan kolet och syret vilket leder till att syret och de två väteatomerna (en vattenmolekyl) släpper. Kvar blir då återigen en positivt laddad karbokatjon. Säger man partiellt positivt laddat när den
29 Reaktionsmekanismen - Steg 6: Karbokatjon Ester (metyletanoat) En proton lossnar, syran återbildas och vi har fått vår färdiga ester: Det positiva kolet drar åt sig elektroner från syret, vilket nu istället innebär att syret blir positivt laddad. Det positivt laddade syret kommer nu dra åt sig bindningselektronerna mellan syret och vätet vilket gör att vätet lossnar i form av en proton (eftersom elektronen stannar kvar hos syret). Anjonen från syran (den negativa jonen som återstår efter att en proton har lossnat) kan nu plocka upp protonen och återbildas till en vanlig syra igen. Vi har därmed fått vår ester och vi kan även se att syran inte förbrukas utan fungerar enbart som en katalysator! Säger man partiellt positivt laddat när den
30 Sammanfattning av esterreaktionen 1. Karboxylsyran gör en nukleofil attack på en proton (vätejon) som den starka syran har avgivit. 2. Karboxylsyran omvandlas till en karbokatjon som är väldigt reaktiv. 3. Syreatomen i alkoholmolekylen gör en nukleofil attack på karbokatjonen och binder till denna. Karboxylsyran och alkoholen är nu bundna till varandra. 4. En proton förflyttas från ett syre till ett annat. 5. En vattenmolekyl avspjälkas. 6. En proton lossnar (och katalysatorn återbildas). Vi har fått vår ester!
31 Länk till några gamla undervisningsfilmer som jag har gjort (estersyntes, substitutionsreaktion och additionsreaktion): ZTsoKP5i7u
32 Se gärna fler filmer av Niklas Dahrén:
Reaktionsmekanismer. Niklas Dahrén
 Reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Subs'tu'onsreak'oner 2. Addi'onsreak'oner 3. Elimina'onsreak'oner 4. Syra-bas-reak'oner 5. Kondensa'onsreak'oner 6. Hydrolysreak'oner 7. Redoxreak'oner
Reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Subs'tu'onsreak'oner 2. Addi'onsreak'oner 3. Elimina'onsreak'oner 4. Syra-bas-reak'oner 5. Kondensa'onsreak'oner 6. Hydrolysreak'oner 7. Redoxreak'oner
Reaktionsmekanismer. Kap 6
 Reaktionsmekanismer Kap 6 Karbokatjoner är elektrofila intermediärer Innehåll Kvalitativa resonemang hur och varför kemiska reaktioner sker Exempel på energiomsättningar vid olika slags organiska reaktioner.
Reaktionsmekanismer Kap 6 Karbokatjoner är elektrofila intermediärer Innehåll Kvalitativa resonemang hur och varför kemiska reaktioner sker Exempel på energiomsättningar vid olika slags organiska reaktioner.
Reaktionsmekanismer. Kap 6
 Reaktionsmekanismer Kap 6 Rep. Kemiska reaktioner https://laughingsquid.com/a-ted-ed-animation-explaining-howall-sorts-of-different-chemical-reactions-are-triggered/ Karbokatjoner är elektrofila intermediärer
Reaktionsmekanismer Kap 6 Rep. Kemiska reaktioner https://laughingsquid.com/a-ted-ed-animation-explaining-howall-sorts-of-different-chemical-reactions-are-triggered/ Karbokatjoner är elektrofila intermediärer
Kovalenta bindningar, elektronegativitet och elektronformler. Niklas Dahrén
 Kovalenta bindningar, elektronegativitet och elektronformler Niklas Dahrén Innehåll ü Opolära kovalenta bindningar ü Polära kovalenta bindningar ü Elektronegativitet ü Paulingskalan ü Elektronformler ü
Kovalenta bindningar, elektronegativitet och elektronformler Niklas Dahrén Innehåll ü Opolära kovalenta bindningar ü Polära kovalenta bindningar ü Elektronegativitet ü Paulingskalan ü Elektronformler ü
Syror, baser och ph-värde. Niklas Dahrén
 Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Valenselektroner = elektronerna i yttersta skalet visas nedan för några element ur grupperna
 Kapitel 9 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 9 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Oxidationstal. Niklas Dahrén
 Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Vätebindningar och Hydro-FON-regeln. Niklas Dahrén
 Vätebindningar och Hydro-FON-regeln Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Vätebindningar och Hydro-FON-regeln Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Dipoler och dipol-dipolbindningar Del 1. Niklas Dahrén
 Dipoler och dipoldipolbindningar Del 1 Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar
Dipoler och dipoldipolbindningar Del 1 Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar
Organiska föreningar del 5: Rita och namnge alkoholer, karboxylsyror och estrar. Niklas Dahrén
 Organiska föreningar del 5: Rita och namnge alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är organiska ämnen med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Alkoholer är organiska
Organiska föreningar del 5: Rita och namnge alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är organiska ämnen med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Alkoholer är organiska
Namnge och rita organiska föreningar - del 4 Alkoholer, karboxylsyror och estrar. Niklas Dahrén
 Namnge och rita organiska föreningar - del 4 Alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är kolväten med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Om man byter ut en av
Namnge och rita organiska föreningar - del 4 Alkoholer, karboxylsyror och estrar Niklas Dahrén Alkoholer är kolväten med en eller flera OH-grupper Alkoholer innehåller OH-grupper: Om man byter ut en av
Jonföreningar och jonbindningar del 1. Niklas Dahrén
 Jonföreningar och jonbindningar del 1 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Jonföreningar och jonbindningar del 1 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Jonföreningar och jonbindningar del 1. Niklas Dahrén
 Jonföreningar och jonbindningar del 1 Niklas Dahrén Del 1: Innehåll o Introduktion till jonföreningar och jonbindningar. o Jämförelse mellan jonföreningar och molekylföreningar. o Hur jonföreningar är
Jonföreningar och jonbindningar del 1 Niklas Dahrén Del 1: Innehåll o Introduktion till jonföreningar och jonbindningar. o Jämförelse mellan jonföreningar och molekylföreningar. o Hur jonföreningar är
Namnge och rita organiska föreningar - del 1 Introduktion till att rita och namnge organiska föreningar. Niklas Dahrén
 Namnge och rita organiska föreningar - del 1 Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi: Organisk kemi är vetenskapen
Namnge och rita organiska föreningar - del 1 Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi: Organisk kemi är vetenskapen
Namnge och rita organiska föreningar - del 5
 Namnge och rita organiska föreningar - del 5 Etrar, aldehyder, ketoner, tioler, fenoler, nitroföreningar, aminer, amider Niklas Dahrén Etrar Etrar har en etergrupp: Vid namngivning lägger man till ändelsen
Namnge och rita organiska föreningar - del 5 Etrar, aldehyder, ketoner, tioler, fenoler, nitroföreningar, aminer, amider Niklas Dahrén Etrar Etrar har en etergrupp: Vid namngivning lägger man till ändelsen
Olika kovalenta bindningar. Niklas Dahrén
 Olika kovalenta bindningar Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar (intramolekylära)
Olika kovalenta bindningar Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar (intramolekylära)
Kemisk bindning. Mål med avsnittet. Jonbindning
 Kemisk bindning Det är få grundämnen som förekommer i ren form i naturen De flesta söker en kompis med kompletterande egenskaper Detta kan ske på några olika sätt, både inom molekylen och mellan molekylen
Kemisk bindning Det är få grundämnen som förekommer i ren form i naturen De flesta söker en kompis med kompletterande egenskaper Detta kan ske på några olika sätt, både inom molekylen och mellan molekylen
Oxidation, reduktion och redoxreaktioner. Niklas Dahrén
 Oxidation, reduktion och redoxreaktioner Niklas Dahrén Vad innebär oxidation och reduktion? Oxida'on: Ämnet får e* elektronundersko* genom a* elektroner avges helt eller delvis (oxida8onstalet ökar). Reduk'on:
Oxidation, reduktion och redoxreaktioner Niklas Dahrén Vad innebär oxidation och reduktion? Oxida'on: Ämnet får e* elektronundersko* genom a* elektroner avges helt eller delvis (oxida8onstalet ökar). Reduk'on:
van der Waalsbindningar (London dispersionskrafter) Niklas Dahrén
 van der Waalsbindningar (London dispersionskrafter) Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta
van der Waalsbindningar (London dispersionskrafter) Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta
Dipoler och dipol-dipolbindningar Del 2. Niklas Dahrén
 Dipoler och dipol-dipolbindningar Del 2 Niklas Dahrén Uppgift 1: Är nedanstående molekyler dipoler? På bild a) är det ganska tydligt att vi får en negativ sida där -atomerna sitter och en positiv sida
Dipoler och dipol-dipolbindningar Del 2 Niklas Dahrén Uppgift 1: Är nedanstående molekyler dipoler? På bild a) är det ganska tydligt att vi får en negativ sida där -atomerna sitter och en positiv sida
FUNKTIONELLA GRUPPER (Ämnesklasser) Fö
 FUNKTINELLA GUPPE (Ämnesklasser) Fö 3 2010 Ex. 32-l + 2 32- + l Kloretan Etanol Generellt: -l - = - Z = generell kolvätekedja (alkyl) Z= Funktionell grupp, Ex. -l, -, -, -N2 m.fl. 1. Föreningars egenskaper
FUNKTINELLA GUPPE (Ämnesklasser) Fö 3 2010 Ex. 32-l + 2 32- + l Kloretan Etanol Generellt: -l - = - Z = generell kolvätekedja (alkyl) Z= Funktionell grupp, Ex. -l, -, -, -N2 m.fl. 1. Föreningars egenskaper
KARBOKATJON KARBANJON
 EAKTINE: Generella typer : 1. Addition Fö D-2010 (rowe Kap 17-18) 2. Substitution 3. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME Z MLYS + Z ADIKALE Z ETELYS KABKATJN + Z Vanligast + Z KABANJN
EAKTINE: Generella typer : 1. Addition Fö D-2010 (rowe Kap 17-18) 2. Substitution 3. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME Z MLYS + Z ADIKALE Z ETELYS KABKATJN + Z Vanligast + Z KABANJN
Kovalenta och polära kovalenta bindningar. Niklas Dahrén
 Kovalenta och polära kovalenta bindningar Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar
Kovalenta och polära kovalenta bindningar Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar
Organiska ämnen (2) s
 Organiska ämnen (2) s126-154 Organiska stamträdet Ämnesklasser- reaktionstyper/reaktionsvägar) Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar
Organiska ämnen (2) s126-154 Organiska stamträdet Ämnesklasser- reaktionstyper/reaktionsvägar) Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar
Kemiska reaktioner och reaktionshastigheter. Niklas Dahrén
 Kemiska reaktioner och reaktionshastigheter Niklas Dahrén Kemiska reaktioner När två partiklar (atomer, molekyler, joner etc.) kolliderar med varandra kan ibland en kemisk reaktion ske. De kolliderande
Kemiska reaktioner och reaktionshastigheter Niklas Dahrén Kemiska reaktioner När två partiklar (atomer, molekyler, joner etc.) kolliderar med varandra kan ibland en kemisk reaktion ske. De kolliderande
http://www.naturvetenskap.org/index.php?option=com_content&view=article&id=226&itemi d=236
 http://sv.wikipedia.org/wiki/petroleum http://www.naturvetenskap.org/index.php?option=com_content&view=article&id=226&itemi d=236 Alkaner C n H 2n+2 metan etan propan butan pentan hexan heptan oktan nonan
http://sv.wikipedia.org/wiki/petroleum http://www.naturvetenskap.org/index.php?option=com_content&view=article&id=226&itemi d=236 Alkaner C n H 2n+2 metan etan propan butan pentan hexan heptan oktan nonan
Periodiska systemet. Atomens delar och kemiska bindningar
 Periodiska systemet Atomens delar och kemiska bindningar Atomens delar I mitten av atomen finns atomkärnan där protonerna finns. Protoner är positivt laddade partiklar Det är antalet protoner som avgör
Periodiska systemet Atomens delar och kemiska bindningar Atomens delar I mitten av atomen finns atomkärnan där protonerna finns. Protoner är positivt laddade partiklar Det är antalet protoner som avgör
Inför provet Kolföreningarnas kemi
 Inför provet Kolföreningarnas kemi 8A $\ Pär Leijonhufvud BY: 23 oktober 2014 C När är provet? Provet blir på fredag den 24/10. Vad kommer med på provet? Några frågor på repetitionen om grundämnen och
Inför provet Kolföreningarnas kemi 8A $\ Pär Leijonhufvud BY: 23 oktober 2014 C När är provet? Provet blir på fredag den 24/10. Vad kommer med på provet? Några frågor på repetitionen om grundämnen och
Framkalla fingeravtryck med superlim. Niklas Dahrén
 Framkalla fingeravtryck med superlim Niklas Dahrén Innehållet i denna undervisningsfilm: Kemin bakom framkallning med superlim inklusive betydelsen av atomernas elektronega6vitet Vanligt superlim kan framkalla
Framkalla fingeravtryck med superlim Niklas Dahrén Innehållet i denna undervisningsfilm: Kemin bakom framkallning med superlim inklusive betydelsen av atomernas elektronega6vitet Vanligt superlim kan framkalla
Introduktion till kemisk bindning. Niklas Dahrén
 Introduktion till kemisk bindning Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Introduktion till kemisk bindning Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Organiska ämnen (2) s
 Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Dipol-dipolbindning. Niklas Dahrén
 Dipol-dipolbindning Niklas Dahrén Dipol-dipolbindning är en intermolekylär bindning Kovalent bindning Intramolekylära bindningar Polär kovalent bindning Jonbindning Kemisk bindning Dipol- dipolbindning
Dipol-dipolbindning Niklas Dahrén Dipol-dipolbindning är en intermolekylär bindning Kovalent bindning Intramolekylära bindningar Polär kovalent bindning Jonbindning Kemisk bindning Dipol- dipolbindning
2. SUBSTITUTION (Nukleofil substitution) S N 2
 . SUBSTITUTION (Nukleofil substitution) Alkylhalider är generellt reaktiva pga att den elektronegativa haliden gör att bindningen till kol polariseras, man får en dipol. Kolet blir elektrofilt (elektronfattigare
. SUBSTITUTION (Nukleofil substitution) Alkylhalider är generellt reaktiva pga att den elektronegativa haliden gör att bindningen till kol polariseras, man får en dipol. Kolet blir elektrofilt (elektronfattigare
Den elektrokemiska spänningsserien. Niklas Dahrén
 Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel Metaller fungerar ofta som reduktionsmedel: Metaller fungerar ofta som reduktionsmedel eftersom de avger sina valenselektroner
Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel Metaller fungerar ofta som reduktionsmedel: Metaller fungerar ofta som reduktionsmedel eftersom de avger sina valenselektroner
Nästan alla ämnen kan förekomma i tillstånden fast, flytande och gas. Exempelvis vatten kan finnas i flytande form, fast form (is) och gas (ånga).
 Nästan alla ämnen kan förekomma i tillstånden fast, flytande och gas. Exempelvis vatten kan finnas i flytande form, fast form (is) och gas (ånga). I alla tre formerna är vatten fortfarande samma ämne och
Nästan alla ämnen kan förekomma i tillstånden fast, flytande och gas. Exempelvis vatten kan finnas i flytande form, fast form (is) och gas (ånga). I alla tre formerna är vatten fortfarande samma ämne och
ATOMENS BYGGNAD. En atom består av : Kärna ( hela massan finns i kärnan) Positiva Protoner Neutrala Neutroner. Runt om Negativa Elektroner
 periodiska systemet ATOMENS BYGGNAD En atom består av : Kärna ( hela massan finns i kärnan) Positiva Protoner Neutrala Neutroner Runt om Negativa Elektroner En Elektron har en negativt laddning. Och elektronerna
periodiska systemet ATOMENS BYGGNAD En atom består av : Kärna ( hela massan finns i kärnan) Positiva Protoner Neutrala Neutroner Runt om Negativa Elektroner En Elektron har en negativt laddning. Och elektronerna
Vad är det som gör att vi lever? Finns det en gud som har skapat livet?
 Organisk kemi 1 Vad är det som gör att vi lever? Finns det en gud som har skapat livet? Sant: ett atomslag är viktigare än alla andra för att bygga liv vilket? Kolatomen är nödvändig för liv! Viktig byggsten
Organisk kemi 1 Vad är det som gör att vi lever? Finns det en gud som har skapat livet? Sant: ett atomslag är viktigare än alla andra för att bygga liv vilket? Kolatomen är nödvändig för liv! Viktig byggsten
Nämn ett ämne som kan omvandlas till diamant a, granit b, meteoritmineral c, kol d, grafit
 1 Vad använder man kol till? Ge exempel. Energi, diamant, 1 Vad kallas en alkohol med två OH grupper? Ge exempel. Etandiol 1 Har kan diamant vara så hårt? För att lagrerna har bindningar mellan varandra
1 Vad använder man kol till? Ge exempel. Energi, diamant, 1 Vad kallas en alkohol med två OH grupper? Ge exempel. Etandiol 1 Har kan diamant vara så hårt? För att lagrerna har bindningar mellan varandra
Den elektrokemiska spänningsserien. Niklas Dahrén
 Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel ü Metaller avger gärna sina valenselektroner till andra ämnen p.g.a. låg elektronegativitet och eftersom de metalljoner som
Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel ü Metaller avger gärna sina valenselektroner till andra ämnen p.g.a. låg elektronegativitet och eftersom de metalljoner som
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Organiska föreningar del 1: Introduktion till organiska föreningar. Niklas Dahrén
 Organiska föreningar del 1: Introduktion till organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi och organiska föreningar: Organisk kemi är vetenskapen om kolföreningarnas
Organiska föreningar del 1: Introduktion till organiska föreningar Niklas Dahrén Organisk kemi är kolföreningarnas kemi Organisk kemi och organiska föreningar: Organisk kemi är vetenskapen om kolföreningarnas
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Polära och opolära ämnen, lösningsmedel och löslighet. Niklas Dahrén
 Polära och opolära ämnen, lösningsmedel och löslighet Niklas Dahrén Polära och opolära ämnen Polära ämnen/molekyler (dipoler): Polära ämnen är (i de flesta fall) dipoler, vilket innebär att en sida/del
Polära och opolära ämnen, lösningsmedel och löslighet Niklas Dahrén Polära och opolära ämnen Polära ämnen/molekyler (dipoler): Polära ämnen är (i de flesta fall) dipoler, vilket innebär att en sida/del
Namnge och rita organiska föreningar - del 2 Alkaner, alkener, alkyner. Niklas Dahrén
 Namnge och rita organiska föreningar - del 2 Alkaner, alkener, alkyner Niklas Dahrén Alkaner Alkaner är s.k. mättade kolväten vilket betyder att de har fullt med väteatomer (och därför enbart enkelbindningar).
Namnge och rita organiska föreningar - del 2 Alkaner, alkener, alkyner Niklas Dahrén Alkaner Alkaner är s.k. mättade kolväten vilket betyder att de har fullt med väteatomer (och därför enbart enkelbindningar).
Organiska föreningar del 3: Rita och namnge alkaner, alkener och alkyner. Niklas Dahrén
 Organiska föreningar del 3: Rita och namnge alkaner, alkener och alkyner Niklas Dahrén Alkaner, alkener och alkyner Alkaner (enbart enkelbindningar) Alkener (minst 1 dubbelbindning) Alkyner (minst 1 trippelbindning)
Organiska föreningar del 3: Rita och namnge alkaner, alkener och alkyner Niklas Dahrén Alkaner, alkener och alkyner Alkaner (enbart enkelbindningar) Alkener (minst 1 dubbelbindning) Alkyner (minst 1 trippelbindning)
Exoterma och endoterma reaktioner. Niklas Dahrén
 Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reaktioner: Reaktioner som avger energi till omgivningen (ofta värmeenergi). Exempel: Alla förbränningar, inklusive
Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reaktioner: Reaktioner som avger energi till omgivningen (ofta värmeenergi). Exempel: Alla förbränningar, inklusive
Organiska föreningar del 2: Introduktion till att rita och namnge organiska föreningar. Niklas Dahrén
 Organiska föreningar del 2: Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Rita organiska föreningar Rita elektronformler och strukturformler Elektronformel: En elektronformel
Organiska föreningar del 2: Introduktion till att rita och namnge organiska föreningar Niklas Dahrén Rita organiska föreningar Rita elektronformler och strukturformler Elektronformel: En elektronformel
Joner Syror och baser 2 Salter. Kemi direkt sid. 162-175
 Joner Syror och baser 2 Salter Kemi direkt sid. 162-175 Efter att du läst sidorna ska du kunna: Joner Förklara skillnaden mellan en atom och en jon. Beskriva hur en jon bildas och ge exempel på vanliga
Joner Syror och baser 2 Salter Kemi direkt sid. 162-175 Efter att du läst sidorna ska du kunna: Joner Förklara skillnaden mellan en atom och en jon. Beskriva hur en jon bildas och ge exempel på vanliga
KEMA00. Magnus Ullner. Föreläsningsanteckningar och säkerhetskompendium kan laddas ner från
 KEMA00 Magnus Ullner Föreläsningsanteckningar och säkerhetskompendium kan laddas ner från http://www.kemi.lu.se/utbildning/grund/kema00/dold Användarnamn: Kema00 Lösenord: DeltaH0 Repetition F2 Vågfunktion
KEMA00 Magnus Ullner Föreläsningsanteckningar och säkerhetskompendium kan laddas ner från http://www.kemi.lu.se/utbildning/grund/kema00/dold Användarnamn: Kema00 Lösenord: DeltaH0 Repetition F2 Vågfunktion
Olika typer av kolväten
 INTDUKTIN TILL GANISK KEMI KABNYLGUPPSKEMI Föreläsning v16 Nina Kann lika typer av kolväten alifatiska - alkaner - alkener - alkyner aromatiska 1 Funktionella grupper alken alkohol l alkylhalid S tiol
INTDUKTIN TILL GANISK KEMI KABNYLGUPPSKEMI Föreläsning v16 Nina Kann lika typer av kolväten alifatiska - alkaner - alkener - alkyner aromatiska 1 Funktionella grupper alken alkohol l alkylhalid S tiol
Kolföreningar. Oändliga variationsmöjligheter
 Kolföreningar Oändliga variationsmöjligheter 1 Mål med avsnittet När vi är färdiga med detta avsnitt skall du kunna: Förklara följande begrepp: alkaner, alkener, alkyner, cykloalkaner, arenor, substituenter
Kolföreningar Oändliga variationsmöjligheter 1 Mål med avsnittet När vi är färdiga med detta avsnitt skall du kunna: Förklara följande begrepp: alkaner, alkener, alkyner, cykloalkaner, arenor, substituenter
ORGANISK KEMI KOLFÖRENINGARNAS KEMI
 KOLFÖRENINGARNAS KEMI KOLATOMEN ÄR EN MÅNGSIDIG BYGGSTEN Kolatomen finns i allt levande Kolatomen finns förstås också i allt material tillverkat av sånt som har varit levande t ex papper, plast och kläder
KOLFÖRENINGARNAS KEMI KOLATOMEN ÄR EN MÅNGSIDIG BYGGSTEN Kolatomen finns i allt levande Kolatomen finns förstås också i allt material tillverkat av sånt som har varit levande t ex papper, plast och kläder
Syror, baser och ph-värde. Niklas Dahrén
 Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Organiska föreningar del 6: Rita och namnge etrar, aldehyder, ketoner, tioler och disulfider. Niklas Dahrén
 Organiska föreningar del 6: Rita och namnge etrar, aldehyder, ketoner, tioler och disulfider Niklas Dahrén Etrar Etrar har en etergrupp (eterbindning): R-grupperna är två identiska eller två olika kolvätegrupper/kolvätekedjor
Organiska föreningar del 6: Rita och namnge etrar, aldehyder, ketoner, tioler och disulfider Niklas Dahrén Etrar Etrar har en etergrupp (eterbindning): R-grupperna är två identiska eller två olika kolvätegrupper/kolvätekedjor
Jonföreningar och jonbindningar del 2. Niklas Dahrén
 Jonföreningar och jonbindningar del 2 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Jonföreningar och jonbindningar del 2 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Organiska föreningar Kokpunkt och löslighet. Niklas Dahrén
 Organiska föreningar Kokpunkt och löslighet Niklas Dahrén Uppgift 1: Rangordna nedanstående ämnen efter stigande kokpunkt Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas polaritet Molekylernas
Organiska föreningar Kokpunkt och löslighet Niklas Dahrén Uppgift 1: Rangordna nedanstående ämnen efter stigande kokpunkt Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas polaritet Molekylernas
Organiska ämnen (2) s
 Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Organiska ämnen (2) s126-154 Haloalkaner kolförening med en halogen ( F, Cl, Br, I ) bundna till kolatomer är reaktiva dvs de reagerar lätt med andra ämnen. (p g a den elektronegativa halogenatomen) används
Jonbindning och metallbindning. Niklas Dahrén
 Jonbindning och metallbindning Niklas Dahrén Jonbindning Jonbindning uppstår mellan metaller och ickemetaller Natrium har en valenselektron och klor har 7 valenselektroner. Cl är bra på a< a
Jonbindning och metallbindning Niklas Dahrén Jonbindning Jonbindning uppstår mellan metaller och ickemetaller Natrium har en valenselektron och klor har 7 valenselektroner. Cl är bra på a< a
Efterarbete: LÖSNINGSFÖRSLAG TILL UPPGIFTER - O +
 Linköping 10-03-15 IFM/Kemi Linköpings universitet TFKE51/GAN-SS Efterarbete: LÖSNINGSFÖRSLAG TILL UPPGIFTER Kap. 1-4 1. N - N + - + N - + N 2. Den första resonansstrukturen är stabilast. Kom ihåg: Ju
Linköping 10-03-15 IFM/Kemi Linköpings universitet TFKE51/GAN-SS Efterarbete: LÖSNINGSFÖRSLAG TILL UPPGIFTER Kap. 1-4 1. N - N + - + N - + N 2. Den första resonansstrukturen är stabilast. Kom ihåg: Ju
1 Tror du reaktionen nedan är momentan eller ej? Motivera. 1p S 2 O H + S(s) + SO 2 (g) + H 2 O(l)
 Tentamen 1 Baskemi 2 2011.05.02 1 Tror du reaktionen nedan är momentan eller ej? Motivera. S 2 O 2-3 + 2H + S(s) + SO 2 (g) + H 2 O(l) 2 Vad är a. ett intermediär? b. en radikal? c. en amfojon 3 Vi studerar
Tentamen 1 Baskemi 2 2011.05.02 1 Tror du reaktionen nedan är momentan eller ej? Motivera. S 2 O 2-3 + 2H + S(s) + SO 2 (g) + H 2 O(l) 2 Vad är a. ett intermediär? b. en radikal? c. en amfojon 3 Vi studerar
Varför kan kolatomen bilda så många olika föreningar?
 Organisk kemi Kolföreningar finns i allt levande, i alla organismer. Med organiska ämnen menas föreningar som innehåller kol med undantag för koldioxider och vissa enkla salter, t ex karbonater. Organisk
Organisk kemi Kolföreningar finns i allt levande, i alla organismer. Med organiska ämnen menas föreningar som innehåller kol med undantag för koldioxider och vissa enkla salter, t ex karbonater. Organisk
Organisk kemi. Till provet ska du
 Organisk kemi Till provet ska du Känna till de tre vanligaste formerna av grundämnet kol och kunna berätta något om deras egenskaper Grafit atomerna sitter ihop i lösa lager, finns i t.ex. blyertspennor
Organisk kemi Till provet ska du Känna till de tre vanligaste formerna av grundämnet kol och kunna berätta något om deras egenskaper Grafit atomerna sitter ihop i lösa lager, finns i t.ex. blyertspennor
Lärare: Jimmy Pettersson. Kol och kolföreningar
 Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Syror och baser. H 2 O + HCl H 3 O + + Cl H + Vatten är en amfolyt + OH NH 3 + H 2 O NH 4. Kemiföreläsning 3 2009-10-27
 Begrepp Syror och baser Kemiföreläsning 9--7 Några vanliga syror HCl (aq) saltsyra HNO salpetersyra H SO svavelsyra H CO kolsyra H PO fosforsyra HAc ättiksyra (egentligen CH COOH, Ac är en förkortning
Begrepp Syror och baser Kemiföreläsning 9--7 Några vanliga syror HCl (aq) saltsyra HNO salpetersyra H SO svavelsyra H CO kolsyra H PO fosforsyra HAc ättiksyra (egentligen CH COOH, Ac är en förkortning
Periodiska systemet. Namn:
 Periodiska systemet Namn: Planering Vecka Aktivitet Viktigt 4 Repetition kemiska begrepp 5 Repetition kemiska begrepp + Periodiska systemet 6 Periodiska systemet + balansering av formler 7 Repetition +
Periodiska systemet Namn: Planering Vecka Aktivitet Viktigt 4 Repetition kemiska begrepp 5 Repetition kemiska begrepp + Periodiska systemet 6 Periodiska systemet + balansering av formler 7 Repetition +
Jonföreningar och jonbindningar del 2. Niklas Dahrén
 Jonföreningar och jonbindningar del 2 Niklas Dahrén Del 1: Innehåll o Introduktion till jonföreningar och jonbindningar. o Jämförelse mellan jonföreningar och molekylföreningar. o Hur jonföreningar är
Jonföreningar och jonbindningar del 2 Niklas Dahrén Del 1: Innehåll o Introduktion till jonföreningar och jonbindningar. o Jämförelse mellan jonföreningar och molekylföreningar. o Hur jonföreningar är
8.1 Se lärobokens svar och anvisningar. 8.2 Se lärobokens svar och anvisningar. 8.3 a) Skrivsättet innebär följande strukturformel
 Kapitel 8 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 8 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Atomen och periodiska systemet
 Atomen och periodiska systemet Ringa in rätt svar 1. Exempel på elementarpartiklar är: joner protoner molekyler atomer elektroner 2. Atomen i sin helhet är: elektriskt neutral positivt laddad negativt
Atomen och periodiska systemet Ringa in rätt svar 1. Exempel på elementarpartiklar är: joner protoner molekyler atomer elektroner 2. Atomen i sin helhet är: elektriskt neutral positivt laddad negativt
Kovalent och polär kovalent bindning. Niklas Dahrén
 Kovalent och polär kovalent bindning Niklas Dahrén Indelning av kemiska bindningar Intramolekylära bindningar Kovalent bindning Polär kovalent bindning Jonbindning Kemisk bindning Dipol- dipolbindning
Kovalent och polär kovalent bindning Niklas Dahrén Indelning av kemiska bindningar Intramolekylära bindningar Kovalent bindning Polär kovalent bindning Jonbindning Kemisk bindning Dipol- dipolbindning
Introduktion till det periodiska systemet. Niklas Dahrén
 Introduktion till det periodiska systemet Niklas Dahrén Det periodiska systemet Vad är det periodiska systemet?: Det periodiska systemet är en tabell där alla kända grundämnen och atomslag ingår. Hur är
Introduktion till det periodiska systemet Niklas Dahrén Det periodiska systemet Vad är det periodiska systemet?: Det periodiska systemet är en tabell där alla kända grundämnen och atomslag ingår. Hur är
REAKTIONER : A. ADDITION Crowe p REAKTIONER: Del D-2009 Generella typer : 1. Addition 2. Substitution 3. Elimination 4.
 EAKTINE: Del D-009 Generella typer : 1. Addition. Substitution. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME rowe 1.-1. MYS ETEYS KABKATJN KABANJN eaktioner innebär att kovalenta bindningar
EAKTINE: Del D-009 Generella typer : 1. Addition. Substitution. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME rowe 1.-1. MYS ETEYS KABKATJN KABANJN eaktioner innebär att kovalenta bindningar
Ättiksyra förekommer naturligt i kroppen och deltar i många biokemiska processer. Vid kroppsenligt ph är syran huvudsakligen protolyserad,
 Ester - Om man blandar alkohol och organisk syra och sedan låter de reagera med varandra bildas en ny organisk syra som kallas en Ester. De vanligaste estrarna är fetter och de består av trevärd alkohol,
Ester - Om man blandar alkohol och organisk syra och sedan låter de reagera med varandra bildas en ny organisk syra som kallas en Ester. De vanligaste estrarna är fetter och de består av trevärd alkohol,
Namngivning av organiska föreningar del 2. Niklas Dahrén
 Namngivning av organiska föreningar del 2 Niklas Dahrén Namnge alkoholer 4 3 2 1 1. Ta reda på stamkolvätet: Leta upp molekylens längsta kolkedja 3ll vilken hydroxylgruppen är bunden. Antalet kolatomer
Namngivning av organiska föreningar del 2 Niklas Dahrén Namnge alkoholer 4 3 2 1 1. Ta reda på stamkolvätet: Leta upp molekylens längsta kolkedja 3ll vilken hydroxylgruppen är bunden. Antalet kolatomer
Föreläsning 11. Alkener II Kapitel 11 F11
 Föreläsning 11 Alkener II Kapitel 11 1) Introduktion 2) Addition av elektrofila reagens 3) ydrogenering 4) ydroborering 5) Radikaladdition 6) Polymerisering 7) xidation 1. Introduktion ur gör man cancermedicinen
Föreläsning 11 Alkener II Kapitel 11 1) Introduktion 2) Addition av elektrofila reagens 3) ydrogenering 4) ydroborering 5) Radikaladdition 6) Polymerisering 7) xidation 1. Introduktion ur gör man cancermedicinen
Kemi A. Kap 9: kolföreningar
 Kemi A Kap 9: kolföreningar Organisk kemi kol och kolföreningar Kolföreningar är mycket viktiga ämnen Kol finns i allt levande men också i saker som inte är levande, ex: Bensin Alkohol Kläder Smink Det
Kemi A Kap 9: kolföreningar Organisk kemi kol och kolföreningar Kolföreningar är mycket viktiga ämnen Kol finns i allt levande men också i saker som inte är levande, ex: Bensin Alkohol Kläder Smink Det
Organiska föreningar del 10: Vad bestämmer kokpunkten hos en förening? Niklas Dahrén
 Organiska föreningar del 10: Vad bestämmer kokpunkten hos en förening? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet
Organiska föreningar del 10: Vad bestämmer kokpunkten hos en förening? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet
Kap. 8. Bindning: Generella begrepp
 Kap. 8. Bindning: Generella begrepp 8.1 Kemiska bindningar: olika typer Bindningslängd: avståndet mellan atomer vid energiminimum Bindningsenergi: Energivinsten vid minimum jämfört med fria atomerna, energin
Kap. 8. Bindning: Generella begrepp 8.1 Kemiska bindningar: olika typer Bindningslängd: avståndet mellan atomer vid energiminimum Bindningsenergi: Energivinsten vid minimum jämfört med fria atomerna, energin
Konc. i början 0.1M 0 0. Ändring -x +x +x. Konc. i jämvikt 0,10-x +x +x
 Lösning till tentamen 2013-02-28 för Grundläggande kemi 10 hp Sid 1(5) 1. CH 3 COO - (aq) + H 2 O (l) CH 3 COOH ( (aq) + OH - (aq) Konc. i början 0.1M 0 0 Ändring -x +x +x Konc. i jämvikt 0,10-x +x +x
Lösning till tentamen 2013-02-28 för Grundläggande kemi 10 hp Sid 1(5) 1. CH 3 COO - (aq) + H 2 O (l) CH 3 COOH ( (aq) + OH - (aq) Konc. i början 0.1M 0 0 Ändring -x +x +x Konc. i jämvikt 0,10-x +x +x
Vad bestämmer ett ämnes kokpunkt? Niklas Dahrén
 Vad bestämmer ett ämnes kokpunkt? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet ü Molekylernas storlek har betydelse
Vad bestämmer ett ämnes kokpunkt? Niklas Dahrén Kokpunkten hos ett ämne bestäms av 3 faktorer: Molekylernas storlek Molekylernas geometriska form Molekylernas polaritet ü Molekylernas storlek har betydelse
Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken Enzymer: Metabolism: , , ,257,
 Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken Enzymer: 223-230 Metabolism: 230-232, 243-249,252-253,257,259-261 Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande) Katabola
Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken Enzymer: 223-230 Metabolism: 230-232, 243-249,252-253,257,259-261 Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande) Katabola
Cellens metabolism (ämnesomsättning)
 Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken: Enzymer: s223-230 Metabolism: s230-232, 243-261 (prio pdf) samf. s264, (262-263) Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande)
Cellens metabolism (ämnesomsättning) Kap8 Sidor i boken: Enzymer: s223-230 Metabolism: s230-232, 243-261 (prio pdf) samf. s264, (262-263) Cellens ämnesomsättning (metabolism) Anabola reaktioner (uppbyggande)
Instuderingsuppgifter
 Instuderingsuppgifter Litterarum radices amarae, fructus dulces Kemisk bindning Uppgiftena är indelade i tre olika kategorier efter svårighetsgrad. bservera dock att det inte går att sätta betyg på en
Instuderingsuppgifter Litterarum radices amarae, fructus dulces Kemisk bindning Uppgiftena är indelade i tre olika kategorier efter svårighetsgrad. bservera dock att det inte går att sätta betyg på en
Exoterma och endoterma reaktioner. Niklas Dahrén
 Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reak+oner: Reak%oner som avger energi %ll omgivningen (o1a värmeenergi). Exempel: Alla förbränningar, inklusive
Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reak+oner: Reak%oner som avger energi %ll omgivningen (o1a värmeenergi). Exempel: Alla förbränningar, inklusive
Van der Waalsbindning (Londonkrafter) Niklas Dahrén
 Van der Waalsbindning (Londonkrafter) Niklas Dahrén Van der Waalsbindning är en intermolekylär bindning Kovalent bindning Intramolekylära bindningar Polär kovalent bindning Jonbindning Kemisk bindning
Van der Waalsbindning (Londonkrafter) Niklas Dahrén Van der Waalsbindning är en intermolekylär bindning Kovalent bindning Intramolekylära bindningar Polär kovalent bindning Jonbindning Kemisk bindning
Organiska föreningar del 7: Rita och namnge fenoler, nitroföreningar och aminer. Niklas Dahrén
 Organiska föreningar del 7: Rita och namnge fenoler, nitroföreningar och aminer Niklas Dahrén Fenoler Fenoler är föreningar som har minst en OH-grupp (hydroxylgrupp/hydroxigrupp) bunden direkt till en
Organiska föreningar del 7: Rita och namnge fenoler, nitroföreningar och aminer Niklas Dahrén Fenoler Fenoler är föreningar som har minst en OH-grupp (hydroxylgrupp/hydroxigrupp) bunden direkt till en
KEMI 3. Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma.
 KEMI 3 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al. : Kemi 3 - Reaktioner och energi + MAOL!!! Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma. Kursinnehåll
KEMI 3 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al. : Kemi 3 - Reaktioner och energi + MAOL!!! Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma. Kursinnehåll
Syror, baser och jonföreningar
 Syror, baser och jonföreningar Joner är laddade byggstenar I en atom är antalet elektroner det samma som antalet protoner i kärnan. En jon är en atom som lämnat ifrån sig eller tagit upp en eller flera
Syror, baser och jonföreningar Joner är laddade byggstenar I en atom är antalet elektroner det samma som antalet protoner i kärnan. En jon är en atom som lämnat ifrån sig eller tagit upp en eller flera
C Dessa atomer är kolets isotoper. Isotoper har: olika A samma Z samma antal e likadana kemiska egenskaper
 2.1 Materiens uppbyggnad Materia 2.2 Atomen t. ex. en litiumatom (Li) omogent ämne eterogen blandning t. ex. en suspension Rent ämne omogen blandning grundämne kan inte sönderdelas kemisk Ca Ag kemisk
2.1 Materiens uppbyggnad Materia 2.2 Atomen t. ex. en litiumatom (Li) omogent ämne eterogen blandning t. ex. en suspension Rent ämne omogen blandning grundämne kan inte sönderdelas kemisk Ca Ag kemisk
Hjälpmedel: räknare, formelsamling, periodiska system. Spänningsserien: K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au. Kemi A
 Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
Analysera gifter, droger och andra ämnen med enkla metoder. Niklas Dahrén
 Analysera gifter, droger och andra ämnen med enkla metoder Niklas Dahrén De flesta ämnen inkl. gifter och droger är antingen molekyl- eller jonföreningar 1. Molekylföreningar: o Molekylföreningar är ämnen
Analysera gifter, droger och andra ämnen med enkla metoder Niklas Dahrén De flesta ämnen inkl. gifter och droger är antingen molekyl- eller jonföreningar 1. Molekylföreningar: o Molekylföreningar är ämnen
Här växer människor och kunskap
 Syror och baser 2 - Elektron, -1 - Protoner, +1 Natrium (Na) Valenselektron 1 st Elektronskal 3st 3 Natrium Neon 11 10 Alla ämnen vill ha fullt ytterskal. Så Na försöker efterlikna Ne. 4 Denna elektron
Syror och baser 2 - Elektron, -1 - Protoner, +1 Natrium (Na) Valenselektron 1 st Elektronskal 3st 3 Natrium Neon 11 10 Alla ämnen vill ha fullt ytterskal. Så Na försöker efterlikna Ne. 4 Denna elektron
Allmän kemi. Läromålen. Molekylers geometri. Viktigt i kap 10. 10.1 VSEPR-modellen. 10.1 Molekylers geometri
 Läromålen Allmän kemi Kap 10 Kemisk bindning 2 Del 1 Molekylers geometri Studenten skall efter att ha genomfört delkurs 1 kunna: n redogöra för atomers och molekylers uppbyggnad och geometri på basal nivå
Läromålen Allmän kemi Kap 10 Kemisk bindning 2 Del 1 Molekylers geometri Studenten skall efter att ha genomfört delkurs 1 kunna: n redogöra för atomers och molekylers uppbyggnad och geometri på basal nivå
Molekyler och molekylmodeller. En modell av strukturen hos is, fruset vatten
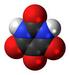 Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Skriv reaktionsformler som beskriver vad som bör hända för följande blandningar: lösning blandas med 50 ml 0,05 H 3 PO 4 lösning.
 Lösning till tentamen 95 för Grundläggande kemi hp Sid (5). a) Perklorsyra är en stark syra varför pk a värde saknas i SI Chem Data. Behövs inte heller för phberäkning eftersom HClO 4 H O ClO 4 H 3 O går
Lösning till tentamen 95 för Grundläggande kemi hp Sid (5). a) Perklorsyra är en stark syra varför pk a värde saknas i SI Chem Data. Behövs inte heller för phberäkning eftersom HClO 4 H O ClO 4 H 3 O går
Isomerer. Samma molekylformel men olika strukturformel. Detta kallas isomeri. Båda har molekylformeln C 4 H 10
 Isomerer Samma molekylformel men olika strukturformel. Detta kallas isomeri Båda har molekylformeln C 4 10 rganiska syror Alla organiska syror innehåller en karboxylgrupp (C) C = m man oxiderar en alkohol
Isomerer Samma molekylformel men olika strukturformel. Detta kallas isomeri Båda har molekylformeln C 4 10 rganiska syror Alla organiska syror innehåller en karboxylgrupp (C) C = m man oxiderar en alkohol
Kap 2 Reaktionshastighet. Reaktionshastighet - mängd bildat eller förbrukat ämne per tidsenhet
 Kap 2 Reaktionshastighet Reaktionshastighet - mängd bildat eller förbrukat ämne per tidsenhet Vilka faktorer påverkar reaktionshastigheten? Exempel: zink i saltsyra Zink i saltsyra: https://www.youtube.com/watch?v=x0qzv92smbm
Kap 2 Reaktionshastighet Reaktionshastighet - mängd bildat eller förbrukat ämne per tidsenhet Vilka faktorer påverkar reaktionshastigheten? Exempel: zink i saltsyra Zink i saltsyra: https://www.youtube.com/watch?v=x0qzv92smbm
Namnge och rita organiska föreningar - del 3 Halogenalkaner, cykliska kolväten och arener. Niklas Dahrén
 Namnge och rita organiska föreningar - del 3 Halogenalkaner, cykliska kolväten och arener Niklas Dahrén Halogenalkaner (alkylhalogenider) En halogenalkan är en alkan där en eller flera av väteatomerna
Namnge och rita organiska föreningar - del 3 Halogenalkaner, cykliska kolväten och arener Niklas Dahrén Halogenalkaner (alkylhalogenider) En halogenalkan är en alkan där en eller flera av väteatomerna
Organisk kemi Kolföreningarnas kemi
 Organisk kemi Kolföreningarnas kemi Organisk kemi kallas också för kolföreningarnas kemi Växter och djur är uppbyggda av kolföreningar. Fram till början av 1800-talet trodde kemisterna att det var omöjligt
Organisk kemi Kolföreningarnas kemi Organisk kemi kallas också för kolföreningarnas kemi Växter och djur är uppbyggda av kolföreningar. Fram till början av 1800-talet trodde kemisterna att det var omöjligt
KEMI 1 MÄNNISKANS KEMI OCH KEMIN I LIVSMILJÖ
 KEMI 1 MÄNNISKANS KEMI OCH KEMIN I LIVSMILJÖ Vad är KEMI? Ordet kemi kommer från grekiskans chemeia =blandning Allt som finns omkring oss och som påverkar oss handlar om KEMI. Vad du tycker DU att kemi
KEMI 1 MÄNNISKANS KEMI OCH KEMIN I LIVSMILJÖ Vad är KEMI? Ordet kemi kommer från grekiskans chemeia =blandning Allt som finns omkring oss och som påverkar oss handlar om KEMI. Vad du tycker DU att kemi
2. Transitions state theory för att jämföra relativa reaktiviteten hos olika substrat
 2. Transitions state theory för att jämföra relativa reaktiviteten hos olika substrat Ex: baskatalyserad hydrolys av en ester jmf substraten p-nitrofenylacetat och fenylacetat OH - attackerar karbonylkolet
2. Transitions state theory för att jämföra relativa reaktiviteten hos olika substrat Ex: baskatalyserad hydrolys av en ester jmf substraten p-nitrofenylacetat och fenylacetat OH - attackerar karbonylkolet
