KEMI 3. Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma.
|
|
|
- Gunnel Martinsson
- för 9 år sedan
- Visningar:
Transkript
1 KEMI 3 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al. : Kemi 3 - Reaktioner och energi + MAOL!!! Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma. Kursinnehåll 1. Kemiska reaktioner 2. Reaktionsformler 3. Reaktionstyper och mekanismer 4. Gaser 5. Energiförändringar i kemiska reaktioner HEMFÖRHÖR: inlämning mån PROVFÖRBEREDELSE: ons PROV: tors Titel: heinä 27-15:10 (Sida 1 av 34)
2 1. KEMISKA REAKTIONER 1.1 Hur sker en kemisk reaktion? lyckad kollision (rätt orientering och tillräckligt med energi) elastisk kollision (fel orientering och/eller för litet energi) 2. REAKTIONSFORMLER 2.1 Att uttrycka en reaktion med symboler utgångsämnen reaktionsprodukter C 4 H 8 (g) + O 2 (g) CO 2 (g) + H 2 O (l) koefficient index aggregationstillstånd Ex. 1: Skriv den balanserade reaktionsformeln för den reaktion där etanol reagerar med natriummetall och bildar vätgas samt natriumetoxid CH 3 CH 2 ONa. Titel: feb 8-7:14 AM (Sida 2 av 34)
3 2.2 En reaktionsformel är ett recept Ex. 2: Skriv den balanserade reaktionsformeln för den reaktion där järn(iii)oxid reduceras av vätgas till järnmetall. Vatten bildas som biprodukt. Ex. 3: n = c = m M n V järn? I exemplet ovan, hur mycket järn(iii)oxid behövs om man vill producera 1,5 ton Ex. 4 : 60 ml av en 0,090 M bariumhydroxidlösning? Hur mycket bariumsulfat fälls ut då 45 ml av en 0,102 M svavelsyralösning tillsätts i Titel: heinä 27-15:23 (Sida 3 av 34)
4 2.3 Utbyte utbyte (%) = verkligt utbyte teoretiskt utbyte Ex. 5: Vid framställning av kaliumaluminiumsulfat dodekahydrat, KAl(SO 4 ) H 2 O, användes 2,541 g aluminiumfolie. Reaktionsprodukten vägde 27,252 g. Beräkna syntesens utbyte i procent då det antas att foliet består av ren aluminium och andra utgångsämnen fanns det tillräckligt av. Titel: heinä 27-15:28 (Sida 4 av 34)
5 2.4 Reaktioner som sker parallellt Ex. 6: En blandning av kalciumkarbonat och natriumkarbonat väger 2,600 g. Då blandningen reagerar med salpetersyra bildas det vatten, natrium- och kalciumnitrat samt 1,105 g koldioxid. Hur mycket av vardera karbonaten innehöll blandningen ursprungligen? Titel: heinä 27-16:29 (Sida 5 av 34)
6 Ex. 7: Svavelsyra framställs industriellt genom att svavel förbränns till svaveldioxid, vilket i sin tur oxideras till svaveltrioxid som sedan upplöses i vatten. Hur mycket svavelsyra kan maximalt erhållas då det finns 155 kg svavel och 155 kg syrgas att tillgå för totalprocessen? Vatten finns det tillräckligt av. Titel: heinä 28-11:22 (Sida 6 av 34)
7 3. REAKTIONSTYPER OCH MEKANISMER 3.2 Var sker reaktionen? Utfällningsreaktioner handlar om joner som dras till varandra och bildar jonbindningar = kristallbildning. Dessa bindningar bygger upp ett kristallint jongitter. bildas. I reaktioner mellan molekylföreningar bryts kovalenta bindningarna i utgångsämnen och nya kovalenta bildningar + Hos organiska föreningar "den svaga länken" funktionella gruppen. (bindningen/bindningarna som lätt bryts) finns vid den komponenter. Vanligtvis handlar kemiska reaktioner mellan molekyler om elektronrika (t.ex. fria elektronpar) och elektronfattiga + Titel: elo 12-13:28 (Sida 7 av 34)
8 3.3 Protonöverföringsreaktioner Reaktionen mellan en bas och vatten: + Reaktionen mellan en syra och vatten: + När man ställer upp reaktionsmekanismer använder man olika sorts pilar. reaktionsriktning rörelsen av ett e lektronpar rörelsen av en elektron reversibel jämviktsreaktion Titel: feb 16-10:37 AM (Sida 8 av 34)
9 3.4 Substitutions- eller ersättningsreaktioner I en substitutionsreaktion ersätter en atom/atomgrupp en annan atom/atomgrupp i en molekyl. En atom eller en funktionell grupp byts ut. [ OH [ I alkyleringsreaktioner ersätts väteatomer med alkylgrupper. Titel: feb 16-10:35 AM (Sida 9 av 34)
10 + HNO 3 H 2 SO 4 + [H + ] kat. Titel: feb 16-11:03 AM (Sida 10 av 34)
11 3.5 Addition till en karbonylgrupp: reaktioner med aldehyder och ketoner Kom ihåg: primär alkohol aldehyd karboxylsyra sekundär alkohol keton NaBH 4 CH 3 OH + Titel: feb 16-12:03 PM (Sida 11 av 34)
12 3.6 Reaktioner med kol-kol -dubbelbindningar + Typiska additionsreaktioner: med H 2 med HBr / HI / HCl med H 2 O + Markovnikovs regel : väteatomen binds till den kolatom vid dubbelbindningen som redan tidigare innehåller mera väte CH 3 OH sur harts Titel: feb 16-12:10 PM (Sida 12 av 34)
13 Additionspolymerisation : additionsreaktionen pågår i en kedjereaktion där upp till hundratusentals monomerer med dubbelbindningar reagerar och bildar långa polymerer. n. En elimineringsreaktion är den omvända reaktionen till en additionsreaktion. + [ OH [ - H 2 SO 4 uppv. additionsreaktion substitutionsreaktion elimineringsreaktion Titel: feb 16-12:27 PM (Sida 13 av 34)
14 3.7 Kondensations- och hydrolysreaktioner alkohol + alkohol eter + H 2 SO O C syra + alkohol ester + H 2 SO 4 syra + amin amid + > 100 O C Titel: feb 16-12:37 PM (Sida 14 av 34)
15 I en hydrolysreaktion sker den omvända reaktionen till en kondensationsreaktion. + NaOH (aq) Reaktionen ovan, förtvålning, används vid tvåltillverkning. Hydrolys av amider sker långsamt: + HCl (aq) upph. Titel: feb 16-12:45 PM (Sida 15 av 34)
16 3.8 Kolföreningars oxidations- och reduktionsreaktioner En organisk förening oxideras då antalet syreatomer ökar eller antalet väteatomer minskar ( reduktion : tvärtom). KMnO 4 eller K 2 Cr 2 O 7 [H + ] KMnO 4 eller K 2 Cr 2 O 7 [H + ] NaBH 4 LiAlH 4 LiAlH 4 Titel: feb 16-2:33 PM (Sida 16 av 34)
17 4. GASER 4.1 Förbränning tillräckligt hög temperatur brinnande material syre O 2 fullständig förbränning: propanol + syre ofullständig förbränning: oktan + syre Titel: heinä 27-16:47 (Sida 17 av 34)
18 4.2 Gaser kväve 78 % syre 20 % koldioxid och andra gaser 0,03 % inerta gaser (Ar) 0,97 % vattenånga 1 % idealgas: punktformade partiklar med ingen växelverkan emellan reell gas: attraktiva krafter mellan partiklarna som har volym Boyles lag: volymen av en gas är omvänt proportionell mot dess tryck V (dm 3 ) p (kpa) Titel: heinä 27-16:56 (Sida 18 av 34)
19 volym, ml tryck, bar Temperatur, o C Temperatur (K) Charles lag / Gay-Lussacs lag: dess temperatur volymen och trycket av en gas är direkt proportionella mot enhetsomvandlingar: pascal, Pa = N/m 2 = N m -2 atm = Pa bar = 100 kpa torr = 1/760 atm = mm Hg K = t( o C) + 273,15 t( o C) = T(K) - 273,15 Avogadros lag: vid konstant tryck och temperatur har en viss substansmängd av vilken gas som helst en viss volym V 1 n = 1 V 2 n 2 n = V V m gasernas allmänna tillståndsekvation: pv = nrt 22,41 dm 3 /mol i NTP: 1 atm 273,15 K Titel: elo 12-14:05 (Sida 19 av 34)
20 Ex. 8: 3,0 dm 3 av svaveldioxid reagerar med 2,0 dm 3 syre enligt reaktionen nedan: 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) konstanta. Hur stor volym av svaveltrioxid bildas? Temperatur- och tryckförhållanden hålls Ex. 9: Trinitrotoluen (TNT) är ett av de vanligaste sprängämnena. Vid explosion sönderfaller det till kolmonoxid, väte, kväve och kol: C 7 H 5 N 3 O 6 (s) CO (g) + H 2 (g) + N 2 (g) + C (s) a) Bestäm koefficienterna för reaktionslikheten. b) Hur många gram TNT exploderade, då det bildades 2,76 liter gasfasprodukter (NTP)? Titel: heinä 27-17:39 (Sida 20 av 34)
21 Ex. 10 : Förbrukningen av bensin i en bil är 7,9 l/100 km. Hur stor volym av koldioxid (25 o C; 1,0 bar) bildas vid körning från Helsingfors till Lahtis (110 km), då det antas att bränslet genomgår fullständig förbränning och att bensin består av ren oktan vars densitet är 0,71 kg/l. Ex. 10 : Då metan hettas upp i närvaro av svavel bildas det koldisulfid och divätesulfid: CH 4 (g) + S 8 (s) CS 2 (g) + H 2 S(g) a) Balansera reaktionslikheten. b) Hur många gram divätesulfid kan maximalt erhållas, då 3,50 g metan och 22,0 g svavel reagerar med varandra i ett 1,00 liters slutet kärl? c) Vad var gasblandningens densitet i kärlet efte r reaktionen? Titel: elo 16-13:14 (Sida 21 av 34)
22 5. ENERGIFÖRÄNDRINGAR I KEMISKA REAKTIONER 5.1 Reaktioner och energi utgångsämnen produkter E 1 bindningarna bryts ENERGI ENERGI nya bindingar bildas E 2 Då E 2 < E 1, reaktionen är endoterm. Då E 1 < E 2, reaktionen är exoterm. 5.2 Energityper i kemiska reaktioner värmeenergi strålningsenergi ljus kemisk energi elektrisk energi mekanisk energi Titel: elo 12-14:28 (Sida 22 av 34)
23 5.4 Entalpiförändrigen säger hur mycket värme som binds eller frigörs C (s) + O 2 (g) produkter Energi utgångsämnen Energi produkter CO 2 (g) utgångsämnen För att reaktionen är exoterm frigörs det energi, vilket leder till att produkterna innehåller mindre potentiell kemisk energi än utgångsämnena. Entalpiförändring = H förändring i värmeinnehåll i en kalorimetrisk mätning vid konstant tryck enhet: kj eller kj/mol termometer omrörning antändning q = mc t vatten syre H = q n prov (torrt) Här antas det att: 1) lösningens specifik värmekapacitet = den för vatten reaktanter isolering 2) lösningens massa = den för vatten Titel: elo 16-13:25 (Sida 23 av 34)
24 Exoterma reaktioner: ΔH < 0 Endoterma reaktioner: ΔH > 0 aktiveringsenergi E a energi entalpiförändring reaktionsförlopp aggregationstillstånd (s, l, g) substansmängd temperatur H utgångsämnenas och reaktanterna kemiska egenskaper tryck Referenstillstånd: 298,15 K 101,325 kpa H o Ex. 11: 2 CO (g) + O 2 (g) 2 CO 2 (g) ΔH o = -566 kj Bestäm den energi som frigörs eller binds då 6,5 dm 3 koldioxid (NTP) sönderdelas till kolmonoxid och syre. Titel: heinä 28-11:10 (Sida 24 av 34)
25 5.7 Bränslen Ex. 12: Bränslen kan jämföras med varandra på många sätt, t.ex. enligt den energimängd som frigörs eller den föroreningsmängd som skapas. Visa vilket av de följande bränslen frigör per gram mest a) energi, b) koldioxid. ΔH c (C, graf.) = 394 kj/mol, ΔH c (H 2, g) = 286 kj/mol och ΔH c (C 4 H 10, g) = kj/mol Titel: feb 1-10:25 AM (Sida 25 av 34)
26 5.5 Bildningsentalpi Bildningsentalpin, H f o, är reaktionsentalpin där 1 mol av en bestämd substans i grundtillstånd bildas från sina grundämnen i grundtillstånd. Ex. 13: Na 2 CO 3 (s). Skriv reaktionslikheten för H f o av Ju mer negativ bildningsentalpin är, desto stabilare är föreningen (OBS! Endast då man jämför föreningar som består av samma grundämnen!) reaktionsentalpi: Bildningsentalpierna kan användas för att beräkna H = summa( H f o produkter ) - summa ( H f o reaktanter ) Ex. 14: Använd bildningsentalpierna för att beräkna reaktionsentalpin för 2 C 2 H 2 (g) + 5 O 2 (g) 4 CO 2 (g) + 2 H 2 O (l) Titel: heinä 28-11:17 (Sida 26 av 34)
27 5.5 Bindningsenergi Bindningsenergin är den energi som behövs för att bryta ned 1 mol av en kovalent bindning i gasfas. bindning. Ju större bindningsenergi, desto starkare Ex. 15: Använd bindningsenergierna för att beräkna reaktionsentalpin för 2 C 2 H 2 (g) + 5 O 2 (g) 4 CO 2 (g) + 2 H 2 O (l) 5.3 Energin hos byggstenarna i ett ämne Molekyler med inre spänningar är instabila och reaktiva då C-C bindningen lätt brister. momentant. Konformationer med inre spänningar har större energiinnehåll och förekommer därför endast Titel: elo 18-12:01 (Sida 27 av 34)
28 5.8 Reaktionshastighet koncentration momentan hastighet vid t o produkter utgångsämnen t o tid reaktionshastighet = c t Faktorer som påverkar reaktionshastigheten: temperatur finfördelning (fasta ämnen) eller reaktionsyta koncentration (även volym och tryck i gasfas) katalysator / inhibitor orientering KOLLISIONSTEORI Titel: heinä 28-11:51 (Sida 28 av 34)
29 aktiverat komplex i övergångstillstånd a) b) c) En katalysator höjer reaktionshastigheten genom att sänka aktiveringsenergin för reaktionen. Detta för att katalysatorn erbjuder ett alternativt reaktions-förlopp för reaktionen. homogen katalys: H + (aq) HCOOH (l) + CH 3 CH 2 OH (l) HCOOCH 2 CH 3 (l) + H 2 O (l) heterogen katalys: Fe N 2 (g) + 3 H 2 (g) 2 NH 3 (g) Ni C 2 H 4 (g) + H 2 (g) C 2 H 6 (g) Titel: heinä 28-11:45 (Sida 29 av 34)
30 Titel: syys 10-12:06 (Sida 30 av 34)
31 Titel: heinä 28-14:46 (Sida 31 av 34)
32 Titel: heinä 28-15:13 (Sida 32 av 34)
33 Titel: elo 16-13:57 (Sida 33 av 34)
34 Titel: sep 10-13:22 (Sida 34 av 34)
Aggregationstillstånd
 4. Gaser Aggregationstillstånd 4.1 Förbränning En kemisk reaktion mellan ett ämne och syre. Fullständig förbränning (om syre finns i överskott), t.ex. etanol + syre C2H6OH (l) +3O2 (g) 3H2O (g) + 2CO2
4. Gaser Aggregationstillstånd 4.1 Förbränning En kemisk reaktion mellan ett ämne och syre. Fullständig förbränning (om syre finns i överskott), t.ex. etanol + syre C2H6OH (l) +3O2 (g) 3H2O (g) + 2CO2
Alla papper, även kladdpapper lämnas tillbaka.
 Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Övningar Homogena Jämvikter
 Övningar Homogena Jämvikter 1 Tiocyanatjoner, SCN -, och järn(iii)joner, Fe 3+, reagerar med varandra enligt formeln SCN - + Fe 3+ FeSCN + färglös svagt gul röd Vid ett försök sätter man en liten mängd
Övningar Homogena Jämvikter 1 Tiocyanatjoner, SCN -, och järn(iii)joner, Fe 3+, reagerar med varandra enligt formeln SCN - + Fe 3+ FeSCN + färglös svagt gul röd Vid ett försök sätter man en liten mängd
Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer. Niklas Dahrén
 Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Substitutionsreaktioner 2. Additionsreaktioner 3. Eliminationsreaktioner 4. Kondensationsreaktioner
Kemiska reaktioner: Olika reaktionstyper och reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Substitutionsreaktioner 2. Additionsreaktioner 3. Eliminationsreaktioner 4. Kondensationsreaktioner
Rättningstiden är i normalfall 15 arbetsdagar, annars är det detta datum som gäller:
 Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2016-10-27 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2016-10-27 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
4. Kemisk jämvikt när motsatta reaktioner balanserar varandra
 4. Kemisk jämvikt när motsatta reaktioner balanserar varandra 4.1. Skriv fullständiga formler för följande reaktioner som kan gå i båda riktningarna (alla ämnen är i gasform): a) Kolmonoxid + kvävedioxid
4. Kemisk jämvikt när motsatta reaktioner balanserar varandra 4.1. Skriv fullständiga formler för följande reaktioner som kan gå i båda riktningarna (alla ämnen är i gasform): a) Kolmonoxid + kvävedioxid
Tentamen i KEMI del A för basåret GU (NBAK10) kl Institutionen för kemi, Göteborgs universitet
 Tentamen i KEMI del A för basåret GU (NBAK10) 2007-02-15 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: Väg och Vatten-huset Hjälpmedel: Räknare Ansvarig lärare: Leif Holmlid 772
Tentamen i KEMI del A för basåret GU (NBAK10) 2007-02-15 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: Väg och Vatten-huset Hjälpmedel: Räknare Ansvarig lärare: Leif Holmlid 772
Stökiometri I Massa-Molmassa Substansmängd
 Stökiometri I Massa-Molmassa Substansmängd 1 1 Bestäm atommassan för a) Syre b) Barium c) N 2 d) 8 S 2 2 Bestäm formelmassan för: a) Natriumklorid b) Aluminiumoxid c) Ag 2 SO 4 d) ZnHg(SCN) 4 e) UO 2 (NO
Stökiometri I Massa-Molmassa Substansmängd 1 1 Bestäm atommassan för a) Syre b) Barium c) N 2 d) 8 S 2 2 Bestäm formelmassan för: a) Natriumklorid b) Aluminiumoxid c) Ag 2 SO 4 d) ZnHg(SCN) 4 e) UO 2 (NO
Reaktionsmekanismer. Kap 6
 Reaktionsmekanismer Kap 6 Karbokatjoner är elektrofila intermediärer Innehåll Kvalitativa resonemang hur och varför kemiska reaktioner sker Exempel på energiomsättningar vid olika slags organiska reaktioner.
Reaktionsmekanismer Kap 6 Karbokatjoner är elektrofila intermediärer Innehåll Kvalitativa resonemang hur och varför kemiska reaktioner sker Exempel på energiomsättningar vid olika slags organiska reaktioner.
Då du skall lösa kemiska problem av den typ som kommer nedan är det praktiskt att ha en lösningsmetod som man kan använda till alla problem.
 Kapitel 2 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 2 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Stökiometri IV Blandade Övningar
 Stökiometri IV Blandade Övningar 1) 1 Man blandar 25,0 cm 3 silvernitratlösning, c = 0,100 M, med 50,0 cm 3 bariumkloridlösning c = 0,0240 M. Hur stor är: [Ag + ] i blandningen? [NO 3- ] i blandningen?
Stökiometri IV Blandade Övningar 1) 1 Man blandar 25,0 cm 3 silvernitratlösning, c = 0,100 M, med 50,0 cm 3 bariumkloridlösning c = 0,0240 M. Hur stor är: [Ag + ] i blandningen? [NO 3- ] i blandningen?
Kapitel 6. Termokemi. Kapaciteten att utföra arbete eller producera värme. Storhet: E = F s (kraft sträcka) = P t (effekt tid) Enhet: J = Nm = Ws
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206.
 1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206. a) Antalet protoner är., antalet neutroner är. och antalet elektroner. hos atomer av isotopen. b) Vilken partikel bildas om en
1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206. a) Antalet protoner är., antalet neutroner är. och antalet elektroner. hos atomer av isotopen. b) Vilken partikel bildas om en
Reaktionsmekanismer. Kap 6
 Reaktionsmekanismer Kap 6 Rep. Kemiska reaktioner https://laughingsquid.com/a-ted-ed-animation-explaining-howall-sorts-of-different-chemical-reactions-are-triggered/ Karbokatjoner är elektrofila intermediärer
Reaktionsmekanismer Kap 6 Rep. Kemiska reaktioner https://laughingsquid.com/a-ted-ed-animation-explaining-howall-sorts-of-different-chemical-reactions-are-triggered/ Karbokatjoner är elektrofila intermediärer
Kapitel 6. Termokemi
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Kapitel 6. Termokemi. Kapaciteten att utföra arbete eller producera värme. Storhet: E = F s (kraft sträcka) = P t (effekt tid) Enhet: J = Nm = Ws
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
KEMI 5. KURSBEDÖMNING: Kursprov: 8 uppgifter varav eleven löser max. 7 Tre av åtta uppgifter är från SE max. poäng: 42 gräns för godkänd: 12
 KEMI 5 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al.: Kemi 5 Reaktioner och jämvikt All kursinfo (t. ex. lektionsanteckningar, eventuella övningsprov...) finns på Matteus.
KEMI 5 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al.: Kemi 5 Reaktioner och jämvikt All kursinfo (t. ex. lektionsanteckningar, eventuella övningsprov...) finns på Matteus.
Kapitel 6. Termokemi
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Exoterma och endoterma reaktioner. Niklas Dahrén
 Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reaktioner: Reaktioner som avger energi till omgivningen (ofta värmeenergi). Exempel: Alla förbränningar, inklusive
Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reaktioner: Reaktioner som avger energi till omgivningen (ofta värmeenergi). Exempel: Alla förbränningar, inklusive
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2
 UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
Gaser: ett av tre aggregationstillstånd hos ämnen. Flytande fas Gasfas
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Tentamen i Allmän kemi 7,5 hp 5 november 2014 ( poäng)
 1 (6) Tentamen i Allmän kemi 7,5 hp 5 november 2014 (50 + 40 poäng) Tentamen består av två delar, räkne- respektive teoridel: Del 1: Teoridel. Max poäng: 50 p För godkänt: 28 p Del 2: Räknedel. Max poäng:
1 (6) Tentamen i Allmän kemi 7,5 hp 5 november 2014 (50 + 40 poäng) Tentamen består av två delar, räkne- respektive teoridel: Del 1: Teoridel. Max poäng: 50 p För godkänt: 28 p Del 2: Räknedel. Max poäng:
Kapitel 5. Gaser. är kompressibel, är helt löslig i andra gaser, upptar jämt fördelat volymen av en behållare, och utövar tryck på sin omgivning.
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 5. 5.3 Den ideala gaslagen 5.4 5.5 Daltons lag för partialtryck 5.6 5.7 Effusion och Diffusion 5.8 5.9 Egenskaper hos några verkliga gaser 5.10 Atmosfärens kemi Copyright
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 5. 5.3 Den ideala gaslagen 5.4 5.5 Daltons lag för partialtryck 5.6 5.7 Effusion och Diffusion 5.8 5.9 Egenskaper hos några verkliga gaser 5.10 Atmosfärens kemi Copyright
Kemi och energi. Exoterma och endoterma reaktioner
 Kemi och energi Exoterma och endoterma reaktioner Energiprincipen Energi kan inte skapas eller förstöras bara omvandlas mellan olika energiformer (energiprincipen) Ex på energiformer: strålningsenergi
Kemi och energi Exoterma och endoterma reaktioner Energiprincipen Energi kan inte skapas eller förstöras bara omvandlas mellan olika energiformer (energiprincipen) Ex på energiformer: strålningsenergi
Gaser: ett av tre aggregationstillstånd hos ämnen. Flytande fas Gasfas
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Gaser: ett av tre aggregationstillstånd hos ämnen. Fast fas Flytande fas Gasfas
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Repetition F4. Lunds universitet / Naturvetenskapliga fakulteten / Kemiska institutionen / KEMA00
 Repetition F4 VSEPR-modellen elektronarrangemang och geometrisk form Polära (dipoler) och opolära molekyler Valensbindningsteori σ-binding och π-bindning hybridisering Molekylorbitalteori F6 Gaser Materien
Repetition F4 VSEPR-modellen elektronarrangemang och geometrisk form Polära (dipoler) och opolära molekyler Valensbindningsteori σ-binding och π-bindning hybridisering Molekylorbitalteori F6 Gaser Materien
Kap 2 Reaktionshastighet. Reaktionshastighet - mängd bildat eller förbrukat ämne per tidsenhet
 Kap 2 Reaktionshastighet Reaktionshastighet - mängd bildat eller förbrukat ämne per tidsenhet Vilka faktorer påverkar reaktionshastigheten? Exempel: zink i saltsyra Zink i saltsyra: https://www.youtube.com/watch?v=x0qzv92smbm
Kap 2 Reaktionshastighet Reaktionshastighet - mängd bildat eller förbrukat ämne per tidsenhet Vilka faktorer påverkar reaktionshastigheten? Exempel: zink i saltsyra Zink i saltsyra: https://www.youtube.com/watch?v=x0qzv92smbm
Kemiska reaktioner och reaktionshastigheter. Niklas Dahrén
 Kemiska reaktioner och reaktionshastigheter Niklas Dahrén Kemiska reaktioner När två partiklar (atomer, molekyler, joner etc.) kolliderar med varandra kan ibland en kemisk reaktion ske. De kolliderande
Kemiska reaktioner och reaktionshastigheter Niklas Dahrén Kemiska reaktioner När två partiklar (atomer, molekyler, joner etc.) kolliderar med varandra kan ibland en kemisk reaktion ske. De kolliderande
Rättningstiden är i normalfall tre veckor, annars är det detta datum som gäller: Efter överenskommelse med studenterna är rättningstiden fem veckor.
 Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Kap 6: Termokemi. Energi:
 Kap 6: Termokemi Energi: Definition: Kapacitet att utföra arbete eller producera värme Termodynamikens första huvudsats: Energi är oförstörbar kan omvandlas från en form till en annan men kan ej förstöras.
Kap 6: Termokemi Energi: Definition: Kapacitet att utföra arbete eller producera värme Termodynamikens första huvudsats: Energi är oförstörbar kan omvandlas från en form till en annan men kan ej förstöras.
Kapitel 3. Stökiometri
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter
Jämviktsuppgifter. 2. Kolmonoxid och vattenånga bildar koldioxid och väte enligt följande reaktionsformel:
 Jämviktsuppgifter Litterarum radices amarae, fructus dulces 1. Vid upphettning sönderdelas etan till eten och väte. Vid en viss temperatur har följande jämvikt ställt in sig i ett slutet kärl. C 2 H 6
Jämviktsuppgifter Litterarum radices amarae, fructus dulces 1. Vid upphettning sönderdelas etan till eten och väte. Vid en viss temperatur har följande jämvikt ställt in sig i ett slutet kärl. C 2 H 6
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Innehåll Kapitel 3 Stökiometri 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 3.7 3.8 Kemiska reaktionslikheter 3.9 3.10 3.11 Copyright Cengage Learning.
Kapitel 3 Innehåll Kapitel 3 Stökiometri 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 3.7 3.8 Kemiska reaktionslikheter 3.9 3.10 3.11 Copyright Cengage Learning.
Energiuppgifter. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi vid en exoterm reaktion? O (s) H 2.
 Energiuppgifter Litterarum radices amarae, fructus dulces 1. Ange ett svenskt ord som är synonymt med termen entalpi. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi
Energiuppgifter Litterarum radices amarae, fructus dulces 1. Ange ett svenskt ord som är synonymt med termen entalpi. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi
KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16
 KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Lärare: Jimmy Pettersson. Kol och kolföreningar
 Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
NKEA02, 9KE211, 9KE311, 9KE , kl Ansvariga lärare: Helena Herbertsson , Lars Ojamäe
 IFM/Kemi Tentamen i Allmän kemi 1 NKEA02, 9KE211, 9KE311, 9KE351 2011-09-19, kl. 14 00-19 00 Ansvariga lärare: Helena Herbertsson 285605, 070-5669944 Lars Ojamäe 281380 50% rätt ger säkert godkänt! Hjälpmedel:
IFM/Kemi Tentamen i Allmän kemi 1 NKEA02, 9KE211, 9KE311, 9KE351 2011-09-19, kl. 14 00-19 00 Ansvariga lärare: Helena Herbertsson 285605, 070-5669944 Lars Ojamäe 281380 50% rätt ger säkert godkänt! Hjälpmedel:
REPETITIONSKURS I KEMI LÖSNINGAR TILL ÖVNINGSUPPGIFTER
 KEMI REPETITIONSKURS I LÖSNINGAR TILL ÖVNINGSUPPGIFTER Magnus Ehinger Fullständiga lösningar till beräkningsuppgifterna. Kemins grunder.10 Vi antar att vi har 10 000 Li-atomer. Av dessa är då 74 st 6 Li
KEMI REPETITIONSKURS I LÖSNINGAR TILL ÖVNINGSUPPGIFTER Magnus Ehinger Fullständiga lösningar till beräkningsuppgifterna. Kemins grunder.10 Vi antar att vi har 10 000 Li-atomer. Av dessa är då 74 st 6 Li
Hjälpmedel: räknare, formelsamling, periodiska system. Spänningsserien: K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au. Kemi A
 Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
(tetrakloroauratjon) (2)
 UTTAGIG TILL KEMIOLYMPIADE 2015 TEORETISKT PROV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. jälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
UTTAGIG TILL KEMIOLYMPIADE 2015 TEORETISKT PROV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. jälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
Allmän kemi. Läromålen. Viktigt i kap 17. Kap 17 Termodynamik. Studenten skall efter att ha genomfört delkurs 1 kunna:
 Allmän kemi Kap 17 Termodynamik Läromålen Studenten skall efter att ha genomfört delkurs 1 kunna: n - använda de termodynamiska begreppen entalpi, entropi och Gibbs fria energi samt redogöra för energiomvandlingar
Allmän kemi Kap 17 Termodynamik Läromålen Studenten skall efter att ha genomfört delkurs 1 kunna: n - använda de termodynamiska begreppen entalpi, entropi och Gibbs fria energi samt redogöra för energiomvandlingar
Syror, baser och ph-värde. Niklas Dahrén
 Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
TK061B Tillämpad bioteknik, antagna 2012, Inga hjälpmedel är tillåtna. 100 poäng
 Organisk kemi Provmoment: Ladokkod: Tentamen ges för: TK061B Tillämpad bioteknik, antagna 2012, 2013 7,5 högskolepoäng TentamensKod: Tentamensdatum: 11 Januari, 2016 Tid: 9:00-13:00 jälpmedel: Inga hjälpmedel
Organisk kemi Provmoment: Ladokkod: Tentamen ges för: TK061B Tillämpad bioteknik, antagna 2012, 2013 7,5 högskolepoäng TentamensKod: Tentamensdatum: 11 Januari, 2016 Tid: 9:00-13:00 jälpmedel: Inga hjälpmedel
Valenselektroner = elektronerna i yttersta skalet visas nedan för några element ur grupperna
 Kapitel 9 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 9 är hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Repetitionsuppgifter. gymnasiekemi
 Repetitionsuppgifter i gymnasiekemi Att börja med: A 2, 5, 7 B 2, 4, 5, 14, 15, 16, 19 C 2, 7, 8 D 1,2, 3 Om det är för lätt: B 9, 10, 12, 13, 21 C 3, 6 D 4, 5 Boel Lindegård 2006 Reviderad 2012 A. Atomernas
Repetitionsuppgifter i gymnasiekemi Att börja med: A 2, 5, 7 B 2, 4, 5, 14, 15, 16, 19 C 2, 7, 8 D 1,2, 3 Om det är för lätt: B 9, 10, 12, 13, 21 C 3, 6 D 4, 5 Boel Lindegård 2006 Reviderad 2012 A. Atomernas
4 Beräkna massprocenthalten koppar i kopparsulfat femhydrat Hur många gram natriumklorid måste man väga upp för att det ska bli 2 mol?
 Stökiometri VI 1 Hur många atomer finns det i en molekyl H 2SO 4? 1 2 Skriv kemiska formeln för jonföreningar: 2 a) Kalciumoxid b) Kaliumjodid c) Strontiumhydroxid d) Aluminiumsulfit 3 Ange eller beräkna:
Stökiometri VI 1 Hur många atomer finns det i en molekyl H 2SO 4? 1 2 Skriv kemiska formeln för jonföreningar: 2 a) Kalciumoxid b) Kaliumjodid c) Strontiumhydroxid d) Aluminiumsulfit 3 Ange eller beräkna:
Prov i kemi kurs A. Atomens byggnad och periodiska systemet 2(7) Namn:... Hjälpmedel: räknedosa + tabellsamling
 Prov i kemi kurs A Namn:... Hjälpmedel: räknedosa + tabellsamling Lösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och
Prov i kemi kurs A Namn:... Hjälpmedel: räknedosa + tabellsamling Lösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och
Föreläsning 4. Koncentrationer, reaktionsformler, ämnens aggregationstillstånd och intermolekylära bindningar.
 Föreläsning 4. Koncentrationer, reaktionsformler, ämnens aggregationstillstånd och intermolekylära bindningar. Koncentrationer i vätskelösningar. Kap. 12.2+3. Lösning = lösningsmedel + löst(a) ämne(n)
Föreläsning 4. Koncentrationer, reaktionsformler, ämnens aggregationstillstånd och intermolekylära bindningar. Koncentrationer i vätskelösningar. Kap. 12.2+3. Lösning = lösningsmedel + löst(a) ämne(n)
Blandade Övningar Stökiometri och Gaslagen 1
 Blandade Övningar Stökiometri och Gaslagen 1 1) 1 Då man upphettar 6,820 g zinkspat, som är ett mineral som innehåller zinkkarbonat, ZnCO 3, bildas 1,182 g CO 2. Hur många % rent ZnCO 3 innehåller mineralet?
Blandade Övningar Stökiometri och Gaslagen 1 1) 1 Då man upphettar 6,820 g zinkspat, som är ett mineral som innehåller zinkkarbonat, ZnCO 3, bildas 1,182 g CO 2. Hur många % rent ZnCO 3 innehåller mineralet?
Stökiometri Molberäkningar
 Stökiometri Molberäkninar Eftersom atomer och ekyler är så fruktansvärt små är det liksom inen ide att räkna de. Men nu faller det si så, att om man använder si av periodiska systemet och rundämnenas så
Stökiometri Molberäkninar Eftersom atomer och ekyler är så fruktansvärt små är det liksom inen ide att räkna de. Men nu faller det si så, att om man använder si av periodiska systemet och rundämnenas så
Namnge och rita organiska föreningar - del 5
 Namnge och rita organiska föreningar - del 5 Etrar, aldehyder, ketoner, tioler, fenoler, nitroföreningar, aminer, amider Niklas Dahrén Etrar Etrar har en etergrupp: Vid namngivning lägger man till ändelsen
Namnge och rita organiska föreningar - del 5 Etrar, aldehyder, ketoner, tioler, fenoler, nitroföreningar, aminer, amider Niklas Dahrén Etrar Etrar har en etergrupp: Vid namngivning lägger man till ändelsen
KEM A02 Allmän- och oorganisk kemi. KINETIK 2(2) A: Kap
 KEM A02 Allmän- och oorganisk kemi KINETIK 2(2) A: Kap 14.6 14.16 14.6 Andra ordningens kinetik Typiskt för bimolekylära reaktioner EXEMPEL: 2 HI H 2 + I 2 v = k [HI] 2 Typiskt för 2:a ordningens reaktion:
KEM A02 Allmän- och oorganisk kemi KINETIK 2(2) A: Kap 14.6 14.16 14.6 Andra ordningens kinetik Typiskt för bimolekylära reaktioner EXEMPEL: 2 HI H 2 + I 2 v = k [HI] 2 Typiskt för 2:a ordningens reaktion:
Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5.
 Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5. Modellsvar Räknefel och slarvfel, - ½ p. Halvpoäng upphöjas inte. Till exempel om totalpoäng är 2½ p. slutpoäng
Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5. Modellsvar Räknefel och slarvfel, - ½ p. Halvpoäng upphöjas inte. Till exempel om totalpoäng är 2½ p. slutpoäng
Tentamen i Kemisk Termodynamik kl 14-19
 Tentamen i Kemisk Termodynamik 2011-06-09 kl 14-19 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer på varje blad! Alla
Tentamen i Kemisk Termodynamik 2011-06-09 kl 14-19 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer på varje blad! Alla
KARBOKATJON KARBANJON
 EAKTINE: Generella typer : 1. Addition Fö D-2010 (rowe Kap 17-18) 2. Substitution 3. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME Z MLYS + Z ADIKALE Z ETELYS KABKATJN + Z Vanligast + Z KABANJN
EAKTINE: Generella typer : 1. Addition Fö D-2010 (rowe Kap 17-18) 2. Substitution 3. Elimination 4. Kondensation EAKTINSINTEMEDIÄE och MEKANISME Z MLYS + Z ADIKALE Z ETELYS KABKATJN + Z Vanligast + Z KABANJN
Repetition F9. Lunds universitet / Naturvetenskapliga fakulteten / Kemiska institutionen / KEMA00
 Repetition F9 Process (reversibel, irreversibel) Entropi o statistisk termodynamik: S = k ln W o klassisk termodynamik: S = q rev / T o låg S: ordning, få mikrotillstånd o hög S: oordning, många mikrotillstånd
Repetition F9 Process (reversibel, irreversibel) Entropi o statistisk termodynamik: S = k ln W o klassisk termodynamik: S = q rev / T o låg S: ordning, få mikrotillstånd o hög S: oordning, många mikrotillstånd
Reaktionsmekanismer. Niklas Dahrén
 Reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Subs'tu'onsreak'oner 2. Addi'onsreak'oner 3. Elimina'onsreak'oner 4. Syra-bas-reak'oner 5. Kondensa'onsreak'oner 6. Hydrolysreak'oner 7. Redoxreak'oner
Reaktionsmekanismer Niklas Dahrén 7 olika reaktionstyper 1. Subs'tu'onsreak'oner 2. Addi'onsreak'oner 3. Elimina'onsreak'oner 4. Syra-bas-reak'oner 5. Kondensa'onsreak'oner 6. Hydrolysreak'oner 7. Redoxreak'oner
Energibalans och temperatur. Oorganisk Kemi I Föreläsning
 Energibalans och temperatur Oorganisk Kemi I Föreläsning 5 20.4.2010 Innehåll Värme i förbränning Energibalans Värmeöverföring Temperaturer Termer och begrepp Standardbildningsentalpi Värmevärde Effektivt
Energibalans och temperatur Oorganisk Kemi I Föreläsning 5 20.4.2010 Innehåll Värme i förbränning Energibalans Värmeöverföring Temperaturer Termer och begrepp Standardbildningsentalpi Värmevärde Effektivt
Repetition F7. Lunds universitet / Naturvetenskapliga fakulteten / Kemiska institutionen / KEMA00
 Repetition F7 Intermolekylär växelverkan kortväga repulsion elektrostatisk växelverkan (attraktion och repulsion): jon-jon (långväga), jon-dipol, dipol-dipol medelvärdad attraktion (van der Waals): roterande
Repetition F7 Intermolekylär växelverkan kortväga repulsion elektrostatisk växelverkan (attraktion och repulsion): jon-jon (långväga), jon-dipol, dipol-dipol medelvärdad attraktion (van der Waals): roterande
Innehåll. Energibalans och temperatur. Termer och begrepp. Mål. Hur mycket energi. Förbränning av fasta bränslen
 Innehåll balans och temperatur Oorganisk Kemi I Föreläsning 4 14.4.2011 Förbränningsvärme balans Värmeöverföring Temperaturer Termer och begrepp Standardbildningsentalpi Värmevärde Effektivt och kalorimetriskt
Innehåll balans och temperatur Oorganisk Kemi I Föreläsning 4 14.4.2011 Förbränningsvärme balans Värmeöverföring Temperaturer Termer och begrepp Standardbildningsentalpi Värmevärde Effektivt och kalorimetriskt
Kemisk reaktionskinetik. (Kap ej i kurs.)
 Kemisk reaktionskinetik. (Kap. 14.1-4. 14.5-6 ej i kurs.) Reaktionshastighet kemisk jämvikt. Reaktionshastighet avgör tiden att komma till jämvikt. Ett system i jämvikt reagerar inte. Jämviktsläge avgörs
Kemisk reaktionskinetik. (Kap. 14.1-4. 14.5-6 ej i kurs.) Reaktionshastighet kemisk jämvikt. Reaktionshastighet avgör tiden att komma till jämvikt. Ett system i jämvikt reagerar inte. Jämviktsläge avgörs
Molekyler och molekylmodeller. En modell av strukturen hos is, fruset vatten
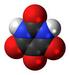 Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1. Läkemedel
 UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1 Provdatum: torsdagen den 15 november Provtid: 120 minuter Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning görs på svarsblanketten som
UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1 Provdatum: torsdagen den 15 november Provtid: 120 minuter Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning görs på svarsblanketten som
Avancerade kemiska beräkningar del 3. Niklas Dahrén
 Avancerade kemiska beräkningar del 3 Niklas Dahrén Uppgifter som jag går igenom i den här filmen: 1. Hur stor substansmängd O 2 behövs för fullständig förbränning av 2 mol metan CH 4? 2. Du ska framställa
Avancerade kemiska beräkningar del 3 Niklas Dahrén Uppgifter som jag går igenom i den här filmen: 1. Hur stor substansmängd O 2 behövs för fullständig förbränning av 2 mol metan CH 4? 2. Du ska framställa
Materia och aggregationsformer. Niklas Dahrén
 Materia och aggregationsformer Niklas Dahrén Vad är materia? Materia är egentligen allting som vi ser omkring oss! Allt som är uppbyggt av atomer kallas för materia. Materia kännetecknas av att det har
Materia och aggregationsformer Niklas Dahrén Vad är materia? Materia är egentligen allting som vi ser omkring oss! Allt som är uppbyggt av atomer kallas för materia. Materia kännetecknas av att det har
Viktigt! Glöm inte att skriva Tentamenskod på alla blad du lämnar in.
 Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2015-10-30 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2015-10-30 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Innehåll. Energibalans och temperatur. Termer och begrepp. Mål. Squad task 1. Förbränning av fasta bränslen
 Innehåll balans och temperatur Oorganisk Kemi I Föreläsning 5 20.4.2010 Värme i förbränning balans Värmeöverföring Temperaturer Termer och begrepp Standardbildningsentalpi Värmevärde Effektivt och kalorimetriskt
Innehåll balans och temperatur Oorganisk Kemi I Föreläsning 5 20.4.2010 Värme i förbränning balans Värmeöverföring Temperaturer Termer och begrepp Standardbildningsentalpi Värmevärde Effektivt och kalorimetriskt
Allmän Kemi 2 (NKEA04 m.fl.)
 Allmän Kemi (NKEA4 m.fl.) --4 Uppgift a) K c [NO] 4 [H O] 6 /([NH ] 4 [O ] 5 ) eller K p P(NO) 4 P(H O) 6 /(P(NH ) 4 P(O ) 5 ) Om kärlets volym minskar ökar trycket och då förskjuts jämvikten åt den sida
Allmän Kemi (NKEA4 m.fl.) --4 Uppgift a) K c [NO] 4 [H O] 6 /([NH ] 4 [O ] 5 ) eller K p P(NO) 4 P(H O) 6 /(P(NH ) 4 P(O ) 5 ) Om kärlets volym minskar ökar trycket och då förskjuts jämvikten åt den sida
Tentamen i Allmän kemi NKEA02, 9KE211, 9KE351. 2010-09-20, kl. 14 00-19 00
 IFM/Kemi Tentamen i Allmän kemi NKEA02, 9KE211, 9KE351 2010-09-20, kl. 14 00-19 00 Ansvariga lärare: Helena Herbertsson 285605, 070-5669944 Lars Ojamäe 281380 50% rätt ger säkert godkänt! Hjälpmedel: Miniräknare
IFM/Kemi Tentamen i Allmän kemi NKEA02, 9KE211, 9KE351 2010-09-20, kl. 14 00-19 00 Ansvariga lärare: Helena Herbertsson 285605, 070-5669944 Lars Ojamäe 281380 50% rätt ger säkert godkänt! Hjälpmedel: Miniräknare
F1 F d un t amen l a s KEMA00
 F1 F d t l F1 Fundamentals KEMA00 A Materia och Energi SI-enheter Mätosäkerhet Potentiell energi Ep = mgh Coulombs lag q1 q2 4 r E p 0 B Grundämnen och atomer Atomnummer z (antal atomer i kärnan) Masstal
F1 F d t l F1 Fundamentals KEMA00 A Materia och Energi SI-enheter Mätosäkerhet Potentiell energi Ep = mgh Coulombs lag q1 q2 4 r E p 0 B Grundämnen och atomer Atomnummer z (antal atomer i kärnan) Masstal
Tentamen i Kemi för miljö- och hälsoskyddsområdet: Allmän kemi och jämviktslära
 Umeå Universitet Kodnummer... Allmän kemi för miljö- och hälsoskyddsområdet Lärare: Olle Nygren och Roger Lindahl Tentamen i Kemi för miljö- och hälsoskyddsområdet: Allmän kemi och jämviktslära 29 november
Umeå Universitet Kodnummer... Allmän kemi för miljö- och hälsoskyddsområdet Lärare: Olle Nygren och Roger Lindahl Tentamen i Kemi för miljö- och hälsoskyddsområdet: Allmän kemi och jämviktslära 29 november
Kapitel Kapitel 12. Repetition inför delförhör 2. Kemisk kinetik. 2BrNO 2NO + Br 2
 Kapitel 1-18 Repetition inför delförhör Kapitel 1 Innehåll Kapitel 1 Kemisk kinetik Redoxjämvikter Kapitel 1 Definition Kapitel 1 Området inom kemi som berör reaktionshastigheter Kemisk kinetik Kapitel
Kapitel 1-18 Repetition inför delförhör Kapitel 1 Innehåll Kapitel 1 Kemisk kinetik Redoxjämvikter Kapitel 1 Definition Kapitel 1 Området inom kemi som berör reaktionshastigheter Kemisk kinetik Kapitel
Oxidationstal. Niklas Dahrén
 Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Tentamen i Organisk kemi 28/5 2013,
 Tentamen i rganisk kemi 28/5 2013, 8.00-13.00. Tentamen består av 9 frågor. Varje fråga ger maximalt 10p. Följande betygsgränser gäller: Lycka till! /Ulf -fak LT (T) G 40-59p 3 40-54p VG 60-90p 4 55-74p
Tentamen i rganisk kemi 28/5 2013, 8.00-13.00. Tentamen består av 9 frågor. Varje fråga ger maximalt 10p. Följande betygsgränser gäller: Lycka till! /Ulf -fak LT (T) G 40-59p 3 40-54p VG 60-90p 4 55-74p
Vilken av följande partiklar är det starkaste reduktionsmedlet? b) Båda syralösningarna har samma ph vid ekvivalenspunkten.
 1 (2/0/0) Beräkna trycket i en behållare med volymen 4,50 dm 3, temperaturen 34,5 ºC och som innehåller 5,83 g vätgas samt 11,66 g syrgas. (Gaserna betraktas som ideala gaser.) 2 (1/0/0) Två lika stora
1 (2/0/0) Beräkna trycket i en behållare med volymen 4,50 dm 3, temperaturen 34,5 ºC och som innehåller 5,83 g vätgas samt 11,66 g syrgas. (Gaserna betraktas som ideala gaser.) 2 (1/0/0) Två lika stora
4.1 Se lärobokens svar och anvisningar. 4.2 För reaktionen 2ICl(g) I 2 (g) + Cl 2 (g) gäller att. För reaktionen I 2 (g) + Cl 2 (g) 2ICl(g) gäller 2
 apitel 4 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
apitel 4 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Materien. Vad är materia? Atomer. Grundämnen. Molekyler
 Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Kapitel Repetition inför delförhör 2
 Kapitel 12-18 Repetition inför delförhör 2 Kapitel 1 Innehåll Kapitel 12 Kapitel 13 Kapitel 14 Kapitel 15 Kapitel 16 Kapitel 17 Kapitel 18 Kemisk kinetik Kemisk jämvikt Syror och baser Syra-basjämvikter
Kapitel 12-18 Repetition inför delförhör 2 Kapitel 1 Innehåll Kapitel 12 Kapitel 13 Kapitel 14 Kapitel 15 Kapitel 16 Kapitel 17 Kapitel 18 Kemisk kinetik Kemisk jämvikt Syror och baser Syra-basjämvikter
Tentamen i Kemisk Termodynamik 2011-01-19 kl 13-18
 Tentamen i Kemisk Termodynamik 2011-01-19 kl 13-18 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer på varje blad! Alla
Tentamen i Kemisk Termodynamik 2011-01-19 kl 13-18 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer på varje blad! Alla
Svar: Halten koksalt är 16,7% uttryckt i massprocent
 Kapitel 6 6.1 Se lärobokens svar och anvisningar. 6.3 Se lärobokens svar och anvisningar. 6. Se lärobokens svar och anvisningar. 6.5 Kalcium reagerar med vatten på samma sätt som natrium. Utgångsämnena
Kapitel 6 6.1 Se lärobokens svar och anvisningar. 6.3 Se lärobokens svar och anvisningar. 6. Se lärobokens svar och anvisningar. 6.5 Kalcium reagerar med vatten på samma sätt som natrium. Utgångsämnena
Arbetshäfte kemi 9. Namn: Det här arbetshäftet innehåller dina anteckningar från genomgångarna i kemi. KEMI 9
 Arbetshäfte kemi 9 Namn: Det här arbetshäftet innehåller dina anteckningar från genomgångarna i kemi.!1 Repetition Grundämne eller kemisk förening 1. Rita och beskriv skillnaden mellan ett grundämne och
Arbetshäfte kemi 9 Namn: Det här arbetshäftet innehåller dina anteckningar från genomgångarna i kemi.!1 Repetition Grundämne eller kemisk förening 1. Rita och beskriv skillnaden mellan ett grundämne och
Exoterma och endoterma reaktioner. Niklas Dahrén
 Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reak+oner: Reak%oner som avger energi %ll omgivningen (o1a värmeenergi). Exempel: Alla förbränningar, inklusive
Exoterma och endoterma reaktioner Niklas Dahrén Exoterma och endoterma reaktioner Exoterma reak+oner: Reak%oner som avger energi %ll omgivningen (o1a värmeenergi). Exempel: Alla förbränningar, inklusive
Energi, katalys och biosyntes (Alberts kap. 3)
 Energi, katalys och biosyntes (Alberts kap. 3) Introduktion En cell eller en organism måste syntetisera beståndsdelar, hålla koll på vilka signaler som kommer utifrån, och reparera skador som uppkommit.
Energi, katalys och biosyntes (Alberts kap. 3) Introduktion En cell eller en organism måste syntetisera beståndsdelar, hålla koll på vilka signaler som kommer utifrån, och reparera skador som uppkommit.
Övningar Stökiometri och Gaslagen
 Övningar Stökiometri och Gaslagen 1 1 På baksidan av ett paket med Liljeholmens Stearinljus står berättat att Lars Johan Hierta, grundaren av Aftonbladet, i London år 1837 kom i kontakt med ett nytt ljus,
Övningar Stökiometri och Gaslagen 1 1 På baksidan av ett paket med Liljeholmens Stearinljus står berättat att Lars Johan Hierta, grundaren av Aftonbladet, i London år 1837 kom i kontakt med ett nytt ljus,
Kemisk bindning. Mål med avsnittet. Jonbindning
 Kemisk bindning Det är få grundämnen som förekommer i ren form i naturen De flesta söker en kompis med kompletterande egenskaper Detta kan ske på några olika sätt, både inom molekylen och mellan molekylen
Kemisk bindning Det är få grundämnen som förekommer i ren form i naturen De flesta söker en kompis med kompletterande egenskaper Detta kan ske på några olika sätt, både inom molekylen och mellan molekylen
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
Mendelevs periodiska system
 Mendelevs periodiska system Notera luckorna som betecknar element som var okända vid den tiden. Med hjälp av systement lyckades Mendelev förutsäga dessa grundämnens egenskaper. Vårt nuvarande periodiska
Mendelevs periodiska system Notera luckorna som betecknar element som var okända vid den tiden. Med hjälp av systement lyckades Mendelev förutsäga dessa grundämnens egenskaper. Vårt nuvarande periodiska
Introduktion till kemisk bindning. Niklas Dahrén
 Introduktion till kemisk bindning Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Introduktion till kemisk bindning Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
TESTA DINA KUNSKAPER I KEMI
 TESTA DINA KUNSKAPER I KEMI INFÖR STUDIERNA VID STOCKHOLMS UNIVERSITET TESTA DINA FÖRKUNSKAPER. 1 För att kunna koncentrera dig på det väsentliga i undervisningen måste du ha din gymnasiekemi aktuell.
TESTA DINA KUNSKAPER I KEMI INFÖR STUDIERNA VID STOCKHOLMS UNIVERSITET TESTA DINA FÖRKUNSKAPER. 1 För att kunna koncentrera dig på det väsentliga i undervisningen måste du ha din gymnasiekemi aktuell.
Kapitel 4. Reaktioner i vattenlösningar
 Kapitel 4 Reaktioner i vattenlösningar Kapitel 4 Innehåll 4.1 Vatten, ett lösningsmedel 4.2 Starka och svaga elektrolyter 4.3 Lösningskoncentrationer 4.4 Olika slags kemiska reaktioner 4.5 Fällningsreaktioner
Kapitel 4 Reaktioner i vattenlösningar Kapitel 4 Innehåll 4.1 Vatten, ett lösningsmedel 4.2 Starka och svaga elektrolyter 4.3 Lösningskoncentrationer 4.4 Olika slags kemiska reaktioner 4.5 Fällningsreaktioner
KEMI 1 MÄNNISKANS KEMI OCH KEMIN I LIVSMILJÖ
 KEMI 1 MÄNNISKANS KEMI OCH KEMIN I LIVSMILJÖ Vad är KEMI? Ordet kemi kommer från grekiskans chemeia =blandning Allt som finns omkring oss och som påverkar oss handlar om KEMI. Vad du tycker DU att kemi
KEMI 1 MÄNNISKANS KEMI OCH KEMIN I LIVSMILJÖ Vad är KEMI? Ordet kemi kommer från grekiskans chemeia =blandning Allt som finns omkring oss och som påverkar oss handlar om KEMI. Vad du tycker DU att kemi
Olika typer av kolväten
 INTDUKTIN TILL GANISK KEMI KABNYLGUPPSKEMI Föreläsning v16 Nina Kann lika typer av kolväten alifatiska - alkaner - alkener - alkyner aromatiska 1 Funktionella grupper alken alkohol l alkylhalid S tiol
INTDUKTIN TILL GANISK KEMI KABNYLGUPPSKEMI Föreläsning v16 Nina Kann lika typer av kolväten alifatiska - alkaner - alkener - alkyner aromatiska 1 Funktionella grupper alken alkohol l alkylhalid S tiol
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
