Uppgifternas delmoment bedöms med noggrannheten 1/3 poäng och slutsumman avrundas till närmsta heltalspoäng.
|
|
|
- Martin Ekström
- för 9 år sedan
- Visningar:
Transkript
1 PROVET I KEMI BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier som används i den slutgiltiga bedömningen. I kemin är målet för bedömningen förståelsen och tillämpningen av den kemiska kunskapen enligt grunderna för gymnasiets läroplan. Vid bedömningen beaktas även de färdigheter med vilka man tillägnat sig experimentell kunskap och förmåga att behandla den. Till sådan kunskap hör till exempel planering av experiment, säker hantering av arbetsredskap och reagens, presentation och tolkning av resultat och förmåga att dra slutsatser samt tillämpa dem. Vid bedömningen av uppgifterna i kemi läggs vikten vid ett framställningssätt som betonar läroämnets karaktär samt precision i begreppen och språkbruket. Reaktionsformlerna uppställs utan oxidationstal med minsta möjliga heltalskoefficienter och med aggregationstillstånden angivna. I organiska reaktionslikheter används strukturformler men aggregationstillstånd krävs inte. Olika sätt att skriva strukturformler godkänns. I beräkningsuppgifter bör storhetsekvationer och formler användas på ett sätt som visar att examinanden förstått uppgiften rätt samt i sin lösning tillämpat korrekt princip eller lag. I svaret framgår entydigt hur man når slutresultatet. Om uppgiften kräver mellanresultat presenteras de med enheter och med tillräcklig noggrannhet. Slutresultaten ges med enheter och med den noggrannhet som utgångsvärdena kräver, och slutsatserna motiveras. Graferna uppritas omsorgsfullt och tillräckligt stora. Rekommendationen är att man använder millimeterpaper, vilket dock inte är obligatoriskt. I grafen anges namn och enheter för axlarna. Till mätpunkterna anpassas en vederbörlig rät linje eller en kontinuerlig böjd linje. I grafen anges sådana punkter som är väsentliga för slutsatserna, till exempel ekvivalenspunkten för en titrerkurva eller den tangent som används när man beräknar en hastighet i ett givet ögonblick. I essäsvar och förklarande svar kompletteras texten vanligen med reaktionsformler, ekvationer eller teckningar. Ett gott svar är disponerat och innehållsmässigt konsekvent. Det är viktigare att betona centrala saker än att presentera spridda detaljer. För högsta poäng i jokeruppgifterna förutsätts förmåga att tillämpa kunskapsfakta också i vidare sammanhang. I kemiprovet är alla funktionsräknare, grafiska räknare och symbolräknare tillåtna. Lösningar som gjorts med en symbolräknare godkänns förutsatt att det i lösningen framgår på vilken situation och vilka ekvationer lösningen med symboler baseras. Räknaren kan också användas för att lösa en ekvation eller för att bestämma efterfrågade värden i en graf. Uppgifternas delmoment bedöms med noggrannheten 1/3 poäng och slutsumman avrundas till närmsta heltalspoäng.
2 1. Förening Användningsområde propanon tar bort nagellack / lösningsmedel etansyra konserveringsmedel etylbutanat aromämne 1,2 etandiol kylarvätska / förhindrar nedisning 2,2,4 trimetylpentan för bestämning av oktantalet / förhindrar knackning i förbränningsmotorn 1,2,3,4,5 pentahydroxipentan sötningsmedel 6 x 1 p.
3 2. a) Magnetit består av FeO där järnets oxidationstal är +II 1/3 p. Fe 2 O 3 där järnets oxidationstal är +III 2/3 p. b) Den begränsande faktorn bestäms n(fe 3 O 4 ) = m/m = 300,0 g/(231,55 g/mol) = 1,2956 mol För fullständig reaktion behövs det minst så här mycket väte: 4 n(fe 3 O 4 ) = 4 1,2956 mol = 5,1825 mol n(h 2 ) = m/m = 10,0 g/(2,016 g/mol) = 4,9603 mol < 5,1825 mol, H 2 är alltså den begränsande faktorn. 2 p. Det teoretiska utbytet av järn är då n(fe) teor. = ¾ n(h 2 ) där stökiometrin fås ur reaktionsformeln 1 p. m(fe) teor. = nm = ¾ 4,9603 mol 55,85 g/mol = 207,77 g 1 p. det verkliga utbytet/det teoretiska utbytet = 195 g/207,77 g = 0,939 Det procentuella utbytet är 93,9 % 1 p.
4 3. a) I en neutral vattenlösning är [H+] = [OH ]. T.ex. NaCl(aq). (En neutral lösning har ph = 7,00, när temperaturen är 25 C.) 1 p. b) En amfolyt är ett ämne som kan fungera som både syra och bas. T.ex. vätesulfatjonen, HSO 4. 1 p. c) En svag syra protolyserar bara ofullständigt i en vattenlösning, dvs. vid jämvikt har bara en del av syramolekylerna avgett en vätejon dvs. en proton till vattenmolekylerna. (Syrakonstanten är mindre än 1 mol/l). T.ex. etansyra, vars K a = 1,8 10 ⁵ mol/l. 1 p. d) En polyprotisk syra avger mer än en vätejon till vatten. T.ex. kolsyra H 2 CO 3. 1 p. e) Ett surt salt är en jonförening som då den löser sig i vatten bildar en sur vattenlösning. (Det typiska är att det är fråga om ett salt som bildats i reaktionen mellan en stark syra och en svag bas.) 1 p. T.ex. NH 4 Cl(s) NH 4 +(aq) + Cl (aq), NH 4 +(aq) + H 2 O(l) NH 3 (aq) + H 3 O+(aq) 1 p.
5 4. a) 4 etylhex 2 en (1 )etyl 3 metylcyklopentan C 3 etylhexan strukturformler 3 x 2/3 p. namn 3 x 2/3 p. b) Föreningen B uppvisar även optisk isomeri eftersom den i sin struktur har två kirala kolatomer (utmärkta i figuren). Föreningen C har inga kirala kol. Alla föreningar uppvisar konformationsisomeri eftersom en enkelbindning tillåter att atomerna roterar runt bindningsaxeln och då kan samma molekyl ha olika konformationer utan att bindningarna bryts. 2 p.
6 5. a) Sim eller slalomglasögon hindrar flyktiga svavelföreningar att nå ögonen. 1 p. b) Mikrovågsugnens strålning upphettar löken alltigenom och inverkan når således också lökens inre delar. Upphettningen denaturerar enzymernas proteiner. / Enzymaktiviteten minskar vid höga temperaturer. 1 p. c) Om man använder en vass kniv söndras färre celler än om man använder en slö kniv. Därvid frigörs färre svavelföreningar. 1 p. d) Svavelföreningarna reagerar med vatten. Den svavelsyra som bildas i reaktionen är inte en flyktig förening och förmår inte reta ögat. 1 p. e) Avkylningen minskar reaktionshastigheten. / Avkylningen minskar enzymaktiviteten. 1 p. Avkylning minskar föreningarnas avdunstning (flyktighet). 1 p.
7 6. a) När en oädlare (Mg eller Zn) metall kopplas till en ädlare metall som ska skyddas, uppstår ett galvaniskt element i vilket metallen som ska skyddas fungerar som katod och den oädlare metallen fungerar som en s.k. offeranod vilken oxideras, dvs. upplöses. 1 p. b) Vid katoden sker följande reduktionsreaktioner i given ordning: 1. Ag+ + e Ag E = +0,80 V 2. Cu²+ + 2 e Cu E = +0,34 V Eftersom jonkoncentrationerna i lösningen är lika, reduceras ämnena vid katoden i den ordning som anges av normalpotentialerna för reduktionsreaktionerna. Först reduceras det ämne vars normalpotential är störst och till sist det ämne vars normalpotential är minst. 1 p H 2 O(l) + 2 e 2 OH (aq) + H 2 (g) E = 0,83 V (Na+ + e Na E = 2,71 V) Enligt normalpotentialerna reduceras vatten vid katoden före natrium. Natrium kan inte reduceras i en vattenlösning dvs. reduktionsreaktionen för natrium sker inte. 2 p. c) Aluminium upplöses i en starkt basisk lösning och det bildas vätgas. 2/3 p. Totalreaktionen uppställs. Reduktion: 6 H 2 O(l) + 6 e 3 H 2 (g) + 6 OH (aq) E = 0,83 V Oxidation: 2 Al(s) + 8 OH (aq) 2 [Al(OH) 4 ] (aq) + 6 e E = +2,31 V Totalreaktion: 2 Al(s) + 2 OH (aq) + 6 H 2 O(l) 2 [Al(OH) 4 ] (aq) + 3 H 2 (g) 2/3 p. E = +1,48 V > 0 2/3 p.
8 7. I svaret har man givit en metod och utifrån den, den observerbara skillnaden mellan föreningarna. Metoden har motiverats med hjälp av föreningarnas kemiska eller fysikaliska egenskaper. 6 x 1 p. Exempel på möjliga försöksarrangemang: 1: vatten eller etanol Förbränningstest: Etanol är en organisk syreförening och den brinner. Vatten brinner inte. Löslighetstest: Natriumklorid eller något annat lättlösligt salt löser sig i vatten men inte i etanol. 2: etanol eller aceton Oxidationstest med kaliumpermanganat: Etanolen oxideras varvid den violetta färgen förändras. Aceton oxideras inte och kaliumpermanganatets färg förändras inte. Kokpunkten: Etanol har en högre kokpunkt än aceton. Mellan etanolmolekylerna finns vätebindningar. Mellan acetonmolekylerna finns dipol dipolbindningar. 3: aceton eller ättiksyra Surheten: Ättiksyrans vattenlösning är sur och en vattenlösning av aceton är neutral. Kokpunkten: Ättiksyrans kokpunkt är högre än kokpunkten för aceton. Mellan ättiksyramolekylerna finns vätebindningar. Mellan acetonmolekylerna finns dipol dipolbindningar. 4: ättiksyra eller trimetylamin Surheten: Ättiksyrans vattenlösning är sur och trimetylaminens vattenlösning basisk. Som indikator kan t.ex. bromtymolblått användas. Tillsats av natriumhydroxid: Ättiksyran neutraliseras varvid det i en exotermisk reaktion frigörs värme och kärlet uppvärms. (Tillsats av natriumhydroxid minskar vattenlösligheten för trimetylamin.) 5: trimetylamin eller hexan Surhet: En vattenlösning av trimetylamin är basisk. Som indikator kan t.ex. bromtymolblått användas. Hexan löser sig inte i vatten. Löslighet: Trimetylamin är en polär förening och den löser sig i vatten. Hexan är en opolär förening och löser sig inte i vatten. 6: hexan eller vatten Löslighet: Natriumklorid eller något annat lättlösligt salt löser sig i vatten men inte i hexan. Förbränningstest: Hexan är ett kolväte och brinner. Vatten brinner inte. Om metoden är avsmakning, 0 p. för momentet i fråga. Om metoden grundar sig på försiktigt doftande, doftandets trygghet är motiverad och föreningens eller föreningsgruppens karakteristiska doft har beskrivits, 2/3 p. för momentet i fråga.
9 8. a) 2SO 2 (g) + O 2 (g) 2 SO 3 (g) i början (mol/l) 0,200 1,00 0 vid jämvikt (mol/l) 0,200 2x 1,00 x 2x 1/3 p. 1 1/3 p. Vid jämvikt har 61,3 % eller 0,1226 mol/l av SO 2 reagerat till SO 3 1/3 p. 2x = 0,1226 x = 0,0613 mol/l, mol/l, mol/l 2,67284 mol/l 2,7 mol/l Jämviktskonstanten vid försökets temperatur är 2,7 mol/l. 1 p. b) H f värdena ur tabellboken H = [2 ( 395,2)] kj [2 ( 296,9) + 0] kj = 196,6 kj dvs. reaktionen är exotermisk. 1 p. När temperaturen sjunker, förskjuts jämvikten mot den sida som producerar värme, dvs. mot den exotermiska sidan. (Le Châteliers princip). Eftersom reaktionen är exotermisk förskjuts jämvikten mot reaktionsprodukterna. 1 p. Då temperaturen sjunker minskar hastigheten för både reaktionen mot höger och reaktionen mot vänster. Reaktionshastigheten mot vänster minskar mer, vilket orsakar att jämvikten förskjuts mot produktsidan. 1 p.
10 9. O OCH 2 CH 3 2 A O OCH 2 CH B O OH + OH C Föreningarna A, D, E, F och G: 1 p./förening Förening B: 2/3 p. Förening C: 1/3 p. För förening G godkänns också att nitrogruppen substitueras till andra kolatomer i den aromatiska ringen.
11 10. a) Löslighet (mol/l): 56,9 mg/l / 535,2 g/mol = 1, ⁴ mol/l = c 1/3 p. [CH 3 (CH 2 ) 14 COO] 2 Mg(s) Mg²+(aq) + 2 CH 3 (CH 2 ) 14 COO (aq) vid jämvikt (mol/l) c 2c 2/3 p. K s = [Mg²+] [CH 3 (CH 2 ) 14 COO ]² = c (2c)² = 4 c³ = 4,8 10 ¹² (mol/l)³ 2/3 p. Q = 0,60 10 ³ (0, ³)² = 4,2 10 ¹² (mol/l)³ < K s, 2/3 p. faller således inte ut. 2/3 p. b) [CH 3 (CH 2 ) 14 COO] 2 Mg(s) Mg²+(aq) + 2 CH 3 (CH 2 ) 14 COO (aq) i början (mol/l) vid jämvikt (mol/l) 0,60 10 ³ 0, ³ x 0,60 10 ³ x 0, ³ 2x 1p. (Utfällning sker, således är x > 0 och utgångskoncentrationerna begränsar 0,60 10 ³ x > 0 samt 0, ³ 2x > 0 dvs. 0 < x < 4,2 10 ⁵) K s = [Mg²+] [CH 3 (CH 2 ) 14 COO ]² = (0,60 10 ³ x) (0, ³ 2x)² = 3,3 10 ¹² (mol/l)³ 1/3p. Om det faller ut 30 mg magnesiumpalmitat x = 0,030 g / (535,13 g/mol 5,0 l) = 1, ⁵ mol/l 2/3 p. Värdet substitueras i uttrycket för jonprodukten. Q = (0,60 10 ³ x) (0, ³ 2x)² = 2,2 10 ¹² (mol/l)³ K s = 3,3 10 ¹² (mol/l)³ Q < K s dvs. jonkoncentrationerna är mindre än i en mättad lösning. Det faller ut mindre än 30 mg magnesiumpalmitat. 1 p. ELLER med räknare (0,60 10 ³ x) (0, ³ 2x)² = 3,3 10 ¹² 4x³ + 0,002736x² 2, ⁷ x + 9, ¹³ = 0 x = 4, ⁶, de andra rötterna 8,1 10 ⁵ och 6,0 10 ⁴ duger ej Det faller ut 4, ⁶ mol/l 5,0 l 535,13 g/mol = 0,013 g magnesiumpalmitat, dvs. mindre än 30 mg.
12 +11. a) Massförändringen har förklarats och de avgående gaserna har identifierats. 1 2/3 p. Sönderfallstemperaturerna och temperaturområdena har givits. 1 1/3 p. Den efterfrågade reaktionen har givits. 2/3 p. Reaktionsformeln har motiverats beräkningsmässigt med hjälp av figurens uppgifter. 1 1/3 p. Massan minskar eftersom sönderfallsreaktionerna producerar gaser. temperaturområde / sönderfallet börjar stabil förening / reaktion avgående gas stabil C CaC 2 O 4 H 2 O(s) sönderfall 100 C CaC 2 O 4 H 2 O(s) CaC 2 O 4 (s) + H 2 O(g) H 2 O(g) stabil C CaC 2 O 4 (s) sönderfall 400 C CaC 2 O 4 (s) CaCO 3 (s) + CO(g) CO(g) stabil C CaCO 3 (s) sönderfall 690 C CaCO 3 (s) CaO(s) + CO 2 (g) CO 2 (g) stabil 840 (950) C CaO(s) I det tredje skedet är massförändringen 61,6 % 31,5 % = 30,1 %. Massan före skede 3 är 0,7244 g 0,7244 g 0,315 = 0,4962 g = m(caco 3 ). Delen som försvunnit: M(x) = m(x) M(CaCO 3 )/m(caco 3 ) = 0,301 0,7244 g 100,09 g/mol/0,4962 g = 43,98 g/mol, vilket motsvarar molmassan för CO 2 : (12, ,00) g/mol = 44,01 g/mol. ELLER Återstoden: M(y) = m(y) M(CaCO 3 )/m(caco 3 ) = 0,384 0,7244 g 100,09 g/mol/0,4962 g = 56,11 g/mol M(CaO) ELLER m(x)/m(x) = m(cac 2 O 4 H 2 O)/M(CaC 2 O 4 H 2 O) M(x) = (0,7244 g 0, ,11 g/mol)/0,7244 g 0, ,11 g/mol = 43,98 g/mol M(CO 2 ) och återstoden: (1 0,616) 146,11 g/mol = 56,11 g/mol M(CaO)
13 b) Vi får ekvationssystemet: m(cac 2 O 4 ) + m(src 2 O 4 ) = 0,5713 g m(caco 3 ) + m(srco 3 ) = 0,4673 g 1 p. Då n(ca) = n(cac 2 O 4 ), fås CaC 2 O 4 Ca CaC 2O 4 på motsvarande sätt: 128,1 g mol 40,08 g mol Då dessa substitueras i ekvationssystemet fås 3,1961 m(ca) + 2,0046 m(sr) = 0,5713 g 2,4973 m(ca) + 1,6849 m(sr) = 0,4673 g Ca 3,1961 Ca m(caco 3 ) = 2,4973 m(ca) m(src 2 O 4 ) = 2,0046 m(sr) m(srco 3 ) = 1,6849 m(sr) 1 p. ur vilket fås m(ca)= 0, g och m(sr) = 0,17632 g. 1 p. Procentandelarna: 0, g/0,6025 g 100 % = 11,3 % kalcium 0,17632 g/0,6025 g 100 % = 29,3 % strontium 1 p. ELLER x = n(ca) = n(caco 3 ) = n(cac 2 O 4 ) y = n(sr) = n(srco 3 ) = n(src 2 O 4 ) Ekvationssystemet: x M(CaC 2 O 4 ) + y M(SrC 2 O 4 ) = 0,5713 g x M(CaCO 3 ) + y M(SrCO 3 ) = 0,4673 g x = 0, och y = 0, m(ca)= 0, g och m(sr) = 0,17632 g Procentandelar: 11,3 % kalcium och 29,3 % strontium
14 +12. a) I svaret har ammoniakens betydelse under första världskriget och i dag motiverats. 1 p. I svaret har åtminstone två föreningar för två olika användningsområden beskrivits och som motivering har man använt föreningens kemiska egenskaper. 2 p. Ammoniak är ett utgångsämne för produktionen av många kemikalier som innehåller kväve. Under kriget var livsmedelsförsörjningen och produktionen av projektiler väsentliga för Tyskland. I dag är över hälften av livsmedelproduktionen baserat på gödningsmedel framställda av ammoniak. För kvävehaltiga gödningsmedel används till exempel ammoniumnitrat och ammoniumfosfat. Växterna behöver kväve för sin proteinproduktion och kväve förkommer i de för växtens energiproduktion viktiga ATP/ADP molekylerna samt i DNA. Av ammoniak framställs industriellt kväveoxider och salpetersyra (Ostwalds process). Av salpetersyra framställs nitrerade föreningar som sprängämnen. Salpetersyra används även som oxidationsmedel. I projektiler och sprängämnen används kväveföreningar. Föreningar som nitroglycerin, trinitrotoluen (TNT) och kaliumnitrat faller mycket snabbt sönder och utvecklar stora mängder gaser och värme, något som sprängverkan baserar sig på. b) I svaret har klorets farlighet förklarats med hjälp av egenskaperna och strukturen. 2 p. Till exempel: Klor är en gas och sprids lätt. Klor underhåller förbränning. Klor är ytterst reaktivt, för kloratomen har sju ytterelektroner och bildar därför lätt föreningar genom att ta emot en elektron. Klor är ett kraftigt oxidationsmedel, eftersom kloratomen har sju ytterelektroner och lätt tar emot en elektron. Klorgas bildar en frätande förening om den kommer i kontakt med vatten (i lungorna). Reaktionen med vatten 1 p. Cl 2 (g) + H 2 O(l) HCl(aq/g) + HClO(aq) eller någon annan möjlig reaktion. c) I svaret har motiverats hur man skyddar sig mot klor med hjälp av klorets egenskaper.1 1/3 p. Att skydda sig med en duk som fuktats med natriumvätekarbonatlösning har förklarats närmare och som motivering har man använt en reaktionsformel. 1 2/3 p. Till exempel: Klorgasen är färgad (gulgrön). Dessutom kan dess lukt igenkännas vid mycket små halter så den observeras därför lätt. Klorgasen har en högre densitet än luft så dess koncentration är störst på löpgravens botten. Eftersom duken är fuktad i en vattenlösning löser sig Cl 2 och bildar en HCl lösning. Vätekloriden reagerar med natriumvätekarbonatet i duken och varken klor eller väteklorid kommer åt att påverka lungorna. HCl(aq/g) + NaHCO 3 (aq) NaCl(aq/g) + H 2 CO 3 (aq) (HOCl faller sönder: 2 HOCl 2 HCl + O 2 )
Syror, baser och ph-värde. Niklas Dahrén
 Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206.
 1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206. a) Antalet protoner är., antalet neutroner är. och antalet elektroner. hos atomer av isotopen. b) Vilken partikel bildas om en
1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206. a) Antalet protoner är., antalet neutroner är. och antalet elektroner. hos atomer av isotopen. b) Vilken partikel bildas om en
KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16
 KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
Stökiometri I Massa-Molmassa Substansmängd
 Stökiometri I Massa-Molmassa Substansmängd 1 1 Bestäm atommassan för a) Syre b) Barium c) N 2 d) 8 S 2 2 Bestäm formelmassan för: a) Natriumklorid b) Aluminiumoxid c) Ag 2 SO 4 d) ZnHg(SCN) 4 e) UO 2 (NO
Stökiometri I Massa-Molmassa Substansmängd 1 1 Bestäm atommassan för a) Syre b) Barium c) N 2 d) 8 S 2 2 Bestäm formelmassan för: a) Natriumklorid b) Aluminiumoxid c) Ag 2 SO 4 d) ZnHg(SCN) 4 e) UO 2 (NO
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden PROVET I KEMI 22.3.2013 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Ylioppilastutkintolautakunta S tudentexamensnämnden PROVET I KEMI 22.3.2013 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Repetitionsuppgifter. gymnasiekemi
 Repetitionsuppgifter i gymnasiekemi Att börja med: A 2, 5, 7 B 2, 4, 5, 14, 15, 16, 19 C 2, 7, 8 D 1,2, 3 Om det är för lätt: B 9, 10, 12, 13, 21 C 3, 6 D 4, 5 Boel Lindegård 2006 Reviderad 2012 A. Atomernas
Repetitionsuppgifter i gymnasiekemi Att börja med: A 2, 5, 7 B 2, 4, 5, 14, 15, 16, 19 C 2, 7, 8 D 1,2, 3 Om det är för lätt: B 9, 10, 12, 13, 21 C 3, 6 D 4, 5 Boel Lindegård 2006 Reviderad 2012 A. Atomernas
Rättningstiden är i normalfall 15 arbetsdagar, annars är det detta datum som gäller:
 Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2016-10-27 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2016-10-27 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Prov i kemi kurs A. Atomens byggnad och periodiska systemet 2(7) Namn:... Hjälpmedel: räknedosa + tabellsamling
 Prov i kemi kurs A Namn:... Hjälpmedel: räknedosa + tabellsamling Lösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och
Prov i kemi kurs A Namn:... Hjälpmedel: räknedosa + tabellsamling Lösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och
Syror och baser. Syror kan ge otäcka frätskador och kan även lösa upp metaller. Därför har flaskor med syra ofta varningssymbolen "varning frätande".
 Syror och baser En syra är ämne som lämnar eller kan lämna ifrån sig en vätejon (H + ). Detta gör att det finns fria vätejoner i lösningen. Lösningen blir därmed sur. En stark syra lämnar alltid ifrån
Syror och baser En syra är ämne som lämnar eller kan lämna ifrån sig en vätejon (H + ). Detta gör att det finns fria vätejoner i lösningen. Lösningen blir därmed sur. En stark syra lämnar alltid ifrån
Tentamen för KEMA02 lördag 14 april 2012, 08-13
 Lunds Universitet, Kemiska Institutionen Tentamen för KEMA02 lördag 14 april 2012, 08-13 Tillåtna hjälpmedel är utdelat formelblad och miniräknare. Redovisa alla beräkningar. Besvara varje fråga på ett
Lunds Universitet, Kemiska Institutionen Tentamen för KEMA02 lördag 14 april 2012, 08-13 Tillåtna hjälpmedel är utdelat formelblad och miniräknare. Redovisa alla beräkningar. Besvara varje fråga på ett
Göran Stenman. Syror och Baser. Göran Stenman, Ursviksskolan 6-9, Ursviken
 Göran Stenman Syror och Baser Göran Stenman, Ursviksskolan 6-9, Ursviken www.lektion.se Syror och baser är frätande, det viktigaste att komma ihåg då vi laborerar är.. Skyddsglasögon Göran Göran Stenman
Göran Stenman Syror och Baser Göran Stenman, Ursviksskolan 6-9, Ursviken www.lektion.se Syror och baser är frätande, det viktigaste att komma ihåg då vi laborerar är.. Skyddsglasögon Göran Göran Stenman
Kapitel Repetition inför delförhör 2
 Kapitel 12-18 Repetition inför delförhör 2 Kapitel 1 Innehåll Kapitel 12 Kapitel 13 Kapitel 14 Kapitel 15 Kapitel 16 Kapitel 17 Kapitel 18 Kemisk kinetik Kemisk jämvikt Syror och baser Syra-basjämvikter
Kapitel 12-18 Repetition inför delförhör 2 Kapitel 1 Innehåll Kapitel 12 Kapitel 13 Kapitel 14 Kapitel 15 Kapitel 16 Kapitel 17 Kapitel 18 Kemisk kinetik Kemisk jämvikt Syror och baser Syra-basjämvikter
Kapitel Kapitel 12. Repetition inför delförhör 2. Kemisk kinetik. 2BrNO 2NO + Br 2
 Kapitel 1-18 Repetition inför delförhör Kapitel 1 Innehåll Kapitel 1 Kemisk kinetik Redoxjämvikter Kapitel 1 Definition Kapitel 1 Området inom kemi som berör reaktionshastigheter Kemisk kinetik Kapitel
Kapitel 1-18 Repetition inför delförhör Kapitel 1 Innehåll Kapitel 1 Kemisk kinetik Redoxjämvikter Kapitel 1 Definition Kapitel 1 Området inom kemi som berör reaktionshastigheter Kemisk kinetik Kapitel
Alla papper, även kladdpapper lämnas tillbaka.
 Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Syror, baser och jonföreningar
 Syror, baser och jonföreningar Joner är laddade byggstenar I en atom är antalet elektroner det samma som antalet protoner i kärnan. En jon är en atom som lämnat ifrån sig eller tagit upp en eller flera
Syror, baser och jonföreningar Joner är laddade byggstenar I en atom är antalet elektroner det samma som antalet protoner i kärnan. En jon är en atom som lämnat ifrån sig eller tagit upp en eller flera
Allmän Kemi 2 (NKEA04 m.fl.)
 Allmän Kemi (NKEA4 m.fl.) --4 Uppgift a) K c [NO] 4 [H O] 6 /([NH ] 4 [O ] 5 ) eller K p P(NO) 4 P(H O) 6 /(P(NH ) 4 P(O ) 5 ) Om kärlets volym minskar ökar trycket och då förskjuts jämvikten åt den sida
Allmän Kemi (NKEA4 m.fl.) --4 Uppgift a) K c [NO] 4 [H O] 6 /([NH ] 4 [O ] 5 ) eller K p P(NO) 4 P(H O) 6 /(P(NH ) 4 P(O ) 5 ) Om kärlets volym minskar ökar trycket och då förskjuts jämvikten åt den sida
Syror och baser. H 2 O + HCl H 3 O + + Cl H + Vatten är en amfolyt + OH NH 3 + H 2 O NH 4. Kemiföreläsning 3 2009-10-27
 Begrepp Syror och baser Kemiföreläsning 9--7 Några vanliga syror HCl (aq) saltsyra HNO salpetersyra H SO svavelsyra H CO kolsyra H PO fosforsyra HAc ättiksyra (egentligen CH COOH, Ac är en förkortning
Begrepp Syror och baser Kemiföreläsning 9--7 Några vanliga syror HCl (aq) saltsyra HNO salpetersyra H SO svavelsyra H CO kolsyra H PO fosforsyra HAc ättiksyra (egentligen CH COOH, Ac är en förkortning
Sura och basiska ämnen Syror och baser. Kap 5:1-5:3, (kap 9)
 Sura och basiska ämnen Syror och baser Kap 5:1-5:3, (kap 9) Syror / sura lösningar En sur lösning - har överskott på vätejoner, H + (protoner) En syra: - smakar surt - färgar BTB gult - reagerar med oädla
Sura och basiska ämnen Syror och baser Kap 5:1-5:3, (kap 9) Syror / sura lösningar En sur lösning - har överskott på vätejoner, H + (protoner) En syra: - smakar surt - färgar BTB gult - reagerar med oädla
Kap 8 Redox-reaktioner. Reduktion/Oxidation (elektrokemi)
 Kap 8 Redox-reaktioner Reduktion/Oxidation (elektrokemi) Zinkbleck (zinkplåt) i en kopparsulfatlösning Zn (s) + CuSO 4 (aq) Zn (s) + Cu 2+ (aq) + SO 4 2+ (aq) Vad händer? Magnesium brinner i luft Vad
Kap 8 Redox-reaktioner Reduktion/Oxidation (elektrokemi) Zinkbleck (zinkplåt) i en kopparsulfatlösning Zn (s) + CuSO 4 (aq) Zn (s) + Cu 2+ (aq) + SO 4 2+ (aq) Vad händer? Magnesium brinner i luft Vad
Joner Syror och baser 2 Salter. Kemi direkt sid. 162-175
 Joner Syror och baser 2 Salter Kemi direkt sid. 162-175 Efter att du läst sidorna ska du kunna: Joner Förklara skillnaden mellan en atom och en jon. Beskriva hur en jon bildas och ge exempel på vanliga
Joner Syror och baser 2 Salter Kemi direkt sid. 162-175 Efter att du läst sidorna ska du kunna: Joner Förklara skillnaden mellan en atom och en jon. Beskriva hur en jon bildas och ge exempel på vanliga
Uppgifternas delmoment bedöms med noggrannheten 1/3 poäng och slutsumman avrundas till närmsta heltalspoäng.
 PROVET I KEMI 15.9.2014 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
PROVET I KEMI 15.9.2014 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
Vilken av följande partiklar är det starkaste reduktionsmedlet? b) Båda syralösningarna har samma ph vid ekvivalenspunkten.
 1 (2/0/0) Beräkna trycket i en behållare med volymen 4,50 dm 3, temperaturen 34,5 ºC och som innehåller 5,83 g vätgas samt 11,66 g syrgas. (Gaserna betraktas som ideala gaser.) 2 (1/0/0) Två lika stora
1 (2/0/0) Beräkna trycket i en behållare med volymen 4,50 dm 3, temperaturen 34,5 ºC och som innehåller 5,83 g vätgas samt 11,66 g syrgas. (Gaserna betraktas som ideala gaser.) 2 (1/0/0) Två lika stora
Den elektrokemiska spänningsserien. Niklas Dahrén
 Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel ü Metaller avger gärna sina valenselektroner till andra ämnen p.g.a. låg elektronegativitet och eftersom de metalljoner som
Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel ü Metaller avger gärna sina valenselektroner till andra ämnen p.g.a. låg elektronegativitet och eftersom de metalljoner som
Övningar Homogena Jämvikter
 Övningar Homogena Jämvikter 1 Tiocyanatjoner, SCN -, och järn(iii)joner, Fe 3+, reagerar med varandra enligt formeln SCN - + Fe 3+ FeSCN + färglös svagt gul röd Vid ett försök sätter man en liten mängd
Övningar Homogena Jämvikter 1 Tiocyanatjoner, SCN -, och järn(iii)joner, Fe 3+, reagerar med varandra enligt formeln SCN - + Fe 3+ FeSCN + färglös svagt gul röd Vid ett försök sätter man en liten mängd
(tetrakloroauratjon) (2)
 UTTAGIG TILL KEMIOLYMPIADE 2015 TEORETISKT PROV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. jälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
UTTAGIG TILL KEMIOLYMPIADE 2015 TEORETISKT PROV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. jälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
Här växer människor och kunskap
 Syror och baser 2 - Elektron, -1 - Protoner, +1 Natrium (Na) Valenselektron 1 st Elektronskal 3st 3 Natrium Neon 11 10 Alla ämnen vill ha fullt ytterskal. Så Na försöker efterlikna Ne. 4 Denna elektron
Syror och baser 2 - Elektron, -1 - Protoner, +1 Natrium (Na) Valenselektron 1 st Elektronskal 3st 3 Natrium Neon 11 10 Alla ämnen vill ha fullt ytterskal. Så Na försöker efterlikna Ne. 4 Denna elektron
Kemiska beteckningar på de vanligaste atomslagen - känna till jonladdning på de vanligaste olika kemiska jonerna
 Elektrokemi Kemiska beteckningar på de vanligaste atomslagen - känna till jonladdning på de vanligaste olika kemiska jonerna Elektrokemiska spänningsserien: Alla metaller i det periodiska systemet finns
Elektrokemi Kemiska beteckningar på de vanligaste atomslagen - känna till jonladdning på de vanligaste olika kemiska jonerna Elektrokemiska spänningsserien: Alla metaller i det periodiska systemet finns
4. Kemisk jämvikt när motsatta reaktioner balanserar varandra
 4. Kemisk jämvikt när motsatta reaktioner balanserar varandra 4.1. Skriv fullständiga formler för följande reaktioner som kan gå i båda riktningarna (alla ämnen är i gasform): a) Kolmonoxid + kvävedioxid
4. Kemisk jämvikt när motsatta reaktioner balanserar varandra 4.1. Skriv fullständiga formler för följande reaktioner som kan gå i båda riktningarna (alla ämnen är i gasform): a) Kolmonoxid + kvävedioxid
Föreläsningsplan 2010. Del 1 Allmän kemi
 IFM-Kemi 9NV221, 9NV321, LINVA6 101018 Kemi för NV-lärare Föreläsningsplan 2010 Del 1 Allmän kemi Föreläsn.1 + 2 Kap. 12. Atomer och atommodeller. Föreläsn. 3 Kap. 14 Kemi: Grundämnen och föreningar. Föreläsn.
IFM-Kemi 9NV221, 9NV321, LINVA6 101018 Kemi för NV-lärare Föreläsningsplan 2010 Del 1 Allmän kemi Föreläsn.1 + 2 Kap. 12. Atomer och atommodeller. Föreläsn. 3 Kap. 14 Kemi: Grundämnen och föreningar. Föreläsn.
Lösning till dugga för Grundläggande kemi Duggauppgifter enligt lottning; nr X, Y och Z.
 till dugga för Grundläggande kemi 2013-11-29 Duggauppgifter enligt lottning; nr X, Y och Z. 1. a) Ange kvalitativt buffertkapacitetens storlek (stor eller liten, med motivering, dock inga beräkningar)
till dugga för Grundläggande kemi 2013-11-29 Duggauppgifter enligt lottning; nr X, Y och Z. 1. a) Ange kvalitativt buffertkapacitetens storlek (stor eller liten, med motivering, dock inga beräkningar)
Hjälpmedel: räknare, formelsamling, periodiska system. Spänningsserien: K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au. Kemi A
 Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
1 Tror du reaktionen nedan är momentan eller ej? Motivera. 1p S 2 O H + S(s) + SO 2 (g) + H 2 O(l)
 Tentamen 1 Baskemi 2 2011.05.02 1 Tror du reaktionen nedan är momentan eller ej? Motivera. S 2 O 2-3 + 2H + S(s) + SO 2 (g) + H 2 O(l) 2 Vad är a. ett intermediär? b. en radikal? c. en amfojon 3 Vi studerar
Tentamen 1 Baskemi 2 2011.05.02 1 Tror du reaktionen nedan är momentan eller ej? Motivera. S 2 O 2-3 + 2H + S(s) + SO 2 (g) + H 2 O(l) 2 Vad är a. ett intermediär? b. en radikal? c. en amfojon 3 Vi studerar
Den elektrokemiska spänningsserien. Niklas Dahrén
 Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel Metaller fungerar ofta som reduktionsmedel: Metaller fungerar ofta som reduktionsmedel eftersom de avger sina valenselektroner
Den elektrokemiska spänningsserien Niklas Dahrén Metaller som reduktionsmedel Metaller fungerar ofta som reduktionsmedel: Metaller fungerar ofta som reduktionsmedel eftersom de avger sina valenselektroner
Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5.
 Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5. Modellsvar Räknefel och slarvfel, - ½ p. Halvpoäng upphöjas inte. Till exempel om totalpoäng är 2½ p. slutpoäng
Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5. Modellsvar Räknefel och slarvfel, - ½ p. Halvpoäng upphöjas inte. Till exempel om totalpoäng är 2½ p. slutpoäng
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2
 UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
Rättningstiden är i normalfall tre veckor, annars är det detta datum som gäller: Efter överenskommelse med studenterna är rättningstiden fem veckor.
 Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Kapitel 4. Reaktioner i vattenlösningar
 Kapitel 4 Reaktioner i vattenlösningar Kapitel 4 Innehåll 4.1 Vatten, ett lösningsmedel 4.2 Starka och svaga elektrolyter 4.3 Lösningskoncentrationer 4.4 Olika slags kemiska reaktioner 4.5 Fällningsreaktioner
Kapitel 4 Reaktioner i vattenlösningar Kapitel 4 Innehåll 4.1 Vatten, ett lösningsmedel 4.2 Starka och svaga elektrolyter 4.3 Lösningskoncentrationer 4.4 Olika slags kemiska reaktioner 4.5 Fällningsreaktioner
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
REPETITIONSKURS I KEMI LÖSNINGAR TILL ÖVNINGSUPPGIFTER
 KEMI REPETITIONSKURS I LÖSNINGAR TILL ÖVNINGSUPPGIFTER Magnus Ehinger Fullständiga lösningar till beräkningsuppgifterna. Kemins grunder.10 Vi antar att vi har 10 000 Li-atomer. Av dessa är då 74 st 6 Li
KEMI REPETITIONSKURS I LÖSNINGAR TILL ÖVNINGSUPPGIFTER Magnus Ehinger Fullständiga lösningar till beräkningsuppgifterna. Kemins grunder.10 Vi antar att vi har 10 000 Li-atomer. Av dessa är då 74 st 6 Li
KEMI 5. KURSBEDÖMNING: Kursprov: 8 uppgifter varav eleven löser max. 7 Tre av åtta uppgifter är från SE max. poäng: 42 gräns för godkänd: 12
 KEMI 5 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al.: Kemi 5 Reaktioner och jämvikt All kursinfo (t. ex. lektionsanteckningar, eventuella övningsprov...) finns på Matteus.
KEMI 5 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al.: Kemi 5 Reaktioner och jämvikt All kursinfo (t. ex. lektionsanteckningar, eventuella övningsprov...) finns på Matteus.
Materien. Vad är materia? Atomer. Grundämnen. Molekyler
 Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 Vilken info ger en reaktionsformel? En reaktionsformel säger - vilka ämnen som reagerar, - vilka som bildas - samt förhållandena mellan ämnena som reagerar/bildas En reaktionsformel
Kemisk jämvikt Kap 3 Vilken info ger en reaktionsformel? En reaktionsformel säger - vilka ämnen som reagerar, - vilka som bildas - samt förhållandena mellan ämnena som reagerar/bildas En reaktionsformel
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
Kemi. Fysik, läran om krafterna, energi, väderfenomen, hur alstras elektrisk ström mm.
 Kemi Inom no ämnena ingår tre ämnen, kemi, fysik och biologi. Kemin, läran om ämnena, vad de innehåller, hur de tillverkas mm. Fysik, läran om krafterna, energi, väderfenomen, hur alstras elektrisk ström
Kemi Inom no ämnena ingår tre ämnen, kemi, fysik och biologi. Kemin, läran om ämnena, vad de innehåller, hur de tillverkas mm. Fysik, läran om krafterna, energi, väderfenomen, hur alstras elektrisk ström
Föreläsning 4. Koncentrationer, reaktionsformler, ämnens aggregationstillstånd och intermolekylära bindningar.
 Föreläsning 4. Koncentrationer, reaktionsformler, ämnens aggregationstillstånd och intermolekylära bindningar. Koncentrationer i vätskelösningar. Kap. 12.2+3. Lösning = lösningsmedel + löst(a) ämne(n)
Föreläsning 4. Koncentrationer, reaktionsformler, ämnens aggregationstillstånd och intermolekylära bindningar. Koncentrationer i vätskelösningar. Kap. 12.2+3. Lösning = lösningsmedel + löst(a) ämne(n)
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
Kemisk bindning. Mål med avsnittet. Jonbindning
 Kemisk bindning Det är få grundämnen som förekommer i ren form i naturen De flesta söker en kompis med kompletterande egenskaper Detta kan ske på några olika sätt, både inom molekylen och mellan molekylen
Kemisk bindning Det är få grundämnen som förekommer i ren form i naturen De flesta söker en kompis med kompletterande egenskaper Detta kan ske på några olika sätt, både inom molekylen och mellan molekylen
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2011 Märit Karls Intramolekylära attraktioner Atomer hålls ihop av elektrostatiska krafter mellan protoner och.elektroner Joner hålls ihop
Tentamen i Allmän kemi NKEA02, 9KE211, 9KE351. 2010-09-20, kl. 14 00-19 00
 IFM/Kemi Tentamen i Allmän kemi NKEA02, 9KE211, 9KE351 2010-09-20, kl. 14 00-19 00 Ansvariga lärare: Helena Herbertsson 285605, 070-5669944 Lars Ojamäe 281380 50% rätt ger säkert godkänt! Hjälpmedel: Miniräknare
IFM/Kemi Tentamen i Allmän kemi NKEA02, 9KE211, 9KE351 2010-09-20, kl. 14 00-19 00 Ansvariga lärare: Helena Herbertsson 285605, 070-5669944 Lars Ojamäe 281380 50% rätt ger säkert godkänt! Hjälpmedel: Miniräknare
Kemiolympiaden 2014 En tävling i regi av Svenska Kemistsamfundet
 KEMILYMPIADE SVERIGE Kemiolympiaden 2014 En tävling i regi av Svenska Kemistsamfundet Till alla elever u är det dags för årets kemiolympiad. Kemiolympiaden är en tävling för gymnasieelever som inte fyllt
KEMILYMPIADE SVERIGE Kemiolympiaden 2014 En tävling i regi av Svenska Kemistsamfundet Till alla elever u är det dags för årets kemiolympiad. Kemiolympiaden är en tävling för gymnasieelever som inte fyllt
Kapitel 14. HA HA K a HO A H A. Syror och baser. Arrhenius: Syror producerar H 3 O + -joner i lösningar, baser producerar OH -joner.
 Kapitel 14 Syror och baser Kapitel 14 Innehåll 14.1 Syror och baser 14.2 Syrastyrka 14.3 ph-skalan 14.4 Beräkna ph för en stark syra 14.5 14.6 14.7 Flerprotoniga syror 14.8 14.9 Molekylstrukturens inverkan
Kapitel 14 Syror och baser Kapitel 14 Innehåll 14.1 Syror och baser 14.2 Syrastyrka 14.3 ph-skalan 14.4 Beräkna ph för en stark syra 14.5 14.6 14.7 Flerprotoniga syror 14.8 14.9 Molekylstrukturens inverkan
Intermolekylära krafter
 Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Intermolekylära krafter Medicinsk Teknik KTH Biologisk kemi Vt 2012 Märit Karls Intermolekylära attraktioner Mål 5-6 i kap 5, 1 och 5! i kap 8, 1 i kap 9 Intermolekylära krafter Varför är is hårt? Varför
Tentamen i KEMI del B för Basåret GU (NBAK10) kl Institutionen för kemi, Göteborgs universitet
 Tentamen i KEMI del B för Basåret GU (NBAK10) 2007-03-23 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: örsalslängan A1, B1, B4 jälpmedel: Räknare valfri Ansvarig lärare: Leif olmlid
Tentamen i KEMI del B för Basåret GU (NBAK10) 2007-03-23 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: örsalslängan A1, B1, B4 jälpmedel: Räknare valfri Ansvarig lärare: Leif olmlid
Kapitel 14. Syror och baser
 Kapitel 14 Syror och baser Kapitel 14 Innehåll 14.1 Syror och baser 14.2 Syrastyrka 14.3 ph-skalan 14.4 Beräkna ph för en stark syra 14.5 Beräkna ph för en svag syra 14.6 Baser 14.7 Flerprotoniga syror
Kapitel 14 Syror och baser Kapitel 14 Innehåll 14.1 Syror och baser 14.2 Syrastyrka 14.3 ph-skalan 14.4 Beräkna ph för en stark syra 14.5 Beräkna ph för en svag syra 14.6 Baser 14.7 Flerprotoniga syror
UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1. Läkemedel
 UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1 Provdatum: torsdagen den 15 november Provtid: 120 minuter Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning görs på svarsblanketten som
UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1 Provdatum: torsdagen den 15 november Provtid: 120 minuter Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning görs på svarsblanketten som
UTTAGNING TILL KEMIOLYMPIADEN 2011
 UTTAGNING TILL KEMIOLYMPIADEN 2011 TEORETISKT PROV 2011-03-15 Provet omfattar 11 uppgifter Provtid: 180 minuter. jälpmedel: Miniräknare, tabell- och formelsamling. Till uppgifterna 1-7 skall du endast
UTTAGNING TILL KEMIOLYMPIADEN 2011 TEORETISKT PROV 2011-03-15 Provet omfattar 11 uppgifter Provtid: 180 minuter. jälpmedel: Miniräknare, tabell- och formelsamling. Till uppgifterna 1-7 skall du endast
Examensämnets censorsmöte har godkänt följande beskrivningar av goda svar.
 PROVET I KEMI 19.9.2016 BESKRIVNING AV GODA SVAR Examensämnets censorsmöte har godkänt följande beskrivningar av goda svar. I kemin är målet för bedömningen förståelsen och tillämpningen av den kemiska
PROVET I KEMI 19.9.2016 BESKRIVNING AV GODA SVAR Examensämnets censorsmöte har godkänt följande beskrivningar av goda svar. I kemin är målet för bedömningen förståelsen och tillämpningen av den kemiska
Molekyler och molekylmodeller. En modell av strukturen hos is, fruset vatten
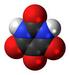 Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Jämviktsuppgifter. 2. Kolmonoxid och vattenånga bildar koldioxid och väte enligt följande reaktionsformel:
 Jämviktsuppgifter Litterarum radices amarae, fructus dulces 1. Vid upphettning sönderdelas etan till eten och väte. Vid en viss temperatur har följande jämvikt ställt in sig i ett slutet kärl. C 2 H 6
Jämviktsuppgifter Litterarum radices amarae, fructus dulces 1. Vid upphettning sönderdelas etan till eten och väte. Vid en viss temperatur har följande jämvikt ställt in sig i ett slutet kärl. C 2 H 6
Kapitel 4. Egenskaper. Reaktioner. Stökiometri. Reaktioner i vattenlösningar. Vattenlösningar. Ett polärt lösningsmedel löser polära molekyler och
 Kapitel 4 Innehåll Vattenlösningar Kapitel 4 Reaktioner i vattenlösningar Egenskaper Reaktioner Stökiometri Copyright Cengage Learning. All rights reserved 2 Kapitel 4 Innehåll 4.1 Vatten, ett lösningsmedel
Kapitel 4 Innehåll Vattenlösningar Kapitel 4 Reaktioner i vattenlösningar Egenskaper Reaktioner Stökiometri Copyright Cengage Learning. All rights reserved 2 Kapitel 4 Innehåll 4.1 Vatten, ett lösningsmedel
Kapitel 15. Syra-basjämvikter
 Kapitel 15 Syra-basjämvikter Kapitel 15 Innehåll 15.1 Lösningar med gemensam jon 15.2 Bufferlösningar 15.3 Bufferkapacitet 15.4 Titrering och ph-kurvor 15.5 Copyright Cengage Learning. All rights reserved
Kapitel 15 Syra-basjämvikter Kapitel 15 Innehåll 15.1 Lösningar med gemensam jon 15.2 Bufferlösningar 15.3 Bufferkapacitet 15.4 Titrering och ph-kurvor 15.5 Copyright Cengage Learning. All rights reserved
Syror, baser och ph-värde. Niklas Dahrén
 Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
Syror, baser och ph-värde Niklas Dahrén Syror är protongivare Syror kännetecknas av följande: 1. De har förmåga att avge vätejoner, H + (protoner), vilket leder till en ph-sänkning. 2. De ger upphov till
KEMIOLYMPIADEN 2007 Uttagning
 KEMILYMPIADEN 2007 Uttagning 1 2006-10-19 Provet omfattar 5 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Inga konstanter och atommassor ges i problemtexten. Dessa hämtas
KEMILYMPIADEN 2007 Uttagning 1 2006-10-19 Provet omfattar 5 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Inga konstanter och atommassor ges i problemtexten. Dessa hämtas
Övningar Stökiometri och Gaslagen
 Övningar Stökiometri och Gaslagen 1 1 På baksidan av ett paket med Liljeholmens Stearinljus står berättat att Lars Johan Hierta, grundaren av Aftonbladet, i London år 1837 kom i kontakt med ett nytt ljus,
Övningar Stökiometri och Gaslagen 1 1 På baksidan av ett paket med Liljeholmens Stearinljus står berättat att Lars Johan Hierta, grundaren av Aftonbladet, i London år 1837 kom i kontakt med ett nytt ljus,
GRUNDARBETEN I KEMI I
 GRUNDARBETEN I KEMI I ARBETSBESKRIVNING NAMN: INLÄMNAD: GODKÄND: 2 3 ARBETE I. GASBRÄNNARE OCH LÅGREAKTIONER Resultat Undersökt förening Lågans färg Uppgifter 1. Förklara kort varför lågorna har olika
GRUNDARBETEN I KEMI I ARBETSBESKRIVNING NAMN: INLÄMNAD: GODKÄND: 2 3 ARBETE I. GASBRÄNNARE OCH LÅGREAKTIONER Resultat Undersökt förening Lågans färg Uppgifter 1. Förklara kort varför lågorna har olika
1. a) Förklara, genom användning av något lämpligt kemiskt argument, varför H 2 SeO 4 är en starkare syra än H 2 SeO 3.
 Lösning till tentamen 2008 12 15 för Grundläggande kemi 10 hp Sid 1(5) 1. a) Förklara, genom användning av något lämpligt kemiskt argument, varför H 2 SeO 4 är en starkare syra än H 2 SeO 3. b) Beräkna
Lösning till tentamen 2008 12 15 för Grundläggande kemi 10 hp Sid 1(5) 1. a) Förklara, genom användning av något lämpligt kemiskt argument, varför H 2 SeO 4 är en starkare syra än H 2 SeO 3. b) Beräkna
PROVET I KEMI BESKRIVNING AV GODA SVAR
 PROVET I KEMI 16.3.2016 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
PROVET I KEMI 16.3.2016 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
För godkänt resultat krävs 20 p och för väl godkänt krävs 30 p. Max poäng är 40 p
 Tentamen i kemi för Basåret, OKEOOl :2 den 20 april 2012 Skrivtid: 8.00-1300 Plats. 8132 Hjälpmedel: Räknare och tabell För godkänt resultat krävs 20 p och för väl godkänt krävs 30 p. Max poäng är 40 p
Tentamen i kemi för Basåret, OKEOOl :2 den 20 april 2012 Skrivtid: 8.00-1300 Plats. 8132 Hjälpmedel: Räknare och tabell För godkänt resultat krävs 20 p och för väl godkänt krävs 30 p. Max poäng är 40 p
O O EtOAc. anilin bensoesyraanhydrid N-fenylbensamid bensoesyra
 Linköping 2009-10-25 IFM/Kemi Linköpings universitet För NKEA07 ht2009 SS Syntes av N-fenylbensamid Inledning: Amider, som tillhör gruppen karboxylsyraderivat, kan framställas från aminer och syraanhydrider.
Linköping 2009-10-25 IFM/Kemi Linköpings universitet För NKEA07 ht2009 SS Syntes av N-fenylbensamid Inledning: Amider, som tillhör gruppen karboxylsyraderivat, kan framställas från aminer och syraanhydrider.
Kursplan och betygskriterier i kemi. Utgångspunkten för kemi är de allmänna mål som finns redovisade i lpo94
 Kursplan och betygskriterier i kemi Utgångspunkten för kemi är de allmänna mål som finns redovisade i lpo94 Kemiundervisningen ska ge eleven kunskap om olika ämnen som man träffar på i vardagslivet. Den
Kursplan och betygskriterier i kemi Utgångspunkten för kemi är de allmänna mål som finns redovisade i lpo94 Kemiundervisningen ska ge eleven kunskap om olika ämnen som man träffar på i vardagslivet. Den
Då du skall lösa kemiska problem av den typ som kommer nedan är det praktiskt att ha en lösningsmetod som man kan använda till alla problem.
 Kapitel 2 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 2 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Lärare: Jimmy Pettersson. Kol och kolföreningar
 Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Svaren bedöms enligt de kriterier som gäller för respektive uppgift. Utgångspunkten vid be-
 PROVET I KEMI 28.3.2019 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
PROVET I KEMI 28.3.2019 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
Oxidationstal. Niklas Dahrén
 Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Oxidationstal Niklas Dahrén Innehåll Förklaring över vad oxidationstal är. Regler för att bestämma oxidationstal. Vad innebär oxidation och reduktion? Oxidation: Ett ämne (atom eller jon) får ett elektronunderskott
Konc. i början 0.1M 0 0. Ändring -x +x +x. Konc. i jämvikt 0,10-x +x +x
 Lösning till tentamen 2013-02-28 för Grundläggande kemi 10 hp Sid 1(5) 1. CH 3 COO - (aq) + H 2 O (l) CH 3 COOH ( (aq) + OH - (aq) Konc. i början 0.1M 0 0 Ändring -x +x +x Konc. i jämvikt 0,10-x +x +x
Lösning till tentamen 2013-02-28 för Grundläggande kemi 10 hp Sid 1(5) 1. CH 3 COO - (aq) + H 2 O (l) CH 3 COOH ( (aq) + OH - (aq) Konc. i början 0.1M 0 0 Ändring -x +x +x Konc. i jämvikt 0,10-x +x +x
Stökiometri IV Blandade Övningar
 Stökiometri IV Blandade Övningar 1) 1 Man blandar 25,0 cm 3 silvernitratlösning, c = 0,100 M, med 50,0 cm 3 bariumkloridlösning c = 0,0240 M. Hur stor är: [Ag + ] i blandningen? [NO 3- ] i blandningen?
Stökiometri IV Blandade Övningar 1) 1 Man blandar 25,0 cm 3 silvernitratlösning, c = 0,100 M, med 50,0 cm 3 bariumkloridlösning c = 0,0240 M. Hur stor är: [Ag + ] i blandningen? [NO 3- ] i blandningen?
Lösningar kan vara sura, neutrala eller basiska Gemensamt för sura och basiska ämnen är att de är frätande.
 Syror och baser Lösningar Lösningar kan vara sura, neutrala eller basiska Gemensamt för sura och basiska ämnen är att de är frätande. Om man blandar en syra och en bas kan man få det att bli neutralt.
Syror och baser Lösningar Lösningar kan vara sura, neutrala eller basiska Gemensamt för sura och basiska ämnen är att de är frätande. Om man blandar en syra och en bas kan man få det att bli neutralt.
a) 55,8 g/mol b) 183,8 g/mol c) 255,6 g/mol d) 303,7 g/mol 2. Galliumnitrid används i lysdioder. Vilken kemisk formel har galliumnitrid?
 UTTAGNING TILL KEMILYMPIADEN 2016 TERETISKT PRV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
UTTAGNING TILL KEMILYMPIADEN 2016 TERETISKT PRV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Uppgifternas delmoment bedöms med noggrannheten 1/3 poäng och slutsumman avrundas till närmsta heltalspoäng.
 PROVET I KEMI 20.3.2015 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
PROVET I KEMI 20.3.2015 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll och poängsättningar som ges här är inte bindande för studentexamensnämndens bedömning. Censorerna beslutar om de kriterier
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 2(2)
 KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 2(2) mer löslighetsprodukt! 12.9 The common ion effect utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många metalljoner
KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 2(2) mer löslighetsprodukt! 12.9 The common ion effect utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många metalljoner
JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3)
 KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3) mer löslighetsprodukt! Repetition Henderson-Hasselbach ekvationen för beräkning av ph i buffert - OK att använda - viktigast
KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3) mer löslighetsprodukt! Repetition Henderson-Hasselbach ekvationen för beräkning av ph i buffert - OK att använda - viktigast
Kovalenta bindningar, elektronegativitet och elektronformler. Niklas Dahrén
 Kovalenta bindningar, elektronegativitet och elektronformler Niklas Dahrén Innehåll ü Opolära kovalenta bindningar ü Polära kovalenta bindningar ü Elektronegativitet ü Paulingskalan ü Elektronformler ü
Kovalenta bindningar, elektronegativitet och elektronformler Niklas Dahrén Innehåll ü Opolära kovalenta bindningar ü Polära kovalenta bindningar ü Elektronegativitet ü Paulingskalan ü Elektronformler ü
Kemi. Fysik, läran om krafterna, energi, väderfenomen, hur alstras elektrisk ström mm.
 Kemi Inom no ämnena ingår tre ämnen, kemi, fysik och biologi. Kemin, läran om ämnena, vad de innehåller, hur de tillverkas mm. Fysik, läran om krafterna, energi, väderfenomen, hur alstras elektrisk ström
Kemi Inom no ämnena ingår tre ämnen, kemi, fysik och biologi. Kemin, läran om ämnena, vad de innehåller, hur de tillverkas mm. Fysik, läran om krafterna, energi, väderfenomen, hur alstras elektrisk ström
Viktigt! Glöm inte att skriva Tentamenskod på alla blad du lämnar in.
 Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2015-10-30 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2015-10-30 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kapitel 3. Stökiometri
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter
Materien. Vad är materia? Atomer. Grundämnen. Molekyler
 Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
Materien Vad är materia? Allt som går att ta på och väger någonting är materia. Detta gäller även gaser som t.ex. luft. Om du sticker ut handen genom bilrutan känner du tydligt att det finns något där
4 Beräkna massprocenthalten koppar i kopparsulfat femhydrat Hur många gram natriumklorid måste man väga upp för att det ska bli 2 mol?
 Stökiometri VI 1 Hur många atomer finns det i en molekyl H 2SO 4? 1 2 Skriv kemiska formeln för jonföreningar: 2 a) Kalciumoxid b) Kaliumjodid c) Strontiumhydroxid d) Aluminiumsulfit 3 Ange eller beräkna:
Stökiometri VI 1 Hur många atomer finns det i en molekyl H 2SO 4? 1 2 Skriv kemiska formeln för jonföreningar: 2 a) Kalciumoxid b) Kaliumjodid c) Strontiumhydroxid d) Aluminiumsulfit 3 Ange eller beräkna:
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden PRVET I KEMI 7.9.013 BESKRIVNING AV GDA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Ylioppilastutkintolautakunta S tudentexamensnämnden PRVET I KEMI 7.9.013 BESKRIVNING AV GDA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Energiuppgifter. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi vid en exoterm reaktion? O (s) H 2.
 Energiuppgifter Litterarum radices amarae, fructus dulces 1. Ange ett svenskt ord som är synonymt med termen entalpi. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi
Energiuppgifter Litterarum radices amarae, fructus dulces 1. Ange ett svenskt ord som är synonymt med termen entalpi. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi
UTTAGNING TILL KEMIOLYMPIADEN 2006
 UTTAGNING TILL KEMIOLYMPIADEN 2006 TEORETISKT PROV 2006-03-15 Provet omfattar 6 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Konstanter som inte ges i problemtexten, hämtas
UTTAGNING TILL KEMIOLYMPIADEN 2006 TEORETISKT PROV 2006-03-15 Provet omfattar 6 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Konstanter som inte ges i problemtexten, hämtas
Huvudansökan, kandidatprogrammet i kemi Urvalsprov kl
 Tekniska anteckningar: KEMIA Sida: 1 (14) Huvudansökan, kandidatprogrammet i kemi Urvalsprov 9.5.2018 kl. 10.00 13.00 Skriv ditt namn och dina personuppgifter med tryckbokstäver. Skriv ditt namn med latinska
Tekniska anteckningar: KEMIA Sida: 1 (14) Huvudansökan, kandidatprogrammet i kemi Urvalsprov 9.5.2018 kl. 10.00 13.00 Skriv ditt namn och dina personuppgifter med tryckbokstäver. Skriv ditt namn med latinska
Tentamen i Allmän kemi 7,5 hp 5 november 2014 ( poäng)
 1 (6) Tentamen i Allmän kemi 7,5 hp 5 november 2014 (50 + 40 poäng) Tentamen består av två delar, räkne- respektive teoridel: Del 1: Teoridel. Max poäng: 50 p För godkänt: 28 p Del 2: Räknedel. Max poäng:
1 (6) Tentamen i Allmän kemi 7,5 hp 5 november 2014 (50 + 40 poäng) Tentamen består av två delar, räkne- respektive teoridel: Del 1: Teoridel. Max poäng: 50 p För godkänt: 28 p Del 2: Räknedel. Max poäng:
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Innehåll Kapitel 3 Stökiometri 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 3.7 3.8 Kemiska reaktionslikheter 3.9 3.10 3.11 Copyright Cengage Learning.
Kapitel 3 Innehåll Kapitel 3 Stökiometri 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 3.7 3.8 Kemiska reaktionslikheter 3.9 3.10 3.11 Copyright Cengage Learning.
Kemiprovet har 11 uppgifter av vilka examinanden svarar på högst sju uppgifter. Det maximala antalet poäng är 120.
 30.1.2018 Meddelande till lärare och studerande i kemi Det digitala studentprovet i kemi Det digitala studentexamensprovet i kemi anordnas för första gången på hösten 2018. I detta meddelande beskrivs
30.1.2018 Meddelande till lärare och studerande i kemi Det digitala studentprovet i kemi Det digitala studentexamensprovet i kemi anordnas för första gången på hösten 2018. I detta meddelande beskrivs
Kapitel 18. Elektrokemi. oxidation-reduktion (redox): innebär överföring av elektroner från ett reduktionsmedel till ett oxidationsmedel.
 Kapitel 18 Innehåll Kapitel 18 Elektrokemi 18.1 Balansera Redoxreaktionslikheter 18.2 Galvaniska celler 18.3 Standardreduktionspotentialer 18.4 Cellpotentialer, Elektriskt arbete och Fri energi 18.5 Cellpotentialens
Kapitel 18 Innehåll Kapitel 18 Elektrokemi 18.1 Balansera Redoxreaktionslikheter 18.2 Galvaniska celler 18.3 Standardreduktionspotentialer 18.4 Cellpotentialer, Elektriskt arbete och Fri energi 18.5 Cellpotentialens
Vätebindningar och Hydro-FON-regeln. Niklas Dahrén
 Vätebindningar och Hydro-FON-regeln Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Vätebindningar och Hydro-FON-regeln Niklas Dahrén Indelning av kemiska bindningar Jonbindning Bindningar mellan jonerna i en jonförening (salt) Kemiska bindningar Metallbindning Kovalenta bindningar Bindningar
Jonföreningar och jonbindningar del 1. Niklas Dahrén
 Jonföreningar och jonbindningar del 1 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Jonföreningar och jonbindningar del 1 Niklas Dahrén Innehåll Del 1: o Hur jonföreningar bildas/framställs. o Hur jonföreningar är uppbyggda (kristallstruktur). o Jonbindning. o Hur atomernas radie påverkas
Kapitel 18. Elektrokemi
 Kapitel 18 Elektrokemi Kapitel 18 Innehåll 18.1 Balansera Redoxreaktionslikheter 18.2 Galvaniska celler 18.3 Standardreduktionspotentialer 18.4 Cellpotentialer, Elektriskt arbete och Fri energi 18.5 Cellpotentialens
Kapitel 18 Elektrokemi Kapitel 18 Innehåll 18.1 Balansera Redoxreaktionslikheter 18.2 Galvaniska celler 18.3 Standardreduktionspotentialer 18.4 Cellpotentialer, Elektriskt arbete och Fri energi 18.5 Cellpotentialens
