Information från. Läkemedelsverket. Handläggning av faryngotonsilliter i öppen vård ny rekommendation. Nya läkemedel.
|
|
|
- Gunilla Dahlberg
- för 8 år sedan
- Visningar:
Transkript
1 Information från Läkemedelsverket Årgång 23 nummer 6 december 2012 sid 18 Handläggning av faryngotonsilliter i öppen vård ny rekommendation Faryngotonsillit är en av de vanligaste infektionsdiagnoserna i svensk primärvård och leder uppskattningsvis till cirka läkarbesök varje år. Läkemedelsverket och Smittskyddsinstitutet har tillsammans med specialister inom området tagit fram rekommendationerna för diagnostik och behandling av barn och vuxna med halsinfektioner. sid 5 Användning av misoprostol för förlossningsinduktion Läkemedelsverket har utrett om den spridda användningen av misoprostol för förlossningsinduktion, utanför godkänd indikation, kan innebära en säkerhetsrisk. Efter en sammanvägning av resultaten är rekommendationen att läkemedel godkända för förlossningsinduktion bör användas. sid 8 Läkemedelsanvändning utanför godkänd indikation inom veterinärmedicinen Läkemedelsverket har i samarbete med Jordbruksverket och Livsmedelsverket skrivit en artikel om användning av läkemedel utanför godkänd indikation inom djursjukvården. Veterinärens ansvar och möjligheter diskuteras. sid 67 Nya läkemedel Caprelsa (vandetanib) Daxas (roflumilast) Fluenz (vaccin mot influensa) Gilenya (fingolimod) Signifor (pasireotid) Zelboraf (vemurafenib) RevitaCAM (meloxikam) Veraflox (pradofloxacin) Ziara (extrakt av Vitex agnus-castus L., fructus [munkpepparfrukt]) sid 12 Läkemedel eller medicinteknisk produkt? Läkemedel och medicintekniska produkter regleras av olika regelverk, men ibland är det svårt att avgöra vilken kategori en produkt tillhör. För att fälla avgörandet behövs en helhetsbedömning av både syftet med produkten och dess huvudsakliga effekt. sid 91 TLV informerar approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information inspection laboratory analysis market surveillance medicinal products medical devices narcotics public health quality registration regulations reliability risk/benefit safety scientific standardisation transparency vigilance approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information inspection laboratory analysis market surveillance medicinal products medical devices narcotics public health quality registration regulations reliability
2 LEDARSIDA Med fokus på ändåmålsenlig antibiotikaanvändning Vi är inne i december månad julmånaden. Det är också en månad då många av oss brottas med förkylningar och andra typer av infektionssjukdomar. Om och av vem antibiotika ska användas vid infektioner är en ständigt närvarande diskussion inom vården. WHO klassar i dag förekomsten av antibiotikaresistenta bakteriestammar som ett av våra största globala folkhälsoproblem. Utvecklingstakten av nya antibiotika är dessutom låg, vilket leder till att allt färre läkemedel idag kan sättas in mot de bakteriestammar som utvecklat resistens. Varje år i november uppmärksammas problemet med antibiotikaresistens under European Antibiotic Awareness Day. I Sverige arrangerade Socialstyrelsen och Jordbruksverket ett nationellt antibiotikaforum den 16 november där Läkemedelsverket och ett flertal andra aktörer inom hälso-, sjukvårds- och miljösektorn bjöds in för att beskriva på vilka sätt man genom samverkan stimulerar utvecklingen av nya effektiva antibiotika, hur man bidrar till en mer rationell antibiotikaanvändning samt hur man når en hållbar läkemedelsproduktion ur ett miljöperspektiv. Forskningsprogrammet MistraPharma, där Läkemedelsverket representeras både i styrelse och referensgrupp, har visat att läkemedel kan leda till extremt stora miljöutsläpp och att antibiotikautsläpp gynnar multiresistenta bakterier i miljön. Forskningsfynden har bland annat resulterat i att svenska landsting, inklusive VG-regionen, nu är först ut i världen med att ställa krav kring utsläpp från produktion när de upphandlar läkemedel till sjukvården. Läkemedelsverket arbetar även inom ramen för den nationella läkemedelsstrategin tillsammans med ett antal olika myndigheter och organisationer inom hälso-, sjukvårds- och miljösektorn för att bromsa utvecklingen och spridningen av antibiotikaresistens samt för att stödja utvecklingen av nya och effektiva antibiotika. I detta nummer finns en kort presentation av Läkemedelsverkets kansli Centrum för bättre läkemedelsanvändning, som har ett samordningsansvar för den nationella läkemedelsstrategin. I förra numret kunde du läsa om behandlingsrekommendationerna för antibiotikaprofylax inom tandvården. I detta nummer ligger fokus på den nya och uppdaterade behandlingsrekommendationen för handläggning av faryngotonsillit i öppenvården. Båda dessa behandlingsrekommendationer är framtagna i samverkan med Smittskyddsinstitutet som en del av ett regeringsuppdrag. Generellt rekommenderas en restriktiv hållning till antibiotikabehandling vid faryngotonsillit. Det är dock viktigt att de fall som kan utvecklas till allvarlig sjukdom identifieras och att dessa patienter får adekvat behandling. Inte bara människor utan även djur kan drabbas av luftvägsinfektioner som kräver behandling. På sidan 14 kan du även läsa om ett nytt antibiotikum, florfenikol, som är godkänt för behandling av just luftvägsinfektioner hos nötkreatur och svin. I detta nummer finns också ett stort antal läkemedelsmonografier som du kan ta del av. Trevlig läsning! Jag vill också redan nu passa på att önska dig en riktig God Jul och ett Gott Nytt 2013! Christina Åkerman Generaldirektör Ansvarig utgivare: Christina Rångemark Åkerman Information från Läkemedelsverket Box 26, Uppsala Telefon Telefax E-post: tidningsredaktion@mpa.se Redaktion: Kristina Bergström, Malika Hadrati, Christina Hambn och Pernilla Örtqvist. Ytterligare exemplar kan rekvireras från: Läkemedelsanvändning, Medicinsk information ISSN Tryck: Taberg Media AB, 2012 Har du ändrat adress? Vill du ha tidningen till en ny adress ber vi dig skicka både din nya och gamla adress till oss via e-post eller brev. 2 Information från Läkemedelsverket 6:2012
3 Innehåll Nyheter och rapporter Användning av misoprostol för förlossningsinduktion... 5 Ny svensk ordförande i europeiska läkemedelsmyndighetens vetenskapliga kommitté... 6 CBL-kansliets roll i den nationella läkemedelsstrategin... 7 Läkemedelsanvändning utanför godkänd produktinformation inom veterinärmedicinen... 8 Gränslandet mellan medicinteknik och läkemedel.. 12 Florfenikol nytt antibiotikum för nötkreatur och grisar på den svenska marknaden Frågor till Läkemedelsverket Frågor till Läkemedelsverket Går tabletten att krossa? Hur mycket natrium innehåller brustabletterna? Utomlands kan man få långa antibiotikakurer mot borreliainfektioner. Varför rekommenderas tre veckors behandling i Sverige? Handläggning av faryngotonsilliter i öppen vård Nya läkemedel Caprelsa (vandetanib) Daxas (roflumilast) Fluenz (vaccin mot influensa) Gilenya (fingolimod) Signifor (pasireotid) Zelboraf (vemurafenib) RevitaCAM (meloxikam) Veraflox (pradofloxacin) Digital publicering Atopica, Cardalis vet., Fortekor vet., Purevax rabies, Ziara (extrakt av Vitex agnus-castus L., fructus [munkpepparfrukt]) Tandvårds- och läkemedelsförmånsverket informerar TLV informerar Tidigare utgivna nummer Tidigare utgivna nummer Ny rekommendation Bakgrundsdokumentation Bakgrund Invasiva grupp A-streptokockinfektioner Purulenta komplikationer till streptokocktonsillit.. 33 Immunologiska komplikationer till streptokockinfektioner Bärarskap och smittspridning av grupp A-streptokocker Om faryngotonsillit hos barn Mikrobiologisk och klinisk diagnostik Effekt av behandling med antibiotika på symtom, sjukdomsförlopp och komplikationer vid faryngotonsillit Behandlingsaspekter på faryngotonsillit orsakad av grupp A-streptokocker antibiotikaval, återfall, kirurgi samt kommunikationen mellan patient och läkare Läkemedel för behandling av faryngotonsillit användning/försäljning, biverkningar samt ekologiska effekter Information från Läkemedelsverket 6:2012 3
4 nyheter och rapporter Ur programmet Barns användning av läkemedel Långtidsuppföljning av läkemedelsbehandling till barn Utveckling av läkemedel till barn Nationellt kunskapsstöd för barns läkemedel Piller i pannkakor och pasta om anpassning av läkemedel till barn Bland talarna Göran Hägglund, Trond Markestad, Richard Bergström, Per Nydert, Gisela Dahlqvist, Synnöve Lindemalm, Birgitta Strandvik, Helle Kieler, Linda Halldner Henriksson, Mikael Hoffman, Pernilla Båtsby, Elin Kimland, Viveca Odlind, Niklas Hedberg, Måns Rosén, Christina Åkerman 4 Information från Läkemedelsverket 6:2012
5 nyheter och rapporter Nyheter och rapporter Söker du nyheter om bristsituationer, indragningar eller säkerhetsfrågor? På vår webbplats, publicerar vi löpande information om detta, men även om större utredningar, lagändringar och mycket annat. Här följer artiklar om aktuella frågor vi vill informera om. Användning av misoprostol för förlossningsinduktion Tabletten Cytotec 200 µg, som innehåller prostaglandin E1-analogen misoprostol, är godkänd i Sverige sedan lång tid för behandling av magsår. Läkemedelsverket har uppmärksammat att Cytotec används vid flera av landets kvinnokliniker för att sätta igång förlossningar. Trots att studier visat att misoprostol kan användas för igångsättning av förlossning, har läkemedelsföretaget Pfizer, som har tillståndet för marknadsföring av Cytotec, aldrig ansökt om denna indikation. Läkemedelsverkets rekommendation är att läkemedel godkända för förlossningsinduktion bör användas. Den beskrivna användningen av Cytotec vid förlossningsinduktion innebär att en tablett på 200 µg löses upp i vatten och sedan ges en dos av vattenlösningen som förmodas motsvara µg. Behandlingen upprepas eventuellt inom tre till sex timmar. Den fria förskrivningsrätten ger läkare rätt att använda läkemedel utanför indikationsområdet. Det finns emellertid läkemedel för förlossningsinduktion på marknaden, vilka har genomgått sedvanlig myndighetsgranskning vad gäller läkemedelsform, dosering, effekt och säkerhet och godkänts för förlossningsinduktion. Av detta skäl beslöt Läkemedelsverket utreda om en omfattande så kallad off-label-användning av Cytotec för förlossningsinduktion kunde anses utgöra en säkerhetsrisk. Utredningen Läkemedelsverket tog kontakt med Statens Beredning för Medicinsk Utvärdering (SBU) för en litteraturgenomgång. Vidare analyserades beredningsmetoden att lösa upp Cytotectabletter i vatten vad gäller dosnoggrannhet vid Läkemedelsverkets laboratorium. Läkemedelsverket tog även kontakt med styrelsen för Svensk Förening för Obstetrik och Gynekologi (SFOG) angående deras syn på användningen. Följande fråga ställdes till SBU, vars Upplysningstjänst gjorde en litteratursökning: Vilken evidens finns för säkerhet och effekt vid användande av misoprostol (Cytotec) vid förlossningsinduktion? SBU sammanfattade sin utredning enligt följande: Förlossningsinduktion är ett relativt väl beforskat område. Det finns två Cochrane-översikter över förlossningsinduktion med misoprostol, en rör vaginalt bruk och en när det tas via munnen. Dessutom finns en systematisk översikt publicerad Dessa konstaterar att misoprostol är effektivt vid förlossningsinduktion och dessutom förefaller säkert. Det finns en viss ökad risk för mekonium (avföring från barnet) i fostervattnet men man tror att det beror på misoprostols direkta effekter på barnets tarm snarare än på att barnet är stressat. Man har också sett en viss ökning av förändringar i barnets hjärtljud, men detta har inte kunnat kopplas till sämre Apgar eller ökat behov av inläggning på neonatal intensivvård. Följande fråga ställdes till Läkemedelsverkets laboratorium: Hur exakt blir dosen när man löser upp en tablett Cytotec, 200 µg, och sedan ger en vätskemängd motsvarande 20 µg eller 25 µg till patienten? I laboratorieutredningen (som finns att läsa i sin helhet på Läkemedelsverkets webbplats) analyserades två beredningsmetoder för Cytotec, vilka används vid Södersjukhuset (SÖS) respektive Skånes universitetssjukhus, Malmö (MAS). En analysmetod utvecklades och validerades vid Läkemedelsverkets laboratorium. För varje analys bereddes tio tabletter till tio prover och haltbestämningar utfördes vid två tillfällen av två olika analytiker. Resultaten framgår av Tabell I. MAS-protokollet beskriver att ytterligare uttag kan göras. Därför gjordes ett uttag tre timmar efter beredning. Analysen visade bibehållen dosnivå (18,5 19,8 µg/dos, medelvärde 19,2) och uppfyllda dosnoggrannhetskrav. Beredning som stått längre tid än tre timmar har inte analyserats. Tabell I. Beredningsmetod Uppmätt dos, medelvärde (µg) Uppmätt dos, intervall (µg) Teoretisk dos (µg) Andel av teoretisk dos (%) MAS 19,7 19,5 20, ,3 MAS 19,2 18,6 20, ,9 SÖS* 23,6 21,8 24, ,5 *Det första SÖS-provet upparbetades under alltför kort tid, varför resultaten inte redovisas här. Se rapport för utförligare förklaring. Information från Läkemedelsverket 6:2012 5
6 nyheter och rapporter Analyserna visar att uppmätta doser i beredningar, utförda enligt MAS- och SÖS-protokoll på det sätt som de är utförda på Läkemedelsverkets laboratorium, uppfyller uppsatta krav på dosnoggrannhet enligt Europafarmakopén. SFOG:s uppfattning är att användningen av misoprostol för förlossningsinduktion, som stöds av ett stort antal vetenskapliga publikationer, uppfyller kraven på vetenskap och beprövad erfarenhet. Kommentar och slutsats SBU:s litteraturgenomgång ger stöd för att användningen av misoprostol för förlossningsinduktion är dokumenterad i litteraturen vad gäller effekt och säkerhet. Vidare talar analyserna vid Läkemedelsverkets laboratorium för att det tycks föreligga acceptabel dosnoggrannhet när användningen sker så som beskrivits från två kliniker. Förlossningsklinikernas uppfattning, speglad i SFOG:s svar, innebär att man anser att användningen av misoprostol vid förlossningsinduktion uppfyller kraven på vetenskap och beprövad erfarenhet. Läkemedelsverkets utredning ger således inte stöd för att användningen, så som den beskrivits från två kliniker, innebär hotad patientsäkerhet. Det är inte känt om andra förlossningskliniker bereder, doserar eller använder misoprostol på annorlunda sätt vid förlossningsinduktion. Beträffande det vetenskapliga stödet bör framhållas att SBU:s sammanfattning av effekt och säkerhet vid förlossningsinduktion baseras på publicerade studier och att någon regelrätt granskning av grunddata, så som normalt sker inför godkännande av ett läkemedel, inte har gjorts eftersom läkemedelsföretaget aldrig ansökt om denna indikation. Därför är Läkemedelsverkets rekommendation att läkemedel godkända för förlossningsinduktion bör användas. Ny svensk ordförande i europeiska läkemedelsmyndighetens vetenskapliga kommitté Den europeiska läkemedelsmyndigheten EMA:s vetenskapliga kommitté för humanläkemedel (CHMP) valde den 17 september 2012 Tomas Salmonson, senior vetenskaplig rådgivare på Läkemedelsverket, till ordförande för den kommande treårsperioden. Tomas Salmonson har varit vice ordförande sedan 2007 och säger själv att det är otroligt glädjande och hedrande att bli vald till ordförande för CHMP, som har ett viktigt uppdrag. Sverige har länge bidragit aktivt till att driva och främja det europeiska arbetet för folkhälsan och han är mycket förväntansfull att ta över ordförandeklubban och fortsätta att leda arbetet framåt. Den europeiska läkemedelsmyndigheten, EMA, har sitt säte i London och ansvarar för den vetenskapliga utvärderingen av läkemedel för användning inom EU. Myndigheten består av sju kommittéer, varav CHMP är en. Samtliga EU- och EEA-EFTAländer är representerade i CHMP, vars ansvar är att bereda myndighetens vetenskapliga yttranden i frågor som rör läkemedel för humant bruk. Tomas Salmonson. Foto: Jeanette Hägglund. 6 Information från Läkemedelsverket 6:2012
7 nyheter och rapporter Centrum för bättre läkemedelsanvändning Läkemedelsverket fick 2011 i uppdrag av regeringen att bilda ett kansli, Centrum för bättre läkemedelsanvändning (CBL). Syftet är att samordna den nationella läkemedelsstrategin (NLS) med visionen Rätt läkemedel till nytta för patient och samhälle. CBL-kansliets ansvar är uppföljning och samordning på insats- och målnivå i samverkan med aktörer inom läkemedelsområdet och att kommunicera resultaten till sjukvård, allmänhet och andra berörda. De långsiktiga målsättningarna är medicinska resultat i världsklass, en jämlik vård, en kostnadseffektiv läkemedelsanvändning, attraktivitet inom innovation av produkter och tjänster och en minimal miljöpåverkan där det på årsbasis upprättas en handlingsplan med tydliga och tidssatta aktiviteter i syfte att förverkliga dessa mål genom följande sju insatsområden: 1. Skapa en bättre och säkrare ordinationsprocess och lägga grunden för generisk förskrivning genom nationellt samordnade IT-stöd. 2. Öka samsyn och förståelse för ordinerad behandling. 3. Utveckla kunskap om och riktlinjer för läkemedel och läkemedelsanvändning för de patientgrupper där detta är mest eftersatt. 4. Minska utveckling och spridning av antibiotikaresistens genom en kombination av lokala och globala insatser. 5. Utveckla långsiktigt hållbar prissättnings-, prioriterings- och finansieringsmodell för samtliga läkemedel. 6. Upprätta en process för ordnat och effektivt införande samt utöka uppföljning av läkemedlens användning och effekter. 7. Minska läkemedlens påverkan på miljön lokalt och globalt. Arbetet med läkemedelsstrategin leds av en utsedd s.k. högnivågrupp med Socialdepartementet som ordförande och med representanter för Läkemedelsindustriföreningen, Läkemedelsverket, Smittskyddsinstitutet, Socialstyrelsen, Statens beredning för medicinsk utvärdering, Sveriges Apoteksförening, Sveriges Kommuner och Landsting, Sveriges läkarförbund, Tandvårds- och läkemedelsförmånsverket samt ett antal landsting och regioner. CBL-kansliet har även bildat rådet för bättre läkemedelsanvändning (CBL-rådet) med cirka 20 medlemmar som representerar olika myndigheter och organisationer i syfte att vi ska få en så bred förståelse och delaktighet från berörda inom läkemedelsområdet som möjligt. Tidigare har det inte funnits en sådan bred nationell samverkan inom läkemedelsområdet för att skapa gemensamma mål och prioriteringar för att åstadkomma rätt läkemedelsanvändning till nytta för patient och samhälle. Den unika samverkansformen mellan myndigheter och organisationer kommer att bidra till en mer säkrare, effektivare, mer innovativ och jämlikare läkemedelsbehandling för patienter i Sverige. För ytterligare information om den nationella läkemedelsstrategin och den reviderade handlingsplanen för 2013, se Information från Läkemedelsverket 6:2012 7
8 nyheter och rapporter Läkemedelsanvändning utanför godkänd produktinformation inom veterinärmedicinen Artikeln är skriven i samarbete med Jordbruksverket och Livsmedelsverket. Det finns inte alltid godkända läkemedel att tillgå för behandling av djur och av olika skäl kan det finnas behov av att frångå de rekommendationer som ges i den godkända produktresumén. Därför ges veterinärer möjlighet att förskriva även läkemedel som inte är godkända för djurslaget och indikationen i fråga ( kaskadanvändning ) och att vid behov avvika från produktinformationens uppgifter om till exempel dos eller behandlingstidens längd. I nedanstående artikel diskuterar författaren sådan off label-användning och pekar på veterinärens möjligheter och ansvar. Att avvika från produktresumén När marknadsföringstillstånd för ett läkemedel beviljas bedöms produktens kvalitet, säkerhet och effekt. Det förutsätts då att läkemedlet kommer att användas på det sätt företaget avser och detaljer om den godkända användningen presenteras i en produktresumé (Summary of Product Characteristics, SPC). SPC:n är en del av godkännandet och används som grund för all marknadsföring (till exempel i FASS vet.). Veterinärer är dock inte begränsade till SPC:n utan kan förskriva läkemedel med avvikande rekommendationer för hur de ska användas och även förskriva läkemedel som alls inte godkänts för djurslaget i fråga i Sverige. I vissa fall, till exempel för ovanliga tillstånd eller djurslag som sällan behandlas, kanske det inte finns godkända alternativ på marknaden utan veterinären blir hänvisad till att förskriva utanför godkänd indikation. Sådan förskrivning beskrivs i ett EU-direktiv (artikel 10 och 11 av läkemedelsdirektivet 2001/82/EC med ändringar) och går under smeknamnet kaskaden eftersom det som beskrivs är en möjlighet att få tillgång till många fler produkter än de godkända. Dessa artiklar har införlivats i svensk författning i Statens jordbruksverks föreskrifter (SJVFS 2009:84) om läkemedel och läkemedelsanvändning, (Faktaruta 1). Föreskriften medger behandling utanför godkänd indikation men endast undantagsvis. Genom att välja uttryck som endast i undantagsfall markeras att en sådan förskrivning ska hållas på ett minimum. För livsmedelsproducerande djur gäller särskilda regler vid förskrivning utanför godkänd indikation, bland annat måste den aktiva substansen och alla övriga ingående ingredienser finnas listade i tabell I till Kommissionens förordning (EG) nr 37/2010 (MRL-förordningen). Vid användning enligt kaskaden räcker det med att substansen är inplacerad i listan för ett djurslag. Speciella regler gäller vid användning av hormoner, beta-agonister och tyreostatika, se rådets direktiv 96/22 med ändringar. För hästar finns också möjlighet att använda ämnen från sexmånaderslistan (Kommissionens förordning [EG] nr 1950/2006) och ytterligare läkemedel kan användas till häst, under förutsättning att hästen aldrig går till slakt. Sådan behandling, och att hästen för all framtid utesluts från livsmedelsproduktion, måste anges i hästpasset. Vid användning av läkemedel till livsmedelsproducerande djur gäller den karenstid som fastställs för djurslaget och vävnaden i fråga även vid förskrivning utanför godkänd indikation förutsatt att dygnsdosen och administreringssättet inte ändras. Om karenstid inte fastställts för djurslaget och administreringssättet i fråga kan man tilllämpa en generell karenstid. En förutsättning är då att substansen är listad i tabell I till 37/2010 (se Faktaruta 2). För produkter som används på licens (Läkemedelsverkets föreskrifter [LVFS 2008:1] om tillstånd till försäljning av icke godkänt läkemedel) gäller den karenstid Läkemedelsverket fastställt. Användning utanför godkänd produktresumé i Sverige Varken i Sverige eller i något annat EU-land finns statistik som tydligt visar hur mycket av användningen som sker utanför godkänd SPC. Det finns inget regelverk som reglerar hur och när en veterinär får frångå till exempel godkänd dos (mer än att karenstiden ska anpassas i förekommande fall, se Faktaruta 2) utan detta regleras bara av allmänna skrivningar i föreskrifter som handlar om veterinärens yrkesutövning och god veterinär behandlingssed. Den enda möjligheten om man vill bedöma veterinärers följsamhet är att undersöka i vilken utsträckning de produkter som förskrivs verkligen är godkända för djur. När det gäller förskrivning till djur av humanmedicinska produkter finns information som tyder på generellt god följsamhet. Trots att ett stort antal produkter försålts under 2010, särskilt till sällskapsdjur (Tabell I) motsvarar detta endast en relativt liten del av den totala försäljningen av läkemedel för användning till djur (Tabell II). Det saknas underlag för att bedöma i vilken utsträckning användningen av humanläkemedel sker i enlighet med lagstiftarens intention enligt D 9 eller om denna användning innebär problem. Statistiken omfattar heller inte veterinärmedicinska läkemedel godkända i annat land eller ex tempore-beredningar. Inte heller finns uppgifter om hur ofta veterinären väljer att frångå rekommendationer i godkänd SPC vid förskrivning (till exempel ändrad dos eller förskrivning på annan indikation). 8 Information från Läkemedelsverket 6:2012
9 nyheter och rapporter Tabell I. Antal produkter försålda mot recept (oavsett beredningsform och styrka men exklusive infusioner och tvättlösningar) enligt Apotekets försäljningsstatistik för Djurslag Human Veterinär Totalt Andel veterinärläkemedel Hund % Katt % Häst % Nötkreatur % Får % Höns % Gris % Get % Tabell II. Antal förpackningar försålda mot recept exklusive infusions- och tvättlösningar, sterilt vatten och Isopto Maxidex enligt Apotekets försäljningsstatistik för Djurslag Human Veterinär Andel veterinärläkemedel Hund % Katt % Get % Häst % Höns % Får % Nötkreatur > 99 % Gris > 99 % Saknar djurslag % Totalt % Medicinska behov Syftet med att tillåta användning av icke godkända läkemedel i vissa fall, är att fylla ett medicinskt behov som inte kan tillgodoses på annat sätt för att minska djurs lidande. Lagstiftaren tycks dock ha förutsatt att denna situation sällan uppstår vilket inte stämmer helt med verkligheten. Eftersom Sverige representerar en liten marknad för veterinärläkemedel är det ibland inte ekonomiskt möjligt för företag att hålla godkända produkter tillgängliga på marknaden. Exempelvis kan det bedömas vara olönsamt att trycka svenska förpackningar om försäljningsvolymen är liten. Därför finns det terapiområden framför allt inom specialiserad smådjurs- och hästsjukvård där det saknas godkända behandlingsalternativ. Veterinärer kan då hänvisas till att förskriva icke godkända produkter rutinmässigt på daglig basis, vilket naturligtvis är olyckligt inte minst med tanke på ansvarsfrågan i de fall en behandling visar sig vara olämplig i det enskilda fallet. Förskrivning av ett godkänt läkemedel ger veterinären gott stöd genom den information om läkemedlets effekt och säkerhet som företagen tagit fram inför godkännandet. Utan denna information lämnas veterinären ensam i sitt ställningstagande. Tyvärr måste vi räkna med att det alltid kommer att saknas vissa produkter i terapiarsenalen, framför allt för ovanliga indikationer och djurslag som sällan behandlas. EU-kom- Information från Läkemedelsverket 6:2012 9
10 nyheter och rapporter missionen har uppmärksammats på att ordvalen i direktivtexten är svårtillämpade då de anger att kaskadförskrivning bara får ske undantagsvis trots att det uppenbarligen kan finnas behov på daglig basis. I den EU-gemensamma lagstiftningen finns inga begränsningar för i vilka substanser som får användas till sällskapsdjur. Som angetts ovan finns dock begränsningar när det gäller användning av läkemedel till livsmedelsproducerande djur. Sverige har dock nyligen (på samma sätt som Finland tidigare) infört begränsningar vad gäller vissa antibiotika som anses särskilt skyddsvärda inom humanmedicinen. Det rör sig om en lista substanser som används för att behandla anmälningspliktiga sjukdomar hos människa och där antibiotikaresistens kan överföras mellan djur och människor. Dessa substanser listas i bilaga 1 till SJVFS 2009:84; D9 4a (Faktaruta 1) och får endast användas då det föreligger synnerliga skäl). Nämnas bör också att det är veterinärens ansvar att hålla sig uppdaterad vad gäller nya läkemedel på marknaden. Exempelvis förskrevs under 2010 över förpackningar med humanläkemedlet Levaxin trots att det numera finns motsvarande läkemedel godkänt till hund, och detta kan inte anses försvarbart. Vetenskap och beprövad erfarenhet Föreskriften som reglerar kaskadanvändning refererar till behovet av att det finns läkemedel tillgängliga för att behandla vissa sjukdomstillstånd. Det förutsätts att produkter som godkänns för användning vid en viss sjukdom alltid är lämpliga för att behandla sjukdomen i fråga och detta stämmer inte alltid med verkligheten. Veterinären väljer inte produkt bara utifrån indikation utan även utifrån verkningsmekanism, säkerhetsprofil etc. Här uppstår ett påtagligt dilemma till exempel vid förskrivning av antibiotika. Ett exempel: Om en veterinär vill förskriva på ett sätt som kombinerar god effekt med låg risk för biverkningar och resistensutveckling så kommer han eller hon kanske att vilja välja penicillin vid en infektion som efter provtagning visat sig vara orsakad av känsliga bakterier, eller där man erfarenhetsmässigt vet att penicillin bör fungera. Om djurslaget är hund eller katt uppstår det dock problem, för någon produkt innehållande penicillin i lämplig oral beredningsform (penicillin V) finns för närvarande inte godkänd till dessa djurslag. För veterinären återstår då att använda humanläkemedel. Om de produkter som finns godkända kan antas ge allvarliga biverkningar eller terapisvikt kan humanläkemedlet väljas utan att kaskadprincipen sätter hinder i vägen. Detta får anses gälla även när syftet är att förhindra antibiotikaresistens som i exemplet ovan. Praktiska överväganden Det finns ett antal omständigheter som gör att det ibland inte är praktiskt möjligt att använda godkända läkemedel. Det kan till exempel vara aspekter på beredningsform, styrka, möjlighet att administrera etc. som förskrivande veterinär tar hänsyn till. Det är svårt att dra gränsen för när det skulle vara olämpligt att förskriva ett icke godkänt alternativ. Det mest uppenbara exemplet på när sådan förskrivning inte är acceptabel är när den enda viktiga skillnaden mellan det godkända och det icke godkända alternativet är priset. Även om det naturligtvis uppskattas av djurägare när ett läkemedel är billigare så bidrar detta till snedvridning av konkurrensen eftersom det premierar det läkemedelsföretag som inte bidragit till att ta fram data för att säkerställa läkemedlets effekt och säkerhet för djurslaget och indikationen i fråga. Alternativa doseringsanvisningar Det kan finnas skäl för förskrivaren att avvika från rekommenderad dosering. För livsmedelsproducerande djur föreskrivs i LIVSFS 2009:3, ändrad i 2012:8 (H65) (Faktaruta 2), att karenstiden i sådana fall ska förlängas proportionellt, men i övrigt finns inga rekommendationer för hur veterinärer ska förhålla sig till doseringsavsnittet i SPC:n. Den veterinär som önskar ändra doser kan göra det fritt under eget ansvar, baserat på vetenskap och beprövad erfarenhet. Det finns tillfällen då en högre dos än den godkända kan behövas, till exempel för vissa antibiotika som varit godkända länge och där SPC:n inte uppdaterats av företaget utan informationen baseras på doser som ansågs lämpliga för många år sedan. Om till exempel målbakterierna har minskat sin känslighet över tid kan det vara så att en högre dos ger ett bättre behandlingsresultat. Svårigheten med antibiotika är också att olika doser kan leda till olika risknivåer vad gäller antibiotikaresistens och även detta är veterinärens ansvar att känna till om man förskriver en annan dos än den godkända. Tyvärr finns det dock i praktiken sällan bra information tillgänglig som möjliggör för veterinären att ta sådana hänsyn. Läkemedelsverket har publicerat rekommendationer för dosering av antibiotika till gris och en motsvarande publikation gällande nötkreatur är under utarbetande. En viktig sak att tänka på är att karenstiden påverkas av dosen. Inte heller här finns några enkla lösningar. En proportionell förlängning i förhållande till dosökningen är sannolikt tillräcklig i de flesta fall, men några garantier finns inte för att resthalterna kommer att understiga gränsvärdet (MRL). Restriktioner avsedda att minska risken för antibiotikaresistens I vissa fall innehåller SPC:n rekommendationer om att antibiotika inte ska användas rutinmässigt. Före godkännandet görs en riskvärdering avseende antibiotikaresistens och för att minska sådana risker begränsas godkännandet. Ett exempel är produkter innehållande tredje generationens cefalosporiner där det skrivs att: <Produktnamn> selekterar resistenta stammar såsom bakterier som producerar betalaktamaser med utvidgat spektrum (ESBL) som kan utgöra en risk för människors hälsa om dessa stammar sprids till människan, till exempel via livsmedel. Därför bör användning av <Produktnamn> reserveras för behandling av kliniska tillstånd som har svarat dåligt, eller förväntas svara dåligt (avser mycket akuta fall då behandling måste inledas utan bakteriologisk diagnos) på förstahandsbehandling. Vid användning av läkemedlet ska hänsyn tas till de officiella, nationella och lokala riktlinjerna för användning av antimikrobiella medel. Ökad användning, inklusive användning som avviker från anvisningarna i produktresumén, kan öka prevalensen av sådan resistens. Om det är möjligt bör <Produktnamn> endast användas baserat på känslighetstest. 10 Information från Läkemedelsverket 6:2012
11 nyheter och rapporter <Produktnamn> är avsett för behandling av enskilda djur. Får inte användas för att förebygga sjukdom eller som en del av hälsoprogram för besättningar. Behandling av grupper av djur ska begränsas strikt till pågående sjukdomsutbrott i enlighet med villkoren för godkänd användning. Inför beslut om behandlingsstrategi är det lämpligt att överväga förbättring av rutinerna för djurhållningen och ge stödjande behandling med lämpliga lokala medel (t.ex. desinfektionsmedel). Motsvarande skrivningar finns för godkända produkter som innehåller fluorokinoloner. Principer för vad som kan anses vara acceptabel användning av kinoloner och vissa cefalosporiner under svenska förhållanden finns numera även listade i D9. Samtidig användning av flera läkemedel Det står varje veterinär fritt att bedöma hur många läkemedel ett visst djur behöver. Men liksom vid användning utanför godkänd SPC läggs ansvaret på den förskrivande veterinären när det gäller att bedöma vilka läkemedel som kan ges samtidigt utan risk för försämrad effekt eller förvärrat biverkningsmönster. Såväl kinetiska som dynamiska läkemedelsinteraktioner måste beaktas och det är sällan den information som finns i SPC:n är tillräcklig för att veterinären ska kunna bedöma kombinationens effekt och säkerhet. Summary Off label use is and will likely remain an important part of the use of veterinary medicinal products in Sweden. The veterinarians need to be aware of their increased responsibility when prescribing medicines which have not been investigated in appropriately designed clinical trials and approved for use with a certain indication in the certain animal species. This includes considerations regarding possible residues in food of animal origin. Of special importance is to note that approved products should be used when available unless these are clearly unsuitable e.g. due to experienced intolerance or therapy failure. In case of warnings and other recommendations e.g. applied to mitigate risk for antimicrobial resistance these should always be complied with. Faktaruta 1. SJVFS 2009:84; D9. 1 En veterinär ska i första hand förskriva och tillhandahålla läkemedel som är godkända i Sverige för aktuellt tillstånd hos det djurslag som ska behandlas. 2 I det fall det inte finns något godkänt veterinärmedicinskt läkemedel enligt 1, får en veterinär förskriva och tillhandahålla annat läkemedel för behandling av aktuellt tillstånd. Sådan förskrivning ska göras enligt 3 7 och endast i undantagsfall, för att undvika att det berörda djuret vållas otillbörligt lidande. 3 Vid förskrivning och tillhandahållande enligt 2, ska veterinären i första hand välja ett veterinärmedicinskt läkemedel som är godkänt i Sverige för användning på en annan djurart eller för ett annat tillstånd hos samma djurart. 4 I de fall det vid behandling av aktuellt tillstånd inte finns något läkemedel av det slag som avses i 3 får veterinären välja ett 1. godkänt humanläkemedel eller 2. veterinärmedicinskt läkemedel som har godkänts i en annan EU-medlemsstat För att ett sådant läkemedel som avses i första stycket p 2 ska kunna förskrivas eller tillhandahållas ska Läkemedelsverket ha beviljat licens enligt Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel. 4 a förskrivning eller tillhandahållande av läkemedel enligt 4 punkt 1 är inte tillåten för substanser som förtecknas i bilaga 1. Veterinär får, om det finns synnerliga skäl för behandling av det enskilda djuret och prognosen vid behandling är god, efter tillstånd från Jordbruksverket behandla djur med läkemedel som innehåller substanser som förtecknas i bilaga 1. [ ] 8 a Veterinär får endast inleda behandling med antibiotika innehållande kinoloner eller tredje eller fjärde generationens cefalosporiner när mikrobiologisk undersökning och resistensbestämning visar att verksamt alternativ saknas. Kravet i första stycket gäller inte kinoloner och tredje generationens cefalosporiner 1. vid behandling av sällskapsdjur och häst, om infektionens lokalisation eller sjukdomens art medför att provtagning inte är möjlig och behandling med annat läkemedel är verkningslös och detta styrks av vetenskap och beprövad erfarenhet. 2. vid behandling av djur som hålls för livsmedelsproduktion, om mikrobiologisk undersökning och resistensbestämning av aktuell infektion har genomförts på djuret eller i djurgruppen under de senaste sex månaderna, och undersökningen visade att verksamt alternativ saknas. 3. om man vid akuta livshotande tillstånd inte kan avvakta svaret på den mikrobiologiska undersökningen och resistensbestämningen. Mikrobiologisk undersökning och resistensbestämning ska göras även om svar inte inväntas innan behandlingen påbörjas enligt st 2 p 3. Veterinären ska motivera valet av antibiotika i journalen. Information från Läkemedelsverket 6:
12 nyheter och rapporter Faktaruta 2. LIVSFS 2009:3; ändrad i 2012:8 (H65). 3 Används en högre dosering av ett läkemedel än vad som anges i de av Läkemedelsverket godkända produktresuméerna tillämpas en karenstid som förlängs i proportion till höjningen av doseringen. Vid samtidig behandling med flera läkemedel, som vart och ett åsatts karenstid, eller vid byte av läkemedel under pågående behandling tillämpas den längsta av karenstiderna för de använda läkemedlen. 4 Vid behandling med läkemedel som inte har en fastställd karenstid för djurslaget eller behandlingssättet ifråga tillämpas en karenstid på minst dygn vid slakt, 2. 7 dygn vid tillvaratagande av mjölk och ägg för livsmedelsändamål, samt dygnsgrader, d C, vid slakt av fisk (vilket innebär att karenstiden löper ut när summan av dagligen uppmätt vattentemperatur uppgår till minst 500). En förutsättning för att tillämpa karenstid enligt första stycket är att den aktiva substansen återfinns i tabell 1 kommissionens förordning (EU) nr 37/2010 av den 22 december 2009 om farmakologiskt aktiva substanser och deras klassificering med avseende på MRL-värden i animaliska livsmedel (EUT L15, , s1 (CELEX 32010R0037). Karenstiderna enligt första stycket tillämpas även för godkända humanpreparat och ex tempore-beredningar som innehåller en aktiv substans som återfinns i tabell 1 i bilagan till kommissionens förordning (EU) nr 37/2010. Karenstiden ska reduceras till 0 dygn för veterinärmedicinska homeopatika för vilka MRL-värde inte krävs enligt den bilagan. Karenstiden enligt föregående stycken gäller inte om en längre karenstid finns fastställd för läkemedlet. Gränslandet mellan medicinteknik och läkemedel Både läkemedel och medicintekniska produkter kan användas för att förebygga och behandla sjukdom hos människor. Produktens syfte tillsammans med dess huvudsakliga verkan (effekt) avgör vilken lagstiftning som ska tillämpas. En produkt avsedd för att administrera läkemedel eller en produkt där en läkemedelskomponent understödjer den huvudsakliga verkan kan vara medicinteknik. Helhetsbedömningen avgör vilka regulatoriska processer som gäller för att nå marknadstillträde. Inledning Medicinteknik innefattar produkter för diagnostisering, behandling och rehabilitering, som säljs till och används inom hälso- och sjukvård. Medicinteknik innefattar även ett stort antal produkter som säljs på internet, apotek och i dagligvaruhandeln och som riktar sig till privatpersoner, däribland förbrukningsvaror och självtester. Allt från enkla förbrukningsvaror, till exempel plåster och katetrar, till komplicerade högteknologiska utrustningar som datortomografer och dialysatorer är medicinteknik. Oavsett hur produkterna är utformade eller hur de ska användas är de grundläggande kraven lika de ska vara säkra och fungera så som tillverkaren angivit. En förutsättning för att en medicinteknisk produkt ska få marknadstillträde är att den uppfyller gällande krav. Genom CE-märkningen (gemensam symbol för flera produktlagstiftningar) intygar tillverkaren att produkten lever upp till gällande nationell lag och EUlag. För medicintekniska produkter förenade med särskilda risker, verifieras överensstämmelsen genom tredjepartsgranskning av så kallat anmält organ (en oberoende organisation som övervakar tillverkningen). Detta förfarande ska säkerställa hög säkerhet för patienter, vårdpersonal och andra personer som kommer i kontakt med produkten. CEmärkningen ger också grund för marknadstillträde och är därmed basen för en effektiv saluföring inom EU. Gränsdragning mot läkemedel Syftet med medicintekniska produkter liknar i vissa fall det för läkemedel och det kan ibland uppstå oklarheter vid gränsdragning mellan lagstiftningarna. Gemensamt för läkemedel och medicinteknik är att de kan vara avsedda att förebygga och behandla sjukdom hos människor. Den huvudsakliga verkan (effekten) avgör vilken lagstiftning som ska tillämpas. Då den huvudsakliga verkan uppnås genom farmakologiska, immunologiska eller metaboliska medel omfattas inte produkten av lagstiftningen för medicinteknik utan sannolikt av läkemedelslagstiftningen. Tillverkaren av en medicinteknisk produkt har ansvaret för att produkten uppfyller gällande krav och ska med prekliniska och kliniska data kunna visa att produktens syfte och huvudsakliga verkan faller under definitionen för medicintekniska produkter. Det innebär att produkter som näsoljor, lusmedel, sårsalvor, medel som lindrar hosta etc. kan vara medicinteknik om tillverkaren har vetenskapliga data som styrker de medicinska påståenden som görs. Att en produkt med medicinskt syfte saknar farmakologisk, immunologisk eller metabol verkan betyder inte ovillkorligen att den är en medicinteknisk produkt, då läkemedelslagstiftningen också ska tilllämpas på varor med läkemedelsliknande effekt eller användningsområde. Därtill har läkemedelslagstiftningen 12 Information från Läkemedelsverket 6:2012
13 nyheter och rapporter tolkningsföreträde gentemot bland annat den medicintekniska lagstiftningen. Som exempel bedöms alla intravenösa injektionsmedel oavsett avsedd effekt och alla kontrastmedel för diagnostisering in vivo (till exempel kontrastmedel för röntgen och radioaktiva markörer för positronemissionstomografi) vara läkemedel. Den utrustning som används för diagnostik vid användandet av dessa är däremot medicinteknisk (röntgen, magnetisk resonanstomografi etc.). Administrering av läkemedel De regulatoriska processerna för att nå marknadstillträde är olika beroende på om produkten i sin helhet omfattas av lagstiftningen för läkemedel eller medicinteknik. En produkt avsedd för att administrera läkemedel kan vara medicinteknisk eller ett läkemedel beroende på hur den är sammansatt och hur den ska användas. En tom spruta ska CE-märkas enligt lagstiftningen för medicintekniska produkter, medan läkemedlet avsett att administreras ska godkännas enligt tillämplig procedur för läkemedel. Om tillverkaren däremot tillhandahåller en förfylld spruta med läkemedel, ska hela kombinationsprodukten godkännas som läkemedel. Själva sprutan ska ändå alltid uppfylla de väsentliga krav som ställs på medicintekniska produkter. Även om medicinteknisk verkan vanligen uppnås genom fysikaliska medel (mekanisk påverkan, barriär etc.), kan vissa lösningar vara medicinteknik. Till exempel kan lösningar för spolning av kärlkatetrar, och även lösningar i kärlkateterlås, vara medicintekniska produkter då dessa produkter inte är avsedda att injiceras. Integrerade produkter Det finns idag många kombinationsprodukter med läkemedel och medicinteknik på marknaden och det sker en snabb utveckling inom nya tillämpningsområden. Om en medicinteknisk produkt innehåller en läkemedelskomponent som understödjer den primära verkan, ska produkten CE-märkas som medicinteknik. En sådan kombinationsprodukt kan sättas på marknaden först efter det att en läkemedelsmyndighet verifierat kvalitet och säkerhet hos läkemedelskomponenten. Läkemedlets effekt ska då vara underordnad den medicintekniska produktens (till exempel en stent beklädd med antikoagulantium, bencement som innehåller antibiotika). Framtida kombinationsprodukter En snabb utveckling sker inom andra områden än där läkemedel och medicintekniska produkter vanligen kombineras. Läkemedel för avancerad terapi (till exempel cellterapi, genterapi, vävnadsteknik) som integreras med medicintekniska produkter eller implanterbara produkter som både kan övervaka och behandla en patient, är exempel på kombinationsprodukter som ställer nya krav på industri, anmälda organ och berörda myndigheter. Med nya kombinationsprodukter finns behov av tydliga krav på kliniska studier, kompatibilitets- och stabilitetsstudier, för att säkerställa att endast ändamålsenliga produkter frisläpps på marknaden. Även i framtiden kommer det att vara av största vikt att produkter effektivt följs upp på marknaden vad gäller olyckor och tillbud (biverkningsrapportering) för att upprätthålla hög säkerhet för patienter och användare. För mer information om medicinteknik och hur vården kan rapportera avvikelser med medicintekniska produkter, se Läkemedelsverkets webbplats Samtliga nummer av Information från Läkemedelsverket finns på Information från Läkemedelsverket 6:
14 nyheter och rapporter Florfenikol nytt antibiotikum för nötkreatur och grisar på den svenska marknaden Nu finns två injektionslösningar som innehåller florfenikol tillgängliga på den svenska marknaden. Artikeln beskriver detta antibiotikum som tidigare inte funnits godkänt i någon beredningsform. Sammanfattning Florfenikol är aktiv substans i injektionslösningarna Florselect och Norfenikol, vilka båda är generika till Nuflor som är godkänt i många EU-länder för behandling av luftvägslidanden hos nötkreatur och grisar. Att Florselect och Norfenikol är godkända som generika innebär att Läkemedelsverket inte har utrett produkternas effekt och säkerhet utan bara bedömt farmakokinetisk likhet med Nuflor (bioekvivalens). Jämförelse mellan farmakokinetiska data och MICdata för aktuella agens antyder att med den godkända dosen uppnås en exponering som är relativt kortvarig. Det kan därför ifrågasättas om effektdurationen alltid är tillräcklig beroende på aktuella agens känslighet och individens farmakokinetik. Florfenikol har ett brett antibiotiskt spektrum och rekommenderas inte som förstahandsalternativ vid behandling av luftvägslidande hos nöt och grisar. Mikrobiologiska egenskaper Florfenikol är ett huvudsakligen bakteriostatiskt antibiotikum som hämmar proteinsyntes genom att binda till ribosomala subenheter hos känsliga bakterier, varvid aminosyror förhindras att bilda peptidkedjor och proteinsyntesen blockeras. Verkningsmekanismen är samma som för kloramfenikol, och florfenikol har kommit att bli veterinärmedicinens molekyl bland fenikolerna då kloramfenikol inte kan användas till livsmedelsproducerande djur på grund av risk för toxiska effekter som inte är dosberoende. Det finns därför inga gränsvärden för livsmedelsrester (MRL-värden) för kloramfenikol. Data som presenterats i samband med en EU-procedur för en florfenikolinnehållande produkt som inte marknadsförs i Sverige anger känsligheten (MIC) för stammar av Pasteurella multocida isolerade från grisar i EU under perioden till 0, µg/ml. MIC 50 och MIC 90 ligger i de flesta rapporter på 0,5 µg/ml och det finns ingen tendens till minskad känslighet över tid. Detsamma gäller för Actinobacillus pleuropneumonie där MIC range rapporterats till 0, med MIC 50 varierande mellan 0,25 och 0,5 samt MIC 90 varierande mellan 0,25 och 1 µg/ml. Liknande känslighetsmönster har även rapporterats för Haemophilus parasuis. Motsvarande data för nötkreatur finns inte presenterade i detalj men det rapporteras att känsligheten är i samma storleksordning som för grispatogenerna (MIC< 2 µg/ml) för Mannheimia haemolytica, Pasteurella multocida, och Histophilus somni. Någon resistens (MIC > 2 µg/ml) rapporterades inte i samband med denna EUprocedur men resistens av överförbar typ finns beskriven i EU för aktuella agens (1,2,3). Farmakokinetik och dosering Den dos som godkänts för de produkter som marknadsförs i Sverige motsvarar den dosering som föreslås internationellt, det vill säga för grisar 15 mg/kg upprepat efter 48 timmar och för nöt 20 mg/kg upprepat efter 48 timmar. Norfenikol är även godkänt för att ges som en engångsdos på 40 mg/ kg. Många florfenikolprodukter är framtagna för att kunna användas antingen som en hög engångsdos eller som en dos som upprepas en gång efter 48 timmar. Florfenikol är en huvudsakligen bakteriostatisk substans där det är viktigt att koncentrationer över lägsta hämmande koncentration (MIC) bibehålls över tillräckligt lång tid. För att uppnå önskat terapeutiskt resultat får läkemedelskoncentrationerna inte hinna falla för mycket innan infektionen är bekämpad eller nästa dos ges. Florfenikol har relativt lång halveringstid men för att ytterligare förlänga effekten så att behandlingen inte alls behöver upprepas krävs antingen en mycket hög initial dos eller en formulering med långsam frisättning av aktiv substans (så kallad modified release formulation). Sådana formuleringar har tagits fram med florfenikol men de finns inte tillgängliga i Sverige. Både Norfenikol och Florselect är vanliga injektionslösningar med snabbt upptag. Värdet av formuleringar med långsammare frisättning har dock ifrågasatts, då de bara tycks ge marginellt längre effektduration jämfört med konventionella beredningsformer. Brytpunkten för resistens är satt till 2 µg/ml och det innebär att läkemedlen bör doseras så att bakterier som är mer känsliga än så kan behandlas effektivt. Det finns inget vedertaget sätt att räkna på sambandet mellan kinetik och känslighet för just florfenikol och de aktuella bakterierna, men som en enkel jämförelse kan man utgå ifrån att en bakterie med typiskt känslighetsmönster (MIC 1) måste vara hämmad under tillräckligt lång tid. Det får inte gå alltför lång tid efter det att koncentrationerna sjunkit så lågt att bakterierna kan växa till igen. Som riktvärde kan man upp- Tabell I. Tillgängliga farmakokinetiska data för produkterna på den svenska marknaden. Djurslag Dos C max Tid > MIC 1 µg/ml (medelvärde) T½ Gris 15 mg/kg im 3,8 13,6 µg/ml a Ca h a 33,5 h b Nöt 20 mg/kg 3,8 µg/ml Ej angivet (C24 = 0,7 1,4 µg/ml) ab 18,3 h a Nöt 40 mg/kg 5 µg/ml Ej angivet (C24 = 2 µg/ml) a 18,3 h a a Norfenikol SPC. b Florselect SPC. 14 Information från Läkemedelsverket 6:2012
15 nyheter och rapporter skatta att subterapeutiska koncentrationer under > 8 timmar kan innebära risk för bakterietillväxt. Vid dosering varannan dag bör därför koncentrationerna ligga över MIC i åtminstone 40 timmar (48 minus 8 timmar) för att det inte ska bli för långt glapp i den terapeutiska exponeringen mellan doserna. Med detta räknesätt kan det ifrågasättas om de plasmakoncentrationer som erhålls med de i Sverige godkända produkterna är tillräckliga. De angivna värdena i tabellen avser total koncentration. De värden på plasmakoncentration som bör användas för att jämföra med MIC-värden i det här fallet är den fria fraktionen men eftersom proteinbindningsgraden är låg (13 % hos nötkreatur [4]) kan dessa värden för plasmakoncentration anses relevanta att jämföra med MIC-data. Uppgifter om aktiva koncentrationer vid tidpunkten 40 timmar efter administrering (grisar 15 mg/kg respektive nöt 20 mg/kg) saknas men ut-ifrån de värden som redovisas kan man uppskatta att terapeutiska koncentrationer (> 1 µg/ml) inte upprätthålls tillräckligt lång tid i de djur som har lägst plasmakoncentration. Kinetikdata representerar medelvärde vilket innebär att ungefär hälften av djuren har plasmakoncentrationer som ligger under dem som redovisats i Tabell I. För många individer kommer då tiden över MIC att bli betydligt kortare än 40 timmar. Norfenikol är även godkänt för engångsbehandling av nötkreatur med luftvägsinfektioner med en högre dos (40 mg/kg). Den dosen ger en längre tids exponering som bör ställas i relation till hur lång tid bakterierna behöver utsättas för antibiotika för att infektionen ska läkas. Den tiden beror på sjukdomens svårighetsgrad men får antas vara minst tre dygn om man utgår ifrån hur långa behandlingstider som tillämpas då antibiotika administreras upprepade gånger eller via foder/vatten (5). Med en halveringstid på 18 timmar kommer koncentrationerna i de flesta individer att ha fallit till långt under 1 µg/ml efter tre dygn. Effekt De båda svenska produkterna Florselect och Norfenicol har godkänts då de visar bioekvivalens mot Nuflor. Såväl C max (maximala plasmakoncentrationer) som AUC (total exponering för florfenikol i plasma) var lika och därmed kan slutsatsen dras att de båda generika har samma effekt och säkerhetsmönster som referensprodukten. Inga nya kliniska studier har utförts. Det är möjligt att få godkännande för ett marknadsföringstillstånd för ett generikum till en referensprodukt som finns godkänd i ett annat EU-land. Detta är en öppning i lagstiftningen avsedd att möjliggöra för förskrivare i ett EU-land att få tillgång till produkter som funnits länge på marknaden i andra medlemsländer men där det tidigare inte funnits företag som varit intresserade av marknadsföring. Det förutsätts att produkter som bedömts säkra och effektiva i ett land vid ett tillfälle också kommer att vara det på en ny marknad. I fallet Nuflor finns det mycket få publicerade studier som utvärderar effekten. Den kliniska dokumentation som ligger till grund för godkännandet i de medlemsländer som beviljat marknadsföringstillstånd ligger långt tillbaka i tiden och är inte tillgänglig för Läkemedelsverket. Florfenikol är ett av flera antibiotika på den svenska marknaden med effekt vid luftvägsinfektioner hos grisar och nöt. I Läkemedelsverkets behandlingsrekommendation Dosering av antibiotika till gris (5) beskrivs penicillinprokain som förstahandsval vid luftvägsinfektioner. Amoxicillin och tetracyklin beskrivs som andrahandsval för svenska förhållanden på grund av att dessa har bredare antibakteriellt spektrum. Florfenikol beskrivs inte i rekommendationen men får anses tillhöra den kategori läkemedel som på grund av sitt breda spektrum inte ska användas som förstahandsval. Rekommendationer är under utarbetande för nöt och behandlingsprinciperna liknar dem för grisar. Säkerhet Antalet rapporterade biverkningar för originalprodukten Nuflor är lågt. De allvarliga biverkningarna begränsar sig huvudsakligen till anafylaktiska reaktioner efter injektion. I toleransstudier har även dokumenterats gastrointestinala störningar såsom diarré och perianal blödning/ödem. Säkerheten har bedömts vid godkänd dosering. Säkerhetsprofilen vid en eventuell högre dosering är inte känd. Slaktkarenstiden för Florselect vid godkänd dosering är 30 dagar (nöt) respektive 18 dagar (grisar). Motsvarande siffror för Norfenikol är något längre (nöt 20 mg/kg: slakt 39 dagar, nöt 40 mg/kg: 44 dagar, grisar 22 dagar) beroende på de data företagen presenterade inför godkännandet. Några karenstider för högre dosering har inte fastställts. Referenser 1. Katsuda K, Kohmoto M, Mikami O, et al. Plasmid-mediated florfenicol resistance in Mannheimia haemolytica isolated from cattle. Veterinary Microbiology 2012;155: Kehrenberg C, Wallmann J, Schwarz S. Molecular analysis of florfenicol-resistant Pasteurella multocida isolates in Germany. Journal of Antimicrobial Chemotherapy 2008;62: Kadlec K, Kehrenberg C, Schwarz S. Efflux-mediated resistance to florfenicol and/or chloramphenicol in Bordetella bronchiseptica: identification of a novel chloramphenicol exporter. Journal of Antimicrobial Chemotherapy 2007;59: D C Plumb. Veterinary drug handbook. Iowa state university press. 3rd edition 1999;page Information från Läkemedelsverket 6:
16 observanda frågor till läkemedelsverket Läsarenkät Hjälp oss med att svara på några frågor om vår tidskrift Information från Läkemedelsverket Enkäten hittar du på Information från Läkemedelsverket 5: Information från Läkemedelsverket 6:2012 Information från Läkemedelsverket 6:
17 frågor till läkemedelsverket Frågor till Läkemedelsverket Läkemedelsverket tar emot och besvarar frågor som rör våra ansvarsområden. Här tar vi upp några frågor och svar som vi tror att fler än frågeställaren kan vara intresserade av. Har du en fråga? Vi nås via e-post eller telefon Växeln är öppen helgfria vardagar Allmänheten kan ringa direkt till Läkemedelsupplysningen på telefon? , helgfria vardagar I förra numret av Information från Läkemedelsverket skrev vi bland annat om delbara tabletter och farmacevtiska hjälpämnen. Artiklarna gav upphov till följdfrågor om det går att krossa en delbar tablett, och om hur natriumhalt deklareras. Går tabletten att krossa? I stort sett gäller samma principer för krossning som för delning av tabletter. Enterotabletter och depottabletter ska inte krossas även om tabletten har skåra och är delbar. Detsamma gäller om läkemedlet har ett snävt terapeutiskt intervall och om den aktiva substansen är mycket potent eller toxisk (till exempel medför krossning av cytostatika i tablettform risk för oönskad exponering). Man bör även ta hänsyn till om pulvret smakar illa, och man bör ta ställning till risken att patienten inte får i sig hela dosen. I oktober 2012 anordnade Läkemedelsverket ett expertmöte för att ta fram ett rekommendationsdokument om administrering av läkemedel via sond. Rekommendationen ska enligt plan publiceras under våren 2013, och då tar vi åter upp frågan om krossning/delning av tabletter. Hur mycket natrium innehåller brustabletterna? Vid vård av patienter med rubbad natriumbalans vore det värdefullt om natriumhalten i mmol angavs i läkemedlets innehållsförteckning. Natrium är ett av de hjälpämnen för vilka innehållet ska deklareras i produktresumén (avsnitt 2) om läkemedlet innehåller en mängd av 1 mmol (motsvarande 23 mg) eller mer. Information om natriuminnehållet ska även finnas i bipacksedeln. För läkemedel som administreras peroralt brukar natriumhalten ofta anges i mg, vilket innebär att en omräkning till mmol kan vara nödvändig. Utomlands kan man få långa antibiotikakurer mot borreliainfektioner. Varför rekommenderas tre veckors behandling i Sverige? Våra rekommendationer togs fram vid ett expertmöte våren Mötesdeltagarna enades om att behandlingstiden vid påvisad infektion bör vara dagar. Det fanns inte vetenskapliga belägg för bättre effekt av längre behandling. Under hösten 2012 inledde Smittskyddsinstitutet (SMI) en utredning om borreliainfektioner. Utredningen berör särskilt diagnostik av borreliainfektion och kommer enligt den preliminära planeringen att fokusera på svensk och officiell europeisk referensmetodik, men även ta hänsyn till eventuella nya möjligheter till diagnostik. Statens beredning för medicinsk utvärdering (SBU) startar också en utredning, samordnad med SMI, som syftar till en systematisk litteraturgenomgång om behandling av borreliainfektioner. Denna genomgång beräknas vara klar hösten Dessa båda utredningar kompletterar varandra. Läkemedelsverket följer dem och resultaten de kommer fram till inför en eventuell revidering av de nuvarande behandlingsrekommendationerna, som publicerades i nummer 4/2009 av Information från Läkemedelsverket. De är även publicerade på vår webbplats under fliken Hälso- & sjukvård och sedan Behandlingsrekommendationer. Information från Läkemedelsverket 6:
18 ny rekommendation Handläggning av faryngotonsilliter i öppenvård ny rekommendation Läkemedelsverket och Smittskyddsinstitutet anordnade den september 2012 ett expertmöte där nedanstående rekommendationer för handläggning av faryngotonsillit utarbetades. Dessa rekommendationer avser i första hand handläggningen av patienter utan allvarlig underliggande sjukdom i öppenvård. Rekommendationerna är avsedda som beslutsstöd till sjukvården och behandlande läkare men ersätter inte den kliniska bedömningen av en individuell patient. Huvudbudskapen i rekommendationerna kan sammanfattas på följande sätt: Virusinfektioner är den vanligaste orsaken till faryngotonsillit, framför allt om patienten samtidigt har snuva och hosta. Etiologisk streptokockdiagnostik (t.ex. snabbtest) bör undvikas i dessa fall. Klinisk undersökning och bedömning utförd av läkare ska alltid föregå eventuellt beslut om snabbtest för påvisande av grupp A-streptokocker (GAS) i svalget. Indikation för snabbtest hos vuxna och barn 3 år föreligger om tre eller fyra kriterier enligt Centor uppfylls, dvs. feber 38,5 grader, ömmande käkvinkeladeniter, beläggningar på tonsiller (vuxna) eller rodnade, svullna tonsiller (barn 3 6 år) samt frånvaro av hosta. Hos barn < 3 år är halsinfektion orsakad av GAS mycket ovanlig varför annan diagnos bör övervägas. Antibiotikabehandling bör föregås av ett positivt snabbtest samtidigt med minst tre uppfyllda Centorkriterier. Vid negativt snabbtest för grupp A-streptokocker (GAS) rekommenderas symtomatisk behandling vid behov. Vid kraftig allmänpåverkan bör patienten remitteras akut till sjukhus, oberoende av resultat av snabbtest. Vid antibiotikabehandling är penicillin V förstahandsalternativ: Vid penicillinallergi ges klindamycin speciellt vid risk för typ 1-reaktioner. Vid recidivinfektioner ges klindamycin alternativt cefadroxil. Vid tre till fyra tonsilliter per år, oberoende av etiologi, kan tonsillektomi övervägas, men först efter det att behandling med klindamycin eller cefadroxil har utvärderats. Att tänka på vid första kontakt med patient med halsont (t.ex. vid telefonrådgivning) Alla patienter som kontaktar sjukvården behöver få en bedömning av sjukdomstillståndet, information om förväntat förlopp, om vad man kan göra för att lindra symtomen och vad som bör föranleda ny kontakt med sjukvården. Patienter med akuta symtom på ont i halsen, dvs. ont varje gång de sväljer men utan tecken på en virusorsakad övre luftvägsinfektion som t.ex. snuva, hosta och nästäppa bör bedömas av en läkare inom 1 (2) dygn. Kraftig allmänpåverkan, uttalad smärta, svårigheter att svälja, andas, gapa och/eller diarré och kräkningar, bör föranleda akut undersökning då det kan tyda på allvarlig infektion. Bakgrund Den september 2012 anordnade Läkemedelsverket och Smittskyddsinstitutet ett expertmöte med syfte att uppdatera behandlingsrekommendationerna från 2001 avseende handläggning av faryngotonsilliter inom öppenvården. I olika länders rekommendationer anvisas olika sätt att handlägga patienter med faryngotonsillit. Vissa länder bedömer faryngotonsillit som en i stort sett självläkande sjukdom, där risken för allvarlig komplikation är liten. Andra länder, där reumatisk feber är vanligare, rekommenderar antibiotikabehandling vid faryngotonsillit. Faryngotonsillit (halsfluss) innebär en inflammation i svalgregionen med rodnad och/eller svullnad i farynx och/ eller tonsiller, med eller utan beläggningar. Dessutom föreligger vanligtvis halsont eller sväljningssmärtor samt feber. Detta kan förekomma med eller utan andra samtidiga symtom på luftvägsinfektion. Faryngotonsillit är en av de vanligaste infektionsdiagnoserna i svensk primärvård och upp- 18 Information från Läkemedelsverket 6:2012
19 ny rekommendation skattas årligen leda till cirka läkarbesök. Olika luftvägsvirus är vanligaste sjukdomsagens hos patienter som söker för halsont (Evidensgrad 2a). Vilken infektionsorsak som är vanligast varierar dock beroende på patientens ålder och symtombild samt på den lokala epidemiologiska situationen. De bakteriella orsakerna till faryngotonsillit domineras helt av grupp A-streptokocker (GAS). Historiskt sett har risken för immunologiska komplikationer varit ett starkt motiv för att antibiotikabehandla GASorsakad faryngotonsillit. Frekvensen av akut reumatisk feber och njurinflammation (glomerulonefrit) är sedan lång tid mycket låg i Sverige (Evidensgrad 3a). Peritonsillit (halsböld) är oavsett genes den vanligaste purulenta komplikationen till faryngotonsillit och har i en metaanalys från Cochrane angivits till cirka 2 % (Evidensgrad 1b). Risken för att utveckla peritonsillit kan minskas med antibiotikabehandling (Evidensgrad 1a). Peritonsillit kan utvecklas även efter en faryngotonsillit som inte orsakas av GAS (Evidensgrad 1b). Incidensen av retro/parafaryngeal abscess, en ovanlig men mycket allvarlig komplikation som framför allt drabbar vuxna, har av okänd anledning ökat under de senaste tio åren (från 94 fall 2001 till 180 fall 2010) enligt Socialstyrelsens slutenvårdsregister. Ökningen har framförallt skett i åldrarna över 35 år. För vidare analys, se Fusobacterium necrophorum är en anaerob bakterie som orsakar Lemierres syndrom. Detta mycket ovanliga syndrom kännetecknas av halsinfektion som kompliceras av vena jugularis-tromboflebit och septiska embolier. En inte alltid vårdkrävande faryngotonsillit föregår ofta sepsisinsjuknandet med fyra till åtta dagar. Det är idag oklart om antibiotikabehandling av faryngotonsillit leder till minskad förekomst av Lemierres syndrom. GAS är en av de mest virulenta humanpatogena mikroorganismerna och kan orsaka ett antal allvarliga tillstånd, framförallt sepsis, nekrotiserande fasciit och Streptococcal Toxic Shock Syndrome (STSS). Invasiv sjukdom föregås dock sällan av klinisk faryngotonsillit eller bärarskap (Evidensgrad 2c). Incidensen av invasiv GAS-infektion ökar med stigande ålder (medianålder > 60 år). Se vidare De flesta allvarliga komplikationer/infektioner kan i praktiken inte förebyggas. Majoriteten av dessa, till exempel peritonsilliter (många föregås inte av tidigare läkarbesök för halsont) samt invasiva GAS-infektioner, måste misstänkas när de inträffar, dvs. man måste vara lyhörd för symtom som kan tyda på komplikation/allvarlig infektion med eller utan samtidiga halssymtom. Se Faktaruta 2. Diagnostik vid faryngotonsillit Mikrobiologisk diagnostik Svalgodling är referensmetodik för att påvisa GAS. Kommersiella antigentest/snabbtest har dock god specificitet och sensitivitet för påvisning av GAS (Evidensgrad 2b) hos såväl patienter med GAS-orsakad klinisk infektion som hos asymtomatiska bärare och testet blir tidigt positivt vid förekomst av GAS. Båda metodernas sensitivitet förutsätter dock korrekt provtagningsteknik. Prov för odling och antigentest bör tas av läkare som är väl förtrogen med provtagningsmetodiken, lämpligen i anslutning till undersökning av svalget. Svalgprov ska tas i god belysning, till exempel med pannlampa. Provtagningspinnen pressas mot tonsillytorna och förs uppåt och neråt på båda tonsillerna, men utan att pinnen vidrör tunga eller uvula. Snabbtest kan användas med bibehållen sensitivitet och specificitet vid misstänkt recidivtonsillit (Evidensgrad 2b). Den höga förekomsten av asymtomatiska bärare av GAS innebär att det diagnostiska värdet av ett positivt test för GAS (snabbtest eller odling) är betydligt lägre hos förskolebarn än hos vuxna. Laboratoriediagnostik CRP och LPK saknar värde i diagnostiken av okomplicerad faryngotonsillit då även virusfaryngotonsilliter kan ge förhöjda värden. LPK, B-celler och leverprover kan dock vara till hjälp i diagnostiken av mononukleos, liksom snabbtest för heterofila antikroppar. Testerna har relativt hög specificitet medan sensitiviteten är cirka 70 % och det tar fem till sju dagar med symtom innan testen blir positivt. Specifik EBVserologi rekommenderas i oklara fall. Flertalet mikrobiologiska laboratorier saknar för närvarande diagnostik för övriga virus som kan orsaka faryngotonsillit, till exempel adenovirus. Kliniska tecken och fynd Diagnostiken vid faryngotonsillit inriktas i första hand på att identifiera GAS-orsakad faryngotonsillit eftersom antibiotikabehandling visats påverka sjukdomsförloppet positivt vid denna etiologi (Evidensgrad 1a). Genom att väga samman olika kliniska tecken och symtom ökar sannolikheten för en etiologisk diagnos med avseende på GAS. Det mest använda instrumentet i detta avseende är Centorkriterierna (Faktaruta 1). Ju fler Centorkriterier som är uppfyllda, desto mer sannolik är förekomst av GAS i svalgodling (Evidensgrad 2b). Faktaruta 1. I studier använda diagnostiska kriterier vid halsont (enligt Centor). Sannolikheten för positiv GAS-odling är högre ju fler kriterier som uppfylls. Feber 38,5 grader Ömmande käkvinkeladeniter Beläggningar på tonsillerna* Frånvaro av hosta *hos barn 3 6 år räcker inflammerade (rodnade och svullna) tonsiller för poäng. Tecken på allvarlig sjukdom Patienter med symtom som kan tyda på allvarlig sjukdom och annan diagnos än faryngotonsillit (se Faktaruta 2) bör handläggas akut. Information från Läkemedelsverket 6:
20 ny rekommendation Faktaruta 2. Symtom/fynd som kan indikera allvarlig infektion hos patienter med eller utan halsont. Dessa symtom är oberoende av uppfyllda Centorkriterier och resultat av snabbtest för GAS, och bör föranleda akut handläggning och ställningstagande till akut remiss till sjukhus. Uttalad allmänpåverkan eller konfusion (invasiv sjukdom) Andningssvårigheter (epiglottit) Svårigheter att svälja saliven (epiglottit) Ensidig kraftig halssmärta (peritonsillit, retro/ parafaryngeal abscess) Svår halssmärta med normalt svalgstatus (retro/ parafaryngeal abscess, epiglottit) Svårt att gapa (peritonsillit, retro/parafaryngeal abscess) Mycket svår lokal smärta på hals, bål eller extremiteter (fasciit) Buksymtom: diarré och kräkningar (på grund av toxinpåverkan av GAS) Membraner på och utanför tonsiller (difteri) Klinisk handläggning av barn och vuxna med faryngotonsillit Vilka patienter har nytta av antibiotikabehandling vid faryngotonsillit? Den absolut vanligaste bakteriella orsaken till faryngotonsillit är GAS. Därför är målsättningen med handläggningen av faryngotonsillit att identifiera de patienter som har en infektion orsakad av GAS och värdera om fördelarna med antibiotikabehandling överväger nackdelarna. Enbart klinisk undersökning kan inte identifiera GAS-orsakad faryngotonsillit, samtidigt som den mikrobiologiska diagnostiken försvåras av att asymtomatiskt bärarskap av GAS är vanligt förekommande, speciellt hos barn. Det är angeläget att undvika att antibiotikabehandla de patienter som har halsinfektioner orsakade av virus. Oftast, men inte alltid, har virusinfekterade patienter samtidig förekomst av multifokala symtom såsom snuva, nästäppa, hosta, heshet, mun-svalgblåsor eller konjunktivit. Figur 1. Handläggning av barn 3 år och vuxna med anamnes och klinisk bild talande för faryngotonsillit. Vid avvikande klinisk status eller allmänpåverkan, överväg andra diagnoser, vidare utredning. Vid kraftig allmänpåverkan: akut remiss till sjukhus. Hos barn < 3 år finns sällan skäl för GAS-diagnostik då streptokockorsakad halsinfektion är mycket ovanligt. Diagnostiska kriterier 1. Feber > 38,5 grader 2. Ingen hosta 3. Förstorade, ömmande lymfkörtlar i käkvinklarna 4. Beläggning på tonsillerna a 0 2 kriterier 3 4 kriterier NEJ Bedömer du att fördelarna med antibiotika överväger vid positivt snabbtest för GAS? JA Inget snabbtest för GAS Ta snabbtest för GAS NEGATIVT b POSITIVT Symtomatisk behandling vid behov Symtomatisk behandling vid behov Antbiotika och vid behov symtomatisk behandling a Barn 3 6 år utvecklar ytterst sällan beläggningar på tonsillerna orsakade av GAS. Rodnade, svullna tonsiller kan användas synonymt till beläggningar i denna åldersgrupp. b Negativt test för GAS kan förväntas hos cirka 50 % av patienterna med 3 Centorkriterier. 20 Information från Läkemedelsverket 6:2012
Antibiotika till djur
 Antibiotika till djur Foto: Björn Nylander Lagstöd och antibiotikapolicys Jenny Bransell, Länsstyrelsen Gävleborg Lagstiftning Riktlinjer och policys (SVF och SVS) Länsstyrelsens kontrollområden Kontroll
Antibiotika till djur Foto: Björn Nylander Lagstöd och antibiotikapolicys Jenny Bransell, Länsstyrelsen Gävleborg Lagstiftning Riktlinjer och policys (SVF och SVS) Länsstyrelsens kontrollområden Kontroll
Livsmedelsverkets föreskrifter om karenstider;
 Livsmedelsverkets föreskrifter om karenstider; (H 65) Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna version innehåller ändringar
Livsmedelsverkets föreskrifter om karenstider; (H 65) Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna version innehåller ändringar
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel som används på djur; LVFS
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel som används på djur; LVFS
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2005:11) om märkning och bipacksedlar
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2005:11) om märkning och bipacksedlar
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Lagstiftningen som berör griskastrering
 2013-10-24 Dnr 5.2.17-10135/13 bilaga 1 1(5) Lagstiftningen som berör griskastrering Svensk lagstiftning Djurskyddslagen (1988:534) I 10-11 står bl.a. att det är förbjudet att göra operativa ingrepp på
2013-10-24 Dnr 5.2.17-10135/13 bilaga 1 1(5) Lagstiftningen som berör griskastrering Svensk lagstiftning Djurskyddslagen (1988:534) I 10-11 står bl.a. att det är förbjudet att göra operativa ingrepp på
Gällande regelverk rörande kastrering av smågrisar
 2012-10-23 Dnr 31-9299/12 bilaga 1 1(5) Gällande regelverk rörande kastrering av smågrisar Svensk lagstiftning Djurskyddslagen (1988:534) Av 10-11 framgår bl.a. att det är förbjudet att göra operativa
2012-10-23 Dnr 31-9299/12 bilaga 1 1(5) Gällande regelverk rörande kastrering av smågrisar Svensk lagstiftning Djurskyddslagen (1988:534) Av 10-11 framgår bl.a. att det är förbjudet att göra operativa
Europeiska unionens officiella tidning. (Icke-lagstiftningsakter) FÖRORDNINGAR
 24.5.2017 L 135/1 II (Icke-lagstiftningsakter) FÖRORDNINGAR KOMMISSIONENS FÖRORDNING (EU) 2017/880 av den 23 maj 2017 om bestämmelser för användningen av ett MRL-värde som fastställts för en farmakologiskt
24.5.2017 L 135/1 II (Icke-lagstiftningsakter) FÖRORDNINGAR KOMMISSIONENS FÖRORDNING (EU) 2017/880 av den 23 maj 2017 om bestämmelser för användningen av ett MRL-värde som fastställts för en farmakologiskt
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter och allmänna råd (LVFS 1995:7) om tillstånd
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter och allmänna råd (LVFS 1995:7) om tillstånd
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter);
 Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter); Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter); Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter);
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter);
När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ
 1408 När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ Ann Marie Janson Lang, Uppsala Inledning Det finns möjlighet att behandla patienter i Sverige med läkemedel även om
1408 När godkända läkemedel saknas licensförskrivning, extempore och andra alternativ Ann Marie Janson Lang, Uppsala Inledning Det finns möjlighet att behandla patienter i Sverige med läkemedel även om
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Svensk författningssamling
 Svensk författningssamling Lag om ändring i läkemedelslagen (1992:859); SFS 2011:234 Utkom från trycket den 22 mars 2011 utfärdad den 10 mars 2011. Enligt riksdagens beslut 1 föreskrivs 2 i fråga om läkemedelslagen
Svensk författningssamling Lag om ändring i läkemedelslagen (1992:859); SFS 2011:234 Utkom från trycket den 22 mars 2011 utfärdad den 10 mars 2011. Enligt riksdagens beslut 1 föreskrivs 2 i fråga om läkemedelslagen
Licens. Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens. (Version 1, september 2018)
 Licens Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens (Version 1, september 2018) Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Licens Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens (Version 1, september 2018) Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Kommittédirektiv. Tilläggsdirektiv till Läkemedels- och apoteksutredningen (S 2011:07) Dir. 2013:26. Beslut vid regeringssammanträde den 7 mars 2013
 Kommittédirektiv Tilläggsdirektiv till Läkemedels- och apoteksutredningen (S 2011:07) Dir. 2013:26 Beslut vid regeringssammanträde den 7 mars 2013 Förlängning av uppdraget Regeringen beslutade den 16 juni
Kommittédirektiv Tilläggsdirektiv till Läkemedels- och apoteksutredningen (S 2011:07) Dir. 2013:26 Beslut vid regeringssammanträde den 7 mars 2013 Förlängning av uppdraget Regeringen beslutade den 16 juni
Livsmedelsverkets författningssamling
 Livsmedelsverkets författningssamling ISSN 1651-3533 Föreskrifter om ändring i Livsmedelsverkets föreskrifter (LIVSFS 2009:3) om karenstider (H 65:1) Utkom från trycket 1 oktober 2012 Omtryck beslutade
Livsmedelsverkets författningssamling ISSN 1651-3533 Föreskrifter om ändring i Livsmedelsverkets föreskrifter (LIVSFS 2009:3) om karenstider (H 65:1) Utkom från trycket 1 oktober 2012 Omtryck beslutade
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om marknadsföring av humanläkemedel; LVFS 2009:6 Utkom
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om marknadsföring av humanläkemedel; LVFS 2009:6 Utkom
1 3 Dessa paragrafer behandlar olika procedurer som är möjliga vid ansökan om godkännande för försäljning.
 Vägledning till Läkemedelverkets föreskrifter (LVFS 2006:11) om godkännande av läkemedel för försäljning m.m. särskilda aspekter avseende naturläkemedel 2014-05-20 Postadress/Postal address: P.O. Box 26,
Vägledning till Läkemedelverkets föreskrifter (LVFS 2006:11) om godkännande av läkemedel för försäljning m.m. särskilda aspekter avseende naturläkemedel 2014-05-20 Postadress/Postal address: P.O. Box 26,
Samordning och uppföljning av genomförandet av den nationella läkemedelsstrategin Läkemedelsverket
 Samordning och uppföljning av genomförandet av den nationella läkemedelsstrategin Läkemedelsverket 2012-12-10 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Samordning och uppföljning av genomförandet av den nationella läkemedelsstrategin Läkemedelsverket 2012-12-10 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
BESLUT. Datum Tandvårds- och läkemedelsförmånsverket, TLV, avslår ansökan om prishöjning för nedanstående läkemedel.
 BESLUT 1 (5) Datum 2017-06-21 Vår beteckning SÖKANDE Ebb Medical AB Box 114 371 22 Karlskrona SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, avslår ansökan
BESLUT 1 (5) Datum 2017-06-21 Vår beteckning SÖKANDE Ebb Medical AB Box 114 371 22 Karlskrona SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, avslår ansökan
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter)
 Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter) Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning av icke godkänt läkemedel (licensföreskrifter) Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2001:12) om säkerhetsövervakning av läkemedel;
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2001:12) om säkerhetsövervakning av läkemedel;
Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver 1 med stöd av 4 kap. 6-7 samt 10 kap. 5 läkemedelsförordningen
Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver 1 med stöd av 4 kap. 6-7 samt 10 kap. 5 läkemedelsförordningen
Frågor och svar om NT-rådet
 Frågor och svar om NT-rådet NT-RÅDET Vad är NT-rådet? Rådet för nya terapier, NT-rådet, är en expertgrupp med representanter för Sveriges landsting och regioner. NT-rådet har mandat att ge rekommendationer
Frågor och svar om NT-rådet NT-RÅDET Vad är NT-rådet? Rådet för nya terapier, NT-rådet, är en expertgrupp med representanter för Sveriges landsting och regioner. NT-rådet har mandat att ge rekommendationer
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande
Jord- och skogsbruksministeriets förordning om veterinärers läkemedelsjournal
 JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING 22/14 Datum Dnr 17.11.2014 2164/14/2014 Ikraftträdelse- och giltighetstid 1.12.2014 - tillsvidare Upphäver Jord- och skogsbruksministeriets förordning om veterinärernas
JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING 22/14 Datum Dnr 17.11.2014 2164/14/2014 Ikraftträdelse- och giltighetstid 1.12.2014 - tillsvidare Upphäver Jord- och skogsbruksministeriets förordning om veterinärernas
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN. Florselect vet 300 mg/ml injektionsvätska, lösning, för nötkreatur och svin.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Florselect vet 300 mg/ml injektionsvätska, lösning, för nötkreatur och svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Florselect vet 300 mg/ml injektionsvätska, lösning, för nötkreatur och svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd till försäljning
Läkemedelsverket, tillsyn och tillstånd
 Läkemedelsverket, tillsyn och tillstånd Maria Ingevaldsson, läkemedelsinspektör Bengt Persson, farmaceutisk utredare SFNM:s vårmöte 2013-05-16, Kalmar 1 En statlig, i huvudsak avgiftsfinansierad, myndighet
Läkemedelsverket, tillsyn och tillstånd Maria Ingevaldsson, läkemedelsinspektör Bengt Persson, farmaceutisk utredare SFNM:s vårmöte 2013-05-16, Kalmar 1 En statlig, i huvudsak avgiftsfinansierad, myndighet
Licens Behandlingsalternativ när godkända läkemedel inte räcker till
 Licens Behandlingsalternativ när godkända läkemedel inte räcker till Läkemedelsverket 2017-11-09 Maria Jafner Kliniska Prövningar och Licenser Gunilla Andrew-Nielsen Enhetschef Enhetsadministratör Malika
Licens Behandlingsalternativ när godkända läkemedel inte räcker till Läkemedelsverket 2017-11-09 Maria Jafner Kliniska Prövningar och Licenser Gunilla Andrew-Nielsen Enhetschef Enhetsadministratör Malika
Uppdraget ska omfatta följande insatser för att nå etappmålet:
 Regeringsbeslut I:3 2014-04-16 S2014/3530/FS (delvis) Socialdepartementet Läkemedelsverket Box 26 751 03 Uppsala Uppdrag om fördjupad analys av olika handlingsalternativ för att nå etappmålet om miljöhänsyn
Regeringsbeslut I:3 2014-04-16 S2014/3530/FS (delvis) Socialdepartementet Läkemedelsverket Box 26 751 03 Uppsala Uppdrag om fördjupad analys av olika handlingsalternativ för att nå etappmålet om miljöhänsyn
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516025HSLF Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516025HSLF Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Svensk författningssamling
 Svensk författningssamling Förordning om ändring i läkemedelsförordningen (2006:272); SFS 2012:347 Utkom från trycket den 11 juni 2012 utfärdad den 31 maj 2012. Regeringen föreskriver 1 i fråga om läkemedelsförordningen
Svensk författningssamling Förordning om ändring i läkemedelsförordningen (2006:272); SFS 2012:347 Utkom från trycket den 11 juni 2012 utfärdad den 31 maj 2012. Regeringen föreskriver 1 i fråga om läkemedelsförordningen
- om klassificeringsarbetet på. Barbro Gerdén Läkare
 Piller, plåster, puder och allt annat - om klassificeringsarbetet på Läkemedelsverket Barbro Gerdén Läkare Läkemedelsverket Dagens presentation Allmänt om klassificering Tolkningsföreträdet för läkemedelsdefinitionen
Piller, plåster, puder och allt annat - om klassificeringsarbetet på Läkemedelsverket Barbro Gerdén Läkare Läkemedelsverket Dagens presentation Allmänt om klassificering Tolkningsföreträdet för läkemedelsdefinitionen
Säkrare användning av läkemedel till barn. Ett kunskapsmaterial för vårdnadshavare läkemedel till barn steg för steg
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Jord- och skogsbruksministeriets förordning om veterinärernas bokföring över medicinsk behandling
 JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING nr 8/VLA/2008 Datum Dnr 16.12.2008 2843/01/2008 Ikraftträdande 1.1.2009 Bemyndigande Lag om medicinsk behandling av djur (617/1997) 44 Läkemedelslag (395/1987,
JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING nr 8/VLA/2008 Datum Dnr 16.12.2008 2843/01/2008 Ikraftträdande 1.1.2009 Bemyndigande Lag om medicinsk behandling av djur (617/1997) 44 Läkemedelslag (395/1987,
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 17316090HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 17316090HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88517075HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88517075HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Livsmedelsverkets författningssamling
 Livsmedelsverkets författningssamling ISSN 1651-3533 Föreskrifter om ändring i Livsmedelsverkets föreskrifter och allmänna råd (SLVFS 1997:25) om karenstider vid hantering av fiskvara från odlad fisk som
Livsmedelsverkets författningssamling ISSN 1651-3533 Föreskrifter om ändring i Livsmedelsverkets föreskrifter och allmänna råd (SLVFS 1997:25) om karenstider vid hantering av fiskvara från odlad fisk som
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516068HSLFS Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516068HSLFS Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Fimea rapporterade för höga siffror för förbrukningen för år 2011. Förbrukningen har korrigerats i samband med publicering av resultaten för år 2012.
 MINDRE MIKROBLÄKEMEDEL ANVÄNDES TILL DJUR I Finland har försäljningen av antimikrobiella läkemedel för djur följts upp sedan 1995 1. Uppgifterna om förbrukningen grundar sig på statistik som läkemedelspartiaffärerna
MINDRE MIKROBLÄKEMEDEL ANVÄNDES TILL DJUR I Finland har försäljningen av antimikrobiella läkemedel för djur följts upp sedan 1995 1. Uppgifterna om förbrukningen grundar sig på statistik som läkemedelspartiaffärerna
Ska du ut och resa? Glöm inte din medicin!
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Tillsammans tar vi nästa steg
 Tillsammans tar vi nästa steg Europeiska Antibiotikadagen 2012 Strama Stockholm 18 november I Sverige: En nationell samverkansfunktion mot antibiotikaresistens har bildats Ett regeringsuppdrag till Socialstyrelsen
Tillsammans tar vi nästa steg Europeiska Antibiotikadagen 2012 Strama Stockholm 18 november I Sverige: En nationell samverkansfunktion mot antibiotikaresistens har bildats Ett regeringsuppdrag till Socialstyrelsen
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006:11) om godkännande av läkemedel
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006:11) om godkännande av läkemedel
Regeringskansliet Faktapromemoria 2014/15:FPM2. Förordning om djurläkemedel. Dokumentbeteckning. Sammanfattning. Landsbygdsdepartementet
 Regeringskansliet Faktapromemoria Förordning om djurläkemedel Landsbygdsdepartementet 2014-10-14 Dokumentbeteckning COM (2014) 558 Proposal for a regulation of the European parliament and of the Council
Regeringskansliet Faktapromemoria Förordning om djurläkemedel Landsbygdsdepartementet 2014-10-14 Dokumentbeteckning COM (2014) 558 Proposal for a regulation of the European parliament and of the Council
1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÖKADE NÅGOT
 1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÖKADE NÅGOT Försäljningen av mikrobläkemedel avsedda för djur har varit föremål för uppföljning i Finland från och med 1995 1. Förbrukningsuppgifterna baserar
1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÖKADE NÅGOT Försäljningen av mikrobläkemedel avsedda för djur har varit föremål för uppföljning i Finland från och med 1995 1. Förbrukningsuppgifterna baserar
Ibaflin används för behandling av följande sjukdomstillstånd hos hund:
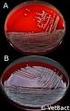 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN 30 mg tabletter för hund 150 mg tabletter för hund 300 mg tabletter för hund 900 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN 30 mg tabletter för hund 150 mg tabletter för hund 300 mg tabletter för hund 900 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
BIPACKSEDEL. Innehavare av godkännande för försäljning Sverige: Vétoquinol Scandinavia AB, Box 9, Åstorp
 BIPACKSEDEL Clavaseptin 40 mg/10 mg tabletter för hund och katt Clavaseptin 200 mg/50 mg tabletter för hund Clavaseptin 400 mg/100 mg tabletter för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE
BIPACKSEDEL Clavaseptin 40 mg/10 mg tabletter för hund och katt Clavaseptin 200 mg/50 mg tabletter för hund Clavaseptin 400 mg/100 mg tabletter för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE
Yttrande över Läkemedelsverkets redovisning av regeringsuppdrag avseende homeopatiska läkemedel
 Planeringsenheten Läkemedelssektionen TJÄNSTESKRIVELSE Sida 1(3) Datum 2015-03-25 Diarienummer 150097 Landstingsstyrelsen Yttrande över Läkemedelsverkets redovisning av regeringsuppdrag avseende homeopatiska
Planeringsenheten Läkemedelssektionen TJÄNSTESKRIVELSE Sida 1(3) Datum 2015-03-25 Diarienummer 150097 Landstingsstyrelsen Yttrande över Läkemedelsverkets redovisning av regeringsuppdrag avseende homeopatiska
Aktiv substans från växtriket Rätt och lätt gällande växtbaserade läkemedel! Erika Svedlund
 Aktiv substans från växtriket Rätt och lätt gällande växtbaserade läkemedel! Erika Svedlund Växtmaterial som aktiv substans t.ex. växtdel extrakt isolerad substans Växtmaterial som aktiv substans t.ex.
Aktiv substans från växtriket Rätt och lätt gällande växtbaserade läkemedel! Erika Svedlund Växtmaterial som aktiv substans t.ex. växtdel extrakt isolerad substans Växtmaterial som aktiv substans t.ex.
Livsmedelsverkets författningssamling
 Livsmedelsverkets författningssamling ISSN 1651-3533 Livsmedelsverkets föreskrifter om karenstider; (H 65) Utkom från trycket 19 februari 2009 beslutade den 9 februari 2009. Med stöd av 5, 6 och 31 livsmedelsförordningen
Livsmedelsverkets författningssamling ISSN 1651-3533 Livsmedelsverkets föreskrifter om karenstider; (H 65) Utkom från trycket 19 februari 2009 beslutade den 9 februari 2009. Med stöd av 5, 6 och 31 livsmedelsförordningen
Läkemedelsförmånsnämndes avslår ansökan om prishöjning för Furadantin tabletter 50 mg.
 BESLUT 1 (5) Läkemedelsförmånsnämnden Datum Vår beteckning SÖKANDE RECIP AB Lagervägen 7 136 50 Haninge SAKEN Ansökan inom läkemedelsförmånerna LÄKEMEDELSFÖRMÅNSNÄMNDENS BESLUT Läkemedelsförmånsnämndes
BESLUT 1 (5) Läkemedelsförmånsnämnden Datum Vår beteckning SÖKANDE RECIP AB Lagervägen 7 136 50 Haninge SAKEN Ansökan inom läkemedelsförmånerna LÄKEMEDELSFÖRMÅNSNÄMNDENS BESLUT Läkemedelsförmånsnämndes
Kosttillskott eller läkemedel? Tomas Nilsson, apotekare/farm dr
 Kosttillskott eller läkemedel? Tomas Nilsson, apotekare/farm dr tomas.nilsson@mpa.se Upplägg Vad är ett läkemedel? Vad är inte ett läkemedel? Vanliga exempel. Hur kan kommunerna ta hjälp av Läkemedelsverket
Kosttillskott eller läkemedel? Tomas Nilsson, apotekare/farm dr tomas.nilsson@mpa.se Upplägg Vad är ett läkemedel? Vad är inte ett läkemedel? Vanliga exempel. Hur kan kommunerna ta hjälp av Läkemedelsverket
Bilaga 3 Nuvarande termer och definitioner i termbanken för ordinationsorsak och angränsande begrepp
 1(8) Termer och definitioner så som de ser ut i termbanken idag (före revidering) indikation omständighet som utgör skäl för att vidta en viss åtgärd I läkemedelssammanhang avses med indikation omständighet
1(8) Termer och definitioner så som de ser ut i termbanken idag (före revidering) indikation omständighet som utgör skäl för att vidta en viss åtgärd I läkemedelssammanhang avses med indikation omständighet
1. Problemet och vad som ska uppnås
 Dnr 581:2010/510012 Konsekvensutredning gällande förslag till föreskrifter om ändring i Läkemedelsverkets föreskrifter LVFS 2006:3 och LVFS 2006:11. 1. Problemet och vad som ska uppnås I Europeiska gemenskapen
Dnr 581:2010/510012 Konsekvensutredning gällande förslag till föreskrifter om ändring i Läkemedelsverkets föreskrifter LVFS 2006:3 och LVFS 2006:11. 1. Problemet och vad som ska uppnås I Europeiska gemenskapen
Biverkningsrapportering i teori och praktik Ebba Hallberg Gruppchef Biverkningsgruppen Enheten för läkemedelssäkerhet
 Biverkningsrapportering i teori och praktik 2016-03-18 Ebba Hallberg Gruppchef Biverkningsgruppen Enheten för läkemedelssäkerhet Varför ny organisation? Ny farmakovigilanslagstiftning 1 juli 2012 initierad
Biverkningsrapportering i teori och praktik 2016-03-18 Ebba Hallberg Gruppchef Biverkningsgruppen Enheten för läkemedelssäkerhet Varför ny organisation? Ny farmakovigilanslagstiftning 1 juli 2012 initierad
Statens jordbruksverks författningssamling Statens jordbruksverk Jönköping, tel: telefax:
 Statens jordbruksverks författningssamling Statens jordbruksverk 551 82 Jönköping, tel: 036-15 50 00 telefax: 036-19 05 46 ISSN 1102-0970 Statens jordbruksverks föreskrifter om veterinärs rätt att förskriva
Statens jordbruksverks författningssamling Statens jordbruksverk 551 82 Jönköping, tel: 036-15 50 00 telefax: 036-19 05 46 ISSN 1102-0970 Statens jordbruksverks föreskrifter om veterinärs rätt att förskriva
Distriktsveterinärernas hygienpolicy
 Policy 2010-09 Distriktsveterinärernas hygienpolicy Bilden av organisationen skapas av oss som arbetar inom den. Därför är det viktigt att vi tänker på liknande sätt och arbetar mot samma mål. Det förhållningssätt
Policy 2010-09 Distriktsveterinärernas hygienpolicy Bilden av organisationen skapas av oss som arbetar inom den. Därför är det viktigt att vi tänker på liknande sätt och arbetar mot samma mål. Det förhållningssätt
Förslag till EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING. om ändring av förordning (EG) nr 726/2004 vad gäller säkerhetsövervakning av läkemedel
 EUROPEISKA KOMMISSIONEN Bryssel den 10.2.2012 COM(2012) 51 final 2012/0023 (COD) Förslag till EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING om ändring av förordning (EG) nr 726/2004 vad gäller säkerhetsövervakning
EUROPEISKA KOMMISSIONEN Bryssel den 10.2.2012 COM(2012) 51 final 2012/0023 (COD) Förslag till EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING om ändring av förordning (EG) nr 726/2004 vad gäller säkerhetsövervakning
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516050 Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516050 Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Inledning... 3. Bedömning av utbytbarhet för den enskilde patienten... 4. Allmänt om utbytbarhet... 3. Utbyte på apotek... 4
 UTKAST Vägledning till 5 kap. 8 a Läkemedelverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit farmaceuts möjlighet att motsätta sig utbyte av läkemedel Postadress/Postal
UTKAST Vägledning till 5 kap. 8 a Läkemedelverkets föreskrifter (LVFS 2009:13) om förordnande och utlämnande av läkemedel och teknisk sprit farmaceuts möjlighet att motsätta sig utbyte av läkemedel Postadress/Postal
Hållbar användning av antibiotika till livsmedelsproducerande djur: Kriterier och bakgrund
 Hållbar användning av antibiotika till livsmedelsproducerande djur: Kriterier och bakgrund Alla aktörer inom livsmedelskedjan har ett ansvar för att utveckling och spridning av antibiotikaresistens hos
Hållbar användning av antibiotika till livsmedelsproducerande djur: Kriterier och bakgrund Alla aktörer inom livsmedelskedjan har ett ansvar för att utveckling och spridning av antibiotikaresistens hos
Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ;
 Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver
Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006: 11) om godkännande av läkemedel för försäljning m.m. ; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver
Prövningsläkemedel kvalitet och spårbarhet. Presentationsupplägg. Bedömning av prövningsläkemedel
 Prövningsläkemedel kvalitet och spårbarhet Cecilia Vellby, farmaciutredare Enheten för kliniska prövningar och licenser Presentationsupplägg Bedömning av prövningsläkemedel Kemisk/farmaceutisk kvalitet
Prövningsläkemedel kvalitet och spårbarhet Cecilia Vellby, farmaciutredare Enheten för kliniska prövningar och licenser Presentationsupplägg Bedömning av prövningsläkemedel Kemisk/farmaceutisk kvalitet
Medicintekniska produkter
 Medicintekniska produkter [4851] Medicintekniska produkter Lag (1993:584) om medicintekniska produkter Lagens tillämpningsområde [4851] Denna lag innehåller allmänna bestämmelser om medicintekniska produkter.
Medicintekniska produkter [4851] Medicintekniska produkter Lag (1993:584) om medicintekniska produkter Lagens tillämpningsområde [4851] Denna lag innehåller allmänna bestämmelser om medicintekniska produkter.
Nominering/underlag för introduktion av nytt cancerläkemedel/ny indikation
 NOMINERINGSMALL Nominering/underlag för introduktion av nytt cancerläkemedel/ny indikation A. Fylls i av den som nominerar: 1. Läkemedlets namn: 2. Indikation: 3. Dosering och administrationssätt: 4. Hur
NOMINERINGSMALL Nominering/underlag för introduktion av nytt cancerläkemedel/ny indikation A. Fylls i av den som nominerar: 1. Läkemedlets namn: 2. Indikation: 3. Dosering och administrationssätt: 4. Hur
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006:3) om traditionella växtbaserade
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2006:3) om traditionella växtbaserade
Generiska läkemedel. Same same different name
 Generiska läkemedel Same same different name Vad är generika? de 5 miljarder som samhället sparar årligen på generika motsvarar 11 000 sjuksköterskor* *(inkl. sociala avgifter) En del patienter som står
Generiska läkemedel Same same different name Vad är generika? de 5 miljarder som samhället sparar årligen på generika motsvarar 11 000 sjuksköterskor* *(inkl. sociala avgifter) En del patienter som står
Medical Products Agency Läkemedelsverket Ledande kraft i samverkan för bättre hälsa. Susanne Baltzer, ansvarig Innovationskontoret
 Medical Products Agency Läkemedelsverket Ledande kraft i samverkan för bättre hälsa Susanne Baltzer, ansvarig Innovationskontoret 1 Läkemedelsverket Statlig myndighet under Socialdepartementet Huvudsakligen
Medical Products Agency Läkemedelsverket Ledande kraft i samverkan för bättre hälsa Susanne Baltzer, ansvarig Innovationskontoret 1 Läkemedelsverket Statlig myndighet under Socialdepartementet Huvudsakligen
SAKEN Beslut om enskild produkt med anledning av genomgången av läkemedelssortimentet.
 BESLUT 1 (5) Läkemedelsförmånsnämnden Datum Vår beteckning BERÖRT FÖRETAG Orion Pharma AB Box 334 192 30 Sollentuna SAKEN Beslut om enskild produkt med anledning av genomgången av läkemedelssortimentet.
BESLUT 1 (5) Läkemedelsförmånsnämnden Datum Vår beteckning BERÖRT FÖRETAG Orion Pharma AB Box 334 192 30 Sollentuna SAKEN Beslut om enskild produkt med anledning av genomgången av läkemedelssortimentet.
Användningsändamål för injektionspreparat som innehåller bensylpenicillinprokain Livsmedelssäkerhetsverket Eviras temporära användningsrekommendation
 BILAGA 1(5) Kontrollavdelningen Pvm/Datum/Date Enheten för djurens hälsa och välfärd juni 2015 Användningsändamål för injektionspreparat som innehåller bensylpenicillinprokain Livsmedelssäkerhetsverket
BILAGA 1(5) Kontrollavdelningen Pvm/Datum/Date Enheten för djurens hälsa och välfärd juni 2015 Användningsändamål för injektionspreparat som innehåller bensylpenicillinprokain Livsmedelssäkerhetsverket
Förfalskade läkemedel ett hot mot folkhälsan
 Förfalskade läkemedel ett hot mot folkhälsan Eva Flodman Engblom Apotekare/Utredare Inspektionsenheten Vad är ett läkemedel? Läkemedelsdefinitionen Enligt 1 läkemedelslagen avses med läkemedel varje substans
Förfalskade läkemedel ett hot mot folkhälsan Eva Flodman Engblom Apotekare/Utredare Inspektionsenheten Vad är ett läkemedel? Läkemedelsdefinitionen Enligt 1 läkemedelslagen avses med läkemedel varje substans
Gränsdragning. NLM = Naturläkemedel TVBL= Traditionella växtbaserade läkemedel VUM = Vissa utvärtes läkemedel. LIVSMEDEL kosttillskott TOBAK
 Gränsdragning LIVSMEDEL kosttillskott MEDICINTEKNIK TOBAK LÄKEMEDEL (syntetiska/växtbaserade) NLM TVBL VUM HOMEOPATIKA KOSMETIKA FODER KEMISKA PRODUKTER NLM = Naturläkemedel TVBL= Traditionella växtbaserade
Gränsdragning LIVSMEDEL kosttillskott MEDICINTEKNIK TOBAK LÄKEMEDEL (syntetiska/växtbaserade) NLM TVBL VUM HOMEOPATIKA KOSMETIKA FODER KEMISKA PRODUKTER NLM = Naturläkemedel TVBL= Traditionella växtbaserade
Läkemedel eller inte läkemedel? en vägledning
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Parenterala läkemedel inom periodens varautbytet
 Parenterala läkemedel inom periodens varautbytet TANDVÅRDS- OCH LÄKEMEDELSFÖRMÅNSVERKET Box 22520 [Fleminggatan 18], 104 22 Stockholm Telefon: 08 568 420 50, Fax: 08 568 420 99, registrator@tlv.se, www.tlv.se
Parenterala läkemedel inom periodens varautbytet TANDVÅRDS- OCH LÄKEMEDELSFÖRMÅNSVERKET Box 22520 [Fleminggatan 18], 104 22 Stockholm Telefon: 08 568 420 50, Fax: 08 568 420 99, registrator@tlv.se, www.tlv.se
Läkemedelsförmånsnämnden föreskrifter (LFNFS 2002:1) om ansökan och beslut hos Läkemedelsförmånsnämnden
 1 (8) Enligt sändlista REMISS Läkemedelsförmånsnämnden föreskrifter (LFNFS 2002:1) om ansökan och beslut hos Läkemedelsförmånsnämnden Läkemedelsförmånsnämnden översänder härmed förslag till föreskrifter
1 (8) Enligt sändlista REMISS Läkemedelsförmånsnämnden föreskrifter (LFNFS 2002:1) om ansökan och beslut hos Läkemedelsförmånsnämnden Läkemedelsförmånsnämnden översänder härmed förslag till föreskrifter
BILAGA. Vetenskapliga uppgifter
 BILAGA Vetenskapliga uppgifter 3 BILAGA Vetenskapliga uppgifter A) INLEDNING Sparfloxacin är ett antibiotikum av kinolontyp och används vid behandling av: - lunginflammation orsakad av pneumokocker inom
BILAGA Vetenskapliga uppgifter 3 BILAGA Vetenskapliga uppgifter A) INLEDNING Sparfloxacin är ett antibiotikum av kinolontyp och används vid behandling av: - lunginflammation orsakad av pneumokocker inom
Stockholms läns landsting 1(2)
 Stockholms läns landsting 1(2) Landstingsradsberedningen SKRIVELSE 2015-04-15 LS 2015-0263 Landstingsstyrelsen Yttrande över Läkemedelsverkets rapport, Förutsättningar för och konskevenser av att införliva
Stockholms läns landsting 1(2) Landstingsradsberedningen SKRIVELSE 2015-04-15 LS 2015-0263 Landstingsstyrelsen Yttrande över Läkemedelsverkets rapport, Förutsättningar för och konskevenser av att införliva
Med stöd av 21 förordningen (2002:687) om läkemedelsförmåner m.m. föreskrivs följande.
 Tandvårds- och läkemedelsförmånsverkets författningssamling Tandvårds- och läkemedelsförmånsverkets föreskrifter och allmänna råd om ansökan och beslut om läkemedel och varor som förskrivs i födelsekontrollerande
Tandvårds- och läkemedelsförmånsverkets författningssamling Tandvårds- och läkemedelsförmånsverkets föreskrifter och allmänna råd om ansökan och beslut om läkemedel och varor som förskrivs i födelsekontrollerande
Läkemedelsförordning (2015:458)
 Import och exportföreskrifter/läkemedel, narkotika m.m. 1 1 kap. Förordningens tillämpningsområde Innehåll [4761] I denna förordning finns kompletterande bestämmelser till (2015:315) ([4701] o.f.). Uttryck
Import och exportföreskrifter/läkemedel, narkotika m.m. 1 1 kap. Förordningens tillämpningsområde Innehåll [4761] I denna förordning finns kompletterande bestämmelser till (2015:315) ([4701] o.f.). Uttryck
Svensk läkemedelsstandard 2014.1
 Svensk läkemedelsstandard 2014.1 Förvaring, märkning, lagrings- och användningstider för läkemedel Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds
Svensk läkemedelsstandard 2014.1 Förvaring, märkning, lagrings- och användningstider för läkemedel Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds
B - ÅRLIG RAPPORT OM KLINISK FORSKNING
 B - ÅRLIG RAPPORT OM KLINISK FORSKNING Enkätsvaren skickas in senast den 29 februari. Upplysningar om enkäten Sakinnehåll: Kerstin Sjöberg, 08-452 76 67 eller kerstin.sjoberg@skl.se. Tekniska frågor: Kenneth
B - ÅRLIG RAPPORT OM KLINISK FORSKNING Enkätsvaren skickas in senast den 29 februari. Upplysningar om enkäten Sakinnehåll: Kerstin Sjöberg, 08-452 76 67 eller kerstin.sjoberg@skl.se. Tekniska frågor: Kenneth
Vägledning för tillverkare av medicintekniska produkter i klass I. approvals authorisation clinical trials communication competence cosmetics
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
Praktiska tips Vägledning vid ansökan om receptfrihet
 Praktiska tips Vägledning vid ansökan om receptfrihet 2015-06-02 Åsa Dismats och Ann-Louise Leo, Läkemedelsverket 1 Innehåll Receptfrihet; Over The Counter Ansökan På Läkemedelsverket Försäljning utanför
Praktiska tips Vägledning vid ansökan om receptfrihet 2015-06-02 Åsa Dismats och Ann-Louise Leo, Läkemedelsverket 1 Innehåll Receptfrihet; Over The Counter Ansökan På Läkemedelsverket Försäljning utanför
Europeiska unionens officiella tidning L 304/1. (Rättsakter vilkas publicering är obligatorisk)
 23.11.2005 Europeiska unionens officiella tidning L 304/1 I (Rättsakter vilkas publicering är obligatorisk) RÅDETS FÖRORDNING (EG) nr 1905/2005 av den 14 november 2005 om ändring av förordning (EG) nr
23.11.2005 Europeiska unionens officiella tidning L 304/1 I (Rättsakter vilkas publicering är obligatorisk) RÅDETS FÖRORDNING (EG) nr 1905/2005 av den 14 november 2005 om ändring av förordning (EG) nr
Kunskapscentrum för läkemedel i miljön Verksamhetsplan
 approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
approvals authorisation clinical trials communication competence cosmetics dialogue directives efficacy environment evaluation guidelines harmonisation health economics herbals homeopathics information
20 Svar på skrivelse från Socialdemokraterna om uteblivna kliniska studier vid sällsynta sjukdomar HSN
 20 Svar på skrivelse från Socialdemokraterna om uteblivna kliniska studier vid sällsynta sjukdomar HSN 2019-1022 Hälso- och sjukvårdsnämnden TJÄNSTEUTLÅTANDE HSN 2019-1022 Hälso- och sjukvårdsförvaltningen
20 Svar på skrivelse från Socialdemokraterna om uteblivna kliniska studier vid sällsynta sjukdomar HSN 2019-1022 Hälso- och sjukvårdsnämnden TJÄNSTEUTLÅTANDE HSN 2019-1022 Hälso- och sjukvårdsförvaltningen
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter (LVFS 2011:3) om läkemedel som omfattas av sjukhusundantaget; LVFS
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter (LVFS 2011:3) om läkemedel som omfattas av sjukhusundantaget; LVFS
BIPACKSEDEL FÖR. Efex vet 10 mg tuggtabletter för katt och hund Efex vet 40 mg tuggtabletter för hund Efex vet 100 mg tuggtabletter för hund
 BIPACKSEDEL FÖR Efex vet 10 mg tuggtabletter för katt och hund Efex vet 40 mg tuggtabletter för hund Efex vet 100 mg tuggtabletter för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING
BIPACKSEDEL FÖR Efex vet 10 mg tuggtabletter för katt och hund Efex vet 40 mg tuggtabletter för hund Efex vet 100 mg tuggtabletter för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING
PRODUKTRESUMÉ. Ljusbrun tablett med bruna prickar, rund och konvex smaksatt tablett med kryssformad brytskåra på ena sidan.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Metrobactin vet 250 mg tabletter för hund och katt Metrobactin vet 500 mg tabletter för hund och katt 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Metrobactin vet 250 mg tabletter för hund och katt Metrobactin vet 500 mg tabletter för hund och katt 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om traditionella växtbaserade läkemedel för humant bruk; Utkom från trycket
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om traditionella växtbaserade läkemedel för humant bruk; Utkom från trycket
6 Genomförande av direktiv 2004/24/EG om ändring, avseende traditionella växtbaserade
 6 Genomförande av direktiv 2004/24/EG om ändring, avseende traditionella växtbaserade läkemedel, av direktiv 2001/83/EG om upprättande av gemenskapsregler för humanläkemedel 6.1 Definitioner och tillämpningsområde
6 Genomförande av direktiv 2004/24/EG om ändring, avseende traditionella växtbaserade läkemedel, av direktiv 2001/83/EG om upprättande av gemenskapsregler för humanläkemedel 6.1 Definitioner och tillämpningsområde
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518026HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518026HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
BESLUT. Datum 2011-07-01
 BESLUT 1 (5) Datum 2011-07-01 Vår beteckning SÖKANDE Johnson och Johnson Consumer Nordic A division of McNeil Sweden AB 169 90 Solna ÄRENDET Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket,
BESLUT 1 (5) Datum 2011-07-01 Vår beteckning SÖKANDE Johnson och Johnson Consumer Nordic A division of McNeil Sweden AB 169 90 Solna ÄRENDET Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket,
BESLUT. Datum
 BESLUT 1 (5) Datum 2012-03-05 Vår beteckning SÖKANDE Gilead Sciences Sweden AB Hemvärnsgatan 9, 8 tr. 171 54 Solna SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket,
BESLUT 1 (5) Datum 2012-03-05 Vår beteckning SÖKANDE Gilead Sciences Sweden AB Hemvärnsgatan 9, 8 tr. 171 54 Solna SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket,
En EU-anpassad lagstiftning om läkemedel för djur. Beslut vid regeringssammanträde den 5 september 2019
 Dir. 2019:53 Kommittédirektiv En EU-anpassad lagstiftning om läkemedel för djur Beslut vid regeringssammanträde den 5 september 2019 Sammanfattning En särskild utredare ska göra en översyn av nuvarande
Dir. 2019:53 Kommittédirektiv En EU-anpassad lagstiftning om läkemedel för djur Beslut vid regeringssammanträde den 5 september 2019 Sammanfattning En särskild utredare ska göra en översyn av nuvarande
