PRODUKTRESUMÉ. Ceftriaxon Stragen 1 g pulver till injektions-/infusionsvätska, lösning Ceftriaxon Stragen 2 g pulver till infusionsvätska, lösning
|
|
|
- Joakim Eklund
- för 9 år sedan
- Visningar:
Transkript
1 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Ceftriaxon Stragen 1 g pulver till injektions-/infusionsvätska, lösning Ceftriaxon Stragen 2 g pulver till infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ceftriaxonnatrium motsvarande 1 g ceftriaxon. Ceftriaxonnatrium motsvarande 2 g ceftriaxon. 3. LÄKEMEDELSFORM Pulver till injektions-/infusionsvätska, lösning Pulver till infusionsvätska, lösning Vitt till gulaktigt pulver 4. KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer Ceftriaxon är indicerat för behandling av följande allvarliga infektioner som kräver paranteral behandling och där det är känt eller sannolikt att infektionen orsakats av mikroorganismer som är känsliga för ceftriaxon (se avsnitt 5.1): septikemi akut bakteriell meningit pneumoni Behandlingen kan påbörjas innan resultat från känslighetstester är kända. Hänsyn skall tas till officiella lokala riktlinjer gällande lämplig användning av antibakteriella medel. 4.2 Dosering och administreringssätt Administreringsväg och administreringssätt Intravenös användning Efter beredning av lösningen enligt anvisningarna i avsnitt 6.2 och 6.6 kan Ceftriaxon Stragen administreras som intravenenös bolusinjektion eller genom intravenös infusion. Dosering och administreringssätt styrs av infektionens svårighetsgrad och lokalisering, den orsakande mikroorganismens känslighet och patientens ålder och tillstånd. En intravenös injektion ska ges under åtminstone 2-4 minuter, direkt i en ven eller via en intravenös infusionskanyl. Doser > 50 mg/kg ska ges som infusion under minst 30 minuter. 1
2 Normaldos Vuxna och ungdomar över 12 år med en kroppsvikt på > 50 kg: Vanlig dos är 1-2 g ceftriaxon en gång per dygn (var 24:e timme). Vid allvarlig infektion eller vid infektioner orsakade av måttligt känsliga mikroorganismer kan dosen ökas upp till 4 g, administrerat en gång per dygn. Nyfödda (0 till 14 dagar) mg/kg kroppsvikt intravenöst en gång per dygn (med 24 timmars intervall). Vid allvarliga infektioner får dygnsdosen aldrig överskrida 50 mg/kg kroppsvikt. Barn 15 dagar- 12 år med en kroppsvikt på<50 kg: mg/kg kroppsvikt intravenöst per dygn (var 24:e timme). Vid svåra infektioner får inte den dagliga dosen på 80 mg per kg kroppsvikt överskridas, utom vid meningit (se avsnitt 4.2 Dosering vid speciella situationer). Till barn med en kroppsvikt på 50 kg eller mer rekommenderas normaldos för vuxna (se ovan). Administrering till nyfödda se avsnitt 4.4. Äldre: Normal vuxendos kan vanligtvis ges till äldre patienter om inte njur- och leverfunktion är uttalat nedsatt (se nedan). Dosering vid speciella situationer Meningit: Till barn med bakteriell meningit skall behandlingen påbörjas med 100 mg/kg (överskrid inte 4 g) administrerat en gång per dygn. Efter det att patogenens känslighet bestämts kan dosen reduceras i enlighet därmed. Till nyfödda under 2 veckors ålder bör dosen inte överskrida 50 mg/kg/dygn Njurinsufficiens: Till patienter med nedsatt njurfunktion är förändring av ceftriaxondosen inte nödvändig under förutsättning att leverfunktionen är normal. I fall med extrem njurinsufficiens (kreatininclearance < 10ml/ min) bör dock dygnsdosen ceftriaxon inte överskrida 2 g. Vid samtidig svår njur- och leverinsufficiens, och till barn med extrem njurinsufficiens bör ceftriaxonkoncentrationen i serum monitoreras regelbundet och dosen eventuellt justeras. Patienter som genomgår hemodialys eller peritonealdialys behöver ingen extrados efter dialysen. Serumkoncentrationen bör emellertid monitoreras för att kunna bestämma om dosjustering är nödvändig eftersom eliminationshastigheten hos dessa patienter kan vara nedsatt. Leverinsufficiens: Om njurfunktionen är normal behöver inte dosen justeras vid leverinsufficiens. Behandlingstid Den normala behandlingstiden beror på behandlingssvaret och den orsakande mikroorganismen. Precis som med antibiotikabehandling i allmänhet skall behandling med ceftriaxon fortsätta i åtminstone 48 till 72 timmar efter det att patienten blivit feberfri eller det föreligger bevis på att bakterien eliminerats. 4.3 Kontraindikationer Överkänslighet mot den aktiva substansen eller mot andra cefalosporiner 2
3 Tidigare omedelbar och/eller allvarlig överkänslighetsreaktion mot penicillin eller något annat betalaktamläkemedel. (se avsnitt 4.4) Ceftriaxon ska inte ges till nyfödda med gulsot, hypoalbuminemi eller acidos. Nyfödda med hyperbilirubinemi och för tidigt födda ska inte behandlas med ceftriaxon. In vitro studier har visat att ceftriaxon kan tränga undan bilirubin från dess bindning till serumalbumin och bilirubinutlöst encefalopati kan utvecklas hos dessa patienter. Calciumbehandling eftersom det finns risk för utfällning av ceftriaxonkalciumsalter hos fullgångna nyfödda. 4.4 Varningar och försiktighet Vid misstänkt eller påvisad infektion med Pseudomonas aeruginosa bör man ta i beaktande att det föreligger hög resistensgrad (> 60 %) mot ceftriaxon, åtminstone i vissa europeiska länder (se avnitt 5.1). Vid infektioner orsakade av Pseudomonas aeruginosa med visad känslighet mot ceftriaxon skall man kombinera med aminoglykosider för att undvika utveckling av sekundär resistens. Vid infektioner orsakade av andra bakterier hos patienter med neutropenisk feber skall interventionsbehandling med ceftriaxon kombineras med aminoglykosid. Särskild försiktighet krävs när det gäller att utröna eventuell tidigare överkänslighetsreaktion mot penicillin eller annat betalaktamläkemedel eftersom patienter som är överkänsliga för denna typ av läkemedel också kan vara överkänsliga mot ceftriaxon (korsallergi). Överkänslighetsreaktioner mot ceftriaxon är mera troligt hos patienter med annan typ av överkänslighet eller asthma bronchiale. Ceftriaxoninjektioner bör användas med stor försiktighet till patienter med allergisk diates eftersom överkänslighetsreaktionerna utvecklas snabbare och förloppet blir allvarligare efter intravenös injektion (se avsnitt 4.8). Överkänslighetsreaktioner förekommer i alla svårighetsgrader upp till anafylaktisk chock ( se avsnitt 4.8) Vid allvarlig njurinsufficiens och samtidig leverinsufficiens krävs dosreduktion såsom beskrivet i avsnitt 4.2. Vid samtidig försämring av njur- och leverfunktion bör serumnivåerna av ceftriaxon monitoreras regelbundet. Regelbunden monitorering av njur- och leverfunktion och hematologiska parametrar rekommenderas under långtidsanvändning (se avsnitt 4.8). Varje administration av antibiotika kan leda till en ökning av patogener som är resistenta mot den använda aktiva substansen. Man måste ta hänsyn till tecken på konsekutiva sekundära infektioner av sådana patogener (inkluderande candida och svamp). Sekundära infektioner skall behandlas (se avsnitt 5.1). Antibiotikassocierad diarré, kolit och pseudomembranös kolit har alla rapporterats vid ceftriaxonbehandling. Dessa diagnoser skall övervägas hos varje patient som utvecklar diarré under eller kort efter behandling. Ceftriaxonbehandlingen bör avslutas om allvarliga och/eller blodiga diarrér inträffar under behandlingen och lämplig behandling bör initieras. Läkemedel som hämmar peristaltiken får inte ges. 3
4 Ceftriaxon bör användas med försiktighet till patienter med tidigare anamnes av gastrointestinal sjukdom, speciellt kolit. Ceftriaxon kan fällas ut i gallblåsan och njurarna och sen upptäckas som skuggor vid ultraljudsundersökning (se avsnitt 4.8). Detta kan inträffa oavsett ålder men är mera troligt hos nyfödda och små barn, som vanligtvis får en större dos ceftriaxon per kg kroppsvikt. Till barn bör doser över 80 mg/kg kroppsvikt undvikas utom vid meningit- på grund av den ökade risken för utfällning i gallblåsan. Det föreligger inga klara bevis på gallstenar eller på att akut kolecystit utvecklas hos barn eller spädbarn som behandlas med ceftriaxon och en konservativ hantering av ceftriaxonutfällning i gallblåsan rekommenderas. Sällsynta fall av pankreatit möjligtvis orsakade av gallobstruktion, har rapporterats hos patienter som behandlats med ceftriaxon. De flesta av dessa patienter hade riskfaktorer för gallstas och galligenslamning, t ex omfattande föregående behandling, svår sjukdom eller behandling med total parenteral nutrition. Att ceftriaxon har utlöst eller bidragit till detta genom utfällning av ceftriaxon i gallan kan inte uteslutas. Cefalosporiner som grupp, tenderar att adsorberas till membranytan på röda blodkroppar och reagerar med antikroppar riktade mot läkemedlet och framkallar ett positivt Coombs test och ibland en ganska mild hemolytisk anemi. I detta avseende kan det vara viss korsreaktion med penicilliner. In vivo och in vitro studier har visat att ceftriaxon, liksom vissa andra cefalosporiner kan tränga undan bilirubin från serumalbumin. Kliniska data som erhållits på nyfödda har bekräftat detta fynd. Ceftriaxon skall därför inte användas på nyfödda med gulsot, hypoalbuminemi eller acidos, hos vilka bilirubinbindningen kan vara försämrad. Speciell försiktighet bör iakttas med prematura barn. Som med andra antibiotika bör tillfällig K-vitaminbrist tas i beaktande. Höga intravenösa doser (> 1g eller > 50mg/ kg kroppsvikt) av ceftriaxon bör administreras långsamt (under minst 30 minuter) för att förhindra höga koncentrationer i gallan. Före behandling av gonorré ska infektioner orsakade av Treponema pallidium uteslutas. 1 g: Detta läkemedel innehåller 3,6 mmol natrium per dos. Detta bör beaktas av patienter som ordinerats saltfattig kost. 2 g: Detta läkemedel innehåller 7,2 mmol natrium per dos. Detta bör beaktas av patienter som ordinerats saltfattig kost. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Aminoglykosider: Vid samtidig användning av cefalosporiner och aminoglykosider har det rapporterats en ökad risk för oto- och nefrotoxicitet. Dosjustering kan bli nödvändig. Dessutom måste dessa läkemedel administreras separat för att undvika fysikalisk-kemisk inkompatibilitet mellan ceftriaxon och aminoglykosiden.. Bakteriostatiska antibiotika såsom kloramfenikol och tetracyklin, kan motverka effekten av ceftriaxon speciellt vid akuta infektioner som följs av snabb proliferation av mikroorganismer. Samtidig användning av ceftriaxon och bakteriostatiska antibiotika rekommenderas därför inte. Probenecid: Probenecid hämmar inte den tubulära sekretionen av ceftriaxon som den gör för andra cefalosporiner. 4
5 Orala antikonceptionella medel: Ceftriaxon kan motverka effekten av hormonella antikonceptionella medel. Tilläg av icke-hormonellt antikonceptionellt medel rekommenderas. Övrigt: Diagnostiska laboratorietester Coombs test kan i sällsynta fall ge falskt positivt resultat under ceftriaxonbehandling (se avsnitt 4.4) Icke enzymatiska metoder för glukosbestämning i urin kan ge falskt positiva resultat. Av detta skäl bör glukosbestämning i urin ske med enzymatiska metoder under ceftriaxonbehandling. Ceftriaxon kan ge falska positiva resultat vid galaktosbestämning i blodet. Ceftriaxon innehåller inte den N-metyltiotetrazol grupp som har associerats med disulfiramliknande effekt vid alkoholkonsumtion under behandling med vissa cefalosporiner. 4.6 Graviditet och amning Adekvata data från behandling av gravida kvinnor med ceftriaxon saknas. Ceftriaxon passerar över placentabarriären. Djurstudier tyder inte på någon reproduktionstoxicitet (se avsnitt 5.3). Som försiktighetsåtgärd ska ceftriaxon bara användas under graviditet efter det att nytta/risk bedömning gjorts av behandlande läkare. Detta gäller särskilt under första trimestern. Ceftriaxon utsöndras i låga koncentrationer i bröstmjölk. Försiktighet ska iakttas vid förskrivning till ammande kvinnor. Diarré och svampinfektioner i mukösa membran kan uppkomma hos det barn som ammas varför det kan bli nödvändigt att avbryta amningen. Risken för sensibilisering bör beaktas. 4.7 Effekter på förmågan att framföra fordon och använda maskiner Ceftriaxon har vanligtvis ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Emellertid skall hänsyn tas till biverkningar som hypotension, yrsel eller vertigo (se avsnitt 4.8). 4.8 Biverkningar Sällsynta rapporter förekommer med allvarliga biverkningar hos för tidigt födda och fullgångna nyfödda. Dessa biverkningar har i vissa fall orsakat dödsfall. Dessa nyfödda hade behandlats med intravenöst ceftriaxon och kalcium. Några hade erhållit ceftriaxon och kalcium vid olika tillfällen och via olika intravenösa linjer. Utfällning av ceftriaxon-kalciumsalt har observerats i lungor och njurar hos dessa döda för tidigt födda spädbarn. Den stora risken för utfällning beror på den lilla blodvolymen hos nyfödda. Dessutom är halveringstiden längre än hos vuxna. Följande biverkningar, spontant reversibla eller reversibla efter avslutad behandling, har setts i samband med ceftriaxonbehandling: Organsystem Blodet och lymfsystemet Mycket vanlig >1/10 Vanlig>1/100 till <1/10 Mindre vanlig >1/1 000 till 1/100 Sällsynt>1/ till < 1/1 000 Eosinofili leukopeni granulocytopeni Mycket sällsynt < 1/ Agranulocytos (<500/mm³), mest efter 10 dagars behandling och en total dos på 20g ceftriaxon eller mer; 5
6 Organsystem Centrala och perifera nervsystemet Magtarm kanalen Njurar och urinvägar Mycket vanlig >1/10 Vanlig>1/100 till <1/10 Mindre vanlig >1/1 000 till 1/100 Huvudvärk, yrsel, vertigo Stomatit, glossit, anorexi, illamående, kräkning, buksmärta, lös avföring eller diarré. Dessa biverkningar är oftast milda och minskar ofta under behandlingens gång, annars efter avslutad behandling Oliguri, ökning av serumkreatinin Sällsynt>1/ till < 1/1 000 Utfällning av ceftriaxon i njurarna hos pediatriska patienter, för det mesta hos barn som är äldre än 3 år och som behandlats Mycket sällsynt < 1/ Koagulationsrubbning, trombocytopeni. Smärre förlängningar av protrombintiden har beskrivits. Anemi (inkl. hemolytisk anemi) Pseudomembranös enterokolit (se avsnitt 4.4). Om allvarlig och ihållande diarre uppträder under eller efter behandling skall pseudomembranös kolit övervägas. Detta är en allvarlig t.o.m. livshotande komplikation, för det mesta orsakad av Clostridium difficile. Beroende på indikationen bör avslutande av behandlingen övervägas och lämplig behandling initieras: d.v.s. intag av specifika antibiotika/ kemoterapeutika med kliniskt visad effekt. Antiperistaltika är kontraindicerad. 6
7 Organsystem Mycket vanlig >1/10 Vanlig>1/100 till <1/10 Mindre vanlig >1/1 000 till 1/100 Sällsynt>1/ till < 1/1 000 antingen med höga dagliga doser (80 mg/kg kroppsvikt per dag eller mer) eller med totala doser över 10g ceftriaxon och som har flera riskfaktorer (t.ex. begränsad vätsketillförsel). Detta symptom är reversibelt efter utsättande av ceftriaxon. Hematuri Mycket sällsynt < 1/ Infektioner och infestationer Allmänna symtom och /eller symtom vid adm.stället Immun systemet Flebiter efter intravenös administrering. Risken kan minskas genom långsam injektion (under 2-4 min.) Smärta vid injektionsstället. Vid snabb intravenös inj. kan intolerans visa sig i form av värmekänsla eller illamående. Detta kan undvikas genom långsam injektion (2-4 min.). Allergiska hudreaktioner (t.ex dermatit, urtikaria, exantem), pruritus, ödematös svullnad i hud och leder Genital mykos. Superinfektioner med icke känsliga mikroorganismer Allvarliga akuta överkänslighetsreaktioner upp till anafylaktisk chock, Lyells syndrom/toxisk epidermolys, Stevens-Johnson syndrom eller erythema multiforme. 7
8 Organsystem Lever och gallväggar Mycket vanlig >1/10 Symtomatisk utfällning av ceftriaxonkalcium-salt i gallblåsan hos barn/ reversibel cholelithiasis hos barn. Denna sjukdom är sällsynt hos vuxna (se nedan) Vanlig>1/100 till <1/10 Förhöjda leverenzymvärden i serum (ASAT, ALAT, alkaliskt fosfatas Mindre vanlig >1/1 000 till 1/100 Sällsynt>1/ till < 1/1 000 Allvarliga akuta överkänslighetsreaktioner och anafylaktisk chock kräver omedelbart utsättande av ceftriaxon och lämplig akutbehandling Pankreatit (se avsnitt 4.4). Förhöjda leverenzymvärden. Symptomatisk utfällning av ceftriaxonkalciumsalt i gallbåsan, hos vuxna, vilket försvann efter avslutad behandling eller utsättning av Ceftriaxon. Dessa opaciteter uppträder vanligtvis bara efter adm. av högre doser än den rekommenderade standarddosen. I de sällsynta fall då precipitaten åtföljs av kliniska symtom så som smärta, rekommenderas symptomatisk behandling. Utsättande av behandlingen ska också övervägas (se avsnitt 4.4). Mycket sällsynt < 1/ Överdosering Inga fall av överdosering har rapporterats. Symptom vid överdosering Typiska tecken på överdosering kan förväntas överensstämma med biverkningsprofilen. I mycket sällsynta fall förekommer kolik tillsammans med nefropati eller cholelithiasis vid användning av höga doser som administrerats oftare och snabbare än rekommenderat. 8
9 Behandling vid intoxikation Överskott av ceftriaxon i serum kan inte reduceras med hemodialys eller peritonealdialys. Det finns ingen specifik antidot. Symptomatisk behandling bör användas. 5. FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: Cefalosporiner och liknande antibakteriella medel, ATC-kod J01DD04 Verkningsmekanism Ceftriaxon har bakteriocid effekt som beror på en hämning av cellväggsyntesen. Ceftriaxon har hög grad stabilitet i närvaro av β-laktamaser producerade av gramnegativa och grampositiva bakterier. Synergistiska effekter på vissa gramnegativa bakterier har noteras in vitro mellan ceftriaxon och aminoglykosider. Resistensmekanism Ceftriaxon är aktivt mot organismer som producerar vissa typer av betalaktamaser t.ex. TEM-1. Emellertid inaktiveras ceftriaxon av betalaktamaser som effektivt kan hydrolysera cefalosporiner, såsom många bredspektrumbetalaktamaser och kromosomala cefalosporinaser såsom enzymer av AmpC-typ. Ceftriaxon kan inte förväntas ha effekt mot majoriteten av bakterier med penicillinbindande proteiner som har reducerad affinitet mot betalaktamläkemedel. Resistens kan också medieras genom bakteriens impermeabilitet eller genom bakteriell drug efflux pump. Mer än en av dessa fyra resistensmekanismer kan vara närvarande i samma organism. Brytpunkter Ceftriaxon EUCAST kliniska MIC brytpunkter Enterobacteriaceae : Staphylococcus Streptococcus A, B, C, G S< 1 mg/l, R> 2mg/l¹ Stafylokockers känslighet mot cefalosporiner är hämtade från känsligheten för meticillin S< 0,5 mg/l, R< 0,5 mg/l² S. pneumoniae : S< 0,5 mg/l, R> 2 mg/l² H. influenzae M. catarrhalis: S< 0,12mg/l, R> 0,12 mg/l² N. gonorrhoeae.: S< 0,12 mg/l, R> 0,12 mg/l² N. meningitides: S< 0,12 mg/l, R> 0,12 mg/l² Icke stamrelaterade brytpunkter: S< 1 mg/l, R> 2 mg/l³ ¹ Cefalosporinbrytpunkter för Enterobacteriaceae kommer att detektera resistens medierad av de flesta ESBLer och andra kliniskt viktiga betalaktamaser i Enterobacteriaceae. Emellertid kommer några ESBL producerande stammar visa sig vara känsliga eller intermediära med dessa brytpunkter. Laboratorier kan vilja använda tester som specifikt screenar för ESBL närvaro. 9
10 ² Arter med MIC värden över S/I brytpunkterna är mycket sällsynta eller ännu inte rapporterade. Identifiering och antimikrobiella känslighetstest på varje sådant isolat måste upprepas och om resultatet bekräftas, måste isolatet skickas till referenslab. Ända tills det föreligger bevis angående klinisk effekt, för bekräftade isolat, med MIC över nuvarande brytpunkter (med kursiv stil) skall de rapporteras som resistenta. ³ Icke stamrelaterade brytpunkter har bestämts i huvudsak med PK/PD data och är oberoende av MIC fördelningen för specifika arter. Mikrobiologi Prevalensen av förvärvad resistens kan variera geografiskt och över tid för vissa arter och lokal information om resistens är önskvärd, speciellt vid behandling av svåra infektioner. Om nödvändigt bör experthjälp sökas, när den lokala resistensprevalensen är sådan att nyttan av läkemedlet kan ifrågasättas för vissa typer av infektioner. Vanligtvis känsliga arter Grampositiva aerober Staphylococcus aureus (MSSA) Staphylococcus epidermidis (MSSA) Streptococcus pyogenes Streptococcus pneumoniae Viridans grupp streptokocker Gramnegativa aerober Escherichia coli¹ Haemophilus influenzae Haemophilus parainfluenzae Klebsiella pneumoniae¹ Klebsiella oxytoca¹ Moraxella catarrhalis Neisseria meningitidis Proteus mirabelis¹ Anaerober Bacteroides fragilis Clostridium spp Peptostreptococcus spp. Arter för vilka förvärvad resistens kan vara ett problem Acinetobacter spp Citrobacter freundii¹ Enterobacter spp.¹ ² Morganella morganii. Serratia marcescens Naturligt resistenta mikroorganismer Clostridium difficile 10
11 Enterococci Listeria monocytogenes Proteus vulgaris Pseudomonas spp. 1) Vissa stammar producerar inducerade eller stabilt undertryckta kromosomalt kodade cefalosporinaser och ESBL (bredspektrumbetalaktamaser) och är därför kliniskt resistenta mot cefalosporiner. 2) Klinisk effekt har visats mot känsliga isolater av Enteobacter cloacae och Enterobacter aerogenes vid godkända kliniska indikationer. 5.2 Farmakokinetiska egenskaper Ceftriaxon är en cefalosporin avsedd för parenteral administering. Ceftriaxon absorberas inte efter oral administrering. Efter en dos på 1-2 g har koncentrationen visat sig kvarstå över MIC värdena i över 24 timmar i över 60 vävnader (inkluderande lungor, hjärta, gallgångar, lever, tonsiller, mellanörat, nässlemhinnan och i ben) samt i många vävnadsvätskor (inkluderande cerebrospinal- och pleuralvätskan, såväl som prostata- och synovialvätskan) för de flesta infektionsorsakande patogener. Distribution Ceftriaxon distribueras bra i olika kompartment och passerar också placentabarriären. Medelvärdet för distributionsvolymen hos friska vuxna är 0,13 l/kg. Ceftriaxon är reversibelt bundet till albumin. Bindningen är 95 % vid plasmakoncentrationer på mindre än 100mg/l med minskande bindningsprocent vid ökande koncentration (till 85% vid plasmakoncentrationer på 300 µg/ml). Serumnivåer Efter en intravenös infusion av 1 g ceftriaxon under 30 minuter var serumnivåerna omedelbart efter avslutad infusion 123,2 µg/ml och 94,81; 57,8; 20,2 och 4,6 µg/ml efter respektive 1,5; 4; 12 respektive 24 timmar efter infusionstarten. Ceftriaxon penetrerar inflammerade meninger hos nyfödda, spädbarn och barn. I CSF nås högsta koncentrationen på 18 mg/l efter ungefär 4 timmar, efter en dos på mg/kg intravenöst. Hos vuxna patienter med meningit erhålls terapeutisk koncentration inom 2-24 timmar med en dos på 50 mg/kg. Ceftriaxon passerar placentan och utsöndras i låga koncentrationer i bröstmjölk. Biotransformation Ceftriaxon genomgår inte systemisk metabolism men bryts ner i tunntarmen av bakterier. Elimination I dosintervallet 0,15 till 3 g är eliminationshalveringstiden mellan 6-9 timmar, total plasmaclearance från 0,6-1,4 l/timme och njurclerance från 0,3-0,7 l/ timme % av ceftriaxon elimineras i urinen som oförändrad aktiv substans medan återstoden utsöndras via gallan i feces då som mikrobiologiskt inaktiva metaboliter. Ceftriaxon koncentreras i urin. Urinkoncentrationen är 5-10 gånger högre än den i plasma. Ceftriaxon kan inte avlägsnas genom dialys. Detta gäller både hemodialys som peritonealdialys. 11
12 Urinutsöndringen sker genom glomerulär filtrering. Ingen tubulär sekretion äger rum. På grund av detta väntas ingen höjning av serumnivåerna vid samtidig administrering av probenecid och någon sådan höjning har heller inte rapporterats, inte ens vid högre dosering t.ex. med 1-2 g probenecid. Icke-linjäritet Ceftriaxons farmakokinetik är icke-linjär med avseende på dosen. Denna icke linjära farmakokinetik förklaras med en koncentrationsberoende minskning av bindningen till plasmaproteiner som leder till en motsvarande ökning i distribution och elimination. Med undantag av eliminationshalveringstiden är alla farmakokinetiska parametrar dosberoende. Upprepad tillförsel på 0,5 till 2 g resulterar i 15% -36% ackumuering över värdet för en enstaka dos. Speciella patientgrupper Äldre, över 75 år : Eliminationshalveringstiden för ceftriaxon i plasma är ungefär 2-3 gånger högre jämfört med unga vuxna. Hos nyfödda 3 dagar gamla spädbarn är halveringstiden för ceftriaxon ungefär 16 timmar och hos nyfödda mellan 9-30 dagar ungefär 9 timmar. Patienter med nedsatt njur- och/eller leverfunktion: Patienter med nedsatt njurfunktion har en ökad utsöndring av ceftriaxon till gallan. Patienter med nedsatt leverfunktion har en ökad renal utsöndring av ceftriaxon. Eliminationshalveringstiden i plasma är nästan inte ökad hos dessa patientgrupper. Patienter med en nedsatt njurfunktion såväl som nedsatt leverfunktion kan ha en ökad eliminationshalveringstid för ceftriaxon i plasma. Vid terminal njurinsufficiens är halveringstiden avsevärt högre och når ungefär 14 timmar. 5.3 Prekliniska säkerhetsuppgifter I djurstudier har vid upprepad dosering biverkningar (t.ex. gastrointestinala störningar och nefrotoxicitet) som associeras med höga parenterala cefalosporindoser, visat sig vara reversibla. Efter höga ceftriaxondoser till apa och hund har diarré, bildande av gallstenar i gallblåsan och nefropati observerats. Ceftriaxon har ingen effekt på fertilitet eller reproduktion och har inte visat sig ha mutagen effekt. 6. FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen Detta läkemedel innehåller inga hjälpämnen 6.2 Inkompatibiliteter Detta läkemedel får inte blandas med andra spädningsvätskor förutom de som nämns under avsnitt 6.6. I synnerhet är ceftriaxon inte blandbart med kalciuminnehållande lösningar så som Hartmanns lösning eller Ringers lösning. Ceftriaxon får inte blandas med lösningar som innehåller andra antimikrobiella substanser. Baserat på litteraturrapporter är ceftriaxon inkompatibelt med amsakrin, vankomycin, flukonazol, aminoglykosider och labetalol. 6.3 Hållbarhet 30 månader Efter upplösning och spädning skall läkemedlet användas omedelbart. 12
13 6.4 Särskilda förvaringsanvisningar Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt. 6.5 Förpackningstyp och innehåll 10 x 1 g pulver till injektions-/infusionsvätska, lösning 10 x 2 g pulver till infusionsvätska, lösning En färglös (typ II (50ml) Ph Eur.) injektionsflaska av glas med en butylgummipropp, aluminiumlock med ett plastskydd (PP) av flip off type. Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras. 6.6 Särskilda anvisningar för destruktion och övrig hantering Ceftriaxon måste lösas upp omedelbart innan injektion (se avsnitt 4.2). Den beredda lösningen bör inspekteras visuellt för partiklar och missfärgning innan administrering. Den beredda lösningen är klar och färglös. Endast för engångsbruk. Intravenös infusion: Vid intravenös infusion löses 1-2g ceftriaxon i ml av en av följande infusionslösningar (som inte innehåller kalcium): 9 mg/ml natriumklorid, 4,5 mg/ml natriumklorid + 2,5% glukos, 5 % glukos, 10% glukos och vatten för injektionsvätskor. Infusionstiden bör vara minst 30 minuter. På grund av möjlig inkompatibilitet får produkten inte lösas i andra injektionslösningar än de som nämnts ovan, inte heller bör produkten blandas med andra flytande antibiotika. Intravenös injektion: Vid en intravenös injektion, löses 1 g ceftriaxon i 10 ml vatten för injektionsvätskor. Injektionen ges intravenöst under 2-4 minuter. Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar. 7. INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Stragen Nordic A/S Hesselvej 41, Ganløse 3660 Stenløse Danmark 8. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 1 g: g: DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
PRODUKTRESUMÉ. Donaxyl 10 mg vaginaltabletter är avsedda för behandling av bakteriell vaginos (se avsnitt 4.4).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Donaxyl 10 mg vaginaltabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje vaginaltablett innehåller 10 mg dekvaliniumklorid. För fullständig förteckning över hjälpämnen,
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Donaxyl 10 mg vaginaltabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje vaginaltablett innehåller 10 mg dekvaliniumklorid. För fullständig förteckning över hjälpämnen,
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En injektionsflaska innehåller cefuroximnatrium motsvarande 250 mg, 750 mg respektive 1500 mg cefuroxim.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefuroxim Sandoz pulver till injektionsvätska, lösning Cefuroxim Sandoz pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En injektionsflaska
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefuroxim Sandoz pulver till injektionsvätska, lösning Cefuroxim Sandoz pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En injektionsflaska
PRODUKTRESUMÉ. Behandling av bakterieinfektioner orsakade av bakteriestammar som är känsliga för enrofloxacin.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Fenoflox vet 100 mg/ml injektionsvätska, lösning för nöt och svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans:
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Fenoflox vet 100 mg/ml injektionsvätska, lösning för nöt och svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans:
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ceftriaxon Copyfarm 1 g, pulver till injektionsvätska, lösning. Ceftriaxon Copyfarm 2 g, pulver till infusionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ceftriaxon Copyfarm 1 g, pulver till injektionsvätska, lösning. Ceftriaxon Copyfarm 2 g, pulver till infusionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
1 LÄKEMEDLETS NAMN Rocephalin 1 g pulver och vätska till injektionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rocephalin 1 g pulver och vätska till injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ceftriaxonnatrium motsvarande ceftriaxon 1 g. För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rocephalin 1 g pulver och vätska till injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ceftriaxonnatrium motsvarande ceftriaxon 1 g. För fullständig
4.1 Terapeutiska indikationer Lindrig och medelsvår ulcerös kolit. Proktit och proktosigmoidit.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pentasa 1 g rektalsuspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 ml innehåller 1 g mesalazin (5-aminosalicylsyra). Beträffande hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pentasa 1 g rektalsuspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 ml innehåller 1 g mesalazin (5-aminosalicylsyra). Beträffande hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM
Behandling av akut interdigital nekrobacillos hos nötkreatur, s.k. Panaritium eller klövspaltsinflammation.
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN NAXCEL 200 mg/ml injektionsvätska, suspension för nötkreatur 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv substans: Ceftiofur (som kristallinsk
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN NAXCEL 200 mg/ml injektionsvätska, suspension för nötkreatur 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv substans: Ceftiofur (som kristallinsk
PRODUKTRESUMÉ. septikemi akut bakteriell meningit pneumoni Behandlingen kan påbörjas innan resultat från känslighetstester är kända.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Ceftriaxon Stragen 500 mg pulver till injektionsvätska, lösning Ceftriaxon Stragen 1 g pulver till injektionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Ceftriaxon Stragen 500 mg pulver till injektionsvätska, lösning Ceftriaxon Stragen 1 g pulver till injektionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller: Meropenemtrihydrat motsvarande meropenem 500 mg respektive 1 g.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Meronem pulver till injektions-/infusionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller: Meropenemtrihydrat motsvarande meropenem
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Meronem pulver till injektions-/infusionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller: Meropenemtrihydrat motsvarande meropenem
Denna information är avsedd för vårdpersonal.
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Loratadin Sandoz 10 mg munsönderfallande tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En munsönderfallande tablett innehåller 10
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Loratadin Sandoz 10 mg munsönderfallande tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En munsönderfallande tablett innehåller 10
Denna information är avsedd för vårdpersonal. Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En endosbehållare (0,3 ml) innehåller
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En endosbehållare (0,3 ml) innehåller
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Isosorbidmononitrat Mylan 10 mg tablett Isosorbidmononitrat Mylan 20 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: Isosorbid-5-mononitrat
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Isosorbidmononitrat Mylan 10 mg tablett Isosorbidmononitrat Mylan 20 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: Isosorbid-5-mononitrat
PRODUKTRESUMÉ. Administreringssätt Selexid tabletter ska intas med minst ett halvt glas vätska och inte i liggande ställning.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Selexid 200 mg filmdragerade tabletter Selexid 400 mg filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller pivmecillinamhydroklorid
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Selexid 200 mg filmdragerade tabletter Selexid 400 mg filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller pivmecillinamhydroklorid
1 LÄKEMEDLETS NAMN Doktacillin 1 g respektive 2 g pulver till injektions-/infusionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Doktacillin 1 g respektive 2 g pulver till injektions-/infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller ampicillinnatrium
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Doktacillin 1 g respektive 2 g pulver till injektions-/infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller ampicillinnatrium
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1/31 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Meloxivet 0,5 mg/ml oral suspension för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans: Meloxikam
BILAGA I PRODUKTRESUMÉ 1/31 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Meloxivet 0,5 mg/ml oral suspension för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans: Meloxikam
1 LÄKEMEDLETS NAMN Ceftriaxon ACS Dobfar Generics 1 g, pulver till injektionsvätska, lösning.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ceftriaxon ACS Dobfar Generics 1 g, pulver till injektionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Pulver till injektionsvätska, lösning: En injektionsflaska
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ceftriaxon ACS Dobfar Generics 1 g, pulver till injektionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Pulver till injektionsvätska, lösning: En injektionsflaska
PRODUKTRESUMÉ. Koncentrationen av elekrolytjoner blir följande när båda dospåsarna lösts upp i 1 liter vatten:
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Movprep pulver till oral lösning, dospåsar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Innehållsämnena i Movprep tillhandahålls i två separata dospåsar. Dospåse A innehåller
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Movprep pulver till oral lösning, dospåsar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Innehållsämnena i Movprep tillhandahålls i två separata dospåsar. Dospåse A innehåller
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Recocam 20 mg/ml injektionsvätska, lösning, för nötkreatur, svin och häst 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller:
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Recocam 20 mg/ml injektionsvätska, lösning, för nötkreatur, svin och häst 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller:
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (0,05 ml) innehåller budesonid 32 mikrogram respektive 64 mikrogram
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rhinocort Aqua 32 mikrogram/dos nässpray, suspension. Rhinocort Aqua 64 mikrogram/dos nässpray, suspension. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (0,05 ml)
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rhinocort Aqua 32 mikrogram/dos nässpray, suspension. Rhinocort Aqua 64 mikrogram/dos nässpray, suspension. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (0,05 ml)
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Spironolakton Pfizer 25 mg tabletter Spironolakton Pfizer 50 mg tabletter Spironolakton Pfizer 100 mg tabletter
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Spironolakton Pfizer 25 mg tabletter Spironolakton Pfizer 50 mg tabletter Spironolakton Pfizer 100 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Spironolakton
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Spironolakton Pfizer 25 mg tabletter Spironolakton Pfizer 50 mg tabletter Spironolakton Pfizer 100 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Spironolakton
Hjälpämne: Natrium (som klorid och hydroxid); 0,8 1,6 mg/ml (35 70 mmol/l)
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vivaglobin, 160 mg/ml injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: humant normalt immunglobulin 160 mg* * motsvarar totalt proteininnehåll
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vivaglobin, 160 mg/ml injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: humant normalt immunglobulin 160 mg* * motsvarar totalt proteininnehåll
Zerbaxa. ceftolozan / tazobaktam. version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 EMA/513109/2015 Zerbaxa ceftolozan / tazobaktam version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen
EMA/513109/2015 Zerbaxa ceftolozan / tazobaktam version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen
Bilaga III. Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel
 Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml suspension innehåller amoxicillintrihydrat motsvarande 50 mg amoxicillin
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Amoxicillin Mylan 50 mg/ml granulat till oral suspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml suspension innehåller amoxicillintrihydrat motsvarande 50 mg amoxicillin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Amoxicillin Mylan 50 mg/ml granulat till oral suspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml suspension innehåller amoxicillintrihydrat motsvarande 50 mg amoxicillin
OBS! Tentamensinstruktion, läs igenom! OBS!
 KOD: Hälsa och samhälle Enheten för omvårdnad ORDINARIE TENTAMEN Läkemedelsberäkning Kurs OM161A Datum: 14 03 15 Tid: 09.00-11.30 Hjälpmedel: Miniräknare Maxpoäng: 10 p (1 p per uppgift) Godkänt (100 %):
KOD: Hälsa och samhälle Enheten för omvårdnad ORDINARIE TENTAMEN Läkemedelsberäkning Kurs OM161A Datum: 14 03 15 Tid: 09.00-11.30 Hjälpmedel: Miniräknare Maxpoäng: 10 p (1 p per uppgift) Godkänt (100 %):
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Finacea 15 % gel. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Finacea 15 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra. Hjälpämnen med känd effekt: 1 mg bensoesyra/g gel 0,12 g propylenglykol/g
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Finacea 15 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra. Hjälpämnen med känd effekt: 1 mg bensoesyra/g gel 0,12 g propylenglykol/g
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Cefamox löslig, 1 g, löslig tablett. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Cefadroxil 1 g.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefamox löslig, 1 g, löslig tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Cefadroxil 1 g. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefamox löslig, 1 g, löslig tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Cefadroxil 1 g. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
1 LÄKEMEDLETS NAMN Rocephalin med lidokain, 1 g pulver och vätska till injektionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rocephalin med lidokain, 1 g pulver och vätska till injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ceftriaxonnatrium motsvarande ceftriaxon 1 g,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rocephalin med lidokain, 1 g pulver och vätska till injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ceftriaxonnatrium motsvarande ceftriaxon 1 g,
Tabletterna är delbara. Hel eller delad tablett får ej tuggas och skall sväljas tillsammans med ½ glas vätska.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ISOSORBIDMONONITRAT MYLAN 60 mg depottablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller isosorbid-5-mononitrat 60 mg. Beträffande hjälpämnen,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ISOSORBIDMONONITRAT MYLAN 60 mg depottablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller isosorbid-5-mononitrat 60 mg. Beträffande hjälpämnen,
BIPACKSEDEL. Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst
 BIPACKSEDEL Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
BIPACKSEDEL Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
1 LÄKEMEDLETS NAMN Amekrin 75 mg koncentrat och vätska till koncentrat till infusionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Amekrin 75 mg koncentrat och vätska till koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Koncentratet (1,5 ml) innehåller amsacrin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Amekrin 75 mg koncentrat och vätska till koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Koncentratet (1,5 ml) innehåller amsacrin
Läkemedlets namn Namn Ciprofloxacin 2 mg/ml Infusionsvätska, lösning. Ciprofloxacin Nycomed. Ciprofloxacin Nycomed. Ciprofloxacin Nycomed
 BILAGA I FÖRTECKNING ÖVER LÄKEMEDLETS NAMN, LÄKEMEDELSFORM(ER), STYRKA, ADMINISTRERINGSSÄTT AV LÄKEMEDLET SAMT SÖKANDE OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSSTATERNA Medlemsstat Innehavare
BILAGA I FÖRTECKNING ÖVER LÄKEMEDLETS NAMN, LÄKEMEDELSFORM(ER), STYRKA, ADMINISTRERINGSSÄTT AV LÄKEMEDLET SAMT SÖKANDE OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSSTATERNA Medlemsstat Innehavare
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Diabact UBT 50 mg tabletter.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Diabact UBT 50 mg tabletter. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 13 C-urea 50 mg, anrikad stabil isotop. För fullständig förteckning över
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Diabact UBT 50 mg tabletter. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 13 C-urea 50 mg, anrikad stabil isotop. För fullständig förteckning över
OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING 2014-06-03 08.00-10.00
 Malmö högskola Hälsa och samhälle Utbildningsområde: Omvårdnad Kod nr: Tidpunkt för inlämning: OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING KURS OM121A, termin 2 2014-06-03 08.00-10.00 Hjälpmedel: Miniräknare, ej
Malmö högskola Hälsa och samhälle Utbildningsområde: Omvårdnad Kod nr: Tidpunkt för inlämning: OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING KURS OM121A, termin 2 2014-06-03 08.00-10.00 Hjälpmedel: Miniräknare, ej
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna information, du kan behöva
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Addaven innehåller: 1 ml 1 ampull (10 ml) Ferrikloridhexahydrat 0,54 mg 5,40
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Addaven innehåller: 1 ml 1 ampull (10 ml) Ferrikloridhexahydrat 0,54 mg 5,40
Bakterie- och svampotiter är ofta sekundära. De bakomliggande orsakerna ska identifieras och behandlas.
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Posatex örondroppar, suspension för hund. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiva substanser: Orbifloxacin Mometasonfuroat (som monohydrat) Posakonazol
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Posatex örondroppar, suspension för hund. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiva substanser: Orbifloxacin Mometasonfuroat (som monohydrat) Posakonazol
PRODUKTRESUMÉ. 0009 mg i sugtabletter med honung-citronsmak. Triolif Mint sugtabletter är gröna, bikonvexa, cylinderformade och 19 mm i diameter
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Triolif Mint sugtabletter Triolif Apelsin sugtabletter Triolif Honung & Citron sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller: Lidokainhydroklorid
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Triolif Mint sugtabletter Triolif Apelsin sugtabletter Triolif Honung & Citron sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller: Lidokainhydroklorid
PRODUKTRESUMÉ. Albumin Biotest 200 g/l är en lösning innehållande 200 g/l (20%) totalt protein av vilket minst 95% är humant albumin.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Albumin Biotest 200 g/l infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Humant albumin Albumin Biotest 200 g/l är en lösning innehållande 200 g/l
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Albumin Biotest 200 g/l infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Humant albumin Albumin Biotest 200 g/l är en lösning innehållande 200 g/l
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Elosalic salva
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Elosalic salva 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram salva innehåller 1 mg mometasonfuroat och 50 mg salicylsyra. Hjälpämne: Ett gram salva innehåller 20
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Elosalic salva 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram salva innehåller 1 mg mometasonfuroat och 50 mg salicylsyra. Hjälpämne: Ett gram salva innehåller 20
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller trimetoprim 100 mg respektive 160 mg.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Idotrim 100 mg tabletter Idotrim 160 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller trimetoprim 100 mg respektive 160 mg. Beträffande hjälpämnen
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Idotrim 100 mg tabletter Idotrim 160 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller trimetoprim 100 mg respektive 160 mg. Beträffande hjälpämnen
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. TRISENOX 1 mg/ml, koncentrat till injektionsvätska, lösning Arseniktrioxid
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN TRISENOX 1 mg/ml, koncentrat till injektionsvätska, lösning Arseniktrioxid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. - Spara denna
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN TRISENOX 1 mg/ml, koncentrat till injektionsvätska, lösning Arseniktrioxid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. - Spara denna
PRODUKTRESUMÉ. 600 mg brustablett innehåller 138,8 mg natrium, motsvarande 7% av WHOs högsta rekommenderat
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
Aktiv substans 1 kapsel à 25 mg innehåller: Klindamycinhydroklorid 29 mg motsvarande klindamycin 25 mg (vit/gul kapsel).
 PRODUKTRESUMÉ 1 DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Antirobe vet. 25 mg hårda kapslar, hund och katt Antirobe vet. 75 mg hårda kapslar, hund och katt Antirobe vet. 150 mg hårda kapslar, hund Antirobe
PRODUKTRESUMÉ 1 DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Antirobe vet. 25 mg hårda kapslar, hund och katt Antirobe vet. 75 mg hårda kapslar, hund och katt Antirobe vet. 150 mg hårda kapslar, hund Antirobe
PRODUKTRESUMÉ. Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans:
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans:
Semisyntetiska. Gentamicin. Streptomycin Kanamycin Neomycin Tobramycin (Nebcina, Tobi ) Gentamicin (Gensumycin ) Sisomicin
 Aminoglykosider Aminoglykosider är naturligt förekommande molekyler hos vissa svamparter och har potent antibakteriell effekt. Ett par är semisyntetiska derivat Naturligt förekommande Streptomycin Kanamycin
Aminoglykosider Aminoglykosider är naturligt förekommande molekyler hos vissa svamparter och har potent antibakteriell effekt. Ett par är semisyntetiska derivat Naturligt förekommande Streptomycin Kanamycin
4.1 Terapeutiska indikationer Soluvit tillgodoser det dagliga behovet av vattenlösliga vitaminer vid intravenös nutrition.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Soluvit pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 flaska innehåller: Motsvarande: Tiaminnitrat 3,1 mg Tiamin (vitamin B 1 ) 2,5
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Soluvit pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 flaska innehåller: Motsvarande: Tiaminnitrat 3,1 mg Tiamin (vitamin B 1 ) 2,5
PRODUKTRESUMÉ. Donaxyl 10 mg vaginaltabletter är avsedda för behandling av bakteriell vaginos (se avsnitt 4.4).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Donaxyl 10 mg vaginaltabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje vaginaltablett innehåller 10 mg dekvaliniumklorid. För fullständig förteckning över hjälpämnen,
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Donaxyl 10 mg vaginaltabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje vaginaltablett innehåller 10 mg dekvaliniumklorid. För fullständig förteckning över hjälpämnen,
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN INCURIN 1 mg tablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans: Östriol 1 mg/tablett För fullständig förteckning över
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN INCURIN 1 mg tablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans: Östriol 1 mg/tablett För fullständig förteckning över
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ HALOCUR 0,5 mg/ml oral lösning SV 4 1. VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN HALOCUR 0,5 mg/ml oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 2.1 Aktivt innehållsämne Halofuginonbas
BILAGA I PRODUKTRESUMÉ HALOCUR 0,5 mg/ml oral lösning SV 4 1. VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN HALOCUR 0,5 mg/ml oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 2.1 Aktivt innehållsämne Halofuginonbas
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN. Aivlosin 8,5 mg/g premix till medicinfoder för svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Aivlosin 8,5 mg/g premix till medicinfoder för svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv(a) substans: Tylvalosin (som tylvalosintartrat) 8,5 mg/g
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Aivlosin 8,5 mg/g premix till medicinfoder för svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv(a) substans: Tylvalosin (som tylvalosintartrat) 8,5 mg/g
4.1 Terapeutiska indikationer Typherix används för aktiv immunisering mot tyfoidfeber av vuxna och barn från 2 års ålder.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
BILAGA III ÄNDRINGAR I PRODUKTRESUMÉ OCH BIPACKSEDEL
 BILAGA III ÄNDRINGAR I PRODUKTRESUMÉ OCH BIPACKSEDEL 1 ÄNDRINGAR SOM KOMMER ATT INFÖRAS I RELEVANTA AVSNITT AV PRODUKTRESUMÉN FÖR LÄKEMEDEL INNEHÅLLANDE MOXIFLOXACIN Följande text ska införas (nya avsnitt
BILAGA III ÄNDRINGAR I PRODUKTRESUMÉ OCH BIPACKSEDEL 1 ÄNDRINGAR SOM KOMMER ATT INFÖRAS I RELEVANTA AVSNITT AV PRODUKTRESUMÉN FÖR LÄKEMEDEL INNEHÅLLANDE MOXIFLOXACIN Följande text ska införas (nya avsnitt
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Porcilis PCV M Hyo, injektionsvätska, emulsion för svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (2 ml) innehåller: Aktiva
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Porcilis PCV M Hyo, injektionsvätska, emulsion för svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (2 ml) innehåller: Aktiva
0,5 mg: vita plana tabletter med brytskåra, diameter 7 mm. 1 mg: vita plana tabletter med brytskåra, diameter 7 mm, märkta phi beta 614.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fluscand 0,5 mg tabletter Fluscand 1 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller flunitrazepam 0,5 mg respektive 1 mg. Hjälpämne: Laktosmonohydrat
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fluscand 0,5 mg tabletter Fluscand 1 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller flunitrazepam 0,5 mg respektive 1 mg. Hjälpämne: Laktosmonohydrat
Längre behandlingstid än 6 månader rekommenderas ej. Vissa före detta rökare kan dock behöva behandling längre för att inte återgå till rökning.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Nicorette 5 mg/16 timmar depotplåster Nicorette 10 mg/16 timmar depotplåster Nicorette 15 mg/16 timmar depotplåster Nicorette 5 mg/16 timmar + 10 mg/16 timmar + 15 mg/16
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Nicorette 5 mg/16 timmar depotplåster Nicorette 10 mg/16 timmar depotplåster Nicorette 15 mg/16 timmar depotplåster Nicorette 5 mg/16 timmar + 10 mg/16 timmar + 15 mg/16
1 LÄKEMEDLETS NAMN Dalacin 10 mg/ml kutan emulsion
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Dalacin 10 mg/ml kutan emulsion 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan emulsion innehåller: Klindamycin-2-fosfat motsvarande klindamycin 10 mg. För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Dalacin 10 mg/ml kutan emulsion 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan emulsion innehåller: Klindamycin-2-fosfat motsvarande klindamycin 10 mg. För fullständig
BIPACKSEDEL. Torphasol vet. 10 mg/ml, injektionsvätska, lösning, för häst
 BIPACKSEDEL Torphasol vet. 10 mg/ml, injektionsvätska, lösning, för häst 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
BIPACKSEDEL Torphasol vet. 10 mg/ml, injektionsvätska, lösning, för häst 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN. Kloramfenikol Santen 5 mg/ml ögondroppar, lösning i endosbehållare 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Kloramfenikol Santen 5 mg/ml ögondroppar, lösning i endosbehållare 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml ögondroppar, lösning innehåller 5 mg kloramfenikol.
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Kloramfenikol Santen 5 mg/ml ögondroppar, lösning i endosbehållare 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml ögondroppar, lösning innehåller 5 mg kloramfenikol.
PRODUKTRESUMÉ. Officiella behandlingsrekommendationer beträffande lämplig användning av antibiotika ska beaktas.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Cefotaxim MIP 1 g pulver till injektions-/infusionsvätska, lösning Cefotaxim MIP 2 g pulver till injektions-/infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Cefotaxim MIP 1 g pulver till injektions-/infusionsvätska, lösning Cefotaxim MIP 2 g pulver till injektions-/infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ. En filmdragerad tablett innehåller 800 mg eller 1 g av fenoximetylpenicillinkalium.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Fenoximetylpenicillin EQL Pharma 800 mg filmdragerade tabletter Fenoximetylpenicillin EQL Pharma 1 g filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Fenoximetylpenicillin EQL Pharma 800 mg filmdragerade tabletter Fenoximetylpenicillin EQL Pharma 1 g filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Bilaga III. Ändringar av relevanta avsnitt av produktresumén och bipacksedeln
 Bilaga III Ändringar av relevanta avsnitt av produktresumén och bipacksedeln Observera: De relevant avsnitten av produktresumé och bipacksedel är resultatet av referral-proceduren. Produktinformationen
Bilaga III Ändringar av relevanta avsnitt av produktresumén och bipacksedeln Observera: De relevant avsnitten av produktresumé och bipacksedel är resultatet av referral-proceduren. Produktinformationen
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN. Tsefalen 500 mg filmdragerade tabletter för hund
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Tsefalen 500 mg filmdragerade tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje filmdragerad tablett innehåller: Aktiv substans:
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Tsefalen 500 mg filmdragerade tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje filmdragerad tablett innehåller: Aktiv substans:
PRODUKTRESUMÉ. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 dos (=0,5 ml) innehåller: Aluminiumhydroxidhydrat motsvarande aluminium
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ditebooster injektionsvätska, suspension i förfylld spruta. Difteri och tetanusvaccin (adsorberad, reducerat innehåll av antigen). 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ditebooster injektionsvätska, suspension i förfylld spruta. Difteri och tetanusvaccin (adsorberad, reducerat innehåll av antigen). 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Antibiotikakompendium
 1 Antibiotikakompendium Introduktion Detta antibiotikakompendium ger en översikt av antibiotika och dess användningsområde i Sverige. Antibiotikakompendiet baseras på läkemedelföretagens monografier (FASS),
1 Antibiotikakompendium Introduktion Detta antibiotikakompendium ger en översikt av antibiotika och dess användningsområde i Sverige. Antibiotikakompendiet baseras på läkemedelföretagens monografier (FASS),
BIPACKSEDEL FÖR Procamidor vet. 20 mg/ml injektionsvätska, lösning
 BIPACKSEDEL FÖR Procamidor vet. 20 mg/ml injektionsvätska, lösning Läkemedelsverket 2013-11-07 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN
BIPACKSEDEL FÖR Procamidor vet. 20 mg/ml injektionsvätska, lösning Läkemedelsverket 2013-11-07 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Spektramox. 500 mg/125 mg filmdragerade tabletter
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Spektramox 500 mg/125 mg filmdragerade tabletter Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. - Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Spektramox 500 mg/125 mg filmdragerade tabletter Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. - Spara denna information, du kan behöva
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN. Dinalgen vet 300 mg/ml oral lösning för nötkreatur och svin
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Dinalgen vet 300 mg/ml oral lösning för nötkreatur och svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml innehåller: Aktiv substans: Ketoprofen
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Dinalgen vet 300 mg/ml oral lösning för nötkreatur och svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml innehåller: Aktiv substans: Ketoprofen
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1/25 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Previcox 57 mg tuggtabletter för hund Previcox 227 mg tuggtabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
BILAGA I PRODUKTRESUMÉ 1/25 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Previcox 57 mg tuggtabletter för hund Previcox 227 mg tuggtabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
(Vita till gulvita kapselformade, bikonvexa filmdragerade tabletter märkta med T på ena sidan och 64 på den andra sidan.)
 Penomax Orion Pharma Filmdragerad tablett 400 mg (Vita till gulvita kapselformade, bikonvexa filmdragerade tabletter märkta med T på ena sidan och 64 på den andra sidan.) Penicilliner med utvidgat spektrum
Penomax Orion Pharma Filmdragerad tablett 400 mg (Vita till gulvita kapselformade, bikonvexa filmdragerade tabletter märkta med T på ena sidan och 64 på den andra sidan.) Penicilliner med utvidgat spektrum
1 LÄKEMEDLETS NAMN Atrovent, 0,25 mg/ml, lösning för nebulisator, endosbehållare Atrovent, 0,5 mg/ml, lösning för nebulisator, endosbehållare
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Atrovent, 0,25 mg/ml, lösning för nebulisator, endosbehållare Atrovent, 0,5 mg/ml, lösning för nebulisator, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Atrovent, 0,25 mg/ml, lösning för nebulisator, endosbehållare Atrovent, 0,5 mg/ml, lösning för nebulisator, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1
BILAGA 1 PRODUKTRESUMÉ
 BILAGA 1 PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Menveo Pulver och lösning till injektionsvätska, lösning Vaccin mot grupp A-, C-, W135- och Y-meningokockinfektion, konjugerat 2. KVALITATIV OCH KVANTITATIV
BILAGA 1 PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Menveo Pulver och lösning till injektionsvätska, lösning Vaccin mot grupp A-, C-, W135- och Y-meningokockinfektion, konjugerat 2. KVALITATIV OCH KVANTITATIV
Bilaga III Tillägg till relevanta avsnitt i Produktresumén och Bipacksedeln
 Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING 2014-04-08 08.00-10.00
 Malmö högskola Hälsa och samhälle Utbildningsområde: Omvårdnad Kod nr: OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING KURS OM121A, termin 2 2014-04-08 08.00-10.00 Hjälpmedel: Miniräknare, ej programmerbar Godkänd:
Malmö högskola Hälsa och samhälle Utbildningsområde: Omvårdnad Kod nr: OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING KURS OM121A, termin 2 2014-04-08 08.00-10.00 Hjälpmedel: Miniräknare, ej programmerbar Godkänd:
BIPACKSEDEL. Metacam 5 mg/ml injektionsvätska, lösning för nötkreatur och svin
 BIPACKSEDEL Metacam 5 mg/ml injektionsvätska, lösning för nötkreatur och svin 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
BIPACKSEDEL Metacam 5 mg/ml injektionsvätska, lösning för nötkreatur och svin 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
1 LÄKEMEDLETS NAMN Ekvacillin 1 g respektive 2 g pulver till injektions-/infusionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ekvacillin 1 g respektive 2 g pulver till injektions-/infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller 1 g respektive
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ekvacillin 1 g respektive 2 g pulver till injektions-/infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 injektionsflaska innehåller 1 g respektive
Leflunomide STADA. Version, V1.0
 Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
PRODUKTRESUMÉ. 1 cm salva appliceras i konjunktivalsäcken flera gånger dagligen, inledningsvis t.ex. var tredje timme.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Kloramfenikol Santen 10 mg/g ögonsalva 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram ögonsalva innehåller 10 mg kloramfenikol För fullständig förteckning över
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Kloramfenikol Santen 10 mg/g ögonsalva 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram ögonsalva innehåller 10 mg kloramfenikol För fullständig förteckning över
Handläggning av antibiotikaallergi
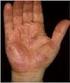 VO INFEKTIONSSJUKDOMAR Dokumenttyp: Medicinskt PM Titel: Antibiotikaallergi Dokumentansvarig: Simon Werner, Malmö Malin Inghammar, Lund Godkänt av: Peter Lanbeck Publicerat av: Irene Silfver Reviderad
VO INFEKTIONSSJUKDOMAR Dokumenttyp: Medicinskt PM Titel: Antibiotikaallergi Dokumentansvarig: Simon Werner, Malmö Malin Inghammar, Lund Godkänt av: Peter Lanbeck Publicerat av: Irene Silfver Reviderad
PRODUKTRESUMÉ. Ges vanligen intravenöst men kan också administreras intramuskulärt. Resistensbestämning bör utföras.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefotaxim Villerton pulver till injektionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Cefotaximnatrium motsvarande cefotaxim 0,5 g. Cefotaximnatrium motsvarande
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefotaxim Villerton pulver till injektionsvätska, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Cefotaximnatrium motsvarande cefotaxim 0,5 g. Cefotaximnatrium motsvarande
Ibaflin används för behandling av följande sjukdomstillstånd hos hund:
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN 30 mg tabletter för hund 150 mg tabletter för hund 300 mg tabletter för hund 900 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN 30 mg tabletter för hund 150 mg tabletter för hund 300 mg tabletter för hund 900 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN. Penomax 400 mg filmdragerade tabletter: 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Penomax 200 mg filmdragerade tabletter Penomax 400 mg filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Penomax 200 mg filmdragerade tabletter: Varje
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Penomax 200 mg filmdragerade tabletter Penomax 400 mg filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Penomax 200 mg filmdragerade tabletter: Varje
PRODUKTRESUMÉ. Barn: Glukosamin Pharma Nord skall inte ges till barn och ungdomar under 18 år.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
4.3 Kontraindikationer Överkänslighet mot ketokonazol eller mot något hjälpämne som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Efter beredning innehåller 1 ml oral suspension 100 mg cefadroxil (som monohydrat).
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefadroxil Mylan100 mg/ml pulver till oral suspension. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Efter beredning innehåller 1 ml oral suspension 100 mg cefadroxil (som
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Cefadroxil Mylan100 mg/ml pulver till oral suspension. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Efter beredning innehåller 1 ml oral suspension 100 mg cefadroxil (som
Vipdomet 12,5 mg/850 mg, filmdragerade tabletter Vipdomet 12,5 mg/1 000 mg, filmdragerade tabletter (alogliptin och metforminhydroklorid)
 Vipdomet 12,5 mg/850 mg, filmdragerade tabletter Vipdomet 12,5 mg/1 000 mg, filmdragerade tabletter (alogliptin och metforminhydroklorid) RISKHANTERINGSPLAN VI.2 Delområden av en offentlig sammanfattning
Vipdomet 12,5 mg/850 mg, filmdragerade tabletter Vipdomet 12,5 mg/1 000 mg, filmdragerade tabletter (alogliptin och metforminhydroklorid) RISKHANTERINGSPLAN VI.2 Delområden av en offentlig sammanfattning
Bipacksedel: Information till användaren
 Bipacksedel: Information till användaren Cefuroxim Villerton 250 mg pulver till injektionsvätska, lösning eller suspension. Cefuroxim Villerton 750 mg pulver till injektionsvätska, lösning eller suspension.
Bipacksedel: Information till användaren Cefuroxim Villerton 250 mg pulver till injektionsvätska, lösning eller suspension. Cefuroxim Villerton 750 mg pulver till injektionsvätska, lösning eller suspension.
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN INVANZ 1 g pulver till koncentrat till infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 1,0 g ertapenem.
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN INVANZ 1 g pulver till koncentrat till infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 1,0 g ertapenem.
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN. Clavaseptin 50 mg/12,5 mg tabletter för hund och katt
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Clavaseptin 50 mg/12,5 mg tabletter för hund och katt 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller: Aktiva substanser:
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Clavaseptin 50 mg/12,5 mg tabletter för hund och katt 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller: Aktiva substanser:
4.1 Terapeutiska indikationer Användes för att lösa upp urinsyrastenar och för att förhindra deras nybildning.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Renapur granulat. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 g granulat innehåller kaliumnatriumvätecitrat (6:6:3:5) 97,108 g. Hjälpämne med känd effekt: para-orange
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Renapur granulat. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 g granulat innehåller kaliumnatriumvätecitrat (6:6:3:5) 97,108 g. Hjälpämne med känd effekt: para-orange
PRODUKTRESUMÉ. Varje tablett Clavaseptin 200 mg/50 mg tabletter för hund innehåller:
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Clavaseptin 40 mg/10 mg tabletter för hund och katt Clavaseptin 200 mg/50 mg tabletter för hund Clavaseptin 400 mg/100 mg tabletter för hund 2.
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Clavaseptin 40 mg/10 mg tabletter för hund och katt Clavaseptin 200 mg/50 mg tabletter för hund Clavaseptin 400 mg/100 mg tabletter för hund 2.
Hjälpämnen med känd effekt: Natrium: Varje brustablett innehåller 195,43 mg natrium (8,52 mmol natrium). Sackaros.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Acetylcystein Alternova 200 mg brustabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 brustablett innehåller acetylcystein 200 mg. Hjälpämnen med känd effekt: Natrium:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Acetylcystein Alternova 200 mg brustabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 brustablett innehåller acetylcystein 200 mg. Hjälpämnen med känd effekt: Natrium:
Pronaxen 250 mg tabletter OTC. 25.9.2015, Version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Pronaxen 250 mg tabletter OTC 25.9.2015, Version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Pronaxen 250
Pronaxen 250 mg tabletter OTC 25.9.2015, Version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Pronaxen 250
Hjälpämnen med känd effekt: 1 ml oral suspension innehåller 200 mg sorbitol, 0,8 mg metylparahydroxibensoat och 0,2 mg propylparahydroxibensoat.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Trimetoprim Meda 10 mg/ml oral suspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml oral suspension innehåller trimetoprim 10 mg. Hjälpämnen med känd effekt: 1
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Trimetoprim Meda 10 mg/ml oral suspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml oral suspension innehåller trimetoprim 10 mg. Hjälpämnen med känd effekt: 1
PRODUKTRESUMÉ. Varje ml beredd suspension innehåller 50 mg fenoximetylpenicillinkalium
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Primve 50 mg/ml pulver till oral suspension 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml beredd suspension innehåller 50 mg fenoximetylpenicillinkalium Hjälpämnen
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Primve 50 mg/ml pulver till oral suspension 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml beredd suspension innehåller 50 mg fenoximetylpenicillinkalium Hjälpämnen
PRODUKTRESUMÉ. Barn: Intramuskulärt: 50 mg/kg/dygn uppdelat på 4 doser. Intravenöst: 100 mg/kg/dygn (eller mer) fördelat på 4-6 doser.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Cloxacillin Stragen 1 g pulver till injektions-/infusionsvätska, lösning Cloxacillin Stragen 2 g pulver till injektions-/infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Cloxacillin Stragen 1 g pulver till injektions-/infusionsvätska, lösning Cloxacillin Stragen 2 g pulver till injektions-/infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV
- Ceftriaxon Tyrol Pharma 1g Pulver zur Herstellung einer Injektions- oder Infusionslösung
 BILAGA I LISTA PÅ PRODUKTNAMN, LÄKEMEDELSFORMER, LÄKEMEDLETS STYRKOR, ADMINISTRERINGSVÄGAR, SÖKANDE, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSLÄNDERNA 1 Medlemsland Tyskland Innehavare av godkännande
BILAGA I LISTA PÅ PRODUKTNAMN, LÄKEMEDELSFORMER, LÄKEMEDLETS STYRKOR, ADMINISTRERINGSVÄGAR, SÖKANDE, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSLÄNDERNA 1 Medlemsland Tyskland Innehavare av godkännande
PRODUKTRESUMÉ. Vuxna och barn (från 12 år ): 2-4 tuggtabletter efter måltid och vid sänggående (högst fyra gånger per dygn).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Galieve Peppermint tuggtablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tuggtablett innehåller: Natriumalginat Natriumvätekarbonat Kalciumkarbonat 250 mg 133,5 mg
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Galieve Peppermint tuggtablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tuggtablett innehåller: Natriumalginat Natriumvätekarbonat Kalciumkarbonat 250 mg 133,5 mg
Evotaz (atazanavir/kobicistat) 5. januari 2016, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Evotaz (atazanavir/kobicistat) 5. januari 2016, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är sammanfattning av riskhanteringsplanen
Evotaz (atazanavir/kobicistat) 5. januari 2016, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är sammanfattning av riskhanteringsplanen
