Bilaga II. Vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning
|
|
|
- Oskar Stig Gunnarsson
- för 8 år sedan
- Visningar:
Transkript
1 Bilaga II Vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning 11
2 Vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning (se bilaga I) Efter att ha övervägt rekommendationen från kommittén för säkerhetsövervakning och riskbedömning av läkemedel av den 11 april 2013 avseende tetrazepam-innehållande läkemedel instämmer CMD(h) i denna rekommendation i enlighet med nedanstående: Övergripande sammanfattning av den vetenskapliga utvärderingen av tetrazepaminnehållande läkemedel av kommittén för säkerhetsövervakning och riskbedömning av läkemedel Tetrazepam är en benzodiazepin som är indicerat för smärtsamma kontrakturer vid reumatologi eller spasticitet. Benzodiazepiner underlättar den hämmande verkan hos gammaaminosmörsyra (GABA) med sedativa, hypnotiska, antikonvulsiva och muskelavslappnande egenskaper. Tetrazepam-innehållande läkemedel är godkända i Belgien, Bulgarien, Frankrike, Lettland, Litauen, Luxemburg, Polen, Rumänien, Slovakien, Spanien, Tjeckien, Tyskland och Österrike (se bilaga I för listan över tetrazepam-innehållande läkemedel som är godkända inom EU). Den 20 december 2012 informerade Frankrike Europeiska läkemedelsmyndigheten, i enlighet med artikel 107i i direktiv 2001/83/EG, om sin avsikt att upphäva godkännandena för försäljning av tetrazepam-innehållande läkemedel efter att ha utvärderat data från säkerhetsövervakningsaktiviteter. Efter rapporter om nya allvarliga hudreaktioner vid användning av tetrazepam granskade den franska nationella behöriga myndigheten i november 2012 den kutana risken i samband med tetrazepam utifrån resultaten av en nationell säkerhetsövervakningsundersökning. Denna granskning av säkerhetsövervakning gällde hudbiverkningar som registrerats i den franska nationella säkerhetsövervakningsdatabasen efter att de första godkännandena för försäljning av tetrazepam beviljades 1967 i denna medlemsstat. Denna utvärdering lyfte fram en ökad kutan risk av tetrazepam utöver de farmakologiskt förväntade biverkningarna av benzodiazepiner: hälften av de biverkningar som rapporterats med tetrazepam var kutana och av de 648 rapporterade allvarliga fallen rapporterades 305 under organsystem Hud och subkutan vävnad : 33 fall av Stevens-Johnson-syndrom (SJS), 33 fall av toxisk epidermal nekrolys (TEN), 59 fall av erythema multiforme (EM) samt 15 fall av läkemedelsreaktioner (eller utslag) med eosinofili och systemiska symtom (DRESS-syndrom) upptäcktes med fatal utgång i 11 fall. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel beaktade de tillgängliga uppgifterna, däribland data från den franska säkerhetsövervakningsundersökningen, data inlämnade av andra medlemsstater, data inlämnade av berörda parter och data från innehavare av godkännanden för försäljning, liksom publicerade data. Säkerhet Under den franska nationella säkerhetsövervakningsundersökningen utfördes en analys av kutana fall som rapporterats i den nationella säkerhetsövervakningsdatabasen efter det ursprungliga godkännande för försäljning fram till den 30 juni Fram till den 30 juni 2012 registrerades fall med tetrazepam i den franska nationella databasen. Av dessa hade en WHO-kod för misstänkt eller interaktion. Efter att en dubbelpost uteslutits kom fall att ingå i analysen. Av dessa fall hörde 805 (49,80 procent) biverkningar till organsystemklassen hud och subkutan vävnad, av vilka 305 (37,9 procent) var allvarliga fall med livshotande och fatala fall. I dessa ingick 33 fall av SJS (inräknat 1 fatalt fall), 33 fall av Lyells syndrom (TEN) (inräknat 9 fatala fall), 59 fall av EM (inräknat 1 fatalt fall), 15 fall av DRESS-syndrom, 3 möjliga fall av DRESS-syndrom samt 5 fall av akut generaliserad exantematisk pustulos. Tetrazepam var det enda misstänkta läkemedlet eller hade en kausalitetspoäng högre än de samtidiga behandlingarna i 18 av 81 fall av SJS, TEN eller DRESS. Fall av anafylaxi rapporterades även. Dessutom beskrevs 10 fall av angioneurotiskt ödem som utlöste en omedelbar överkänslighetsmekanism och 67 fall av läkemedelsutslag, utöver de tidigare fallen, med eller utan involvering av minst ett organ. 12
3 Många av de kutana oönskade händelserna var makulopapulära, men de var vissa gånger också vesikulära, pustulära, purpuriska eller bullösa. Detta är indikativt för att allvarliga hudreaktioner med tetrazepam troligtvis är kopplade till en typ IV försenad överkänslighetsmekanism, vilket stöds av positiva lapptester i 79 av 115 fall som genomgick ett allergitest. Som innehavaren av godkännandet för försäljning av originalläkemedlet uppgav i sitt skriftliga svar på frågelistan från kommittén för säkerhetsövervakning och riskbedömning av läkemedel, enligt säkerhetsövervakningsdatabasen tillhörande innehavaren av godkännandet för försäljning sedan läkemedlets lansering 1969 fram till den 31 maj 2012 (dataspärrpunkten), rapporterades 513 kutana eller allergiska distinkta fall gällande 748 reaktioner med tetrazepam. Trettioåtta (38) fall var icke medicinskt bekräftade fall och 475 fall var medicinskt bekräftade; av dessa rapporterades 180 fall direkt till företaget, medan 245 fall rapporterades av hälsomyndigheterna och 50 fall identifierades i den vetenskapliga litteraturen. Totalt sett är de vanligast rapporterade hudreaktionerna i fallande ordning olika typer av utslag utan någon specificitet (162 fall), klåda (94 fall), erythema multiforme (48 fall), urtikaria (47 fall), toxisk epidermal nekrolys (35 fall), angioneurotiskt ödem (34 fall), Stevens-Johnson-syndrom (31 fall), erytem (28 fall), toxiska hudutslag (19 fall), hudexfoliation (16 fall), bullös dermatit, ej närmare specificerade (16 fall) samt DRESS-syndrom (7 fall). En specifik analys av de mest relevanta allvarliga hudbiverkningarna som rapporterats av innehavaren av godkännandet för försäljning avseende deras art och svårighetsgrad gjordes i svaret från innehavaren av godkännandet för försäljning till frågelistan från kommittén för säkerhetsövervakning och riskbedömning av läkemedel. Totalt sett avser över 40 procent av de rapporterade fallen organsystemklassen hudsjukdom. Allvarliga hudbiverkningar av läkemedel, såsom SJS, TEN, DRESS-syndrom och EM diagnostiserades efter tetrazepam-behandling och 11 fatala fall rapporterades. I 8 fall rapporterades det som en följd av hudreaktionen och i 3 fall var det förknippat med en associerad reaktion. Allergitester utfördes i flera fall. Totalt sett var uppskattningsvis procent av de utförda allergitesterna positiva. I de flesta fall rapporterades en kausal relation av tetrazepam som möjlig (86 procent av fallen) och i vissa fall som trolig (11 procent av fallen). Kommittén för säkerhetsövervakning och riskbedömning av läkemedel fann att de flesta rapporterade fall inbegrep användning av multipla läkemedel. Mycket talar dock för att reaktionen bör tillskrivas tetrazepam i ett stort antal fall. Detta bekräftas av resultaten av allergitesterna där det i många fall bara var tetrazepam som fick positiva resultat. Dessutom rapporterades fall av återinsättning med nya hudsjukdomsepisoder. Vad gäller fallen av SJS/TEN som beskrivs av innehavaren av godkännande för försäljning rapporterades 65 medicinskt bekräftade allvarliga fall av SJS/TEN. Dessa fall gällde 31 fall av SJS och 35 fall av TEN, inräknat ett fall med båda reaktionerna. I 10 fall bekräftades diagnosen genom hudbiopsi. Tiden fram till debuten varierade mellan 1 och 3 veckor hos 14 patienter, medan 9 fall rapporterades med en kortare tid till debuten (< 7 dagar) inräknat 6 fall med en mycket kort tid till debuten på mellan 1 och 3 dagar. Nästan alla fall hade information om behandlingstiden med tetrazepam och i de flesta fall sågs en tid på upp till en månads behandling, medan tiden var mycket kort i 9 fall (mindre än 4 dagar). Allvarliga hudbiverkningar med tetrazepam beskrivs också i den publicerade litteraturen 1,2,3,4,5,6,7,8,9,10,11. Kutana oönskade händelser uppgavs också i svar från andra innehavare av godkännande för försäljning och i data inlämnade av berörda parter. 1 Sanchez I et al. Stevens-Johnson-syndrom av tetrazepam. Allergol Immunopathol 1998;26: Camarasa JG et al. Tetrazepam-allergi upptäckt genom lapptest. Contact Dermatitis 1990;22:246 3 Quinones D et al. Fotodermatit av tetrazepam. Contact Dermatitis 1998 ;39(2):84 4 Bachmeyter C. Troliga läkemedelsutslag med eosinofili och systemiska symtom relaterade till tetrazepam. J Eur Acad Dermatol Venereol 2008;22(7): Cabreizo Ballesteros et al. Erythema multiforme av tetrazepam. J Investig Allergol Clin Immunol 2007;17(3): Delesalle F et la. Toxisk epidermal nekrolys orsakad av tetrazepam. International Journal of Dermatology 2006;45(4):480 7 Del Pozo MD et al. Tetrazepam-allergi. Allergy 1999;54(11): Sanchez-Morillas L et al. Systemisk dermatit till följd av tetrazepam. J Investig Allergol Clin Immunol 2008;18(5): Blanco R et la. Fördröjd överkänslighet för tetrazepam. Allergy 1997;52(11): LagnouiR et al. Fatal toxisk epidemal nekrolys förknippad med tetrazepam. Therapie 2001;56(2):
4 Innehavaren av godkännande för försäljning framförde sin uppfattning om den möjliga mekanismen för hudreaktioner inducerade av tetrazepam: att en strukturell skillnad mellan tetrazepam och andra benzodiazepiner (dvs. den utbytta cyclohexenylringen i tetrazepam) kan vara förbunden med de olika kutana överkänslighetsreaktioner som ses för tetrazepam. Potentialen för nukleofil attack som föreslås i litteraturen (av Barbaud et al, 2009) överensstämmer med mekanismen som föreslås genom in silico-analys, och kan förklara den rapporterade bristen på korsreaktivitet mellan tetrazepam och andra benzodiazepiner hos patienter med kutana överkänslighetsreaktioner. Tetrazepams affinitet för hud kan förklara platsen för överkänslighetsreaktionen. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel övervägde riskminimeringsåtgärder, däribland reducering av behandlingstiden till 6 dagar och en begränsad indikation, för att minska risken för allvarliga hudbiverkningar. Andra riskminimeringsåtgärder såsom ändringar av produktinformationen (kontraindikationer, varningar), kommunikationsmaterial (patientinformationskort, brev till hälso- och sjukvårdspersonal) samt minskning av förpackningsstorleken övervägdes också under diskussionerna. Vad gäller tetrazepams indikationer ifrågasatte kommittén för säkerhetsövervakning och riskbedömning av läkemedel effekten av en reducering av behandlingstiden med tanke på potentialen för upprepad användning. Dessutom fann kommittén för säkerhetsövervakning och riskbedömning av läkemedel att de kliniska uppgifterna till stöd för nyttan av en behandlingstid på 6 dagar inte var tillräckligt robusta. Med tanke på hur oförutsebar denna typ av biverkningar är, skulle en begränsad indikation inte vara en effektiv riskminimeringsåtgärd. Möjligheten att använda ett patientinformationskort diskuterades även, men ansågs inte effektivt för att förhindra dessa typer av allvarliga hudbiverkningar av läkemedel. Efter att ha bedömt samtliga föreslagna riskminimeringsåtgärder fann kommittén för säkerhetsövervakning och riskbedömning av läkemedel att de föreslagna åtgärderna, med tanke på risken för allvarliga hudbiverkningar med tetrazepam och deras oförutsebarhet, inte var tillräckliga för att reducera risken till en kliniskt acceptabel nivå. Utifrån detta fann kommittén för säkerhetsövervakning och riskbedömning av läkemedel att tetrazepam, jämfört med läkemedlen av samma farmakologiska klass, är förknippat med en ökad risk för allvarliga hudbiverkningar, däribland Stevens-Johnson-syndrom, toxisk epidermal nekrolys, erythema multiforme och DRESS-syndrom som kan vara livshotande och fatala. Effekt Tetrazepam är en benzodiazepin indicerat för smärtsamma kontrakturer vid reumatologi och vid spastiska syndrom i medlemsstaterna. Vissa medlemsstater har båda indikationerna. Resultaten av kliniska studier vid användning av tetrazepam vid båda indikationerna har publicerats efter godkännandena för försäljning av tetrazepam. I huvudsak stöds effekten av tetrazepam vid indikationen smärtsamma kontrakturer främst av två små dubbelblinda, placebokontrollerade kliniska prövningar (Arbus 1987 och Salzmann 1993) med 70 patienter totalt (50 patienter respektive 20 patienter). I dessa studier visades bara en begränsad effekt. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel noterade även att de aktuella riktlinjerna inte tar upp användningen av tetrazepam vid indikationen spasticitet. Effekten av tetrazepam jämfördes också med andra aktiva läkemedel i kontrollerade dubbelblinda studier: dessa studier visade ingen statistiskt signifikant skillnad mellan grupperna vid de båda indikationerna. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel fann att de tillgängliga effektuppgifterna, däribland data som lämnats in efter det ursprungliga godkännandet för försäljning, bara visade en mycket begränsad klinisk effekt av tetrazepam vid dess godkända indikationer. Huvudsakliga slutsatser 11 Thomas E et al. Akut generaliserad exantematisk pustulos till följd av tetrazepam. J Investig Allergol Clin Immunol 2008;18(2):
5 Utifrån detta drog kommittén för säkerhetsövervakning och riskbedömning av läkemedel slutsatsen att tetrazepam är förknippat med säkerhetsproblem bestående av allvarliga, potentiellt fatala hudreaktioner och uppvisar begränsad klinisk effekt. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel fann att de riskminimeringsåtgärder som diskuterades under bedömningen, inräknat reducering av behandlingstiden och begränsning av indikationen, inte var tillräckliga för att minska risken. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel drog därför slutsatsen av nytta-riskförhållandet för tetrazepam-innehållande läkemedel inte är gynnsamt. Skäl till rekommendationen från kommittén för säkerhetsövervakning och riskbedömning av läkemedel Skälen är följande: Kommittén för säkerhetsövervakning och riskbedömning av läkemedel har beaktat förfarandet enligt artikel 107i i direktiv 2001/83/EG för tetrazepam-innehållande läkemedel. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel har beaktat samtliga tillgängliga data för tetrazepam-innehållande läkemedel avseende risken för hudbiverkningar. I detta ingick data från medlemsstaterna och publicerade litteraturuppgifter som blev tillgängliga efter de ursprungliga godkännandena för försäljning, liksom svaren från innehavarna av godkännandet för försäljning och data inlämnade av berörda parter. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel noterade att allvarliga hudbiverkningar har rapporterats med tetrazepam, däribland fatala fall. Efter att ha granskat alla tillgängliga data fann kommittén för säkerhetsövervakning och riskbedömning av läkemedel att tetrazepam, jämfört med läkemedlen av samma farmakologiska klass, är förknippat med en ökad risk för allvarliga hudbiverkningar inräknat Stevens-Johnson-syndrom, toxisk epidermal nekrolys, erythema multiforme och DRESS-syndrom ( Drug Reaction of Eosinophilia Systemic Symptoms ) som kan vara livshotande och fatala. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel fann att de tillgängliga effektuppgifterna, inräknat data som lämnades in efter det ursprungliga godkännandet för försäljning, bara visade en mycket begränsad klinisk effekt av tetrazepam vid dess godkända indikationer. Kommittén för säkerhetsövervakning och riskbedömning av läkemedel fann att de riskminimeringsåtgärder som diskuterades under bedömningen, inräknat reducering av behandlingstiden och begränsning av indikationen, inte var tillräckliga för att minska risken för allvarliga hudreaktioner. Med tanke på säkerhetsproblemen avseende allvarliga, potentiellt fatala, hudreaktioner och den begränsade effekten av tetrazepam, fann kommittén för säkerhetsövervakning och riskbedömning av läkemedel att nytta-riskförhållandet för tetrazepam-innehållande läkemedel i enlighet med artikel 116 i direktiv 2001/83/EG inte längre anses gynnsamt. Enligt bestämmelserna enligt artikel 107i i direktiv 2001/83/EG, rekommenderar kommittén för säkerhetsövervakning och riskbedömning av läkemedel att godkännandena för försäljning av samtliga läkemedel i bilaga I tillfälligt upphävs. Villkoren för upphörande av det tillfälliga upphävandet av godkännandena för försäljning anges i bilaga III. CMD(h):s ståndpunkt Efter att ha övervägt rekommendationen från kommittén för säkerhetsövervakning och riskbedömning av läkemedel av den 11 april 2013 i enlighet med artikel 107k.1 och 2 i direktiv 2001/83/EG och den muntliga förklaringen från en innehavare av godkännande för 15
6 försäljning den 22 april 2013, har CMD(h) fastslagit en ståndpunkt om tillfälligt upphävande av godkännandena för försäljning av tetrazepam-innehållande läkemedel. Villkoren för upphörande av det tillfälliga upphävandet av godkännandena för försäljning anges i bilaga III. 16
BILAGA I LISTA ÖVER LÄKEMEDELSNAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSLÄNDERNA
 BILAGA I LISTA ÖVER LÄKEMEDELSNAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSLÄNDERNA 1 Medlemsstat EU/EES Innehavare av godkännande Läkemedlets namn
BILAGA I LISTA ÖVER LÄKEMEDELSNAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSLÄNDERNA 1 Medlemsstat EU/EES Innehavare av godkännande Läkemedlets namn
Bilaga I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga II. Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser 198 Vetenskapliga slutsatser Efter utvärderingen av en periodisk säkerhetsrapport om ambroxol-innehållande läkemedel enligt förfarandet för arbetsdelning som inleddes
Bilaga II Vetenskapliga slutsatser 198 Vetenskapliga slutsatser Efter utvärderingen av en periodisk säkerhetsrapport om ambroxol-innehållande läkemedel enligt förfarandet för arbetsdelning som inleddes
Bilaga I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om den periodiska säkerhetsrapporten
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om den periodiska säkerhetsrapporten
Bilaga II. EMA:s vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning
 Bilaga II EMA:s vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning 5 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen
Bilaga II EMA:s vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning 5 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen
Vetenskapliga slutsatser och skäl till slutsatserna
 Bilaga IV Vetenskapliga slutsatser och skäl till ändringen av villkoren för godkännanden för försäljning och detaljerad förklaring av skillnaderna från rekommendationen från kommittén för säkerhetsövervakning
Bilaga IV Vetenskapliga slutsatser och skäl till ändringen av villkoren för godkännanden för försäljning och detaljerad förklaring av skillnaderna från rekommendationen från kommittén för säkerhetsövervakning
Bilaga I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandet för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandet för försäljning 1 Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandet för försäljning 1 Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning 1 Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om den periodiska säkerhetsrapporten
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning 1 Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om den periodiska säkerhetsrapporten
Bilaga II. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning 12 Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning 12 Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
Bilaga I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning Vetenskapliga slutsatser Med hänsyn till utredningsrapporten från kommittén för säkerhetsövervakning
Bilaga I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om de periodiska säkerhetsuppdateringarna
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännande för försäljning 1 Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om de periodiska säkerhetsuppdateringarna
Fantasinamn Styrka Läkemedelsfor m
 Bilaga I Förteckning över det veterinärmedicinska läkemedlets namn, läkemedelsform, styrka, djurslag och innehavare av godkännande för försäljning i medlemsstaterna 1/10 Medlemsstat EU/EES Innehavare av
Bilaga I Förteckning över det veterinärmedicinska läkemedlets namn, läkemedelsform, styrka, djurslag och innehavare av godkännande för försäljning i medlemsstaterna 1/10 Medlemsstat EU/EES Innehavare av
Bilaga IV. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännanden för försäljning
 Bilaga IV Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännanden för försäljning Vetenskapliga slutsatser CHMP har beaktat nedanstående rekommendation från kommittén för säkerhetsövervakning
Bilaga IV Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännanden för försäljning Vetenskapliga slutsatser CHMP har beaktat nedanstående rekommendation från kommittén för säkerhetsövervakning
Denna rekommendation beskrivs närmare här nedan.
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning och detaljerad förklaring av skillnaderna från rekommendationen från kommittén för säkerhetsövervakning
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning och detaljerad förklaring av skillnaderna från rekommendationen från kommittén för säkerhetsövervakning
Läkemedlets namn. Tibolon Aristo 2,5 mg tablett oral användning
 Bilaga I Förteckning över läkemedlets namn, läkemedelsformer, styrkor, administreringssätt av läkemedlet samt sökande och innehavare av godkännande för försäljning i medlemsstaterna 1 Medlemsstat EU/EES
Bilaga I Förteckning över läkemedlets namn, läkemedelsformer, styrkor, administreringssätt av läkemedlet samt sökande och innehavare av godkännande för försäljning i medlemsstaterna 1 Medlemsstat EU/EES
Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser och skäl till upphävande eller ändring av villkoren i godkännandena för försäljning och utförlig förklaring av skillnaderna jämfört med rekommendationen från PRAC 70
Bilaga II Vetenskapliga slutsatser och skäl till upphävande eller ändring av villkoren i godkännandena för försäljning och utförlig förklaring av skillnaderna jämfört med rekommendationen från PRAC 70
Bilaga II. Vetenskapliga slutsatser och utförlig förklaring av de vetenskapliga skälen till skillnaderna från PRAC:s rekommendation
 Bilaga II Vetenskapliga slutsatser och utförlig förklaring av de vetenskapliga skälen till skillnaderna från PRAC:s rekommendation 38 Vetenskapliga slutsatser och utförlig förklaring av de vetenskapliga
Bilaga II Vetenskapliga slutsatser och utförlig förklaring av de vetenskapliga skälen till skillnaderna från PRAC:s rekommendation 38 Vetenskapliga slutsatser och utförlig förklaring av de vetenskapliga
Ny lydelse för produktinformation Utdrag ur PRAC:s rekommendationer om signaler
 12 October 2017 EMA/PRAC/662565/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Ny lydelse för produktinformation Utdrag ur PRAC:s rekommendationer om signaler Antagna vid PRAC:s möte den 25 29
12 October 2017 EMA/PRAC/662565/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Ny lydelse för produktinformation Utdrag ur PRAC:s rekommendationer om signaler Antagna vid PRAC:s möte den 25 29
Bilaga II. Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser 7 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av povidoninnehållande metadonprodukter för oralt bruk Metadon är en syntetisk
Bilaga II Vetenskapliga slutsatser 7 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av povidoninnehållande metadonprodukter för oralt bruk Metadon är en syntetisk
Bilaga II. Vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning
 Bilaga II Vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning 3 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Leflunomide
Bilaga II Vetenskapliga slutsatser och skäl till tillfälligt upphävande av godkännandena för försäljning 3 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Leflunomide
BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÄNDRING AV PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL
 BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÄNDRING AV PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL 11 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Kytril
BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÄNDRING AV PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL 11 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Kytril
Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för eller tillfälligt upphävande av godkännanden för försäljning, efter vad som är tillämpligt, med hänsyn till de godkända indikationerna
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för eller tillfälligt upphävande av godkännanden för försäljning, efter vad som är tillämpligt, med hänsyn till de godkända indikationerna
BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL. Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid
 BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer
BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer
Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver 1 med stöd av 4 kap. 6-7 samt 10 kap. 5 läkemedelsförordningen
Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver 1 med stöd av 4 kap. 6-7 samt 10 kap. 5 läkemedelsförordningen
Handläggning av antibiotikaallergi
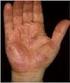 VO INFEKTIONSSJUKDOMAR Dokumenttyp: Medicinskt PM Titel: Antibiotikaallergi Dokumentansvarig: Simon Werner, Malmö Malin Inghammar, Lund Godkänt av: Peter Lanbeck Publicerat av: Irene Silfver Reviderad
VO INFEKTIONSSJUKDOMAR Dokumenttyp: Medicinskt PM Titel: Antibiotikaallergi Dokumentansvarig: Simon Werner, Malmö Malin Inghammar, Lund Godkänt av: Peter Lanbeck Publicerat av: Irene Silfver Reviderad
Gul till brun viskös lösning med apelsinsmak. Partiklar från växtmaterial kan förekomma.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Bilaga II. EMA:s vetenskapliga slutsatser och skäl till fortsatt godkännande för försäljning
 Bilaga II EMA:s vetenskapliga slutsatser och skäl till fortsatt godkännande för försäljning 24 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av produkter som innehåller
Bilaga II EMA:s vetenskapliga slutsatser och skäl till fortsatt godkännande för försäljning 24 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av produkter som innehåller
VASOBRAL, skårad tablett. 0.10 g/1 g av 100 ml. VASOBRAL, oral lösning i en injektionsflaska
 Bilaga I Lista namn (s) form (er) farmaceutisk (s) form (er) av läkemedel (s), rutt (er) i administrationen, innehavaren av godkännandet på marknaden i medlemsstaterna 1 Medlemsstat (i EES) Innehavare
Bilaga I Lista namn (s) form (er) farmaceutisk (s) form (er) av läkemedel (s), rutt (er) i administrationen, innehavaren av godkännandet på marknaden i medlemsstaterna 1 Medlemsstat (i EES) Innehavare
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Allergi mot Betalaktamantibiotika
 Allergi mot Betalaktamantibiotika Simon Werner Infektionsläkare Skånes Universitetssjukhus Jag tål inte penicillin Hur gör vi? Vad behöver vi ta reda på (Anamnes?) (När allergiutreda?) Vilka antibiotika
Allergi mot Betalaktamantibiotika Simon Werner Infektionsläkare Skånes Universitetssjukhus Jag tål inte penicillin Hur gör vi? Vad behöver vi ta reda på (Anamnes?) (När allergiutreda?) Vilka antibiotika
Bilaga II. Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser 11 Vetenskapliga slutsatser CMD(h) har övervägt den ändrade rekommendationen från kommittén för säkerhetsövervakning och riskbedömning av läkemedel (PRAC) av den 10 juli
Bilaga II Vetenskapliga slutsatser 11 Vetenskapliga slutsatser CMD(h) har övervägt den ändrade rekommendationen från kommittén för säkerhetsövervakning och riskbedömning av läkemedel (PRAC) av den 10 juli
Övergripande sammanfattning av den vetenskapliga utvärderingen av suppositorier som innehåller terpenderivat (se bilaga I)
 BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÅTERKALLANDE ELLER ÄNDRING AV RELEVANTA AVSNITT I PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL SOM TILLÄMPLIGT MED AVSEENDE PÅ ÅLDERSGRUPPEN FÖR DEN GODKÄNDA
BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÅTERKALLANDE ELLER ÄNDRING AV RELEVANTA AVSNITT I PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL SOM TILLÄMPLIGT MED AVSEENDE PÅ ÅLDERSGRUPPEN FÖR DEN GODKÄNDA
Bilaga II. Vetenskapliga slutsatser och skäl till avslag
 Bilaga II Vetenskapliga slutsatser och skäl till avslag 4 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Levothyroxine Alapis och associerade namn (se bilaga
Bilaga II Vetenskapliga slutsatser och skäl till avslag 4 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Levothyroxine Alapis och associerade namn (se bilaga
Svensk författningssamling
 Svensk författningssamling Förordning om ändring i läkemedelsförordningen (2006:272); SFS 2012:347 Utkom från trycket den 11 juni 2012 utfärdad den 31 maj 2012. Regeringen föreskriver 1 i fråga om läkemedelsförordningen
Svensk författningssamling Förordning om ändring i läkemedelsförordningen (2006:272); SFS 2012:347 Utkom från trycket den 11 juni 2012 utfärdad den 31 maj 2012. Regeringen föreskriver 1 i fråga om läkemedelsförordningen
Bisolvon. Bipacksedel: Information till användaren. 1,6 mg/ml oral lösning bromhexinhydroklorid
 Bipacksedel: Information till användaren Bisolvon 1,6 mg/ml oral lösning bromhexinhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är
Bipacksedel: Information till användaren Bisolvon 1,6 mg/ml oral lösning bromhexinhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516050 Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88516050 Utgivare: Rättschef Pär Ödman, Socialstyrelsen Föreskrifter
Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren i godkännanden för försäljning eller tillfälligt upphävande av godkännanden för försäljning, i tillämpliga fall, med beaktande av de
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren i godkännanden för försäljning eller tillfälligt upphävande av godkännanden för försäljning, i tillämpliga fall, med beaktande av de
Förslag till EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING. om ändring av förordning (EG) nr 726/2004 vad gäller säkerhetsövervakning av läkemedel
 EUROPEISKA KOMMISSIONEN Bryssel den 10.2.2012 COM(2012) 51 final 2012/0023 (COD) Förslag till EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING om ändring av förordning (EG) nr 726/2004 vad gäller säkerhetsövervakning
EUROPEISKA KOMMISSIONEN Bryssel den 10.2.2012 COM(2012) 51 final 2012/0023 (COD) Förslag till EUROPAPARLAMENTETS OCH RÅDETS FÖRORDNING om ändring av förordning (EG) nr 726/2004 vad gäller säkerhetsövervakning
Pediatrisk population Effekt och säkerhet av ketoprofen vid behandling av barn har inte fastställts.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Siduro 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Siduro 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
 Bipacksedel: Information till användaren Clindamycin Orifarm 300 mg hårda kapslar klindamycin Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är
Bipacksedel: Information till användaren Clindamycin Orifarm 300 mg hårda kapslar klindamycin Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är
Bipacksedel: Information till användaren. Clindamycin Orifarm 150 mg hårda kapslar. klindamycin
 Bipacksedel: Information till användaren Clindamycin Orifarm 150 mg hårda kapslar klindamycin Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är
Bipacksedel: Information till användaren Clindamycin Orifarm 150 mg hårda kapslar klindamycin Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är
Bilaga II. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandet för försäljning
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandet för försäljning 21 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Oxynal
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandet för försäljning 21 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Oxynal
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
 Bipacksedel: Information till användaren Bisolvon 8 mg tabletter bromhexinhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig
Bipacksedel: Information till användaren Bisolvon 8 mg tabletter bromhexinhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
RAPPORT FRÅN KOMMISSIONEN TILL RÅDET, EUROPAPARLAMENTET, EUROPEISKA EKONOMISKA OCH SOCIALA KOMMITTÉN SAMT REGIONKOMMITTÉN
 EUROPEISKA KOMMISSIONEN Bryssel den 17.6.011 KOM(011) 35 slutlig RAPPORT FRÅN KOMMISSIONEN TILL RÅDET, EUROPAPARLAMENTET, EUROPEISKA EKONOMISKA OCH SOCIALA KOMMITTÉN SAMT REGIONKOMMITTÉN Andra rapporten
EUROPEISKA KOMMISSIONEN Bryssel den 17.6.011 KOM(011) 35 slutlig RAPPORT FRÅN KOMMISSIONEN TILL RÅDET, EUROPAPARLAMENTET, EUROPEISKA EKONOMISKA OCH SOCIALA KOMMITTÉN SAMT REGIONKOMMITTÉN Andra rapporten
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
BILAGA II EEUROPEISKA LÄKEMEDELSMYNDIGHETENS VETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉERNA OCH BIPACKSEDLARNA
 BILAGA II EEUROPEISKA LÄKEMEDELSMYNDIGHETENS VETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉERNA OCH BIPACKSEDLARNA 108 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA
BILAGA II EEUROPEISKA LÄKEMEDELSMYNDIGHETENS VETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉERNA OCH BIPACKSEDLARNA 108 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA
6-12 år: 2,5-5 ml (2-4 mg) 3 gånger dagligen. 1-5 år: 2,5 ml (2 mg) 3 gånger dagligen.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhex 0,8 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller: Bromhexinhydroklorid 0,8 mg. Hjälpämnen med känd effekt: Sorbitol
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhex 0,8 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller: Bromhexinhydroklorid 0,8 mg. Hjälpämnen med känd effekt: Sorbitol
PRODUKTRESUMÉ. Vid besvär från andningsvägarna rekommenderas medicinsk rådgivning om symtomen inte förbättras.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bisolvon 8 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: bromhexinhydroklorid 8 mg Hjälpämnen: laktosmonohydrat 74 mg För fullständig
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bisolvon 8 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: bromhexinhydroklorid 8 mg Hjälpämnen: laktosmonohydrat 74 mg För fullständig
BILAGA I NAMN, LÄKEMEDELSFORM, STYRKA, DJURSLAG, ADMINISTRERINGSSÄTT OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING 1/7
 BILAGA I NAMN, LÄKEMEDELSFORM, STYRKA, DJURSLAG, ADMINISTRERINGSSÄTT OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING 1/7 Sökande eller innehavare av godkännande för försäljning Produktens fantasinamn Läkemedelsform
BILAGA I NAMN, LÄKEMEDELSFORM, STYRKA, DJURSLAG, ADMINISTRERINGSSÄTT OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING 1/7 Sökande eller innehavare av godkännande för försäljning Produktens fantasinamn Läkemedelsform
PRODUKTRESUMÉ. 600 mg brustablett innehåller 138,8 mg natrium, motsvarande 7% av WHOs högsta rekommenderat
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
Leflunomide STADA. Version, V1.0
 Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Vetenskapliga slutsatser
 Bilaga II EMA:s vetenskapliga slutsatser, skäl till återkallande av det tillfälliga upphävandet och ändring av godkännandena för försäljning av läkemedel innehållande aprotinin 8 Vetenskapliga slutsatser
Bilaga II EMA:s vetenskapliga slutsatser, skäl till återkallande av det tillfälliga upphävandet och ändring av godkännandena för försäljning av läkemedel innehållande aprotinin 8 Vetenskapliga slutsatser
Information till hälso- och sjukvårdspersonal
 13 maj 2013 Information till hälso och sjukvårdspersonal Nya begränsningar för Protelos/Osseor (strontiumranelat) i behandling av osteoporos på grund av ökad risk för hjärtinfarkt Bästa förskrivare! Detta
13 maj 2013 Information till hälso och sjukvårdspersonal Nya begränsningar för Protelos/Osseor (strontiumranelat) i behandling av osteoporos på grund av ökad risk för hjärtinfarkt Bästa förskrivare! Detta
FÖRSLAG TILL YTTRANDE
 EUROPAPARLAMENTET 2009-2014 Utskottet för den inre marknaden och konsumentskydd 2008/0257(COD) 6.1.2010 FÖRSLAG TILL YTTRANDE från utskottet för den inre marknaden och konsumentskydd till utskottet för
EUROPAPARLAMENTET 2009-2014 Utskottet för den inre marknaden och konsumentskydd 2008/0257(COD) 6.1.2010 FÖRSLAG TILL YTTRANDE från utskottet för den inre marknaden och konsumentskydd till utskottet för
Bilaga II. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning 3 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Quixil
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning 3 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Quixil
Vetenskapliga slutsatser
 Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för eller tillfälligt upphävande av godkännanden för försäljning, efter vad som är tillämpligt, med hänsyn till de godkända indikationerna
Bilaga II Vetenskapliga slutsatser och skäl till ändring av villkoren för eller tillfälligt upphävande av godkännanden för försäljning, efter vad som är tillämpligt, med hänsyn till de godkända indikationerna
4.3 Kontraindikationer Överkänslighet mot ketokonazol eller mot något hjälpämne som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
Bipacksedel: Information till användaren. Mucoangin Citron 20 mg sugtabletter ambroxolhydroklorid
 Bipacksedel: Information till användaren Mucoangin Citron 20 mg sugtabletter ambroxolhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som
Bipacksedel: Information till användaren Mucoangin Citron 20 mg sugtabletter ambroxolhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som
KANUMA: INFORMATION FÖR SJUKVÅRDSPERSONAL
 KANUMA: INFORMATION FÖR SJUKVÅRDSPERSONAL KANUMA 2 mg/ml koncentrat till infusionsvätska (sebelipas alfa) Viktig säkerhetsinformation: Detta läkemedel är föremål för utökad övervakning. Detta kommer att
KANUMA: INFORMATION FÖR SJUKVÅRDSPERSONAL KANUMA 2 mg/ml koncentrat till infusionsvätska (sebelipas alfa) Viktig säkerhetsinformation: Detta läkemedel är föremål för utökad övervakning. Detta kommer att
BILAGA II VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL AVSLAG
 BILAGA II VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL AVSLAG 3 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA UTVÄRDERINGEN AV MYDERISON Tolperison är ett centralt verkande muskelavslappnande
BILAGA II VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL AVSLAG 3 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA UTVÄRDERINGEN AV MYDERISON Tolperison är ett centralt verkande muskelavslappnande
Överdiagnostik av penicillinallergi. Gunnar Jacobsson Infektionsläkare
 Överdiagnostik av penicillinallergi Gunnar Jacobsson Infektionsläkare 20181113 Penicillinallergi - hur många av uppgivna reaktioner kan inte verifieras med testning? 1. 30 % 2. 50 % 3. 75 % 4. 90 % Vanligt
Överdiagnostik av penicillinallergi Gunnar Jacobsson Infektionsläkare 20181113 Penicillinallergi - hur många av uppgivna reaktioner kan inte verifieras med testning? 1. 30 % 2. 50 % 3. 75 % 4. 90 % Vanligt
Bilaga I. Vetenskapliga slutsatser
 Bilaga I Vetenskapliga slutsatser 1 Vetenskapliga slutsatser Daklizumab beta är en human IgG1 monoklonal antikropp som modulerar IL-2-signalering genom att blockera CD25-beroende, högaffinitets IL-2-receptorsignalering,
Bilaga I Vetenskapliga slutsatser 1 Vetenskapliga slutsatser Daklizumab beta är en human IgG1 monoklonal antikropp som modulerar IL-2-signalering genom att blockera CD25-beroende, högaffinitets IL-2-receptorsignalering,
Vetenskapliga slutsatser och utförlig förklaring av de vetenskapliga skälen till skillnaderna från PRAC:s rekommendation
 Bilaga IV Vetenskapliga slutsatser, skäl till ändring av villkoren för godkännanden för försäljning och utförlig förklaring av de vetenskapliga skälen till skillnaderna från PRAC:s rekommendation 1 Vetenskapliga
Bilaga IV Vetenskapliga slutsatser, skäl till ändring av villkoren för godkännanden för försäljning och utförlig förklaring av de vetenskapliga skälen till skillnaderna från PRAC:s rekommendation 1 Vetenskapliga
För användning på hud. Krämen appliceras med ett rent finger på det påverkade hudområdet.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectatone 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectatone kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol. För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectatone 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectatone kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol. För fullständig
Ethambutol Orion 500 mg tabletter Datum: , Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Ethambutol Orion 500 mg tabletter Datum: 21.10.2016, Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst
Ethambutol Orion 500 mg tabletter Datum: 21.10.2016, Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst
Förslag till RÅDETS BESLUT. om Regionkommitténs sammansättning
 EUROPEISKA KOMMISSIONEN Bryssel den 11.6.2014 COM(2014) 226 final 2014/0128 (NLE) Förslag till RÅDETS BESLUT om Regionkommitténs sammansättning SV SV MOTIVERING 1. BAKGRUND TILL FÖRSLAGET I artikel 305
EUROPEISKA KOMMISSIONEN Bryssel den 11.6.2014 COM(2014) 226 final 2014/0128 (NLE) Förslag till RÅDETS BESLUT om Regionkommitténs sammansättning SV SV MOTIVERING 1. BAKGRUND TILL FÖRSLAGET I artikel 305
Bilaga IV. Vetenskapliga slutsatser
 Bilaga IV Vetenskapliga slutsatser 1 Vetenskapliga slutsatser Den 10 mars 2016 informerades Europeiska kommissionen om att en ökad risk för dödsfall och högre incidens av allvarliga biverkningar hade observerats
Bilaga IV Vetenskapliga slutsatser 1 Vetenskapliga slutsatser Den 10 mars 2016 informerades Europeiska kommissionen om att en ökad risk för dödsfall och högre incidens av allvarliga biverkningar hade observerats
Vägledning om tolkning av spontana fallrapporter om misstänkta läkemedelsbiverkningar
 Den 30 januari 2017 Inspektioner, säkerhetsövervakning av humanläkemedel och kommittéer för säkerhetsövervakning EMA/749446/2016 Revision 1* Vägledning om tolkning av spontana fallrapporter om misstänkta
Den 30 januari 2017 Inspektioner, säkerhetsövervakning av humanläkemedel och kommittéer för säkerhetsövervakning EMA/749446/2016 Revision 1* Vägledning om tolkning av spontana fallrapporter om misstänkta
4.3 Kontraindikationer Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Basiron AC Wash 5% gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram gel innehåller bensoylperoxid 50 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Basiron AC Wash 5% gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram gel innehåller bensoylperoxid 50 mg. För fullständig förteckning över hjälpämnen, se avsnitt
BILAGA. till ändrat förslag till. rådets beslut
 EUROPEISKA KOMMISSIONEN Bryssel den 6.9.2016 COM(2016) 552 final ANNEX 2 BILAGA till ändrat förslag till rådets beslut om undertecknande och provisorisk tillämpning av luftfartsavtalet mellan Amerikas
EUROPEISKA KOMMISSIONEN Bryssel den 6.9.2016 COM(2016) 552 final ANNEX 2 BILAGA till ändrat förslag till rådets beslut om undertecknande och provisorisk tillämpning av luftfartsavtalet mellan Amerikas
Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat, cetostearylalkohol, propylenglykol.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Karbamid Evolan 50 mg/g kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g kräm innehåller karbamid (urea) 50 mg. Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Karbamid Evolan 50 mg/g kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g kräm innehåller karbamid (urea) 50 mg. Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat,
Bipacksedeln: Information till patienten. Azyter 15 mg/g, ögondroppar, lösning i endosbehållare. azitromycindihydrat
 Bipacksedeln: Information till patienten Azyter 15 mg/g, ögondroppar, lösning i endosbehållare azitromycindihydrat Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller
Bipacksedeln: Information till patienten Azyter 15 mg/g, ögondroppar, lösning i endosbehållare azitromycindihydrat Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel som används på djur; LVFS
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel som används på djur; LVFS
Remeron. 13.11.2014, Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Remeron 13.11.2014, Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Depression är en sjukdom som präglas
Remeron 13.11.2014, Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Depression är en sjukdom som präglas
Pediatrisk population Säkerheten och effekten av ketoprofengel hos barn har inte fastställts.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Orudis 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Orudis 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
Bilaga II. Vetenskapliga slutsatser och skäl till återkallande av godkännanden för försäljning
 Bilaga II Vetenskapliga slutsatser och skäl till återkallande av godkännanden för försäljning 4 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Caustinerf arsenical,
Bilaga II Vetenskapliga slutsatser och skäl till återkallande av godkännanden för försäljning 4 Vetenskapliga slutsatser Övergripande sammanfattning av den vetenskapliga utvärderingen av Caustinerf arsenical,
4.1 Terapeutiska indikationer Typherix används för aktiv immunisering mot tyfoidfeber av vuxna och barn från 2 års ålder.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
4.3 Kontraindikationer Överkänslighet mot den aktiva substansen, famciklovir eller mot något hjälpämne i som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectavir 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectavir kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol, propylenglykol.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectavir 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectavir kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol, propylenglykol.
Bipacksedel: Information till användaren. Hidrasec 10 mg granulat till oral suspension Hidrasec 30 mg granulat till oral suspension racekadotril
 Bipacksedel: Information till användaren Hidrasec 10 mg granulat till oral suspension Hidrasec 30 mg granulat till oral suspension racekadotril Läs noga igenom denna bipacksedel innan du börjar använda
Bipacksedel: Information till användaren Hidrasec 10 mg granulat till oral suspension Hidrasec 30 mg granulat till oral suspension racekadotril Läs noga igenom denna bipacksedel innan du börjar använda
Skärpta rekommendationer avseende risken för allvarliga överkänslighetsreaktioner vid användning av Rienso (ferumoxytol)
 8 januari 2014 Skärpta rekommendationer avseende risken för allvarliga överkänslighetsreaktioner vid användning av Rienso (ferumoxytol) Bästa hälso- och sjukvårdspersonal, I oktober 2013 skickades ett
8 januari 2014 Skärpta rekommendationer avseende risken för allvarliga överkänslighetsreaktioner vid användning av Rienso (ferumoxytol) Bästa hälso- och sjukvårdspersonal, I oktober 2013 skickades ett
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Bromhexin ABECE 1,6 mg/ml oral lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhexin ABECE 0,8 mg/ml oral lösning Bromhexin ABECE 1,6 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Bromhexin Abece 0,8 mg/ml oral lösning 1 ml innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhexin ABECE 0,8 mg/ml oral lösning Bromhexin ABECE 1,6 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Bromhexin Abece 0,8 mg/ml oral lösning 1 ml innehåller:
(6) Kommissionen vidarebefordrade de mottagna meddelandena till de övriga medlemsstaterna senast den 15 mars 2017.
 L 162/22 KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2017/1112 av den 22 juni 2017 om ändring av förordning (EG) nr 3199/93 om ömsesidigt erkännande av förfaranden för att fullständigt denaturera alkohol
L 162/22 KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2017/1112 av den 22 juni 2017 om ändring av förordning (EG) nr 3199/93 om ömsesidigt erkännande av förfaranden för att fullständigt denaturera alkohol
PRODUKTRESUMÉ. Vid besvär från andningsvägarna rekommenderas medicinsk rådgivning om symtomen inte förbättras.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bisolvon 1,6 mg/ml oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: bromhexinhydroklorid 1,6 mg Hjälpämnen: flytande maltitol 500 mg För fullständig
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bisolvon 1,6 mg/ml oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: bromhexinhydroklorid 1,6 mg Hjälpämnen: flytande maltitol 500 mg För fullständig
BILAGA I. Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
 BILAGA I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning Vetenskapliga slutsatser - Abstinenssyndrom: För Effentora/Actiq har det förekommit 54 fall av frossbrytningar,
BILAGA I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning Vetenskapliga slutsatser - Abstinenssyndrom: För Effentora/Actiq har det förekommit 54 fall av frossbrytningar,
BILAGA. Medlemsstaternas svar om genomförandet av kommissionens rekommendationer för valen till Europaparlamentet. till
 EUROPEISKA KOMMISSIONEN Bryssel den 27.3.2014 COM(2014) 196 ANNEX 1 BILAGA Medlemsstaternas svar om genomförandet av kommissionens rekommendationer för valen till Europaparlamentet till RAPPORT FRÅN KOMMISSIONEN
EUROPEISKA KOMMISSIONEN Bryssel den 27.3.2014 COM(2014) 196 ANNEX 1 BILAGA Medlemsstaternas svar om genomförandet av kommissionens rekommendationer för valen till Europaparlamentet till RAPPORT FRÅN KOMMISSIONEN
Dextropropoxifeninnehållande läkemedel som godkänts för försäljning i Europeiska unionen. Styrka/ dextropropoxifen/ paracetamol/ koffein
 BILAGA I FÖRTECKNING ÖVER LÄKEMEDLETS NAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT AV LÄKEMEDLET SAMT INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSSTATERNA 1 Dextropropoxifeninnehållande läkemedel
BILAGA I FÖRTECKNING ÖVER LÄKEMEDLETS NAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT AV LÄKEMEDLET SAMT INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSSTATERNA 1 Dextropropoxifeninnehållande läkemedel
BILAGA. Vetenskapliga uppgifter
 BILAGA Vetenskapliga uppgifter 3 BILAGA Vetenskapliga uppgifter A) INLEDNING Sparfloxacin är ett antibiotikum av kinolontyp och används vid behandling av: - lunginflammation orsakad av pneumokocker inom
BILAGA Vetenskapliga uppgifter 3 BILAGA Vetenskapliga uppgifter A) INLEDNING Sparfloxacin är ett antibiotikum av kinolontyp och används vid behandling av: - lunginflammation orsakad av pneumokocker inom
RAPPORT FRÅN KOMMISSIONEN TILL EUROPAPARLAMENTET, RÅDET, EUROPEISKA EKONOMISKA OCH SOCIALA KOMMITTÉN OCH REGIONKOMMITTÉN
 EUROPEISKA KOMMISSIONEN Bryssel den 23.3.2011 KOM(2011) 138 slutlig RAPPORT FRÅN KOMMISSIONEN TILL EUROPAPARLAMENTET, RÅDET, EUROPEISKA EKONOMISKA OCH SOCIALA KOMMITTÉN OCH REGIONKOMMITTÉN Andra rapporten
EUROPEISKA KOMMISSIONEN Bryssel den 23.3.2011 KOM(2011) 138 slutlig RAPPORT FRÅN KOMMISSIONEN TILL EUROPAPARLAMENTET, RÅDET, EUROPEISKA EKONOMISKA OCH SOCIALA KOMMITTÉN OCH REGIONKOMMITTÉN Andra rapporten
4.1 Terapeutiska indikationer Behandling av seborroisk dermatit i hårbotten och pityriasis capitis (mjällbildning).
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ketoconazol Actavis 20 mg/g schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g schampo innehåller ketokonazol 20 mg För fullständig förteckning över hjälpämnen, se
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ketoconazol Actavis 20 mg/g schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g schampo innehåller ketokonazol 20 mg För fullständig förteckning över hjälpämnen, se
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller: Dextran 70 1,0 mg och hypromellos
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller: Dextran 70 1,0 mg och hypromellos
Medlemsstat Innehavare av godkännande för försäljning Läkemedlets namn Styrka Läkemedelsform Administreringssätt
 BILAGA I FÖRTECKNING ÖVER LÄKEMEDLETS NAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT AV LÄKEMEDLE OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSSTATERNA CHMP/309507/2007 1/6 EMEA 2007 Medlemsstat
BILAGA I FÖRTECKNING ÖVER LÄKEMEDLETS NAMN, LÄKEMEDELSFORM, STYRKA, ADMINISTRERINGSSÄTT AV LÄKEMEDLE OCH INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING I MEDLEMSSTATERNA CHMP/309507/2007 1/6 EMEA 2007 Medlemsstat
Symbicort Turbuhaler. Datum, version OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Symbicort Turbuhaler Datum, version OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Astma Astma är en vanlig, kronisk
Symbicort Turbuhaler Datum, version OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Astma Astma är en vanlig, kronisk
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning
 Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om de periodiska säkerhetsrapporterna
Bilaga I Vetenskapliga slutsatser och skäl till ändring av villkoren för godkännandena för försäljning Vetenskapliga slutsatser Med hänsyn till PRAC:s utredningsprotokoll om de periodiska säkerhetsrapporterna
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Finacea, 15% gel Azelainsyra
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Finacea, 15% gel Azelainsyra Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig. - Spara
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Finacea, 15% gel Azelainsyra Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig. - Spara
Bipacksedel: Information till användaren. Flucloxacillin Orion 750 mg filmdragerade tabletter. Flucloxacillin Orion 1 g filmdragerade tabletter
 Bipacksedel: Information till användaren Flucloxacillin Orion 500 mg filmdragerade tabletter Flucloxacillin Orion 750 mg filmdragerade tabletter Flucloxacillin Orion 1 g filmdragerade tabletter flukloxacillin
Bipacksedel: Information till användaren Flucloxacillin Orion 500 mg filmdragerade tabletter Flucloxacillin Orion 750 mg filmdragerade tabletter Flucloxacillin Orion 1 g filmdragerade tabletter flukloxacillin
Bilaga III Tillägg till relevanta avsnitt i Produktresumén och Bipacksedeln
 Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
