Produkt: Aranesp (darbepoetin alfa) Riskhanteringsplan, EU RMP Version 4 Datum: 08 oktober 2013 Sida 176
|
|
|
- Henrik Lundqvist
- för 9 år sedan
- Visningar:
Transkript
1 Datum: 08 oktober 2013 Sida 176 VI.2 Avsnitt i en sammanfattning för allmänheten IV.2.1 Översikt om sjukdomsepidemiologi En av njurens uppgifter är att tillverka erytropoetin, ett hormon som stimulerar benmärgen till att bilda fler röda blodkroppar. När njurfunktionen försämras tillverkas för lite erytropoetin, vilket leder till anemi (blodbrist; för få röda blodkroppar). De flesta patienter som står på dialys har anemi. Långvarig njursvikt förekommer hos både män och kvinnor och sannolikheten att utveckla njursvikt ökar med åldern. Risken för att drabbas av anemi är högre för yngre, svarta, diabetespatienter som står på dialys eller patienter som nyligen har varit inlagda på sjukhus. De patienter som inte står på dialys, men som drabbas av anemi, är oftare kvinnor som inte har kaukasiskt ursprung och som är något äldre. Hos patienter med njursvikt är anemi kopplat till hjärt- och kärlproblem, vilket kan leda till dödsfall. Anemi är också vanligt hos patienter med cancer och kan orsakas eller förvärras av kemoterapi, strålbehandling, infektion, dålig kosthållning, blödningar, tumörceller i benmärgen och andra faktorer. En av de vanligaste biverkningarna av kemoterapi är att benmärgen hindras från att tillverka tillräckligt med blodkroppar. Mot slutet av behandlingen med kemoterapi, speciellt om patienten har fått mycket kemoterapi, kan han eller hon drabbas av anemi. Detta är vanligare hos kvinnor än hos män. Förekomsten av anemi ökar med åldern. Symtomen på anemi är bland annat trötthet, svaghet och andnöd. IV.2.2 Sammanfattning av behandlingsfördelarna Darbepoetin alfa (Aranesp ) är ett godkänt läkemedel för behandling av symtomgivande anemi hos: vuxna och barn med kronisk njursvikt (långvarigt nedsatt njurfunktion som förvärras med tiden) vuxna som behandlas med kemoterapi mot icke-myeloid cancer (cancer som inte uppkommit i benmärgen). Darbepoetin alfa ökar produktionen av röda blodkroppar och fungerar på samma sätt som det kroppsegna erytropoetinet. Det finns flera andra läkemedel som verkar på samma sätt som darbepoetin alfa och denna läkemedelsgrupp kallas för erytropoesstimulerande läkemedel (ESA). Darbepoetin alfa har längre verkningstid än de flesta andra ESA (korttidsverkande ESA), vilket innebär att det inte behöver ges lika ofta.
2 Datum: 08 oktober 2013 Sida 177 Hos patienter med kronisk njursvikt jämfördes darbepoetin alfa först med korttidsverkande ESA i 4 studier med över 1200 patienter. Darbepoetin alfa ökade och bibehöll halterna av de röda blodkropparna lika bra som korttidsverkande ESA hos patienter med kronisk njursvikt. Detta var fallet även om darbepoetin alfa gavs mer sällan än de korttidsverkande ESA. Ytterligare studier har visat att darbepoetin alfa kan korrigera och bibehålla nivåerna av de röda blodkropparna hos vissa patienter till och med när det ges med ännu längre intervaller (upp till en gång per månad) än i de inledande studierna (en gång per vecka eller varannan vecka). Hos patienter med cancer jämfördes darbepoetin alfa först med placebo (behandling utan aktiv substans) i 2 studier med 669 patienter som behandlades med kemoterapi mot olika typer av cancer, som lungcancer, myelom och lymfom. Det huvudsakliga måttet på effekt var en minskning av antalet patienter som behövde blodtransfusioner, vilket annars kan ge en tillfällig ökning av de röda blodkropparna. Bland cancerpatienterna som behandlades med kemoterapi var det färre patienter bland dem som fick darbepoetin alfa som behövde blodtransfusioner jämfört med dem som fick placebo. IV.2.3 Okända parametrar relaterade till behandlingsfördelarna Sedan studierna med darbepoetin alfa först inleddes har ungefär patienter med njurproblem och 6700 cancerpatienter deltagit i kliniska prövningar sponsrade av Amgen. Kunskapen från dessa samt från det stora antal patienter (motsvarande totalt > 4,4 miljoner patientår) som har fått det godkända läkemedlet sedan darbepoetin alfa först marknadsgodkändes år 2001, har lett till att fördelarna med darbepoetin alfa är väl förstådda.
3 Datum: 08 oktober 2013 Sida 178 VI.2.4 Sammanfattning av säkerhetsbetänkligheter Viktiga identifierade risker Risk Vad är känt Förebyggande åtgärder Högt blodtryck (hypertoni, däribland hypertensiv kris) Blodproppar (tromboemboliska händelser) (i venerna, endast hos patienter med njursjukdom). Högt blodtryck drabbar upp till ungefär 80 % av patienterna med kronisk njursvikt och 40 % av patienterna med cancer. I kliniska studier var högt blodtryck en biverkning av behandlingen med darbepoetin alfa hos 1 av 10 patienter med kronisk njursvikt och hos < 1 av 10 cancerpatienter. Ett förhöjt blodtryck kan bero på en snabb ökning av hemoglobin (röda blodkroppar) i blodet och är också en känd biverkning av många cancerläkemedel. Högt blodtryck kan leda till hälsoproblem som hjärtproblem, stroke och förvärrad kronisk njursvikt. Patienter med njursvikt och som tidigare har haft en blodpropp, genomgått en operation eller är orörliga under en längre tid samt cancerpatienter, löper högre risk att drabbas av blodproppar. Det är vanligast att blodproppar i venerna (djup ventrombos) uppstår i benen. Men delar av blodproppen kan brytas loss och vandra till andra delar av kroppen. Blodproppar i lungan kan orsaka andningssvikt, vilket i sin tur kan leda till sjukhusvistelse eller dödsfall. Baserat på de studiedata som finns anses blodproppar vara en mindre vanlig biverkning av darbepoetin alfa hos patienter med kronisk njursvikt och en vanlig biverkning hos patienter med cancer. Patienter ska inte ta darbepoetin alfa om de har högt blodtryck som inte hålls under kontroll med hjälp av läkemedel. Hos patienter med kronisk njursvikt ska blodtrycket kontrolleras ofta under behandlingen med darbepoetin alfa, särskilt i början av behandlingen. Patienterna ska tala om för läkare om de drabbas av symtom som kraftig huvudvärk, dåsighet, förvirring, synproblem, illamående, kräkningar eller anfall (kramp). Dessa kan vara tecken på högt blodtryck. Det är viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och håller hemoglobinhalterna inom det rekommenderade intervallet. Bildningen av blodproppar kan kopplas till hur snabbt hemoglobin (koncentrationen av röda blodkroppar) korrigeras och till höga halter hemoglobin i blodet. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Friska personer ska inte använda darbepoetin alfa, eftersom det kan orsaka kärlproblem. Sida 1 av 3
4 Datum: 08 oktober 2013 Sida 179 Viktiga identifierade risker (fortsättning) Risk Vad är känt Förebyggande åtgärder Anfall eller kramper (konvulsioner) Allergiska reaktioner (hypersensitivitet) Antikroppar mot darbepoetin alfa som gör att kroppen helt eller delvis slutar att tillverka röda blodkroppar, endast hos patienter med njurproblem (antikroppsmedierad erytroblastopeni) Anfall kan förekomma hos patienter med farligt högt blodtryck eller en plötslig ökning av det arteriella blodtrycket, infektion eller epilepsi. Anfall kan också vara relaterade till tumörer eller blödningar i hjärnan samt till kemoterapi som ges direkt i vätskan som omger hjärnan och ryggmärgen. Konvulsioner kan leda till skador och till ett tillstånd (status epilepticus) som i sin tur kan leda till dödsfall eller permanent funktionsnedsättning. Baserat på de studiedata som finns anses konvulsioner vara en mindre vanlig biverkning av darbepoetin alfa. Allergiska reaktioner mot darbepoetin alfa är bland annat hudutslag och klåda. I sällsynta fall kan dessa reaktioner vara allvarliga, som svullnad i ansiktet och svalget samt andningssvårigheter, och då vara dödliga om de inte behandlas omedelbart. Baserat på de studiedata som finns anses allergiska reaktioner vara en mycket vanlig biverkning av darbepoetin alfa. Svåra reaktioner har förekommit hos patienter på sjukhus. Erytroblastopeni, eller PRCA (pure red cell aplasia), leder till svår anemi, med symtom som ovanlig trötthet och brist på energi. Om patienter har drabbats av PRCA på grund av antikroppar mot darbepoetin alfa eller andra ESA får de inte använda dessa läkemedel och behöver i stället få blodtransfusioner för att öka antalet röda blodkroppar i blodet. Mycket få patienter som tar darbepoetin alfa har drabbats av PRCA på grund av antikroppar mot darbepoetin alfa eller andra ESA. De flesta av dessa patienter hade kronisk njursvikt och fick darbepoetin alfa under huden eller hade hepatit C som behandlas med interferon och ribavirin. Patienter ska tala om för läkare om de har epilepsi eller har haft konvulsioner (kramper eller anfall). Darbepoetin alfa ska ges med försiktighet till dessa patienter och läkare ska övervaka dem noga för tidiga symtom på neurologiska problem. Förhållandet mellan anfall och hur snabbt hemoglobin korrigeras är oklart. Det är emellertid viktigt att läkaren och patienten följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna kontrolleras regelbundet. Patienter som tidigare har drabbats av allergiska reaktioner mot darbepoetin alfa, andra ESA eller andra innehållsämnen i detta läkemedel ska inte använda darbepoetin alfa. Personer med latexallergi ska känna till att den förfyllda sprutans grå nålskydd innehåller en typ av latex. Även om det är svårt att förutsäga allergiska reaktioner kan följderna minimeras genom lämpliga, förebyggande åtgärder. Darbepoetin alfa ska inte användas för att behandla anemi som beror på en hepatit C- infektion. Om patienten inte svarar på behandlingen med darbepoetin alfa ska orsaken klarläggas med hjälp av olika tester. Det kan innebära kontroller av benmärgen för tecken på PRCA. Om det är positivt ska det följas upp av testning för antikroppar mot ESA. Patienter som har sådana antikroppar ska inte få någon ytterligare behandling med darbepoetin alfa eller annan ESA, eftersom antikropparna kan reagera mot samtliga av dessa läkemedel. Sida 2 av 3
5 Datum: 08 oktober 2013 Sida 180 Viktiga identifierade risker (fortsättning) Risk Vad är känt Förebyggande åtgärder Stroke eller transitorisk ischemisk attack (TIA), endast hos patienter med njurproblem (cerebrovaskulära sjukdomar) Blodproppar i den del av kroppen där det sätts in en port som används för att koppla en dialyspatient till dialysmaskinen (vaskulär accesstrombos) Stroke kan orsakas av blödningar eller blodproppar i hjärnan och kan leda till tillfällig eller permanent funktionsnedsättning eller dödsfall. Risken för stroke är högre hos patienter med diabetes, högt blodtryck, eller blodkoaguleringsrubbningar, samt hos äldre patienter. Risken för stroke identifierades i en studie med diabetespatienter med kronisk njursvikt (som inte stod på dialys) som behandlades med darbepoetin alfa och nådde högre hemoglobinhalter än de som för närvarande rekommenderas. En större andel patienter som behandlades med darbepoetin alfa (5 %) drabbades av stroke än de som behandlades med placebo (behandling utan aktiv substans) (3 %). En blodpropp som blockerar kopplingen mellan dialyspatienten och dialysmaskinen kan innebära att patienten måste få dialysen på något annat sätt, t.ex. genom en central kateter, vilket innebär en högre risk för infektion, eller direkt i buken (peritonealdialys). Om blockeringen är permanent kan det krävas en operation eller annat ingrepp för att avlägsna blockeringen. Den ökade risken för blockering observerades i kliniska prövningar där andra ESA gavs till dialyspatienter för att de skulle uppnå en högre hemoglobinhalt som är högre än den för närvarande rekommenderas. Förhållandet mellan stroke och hemoglobinhalterna är osäkert. Men risken observerades när darbepoetin alfa gavs för att korrigera hemoglobin till en högre halt än den som för närvarande rekommenderas. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Förhållandet mellan accesstrombos och hemoglobinhalterna är osäkert. Men risken observerades när ESA gavs för att bibehålla hemoglobinhalten vid en högre nivå än den som för närvarande rekommenderas. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Sida 3 av 3
6 Datum: 08 oktober 2013 Sida 181 Viktiga potentiella risker Risk Minskad blodförsörjning till hjärtat (vilket kan orsaka hjärtinfarkt), endast hos patienter med njurproblem (ischemisk hjärtsjukdom, däribland myokardiell infarkt) Hjärtsvikt, endast hos patienter med njurproblem Stroke eller transitorisk ischemisk attack (TIA), endast hos patienter med cancer (cerebrovaskulära sjukdomar) Vad är känt Hjärtsjukdomar som orsakas av minskat blodflöde till hjärtat, däribland hjärtinfarkter, betraktas som en potentiell risk hos patienter med kronisk njursvikt. Detta baseras på resultaten från studier där ökad risk för allvarliga hjärt- och kärlproblem (allvarliga kardiovaskulära händelser) observerades hos de patienter som fick andra ESA än darbepoetin alfa för att öka hemoglobinhalterna utöver den högsta rekommenderade halten jämfört med de patienter hos vilka hemoglobinhalterna hölls inom det rekommenderade intervallet. Det observerades dock inte någon ökad risk för hjärtinfarkt i en studie med diabetespatienter med kronisk njursjukdom (som inte stod på dialys) som behandlades med darbepoetin alfa och uppnådde högre hemoglobinhalter än de som för närvarande rekommenderas. Förhållandet mellan kardiovaskulära händelser och hemoglobinhalterna är osäkert, men risken observerades när andra ESA än darbepoetin alfa gavs för att korrigera hemoglobin till en högre halt än den som för närvarande rekommenderas. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Hjärtsvikt betraktas som en potentiell risk hos patienter med kronisk njursvikt och som får darbepoetin alfa. Detta baseras på resultaten i samma studie som beskriver risken för ischemisk hjärtsjukdom ovan. Det observerades dock ingen ökad risk för hjärtsvikt i en studie med diabetespatienter med kronisk njursjukdom (som inte stod på dialys) som behandlades med darbepoetin alfa och uppnådde högre hemoglobinhalter än de som för närvarande rekommenderas. Precis som ovan är förhållandet mellan kardiovaskulära händelser och hemoglobinhalterna osäkert, men risken observerades när andra ESA än darbepoetin alfa gavs för att korrigera hemoglobin till en högre halt än den som för närvarande rekommenderas. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Stroke betraktas som en potentiell risk hos cancerpatienter. Detta baseras på resultaten från en klinisk studie med patienter med lungcancer. I studien observerades en liten skillnad i cerebrovaskulära händelser mellan de försökspersoner som fick darbepoetin alfa och de som fick placebo (behandling utan aktiv substans). När det gjordes en sammantagen bedömning av resultaten från ett flertal studier med cancerpatienter observerades emellertid ingen skillnad i andelen patienter som drabbades av dessa händelser mellan de som fick darbepoetin alfa och de som fick placebo. I studien med lungcancerpatienter (se ovan) observerades risken när darbepoetin alfa gavs för att korrigera hemoglobin till en högre halt än den som för närvarande rekommenderas. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Sida 1 av 2
7 Datum: 08 oktober 2013 Sida 182 Viktiga potentiella risker (fortsättning) Risk Dödsfall eller tumörprogression/-återfall hos patienter med cancer eller som har haft cancer Antikroppar mot darbepoetin alfa som gör att kroppen helt eller delvis slutar att tillverka röda blodkroppar, endast hos patienter med cancer (antikroppsmedierad erytroblastopeni) Data som saknas Risk Mängden data om gravida eller ammande kvinnor är begränsad Mängden data om barn eller ungdomar med kronisk njursjukdom är begränsad Vad är känt Dödsfall och tumörprogression/-återfall betraktas som en potentiell risk. Detta baseras på resultaten från kliniska studier där darbepoetin alfa eller andra ESA gavs till cancerpatienter vars anemi inte var orsakad av kemoterapi eller där läkemedlen gavs för att uppnå högre hemoglobinhalter än de som rekommenderas. I teorin kan darbepoetin alfa öka antalet röda blodkroppar och öka tillväxten av cancercellerna. Men i djurstudier och studier på normala celler och cancerceller har darbepoetin alfa inte haft någon direkt effekt på cancer. Kliniska studier där darbepoetin alfa har administrerats till patienter i enlighet med läkemedlets godkännande har dessutom inte visat någon ökad risk för dödsfall eller tumörprogression/-återfall. Det är därför viktigt att läkare och patienter följer dosanvisningarna för darbepoetin alfa och att hemoglobinhalterna hålls inom det rekommenderade intervallet. Antikroppsmedierad erytroblastopeni betraktas som en potentiell risk för cancerpatienter, eftersom dessa patienter skulle kunna bilda antikroppar mot darbepoetin alfa på samma sätt patienter med kronisk njursvikt. Det har dock inte rapporterats några tydliga fall av antikroppsmedierad erytroblastopeni hos cancerpatienter. Vad är känt Sida 2 av 2 Gravida eller ammande kvinnor har inte deltagit i studierna med darbepoetin alfa och det är okänt om darbepoetin alfa överförs till bröstmjölk. Djurstudier tyder inte på att darbepoetin alfa har några direkta skadliga effekter under dräktigheten och förlossningen eller på utvecklingen hos de nyfödda ungarna. Men de potentiella riskerna för människa i motsvarande situationer är inte kända. Därför bör läkare tillämpa försiktighet när de fattar beslut om att förskriva darbepoetin alfa till gravida kvinnor. Eftersom många läkemedel kan passera över i bröstmjölk ska inte heller ammande kvinnor använda darbepoetin alfa. Darbepoetin alfa är godkänt för användning i barn och ungdomar med anemi som orsakas av kronisk njursvikt. Darbepoetin alfa har studerats i ett begränsat antal ungdomar och barn 1 år. Säkerheten av darbepoetin alfa hos dessa patienter liknade den som observerades hos vuxna patienter med kronisk njursvikt. Säkerheten av darbepoetin alfa hos barn < 1 år har inte studerats. Sida 1 av 2
8 Datum: 08 oktober 2013 Sida 183 Data som saknas (fortsättning) Risk Mängden data om patienter som inte svarar bra på darbepoetin alfa (hyporesponders) är begränsad Mängden data om säkerheten hos njurpatienter som får en högre dos darbepoetin alfa är begränsad Vad är känt Hyporesponders är patienter vars hemoglobinhalter inte ökar till en lämplig nivå trots behandling med darbepoetin alfa eller annan ESA. Man har observerat att dessa patienter löper ökad risk för dödsfall eller allvarliga hjärt-kärlproblem (kardiovaskulära händelser) jämfört med patienter som svarar bra på ESA. Det verkar inte som att ESA-dosen är orsaken till denna ökade risk. Orsaken till det skenbara sambandet mellan dåligt svar på ESAbehandling och dödsfall eller allvarliga kardiovaskulära händelser är inte känd. Darbepoetin alfa kan administreras en gång per vecka, en gång varannan vecka eller en gång per månad för att korrigera och bibehålla hemoglobinhalterna hos patienter med kronisk njursvikt som inte står på dialys. Det har inte observerats några ytterligare säkerhetsbetänkligheter hos patienter som får darbepoetin alfa en gång per månad, även om det är färre sådana patienter som har studerats jämfört med de patienter som fått läkemedlet en gång per vecka eller varannan vecka. Dessa patienter kan behöva en högre dos, även om dosen beräknas som ett genomsnitt per vecka. VI.2.5 Sammanfattning av ytterligare riskminimeringsåtgärder ordnade efter säkerhetsbetänklighet Det finns inga ytterligare riskminimeringsåtgärder för darbepoetin alfa. VI.2.6 Planerad utvecklingsplan efter marknadsgodkännandet Sida 2 av 2
9 Datum: 08 oktober 2013 Sida 184 Lista över studier som ingår i utvecklingsplanen efter marknadsgodkännandet Tabell 1. Planerad utvecklingsplan för säkerhet och effekt efter marknadsgodkännandet Studie/aktivitet (inklusive studienummer) Syften Säkerhetsbetänklig het(er) eller effektfrågeställning som behandlas Status Planerat datum för inlämning av preliminära eller slutliga resultat Studie En randomiserad, dubbelblind, placebokontrollerad studie för utvärdering av långsiktig säkerhet och effekt av darbepoetin alfa som administreras vid 500 μg var tredje vecka hos försökspersoner med anemi och långt framskriden icke-småcellig lungcancer som får flera kurer av kemoterapi. Studie : En dubbelblind, randomiserad multicenterstudie för utvärdering av nybehandling med darbepoetin alfa en gång per vecka eller en gång varannan vecka för korrigering av anemi hos en pediatrisk population med kronisk njursjukdom som står på eller inte står på dialys. Visa att darbepoetin alfa inte är sämre än placebo med avseende på total överlevnad och progressionsfri överlevnad samt att visa att darbepoetin alfa är bättre än placebo för att minska antalet blodtransfusioner. Dessutom kommer även andra parametrar för säkerhet och effekt att utvärderas. Undersöka om darbepoetin alfa en gång per vecka och en gång varannan vecka kan korrigera hemoglobinkoncentrationer hos försökspersoner mellan 1 och 18 år. Dessutom kommer dessa försökspersoner att bedömas för säkerhet, tolerabilitet och dosnivåer av darbepoetin alfa, hemoglobinkoncentrationer samt livskvalitet under studieperioden. Slutligen kommer halterna av darbepoetin alfa i blodet att utvärderas hos försökspersoner < 6 år. Dödsfall och/eller tumörprogression eller återfall hos patienter med cancer; blodproppar; stroke/ transitorisk ischemisk attack (TIA); patienter som inte svarar bra på darbepoetin alfa. Säkerhet och effekt hos barn och ungdomar samt farmakokinetik hos barn < 6 år. Pågår Pågår Slutrapport förväntas 2019 Slutrapport förväntas 2016 Sida 1 av 2
10 Datum: 08 oktober 2013 Sida 185 Tabell 1. Planerad utvecklingsplan för säkerhet och effekt efter marknadsgodkännandet Studie/aktivitet (inklusive studienummer) Studie : En fas 3, multicenter, randomiserad, dubbelblind, parallellgruppsstudie för utvärdering av doser av darbepoetin alfa som titrerats till att upprätthålla en hemoglobinkoncentration på 10,0 g/dl (i enlighet med förskrivningsinformation i USA) jämfört med låga, fasta doser av darbepoetin alfa hos försökspersoner med kronisk njursvikt som inte står på dialys och som har anemi, och som inte har behandlats med en ESA nyligen. Meta-analys för återanalys av kliniska prövningsdata rörande hemoglobinhalter och ESA-doser i patientböckerna (CRF) ESA APRISE-onkologiprogram ESAanvändningsmönster (endast amerikanskt krav för riskutvärdering och mitigeringsstrategi) Syften Utvärdera antalet försökspersoner som behöver blodtransfusioner i varje darbepoetin alfa-dosgrupp och för att utvärdera skillnaden mellan de två dosgrupperna med avseende på antalet försökspersoner som behöver blodtransfusioner. Dessutom kommer såväl ytterligare information om blodtransfusionerna som hemoglobinkoncentrationer och doser av darbepoetin alfa att utvärderas i de två dosgrupperna. Vidare kommer darbepoetin alfas säkerhetsprofil att beskrivas, däribland biverkningar och förekomsten av kliniska händelser som bedömts vara av intresse. Analysera befintliga studiedata för att undersöka förhållandet mellan darbepoetin alfa-dos och hemoglobinkoncentrationer och mortalitet/kardiovaskulära utfall. Förhållandet mellan hemoglobinkoncentrationer och dessa utfall kommer att undersökas ytterligare i delgrupper av patienterna, såsom patienter med eller utan diabetes och som står eller inte står på dialys. Utvärdera ESA-användning genom att kontrollera hur mycket ESA som används av patienter som får myelosuppressiv kemoterapi och relaterade parametrar Säkerhetsbetänklig het(er) eller effekt frågeställning som behandlas Identifierade och potentiella risker Säkerhet då högre doser ges till njurpatienter ESA-användning (endast krav i USA) Status Pågår Pågår Pågår Planerat datum för inlämning av preliminära eller slutliga resultat Slutrapport förväntas 2017 Resultat från första stadiet och metoder för det andra stadiet förväntas i februari 2014 Data lämnas till FDA i USA enligt ett i förväg uppsatt schema (det kommer inte att tas fram någon slutrapport) Sida 2 av 2
11 Datum: 08 oktober 2013 Sida 186 Studier som utgör ett villkor för marknadsgodkännandet Ingen av de ovan beskrivna studierna utgör ett villkor för marknadsgodkännandet. VI.2.7 Sammanfattning av ändringarna i riskhanteringsplanen i tidsordning Inledningsvis upprättades separata riskhanteringsplaner för nefrologi- respektive onkologiindikationerna (version 1.0 till 3.0 av varje). Dessa riskhanteringsplaner har slagits samman och uppdaterats i detta dokument (version 4). Tabell 2. Huvudsakliga ändringar i riskhanteringsplanen i datumordning Versions nummer Datum Säkerhetsbetänkligheter Anmärkningar Nefrologi-RMP dec 2008 Identifierade risker Hypertoni Venös tromboemboli Kramper Allergiska reaktioner (hypersensitivitet) Antikroppsmedierad erytroblastopeni Potentiella risker Ischemisk hjärtsjukdom, däribland myokardiell infarkt Hjärtsvikt Cerebrovaskulär blödning och ischemiska tillstånd Vaskulär access-trombos Data som saknas Graviditet Ammande mödrar Användning i en geriatrisk population Användning i en pediatrisk population Hyporesponders jul 2010 Cerebrovaskulär blödning och ischemiska tillstånd ändrades från en potentiell till en identifierad risk. Nefrogen systemisk fibros och dödlighet hos försökspersoner som tidigare har haft tumörsjukdomar lades till som potentiella risker. Risker förknippade med olika tillverkningsprocesser (rullflaskor jämfört med högkapacitetsmetoder) togs bort. Risk för hypertoni och tromboemboliska händelser identifierades genom analys av kliniska prövningsdata. Risk för kramper, hypersensitivitetsreaktioner och antikroppsmedierad erytroblastopeni identifierades genom analys av data efter marknadsgodkännandet. De potentiella riskerna fastställdes utifrån kliniska prövningsdata. Cerebrovaskulär risk ändrades och mortalitetsrisken lades till, baserat på resultaten från TREAT. Nefrogen systemisk fibros lades till för att överensstämma med PSURriskidentifiering. Tillverkningsrisker ändrades eftersom endast högkapacitetsmetoder används. Sida 1 av 3
12 Datum: 08 oktober 2013 Sida 187 Tabell 2. Huvudsakliga ändringar i riskhanteringsplanen i datumordning Versions nummer Datum Säkerhetsbetänkligheter Anmärkningar Nefrologi-RMP (fortsättning) dec 2011 Vaskulär access-trombos ändrades från en potentiell till en identifierad risk. Hypertensiv kris lades till beskrivningen av den identifierade hypertonirisken. Nefrogen systemisk fibros togs bort som en potentiell risk. Onkologi-RMP 1.0 april 2005 Viktiga områden Trombotiska händelser Immunogenicitet definierat som positiv antikroppsbindning till erytropoetin och erytroblastopeni Överlevnad och tumörprogression jun 2009 Identifierade risker Hypertoni Tromboemboliska händelser (tidigare trombotiska händelser ) Kramper Allergiska reaktioner (hypersensitivitet) Potentiella risker Antikroppsmedierad erytroblastopeni Cerebrovaskulära störningar Ökad dödlighet och negativa tumörutfall Data som saknas Graviditet Ammande mödrar Användning i en pediatrisk population Hyporesponders Vaskulär access-trombos ändrades på grund av resultaten från placebokontrollerade studier. Allvarlig hypertoni observerades hos patienter med kronisk njursjukdom. Förekomsten av nefrogen systemisk fibros var låg (3 fall på 9 år). Risken för trombotiska händelser och överlevnad/tumörprogression baserades på resultat från kliniska studier. Immunogenicitetsrisken baserades på resultaten med en annan ESA; det observerades inga fall hos cancerpatienter som fick darbepoetin alfa. Baserat på den nya mallen för en riskhanteringsplan kategoriserades de tidigare viktiga områdena som risker. Antikroppsmedierad erytroblastopeni ändrades från identifierad till potentiell risk. Nya och potentiella risker lades också till baserat på kliniska prövningsdata och data från efter marknadsgodkännandet. Data som saknas uppdaterades med information om hyporesponders. Sida 2 av 3
13 Datum: 08 oktober 2013 Sida 188 Tabell 2. Huvudsakliga ändringar i riskhanteringsplanen i datumordning Versions nummer Datum Säkerhetsbetänkligheter Anmärkningar Kombinerad RMP för nefrologi och onkologi 4 08 okt 2013 Säkerhet vid högre doser lades till som data som saknas för nefrologi-indikationen Tillägg begärdes av EMA efter CHMP:s godkännande av Aranesp QM dosvariation 108. Användning i en geriatrisk population togs bort från data som saknas (tidigare för nefrologiindikationen) Namn på risk i nefrologiindikationen ändrades från cerebrovaskulär blödning och ischemiska tillstånd till cerebrovaskulära störningar För båda indikationerna utgör äldre patienter en stor andel av patienterna som har fått läkemedlet. Riskbeskrivningen för cerebrovaskulära störningar uppdaterades så att den överensstämde mellan indikationerna. Sida 3 av 3
Delområden av en offentlig sammanfattning
 Pemetrexed STADA 25 mg/ml koncentrat till infusionsvätska, lösning 7.5.2015, Version V1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information
Pemetrexed STADA 25 mg/ml koncentrat till infusionsvätska, lösning 7.5.2015, Version V1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Aranesp 25 mikrogram injektionsvätska, lösning i injektionsflaska Aranesp 40 mikrogram injektionsvätska, lösning i injektionsflaska Aranesp 60 mikrogram injektionsvätska,
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Aranesp 25 mikrogram injektionsvätska, lösning i injektionsflaska Aranesp 40 mikrogram injektionsvätska, lösning i injektionsflaska Aranesp 60 mikrogram injektionsvätska,
Sammanfattning av riskhanteringsplanen för Cosentyx (sekukinumab)
 EMA/775515/2014 Sammanfattning av riskhanteringsplanen för Cosentyx (sekukinumab) Detta är en sammanfattning av riskhanteringsplanen för Cosentyx som beskriver åtgärder som ska vidtas för att säkerställa
EMA/775515/2014 Sammanfattning av riskhanteringsplanen för Cosentyx (sekukinumab) Detta är en sammanfattning av riskhanteringsplanen för Cosentyx som beskriver åtgärder som ska vidtas för att säkerställa
Zerbaxa. ceftolozan / tazobaktam. version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 EMA/513109/2015 Zerbaxa ceftolozan / tazobaktam version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen
EMA/513109/2015 Zerbaxa ceftolozan / tazobaktam version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen
Vipdomet 12,5 mg/850 mg, filmdragerade tabletter Vipdomet 12,5 mg/1 000 mg, filmdragerade tabletter (alogliptin och metforminhydroklorid)
 Vipdomet 12,5 mg/850 mg, filmdragerade tabletter Vipdomet 12,5 mg/1 000 mg, filmdragerade tabletter (alogliptin och metforminhydroklorid) RISKHANTERINGSPLAN VI.2 Delområden av en offentlig sammanfattning
Vipdomet 12,5 mg/850 mg, filmdragerade tabletter Vipdomet 12,5 mg/1 000 mg, filmdragerade tabletter (alogliptin och metforminhydroklorid) RISKHANTERINGSPLAN VI.2 Delområden av en offentlig sammanfattning
Sammanfattning av riskhanteringsplanen (RMP) för Portrazza (necitumumab)
 EMA/33513/2016 Sammanfattning av riskhanteringsplanen (RMP) för Portrazza (necitumumab) Detta är en sammanfattning av riskhanteringsplanen för Portrazza som beskriver åtgärder som ska vidtas för att säkerställa
EMA/33513/2016 Sammanfattning av riskhanteringsplanen (RMP) för Portrazza (necitumumab) Detta är en sammanfattning av riskhanteringsplanen för Portrazza som beskriver åtgärder som ska vidtas för att säkerställa
Lamictal. 30-12-2015, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Lamictal 30-12-2015, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Epilepsi Epilepsi är en allvarlig
Lamictal 30-12-2015, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Epilepsi Epilepsi är en allvarlig
Vipidia 25 mg, filmdragerade tabletter Vipidia 12,5 mg, filmdragerade tabletter Vipidia 6,25 mg, filmdragerade tabletter (alogliptin)
 Vipidia 25 mg, filmdragerade tabletter Vipidia 12,5 mg, filmdragerade tabletter Vipidia 6,25 mg, filmdragerade tabletter (alogliptin) RISKHANTERINGSPLAN VI.2 Delområden av en offentlig sammanfattning VI.2.1
Vipidia 25 mg, filmdragerade tabletter Vipidia 12,5 mg, filmdragerade tabletter Vipidia 6,25 mg, filmdragerade tabletter (alogliptin) RISKHANTERINGSPLAN VI.2 Delområden av en offentlig sammanfattning VI.2.1
Serdolect 4 mg, 12 mg, 16 mg, 20 mg tablett 4.3.2015, Version 4.0
 Serdolect 4 mg, 12 mg, 16 mg, 20 mg tablett 4.3.2015, Version 4.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst
Serdolect 4 mg, 12 mg, 16 mg, 20 mg tablett 4.3.2015, Version 4.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 LOSATRIX 12,5 MG FILMDRAGERADE TABLETTER Datum: 8.9.2015, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
LOSATRIX 12,5 MG FILMDRAGERADE TABLETTER Datum: 8.9.2015, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 1 (3) 22 februari 2016 Drospirenon/etinylestradiol Version 4.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Preventivmedel
1 (3) 22 februari 2016 Drospirenon/etinylestradiol Version 4.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Preventivmedel
Pronaxen 250 mg tabletter OTC. 25.9.2015, Version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Pronaxen 250 mg tabletter OTC 25.9.2015, Version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Pronaxen 250
Pronaxen 250 mg tabletter OTC 25.9.2015, Version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Pronaxen 250
Sammanfattning av riskhanteringsplan (RMP) för Cerdelga (eliglustat)
 EMA/743948/2014 Sammanfattning av riskhanteringsplan (RMP) för Cerdelga (eliglustat) VI.2 Sektionerna av den offentliga sammanfattningen Detta är en sammanfattning av riskhanteringsplanen (RMP) för Cerdelga,
EMA/743948/2014 Sammanfattning av riskhanteringsplan (RMP) för Cerdelga (eliglustat) VI.2 Sektionerna av den offentliga sammanfattningen Detta är en sammanfattning av riskhanteringsplanen (RMP) för Cerdelga,
Sammanfattning av riskhanteringsplanen för Synjardy (empagliflozin/metformin)
 EMA/217413/2015 Sammanfattning av riskhanteringsplanen för Synjardy (empagliflozin/metformin) Detta är en sammanfattning av riskhanteringsplanen för Synjardy som beskriver åtgärder som ska vidtas för att
EMA/217413/2015 Sammanfattning av riskhanteringsplanen för Synjardy (empagliflozin/metformin) Detta är en sammanfattning av riskhanteringsplanen för Synjardy som beskriver åtgärder som ska vidtas för att
Aripiprazole Accord (aripiprazol)
 Aripiprazole Accord (aripiprazol) Patient/Anhörig Informationsbroschyr Denna broschyr innehåller viktig säkerhetsinformation som du ska bekanta dig med innan påbörjande av behandlingen med aripiprazol
Aripiprazole Accord (aripiprazol) Patient/Anhörig Informationsbroschyr Denna broschyr innehåller viktig säkerhetsinformation som du ska bekanta dig med innan påbörjande av behandlingen med aripiprazol
Information för offentlig sammanfattning
 Information för offentlig sammanfattning Sjukdomsepidemiologi översikt Ökad förväntad livslängd och åldrande befolkningar förväntas leda till att artros blir den fjärde av de främsta orsakerna till funktionshinder
Information för offentlig sammanfattning Sjukdomsepidemiologi översikt Ökad förväntad livslängd och åldrande befolkningar förväntas leda till att artros blir den fjärde av de främsta orsakerna till funktionshinder
Översikt av sjukdomsepidemiologin
 Översikt av sjukdomsepidemiologin Vectibix används för behandling av (cancer i tjocktarmen) hos vuxna patienter med en särskild typ av tumör som kallas vildtyp RAS-tumör. Kolorektalcancer är globalt sett
Översikt av sjukdomsepidemiologin Vectibix används för behandling av (cancer i tjocktarmen) hos vuxna patienter med en särskild typ av tumör som kallas vildtyp RAS-tumör. Kolorektalcancer är globalt sett
Sammanfattning av riskhanteringsplanen för Ofev (nintedanib)
 EMA/738120/2014 Sammanfattning av riskhanteringsplanen för Ofev (nintedanib) Detta är en sammanfattning av riskhanteringsplanen för Ofev som beskriver åtgärder som ska vidtas för att säkerställa att Ofev
EMA/738120/2014 Sammanfattning av riskhanteringsplanen för Ofev (nintedanib) Detta är en sammanfattning av riskhanteringsplanen för Ofev som beskriver åtgärder som ska vidtas för att säkerställa att Ofev
Material för offentlig sammanfattning
 STADA Arzneimittel AG Sida 1 / 6 VI.2 Material för offentlig sammanfattning Paminject 3 mg/ml, koncentrat till infusionsvätska, lösning VI.2.1 Översikt över sjukdomens epidemiologi Enligt regelverket för
STADA Arzneimittel AG Sida 1 / 6 VI.2 Material för offentlig sammanfattning Paminject 3 mg/ml, koncentrat till infusionsvätska, lösning VI.2.1 Översikt över sjukdomens epidemiologi Enligt regelverket för
Delområden av en offentlig sammanfattning
 Olmestad Comp 20 mg/12,5 mg filmdragerade tabletter Olmestad Comp 20 mg/25 mg filmdragerade tabletter 17.12.2015, version V1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig
Olmestad Comp 20 mg/12,5 mg filmdragerade tabletter Olmestad Comp 20 mg/25 mg filmdragerade tabletter 17.12.2015, version V1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig
Leflunomide STADA. Version, V1.0
 Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
s00015487-06 Affärshemligheter och konfidentiell information 2015 Boehringer Ingelheim International GmbH eller ett eller flera dotterbolag
 Sida 1199 av 5 av 275 DEL VI.2 Del VI.2.1 DELOMRÅDEN AV EN OFFENTLIG SAMMANFATTNING Information om sjukdomsförekomst Ischemisk stroke orsakas av en blodpropp i en artär i hjärnan. Bland personer över 55
Sida 1199 av 5 av 275 DEL VI.2 Del VI.2.1 DELOMRÅDEN AV EN OFFENTLIG SAMMANFATTNING Information om sjukdomsförekomst Ischemisk stroke orsakas av en blodpropp i en artär i hjärnan. Bland personer över 55
CYPRETYL OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 CYPRETYL Datum: 29.6.2015, Version: 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst Akne är ett allmänt hudbesvär
CYPRETYL Datum: 29.6.2015, Version: 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst Akne är ett allmänt hudbesvär
Risk Vad är känt Förebyggande möjligheter
 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Hereditärt angioödem (HAE) är en sällsynt ärftlig sjukdom som karakteriseras av återkommande episoder av anhopning
VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Hereditärt angioödem (HAE) är en sällsynt ärftlig sjukdom som karakteriseras av återkommande episoder av anhopning
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 1 (6) 8 februari 2016 Lemilvo (aripiprazol) Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Schizofreni
1 (6) 8 februari 2016 Lemilvo (aripiprazol) Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Schizofreni
Bilaga III Tillägg till relevanta avsnitt i Produktresumén och Bipacksedeln
 Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
Genvoya OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 EMA/661227/2015 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen för, som specificerar de åtgärder som
EMA/661227/2015 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen för, som specificerar de åtgärder som
Kontakta din läkare. sanofi-aventis Box 14142, 167 14 BROMMA. Tel 08-634 50 00, infoavd@sanofi-aventis.com, www.sanofi-aventis.se
 Kontakta din läkare Kontakta genast din läkare om du drabbas av något av nedanstående symtom medan du behandlas med JEVTANA. feber, dvs en kroppstemperatur på 38 C eller högre diarré (t.ex. om du har lös
Kontakta din läkare Kontakta genast din läkare om du drabbas av något av nedanstående symtom medan du behandlas med JEVTANA. feber, dvs en kroppstemperatur på 38 C eller högre diarré (t.ex. om du har lös
Clarityn 10 mg tabletter loratadin. Datum 10.8.2015, Version 4.0
 Clarityn 10 mg tabletter loratadin Datum 10.8.2015, Version 4.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN Syftet med informationen i detta dokument är att göra läsarna medvetna om frågor angående
Clarityn 10 mg tabletter loratadin Datum 10.8.2015, Version 4.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN Syftet med informationen i detta dokument är att göra läsarna medvetna om frågor angående
Din behandling med Nexavar (sorafenib)
 Din behandling med Nexavar (sorafenib) (sorafenib) tabletter Introduktion Cancer är oftast en svårbehandlad sjukdom och det finns ett stort behov av nya behandlingsformer. Därför är Nexavar ett viktigt
Din behandling med Nexavar (sorafenib) (sorafenib) tabletter Introduktion Cancer är oftast en svårbehandlad sjukdom och det finns ett stort behov av nya behandlingsformer. Därför är Nexavar ett viktigt
Information till dig som får behandling med JEVTANA (cabazitaxel)
 Information till dig som får behandling med JEVTANA (cabazitaxel) Om JEVTANA JEVTANA är ett läkemedel som används för behandling av prostatacancer som har fortskridit efter att du har behandlats med annan
Information till dig som får behandling med JEVTANA (cabazitaxel) Om JEVTANA JEVTANA är ett läkemedel som används för behandling av prostatacancer som har fortskridit efter att du har behandlats med annan
RENNIE ORANGE (kalciumkarbonat + magnesiumsubkarbonat) Offentlig sammanfattning av riskhanteringsplanen Versio 1.4, 24.7.2015
 1 RENNIE ORANGE (kalciumkarbonat + magnesiumsubkarbonat) Offentlig sammanfattning av riskhanteringsplanen Versio 1.4, 24.7.2015 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst
1 RENNIE ORANGE (kalciumkarbonat + magnesiumsubkarbonat) Offentlig sammanfattning av riskhanteringsplanen Versio 1.4, 24.7.2015 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst
Nexplanon. 30.3.2016, version 5.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Nexplanon 30.3.2016, version 5.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Implanon och Implanon NXT/Nexplanon
Nexplanon 30.3.2016, version 5.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Implanon och Implanon NXT/Nexplanon
Delområden av en offentlig sammanfattning. Oxikodonhydroklorid är en stark värkmedicin som används för behandling av medelsvår eller svår smärta.
 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Oxikodonhydroklorid är en stark värkmedicin som används för behandling av medelsvår eller svår smärta. Globalt uppskattar
VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Oxikodonhydroklorid är en stark värkmedicin som används för behandling av medelsvår eller svår smärta. Globalt uppskattar
Olmesartan medoxomil STADA. 10.11.2015, Version V1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Olmesartan medoxomil STADA 10.11.2015, Version V1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Olmesartan medoxomil STADA 10 mg filmdragerade tabletter
Olmesartan medoxomil STADA 10.11.2015, Version V1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Olmesartan medoxomil STADA 10 mg filmdragerade tabletter
PATIENTINFORMATION FRÅN SANOFI GENZYME. Information till dig som blivit ordinerad Aubagio (teriflunomid)
 PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad Aubagio (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad Aubagio (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
Offentlig sammanfattning av riskhanteringsplanen för Sirturo (bedakilin)
 EMA/16634/2014 Offentlig sammanfattning av riskhanteringsplanen för Sirturo (bedakilin) Detta är en sammanfattning av riskhanteringsplanen för Sirturo som beskriver de åtgärder som ska vidtas för att säkerställa
EMA/16634/2014 Offentlig sammanfattning av riskhanteringsplanen för Sirturo (bedakilin) Detta är en sammanfattning av riskhanteringsplanen för Sirturo som beskriver de åtgärder som ska vidtas för att säkerställa
Granocyte Version V1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Granocyte Version V1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Minskning i varaktigheten av ett minskat antal
Granocyte Version V1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Minskning i varaktigheten av ett minskat antal
Högt blodtryck. Med nya kostvanor, motion och läkemedel minskar risken för slaganfall och sjukdomar i hjärta och njurar.
 Högt blodtryck Med nya kostvanor, motion och läkemedel minskar risken för slaganfall och sjukdomar i hjärta och njurar. Högt blodtryck (hypertoni) är något av en folksjukdom. Man räknar med att ungefär
Högt blodtryck Med nya kostvanor, motion och läkemedel minskar risken för slaganfall och sjukdomar i hjärta och njurar. Högt blodtryck (hypertoni) är något av en folksjukdom. Man räknar med att ungefär
Boostrix polio. 6.3.2015, version 1
 Boostrix polio 6.3.2015, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Kikhosta Kikhosta (pertussis)
Boostrix polio 6.3.2015, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Kikhosta Kikhosta (pertussis)
19.5.2015, Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Oxycodone/Naloxone 5 mg/2,5 mg depottablett Oxycodone/Naloxone 10 mg/5 mg depottablett Oxycodone/Naloxone 20 mg/10 mg depottablett Oxycodone/Naloxone 40 mg/20 mg depottablett 19.5.2015, Version 1.1 OFFENTLIG
Oxycodone/Naloxone 5 mg/2,5 mg depottablett Oxycodone/Naloxone 10 mg/5 mg depottablett Oxycodone/Naloxone 20 mg/10 mg depottablett Oxycodone/Naloxone 40 mg/20 mg depottablett 19.5.2015, Version 1.1 OFFENTLIG
Afamcivir 500 mg film-dragerade tabletter. 06 July 2015, Version 9/2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Afamcivir 500 mg film-dragerade tabletter 06 July 2015, Version 9/2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1. Information om sjukdomsförekomst
Afamcivir 500 mg film-dragerade tabletter 06 July 2015, Version 9/2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1. Information om sjukdomsförekomst
Patientguide. Viktig information till dig som påbörjar behandling med LEMTRADA
 Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Innehållsförteckning 1> Vad är LEMTRADA och hur fungerar det? 3 2> Översikt över behandling med LEMTRADA 4 3> Biverkningar
Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Innehållsförteckning 1> Vad är LEMTRADA och hur fungerar det? 3 2> Översikt över behandling med LEMTRADA 4 3> Biverkningar
Aripiprazol Stada. 16.7.2015, Version 1.7 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Aripiprazol Stada 16.7.2015, Version 1.7 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Aripiprazol Stada 5 mg tabletter Aripiprazol Stada 10 mg tabletter
Aripiprazol Stada 16.7.2015, Version 1.7 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Aripiprazol Stada 5 mg tabletter Aripiprazol Stada 10 mg tabletter
För dig som behandlas med Tracleer (bosentan)
 För dig som behandlas med Tracleer (bosentan) 1 Innehåll Hur behandlas PAH?... 4 Hur fungerar behandlingen med Tracleer?... 4 Kommer Tracleer att få mig att må bättre?... 5 Gångtest... 7 Funktionsklassificering...
För dig som behandlas med Tracleer (bosentan) 1 Innehåll Hur behandlas PAH?... 4 Hur fungerar behandlingen med Tracleer?... 4 Kommer Tracleer att få mig att må bättre?... 5 Gångtest... 7 Funktionsklassificering...
Din behandling med XALKORI (crizotinib)
 Version 1/2015-11 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar
Version 1/2015-11 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 1 (3) 11 May 2016 Fludarabin Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Förekomsten av kronisk lymfatisk
1 (3) 11 May 2016 Fludarabin Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Förekomsten av kronisk lymfatisk
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 ARPIPRAZOLE RATIOPHARM TABLETTER Datum: 26.9.2014, Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
ARPIPRAZOLE RATIOPHARM TABLETTER Datum: 26.9.2014, Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
Bipacksedel: Information till användaren
 Bipacksedel: Information till användaren Pregnyl 1 500 IE pulver och vätska till injektionsvätska, lösning Pregnyl 5 000 IE pulver och vätska till injektionsvätska, lösning humant koriongonadotropin Läs
Bipacksedel: Information till användaren Pregnyl 1 500 IE pulver och vätska till injektionsvätska, lösning Pregnyl 5 000 IE pulver och vätska till injektionsvätska, lösning humant koriongonadotropin Läs
Till dig som har förmaksflimmer och behandlas med Xarelto. Patientinformation
 1 Till dig som har förmaksflimmer och behandlas med Xarelto Patientinformation Innehållsförteckning Orsaker till förmaksflimmer 5 Symtom 7 Tre typer av förmaksflimmer 7 Behandling av förmaksflimmer 8 Förmaksflimmer
1 Till dig som har förmaksflimmer och behandlas med Xarelto Patientinformation Innehållsförteckning Orsaker till förmaksflimmer 5 Symtom 7 Tre typer av förmaksflimmer 7 Behandling av förmaksflimmer 8 Förmaksflimmer
Bipacksedel: Information till användaren. Allopurinol Orion 100 mg tabletter Allopurinol Orion 300 mg tabletter. allopurinol
 Bipacksedel: Information till användaren Allopurinol Orion 100 mg tabletter Allopurinol Orion 300 mg tabletter allopurinol Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller
Bipacksedel: Information till användaren Allopurinol Orion 100 mg tabletter Allopurinol Orion 300 mg tabletter allopurinol Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Abseamed 1000 IE/0,5 ml injektionsvätska, lösning, i en förfylld spruta 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml av lösningen innehåller 2000 IE
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Abseamed 1000 IE/0,5 ml injektionsvätska, lösning, i en förfylld spruta 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml av lösningen innehåller 2000 IE
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna information, du kan behöva
Testogel 25 mg, gel i dospåse Testosteron
 Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig. - Spara denna information, du kan behöva läsa den igen. - Om du har ytterligare
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig. - Spara denna information, du kan behöva läsa den igen. - Om du har ytterligare
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. DALACIN vagitorier 100 mg Klindamycinfosfat, motsvarande 100 mg klindamycin
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN DALACIN vagitorier 100 mg Klindamycinfosfat, motsvarande 100 mg klindamycin Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN DALACIN vagitorier 100 mg Klindamycinfosfat, motsvarande 100 mg klindamycin Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna
INFORMATION TILL DIG SOM BEHANDLAS MED Zoladex PATIENTINFORMATION
 INFORMATION TILL DIG SOM BEHANDLAS MED Zoladex PATIENTINFORMATION Patientinformation till dig som behandlas med Zoladex vid prostatacancer Urinblåsa Prostata Yttre slutmuskel Urinrör Penis Sädesledare
INFORMATION TILL DIG SOM BEHANDLAS MED Zoladex PATIENTINFORMATION Patientinformation till dig som behandlas med Zoladex vid prostatacancer Urinblåsa Prostata Yttre slutmuskel Urinrör Penis Sädesledare
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Retacrit 1 000 IE/0,3 ml injektionsvätska, lösning i förfylld spruta 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 förfylld spruta med 0,3 ml injektionsvätska,
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Retacrit 1 000 IE/0,3 ml injektionsvätska, lösning i förfylld spruta 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 förfylld spruta med 0,3 ml injektionsvätska,
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Emovat salva 0,05% Emovat kräm 0,05% Klobetason
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Emovat salva 0,05% Emovat kräm 0,05% Klobetason Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. 1* Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Emovat salva 0,05% Emovat kräm 0,05% Klobetason Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. 1* Spara denna information, du kan behöva
BILAGA II EEUROPEISKA LÄKEMEDELSMYNDIGHETENS VETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉERNA OCH BIPACKSEDLARNA
 BILAGA II EEUROPEISKA LÄKEMEDELSMYNDIGHETENS VETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉERNA OCH BIPACKSEDLARNA 108 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA
BILAGA II EEUROPEISKA LÄKEMEDELSMYNDIGHETENS VETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉERNA OCH BIPACKSEDLARNA 108 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA
Värt att veta om din behandling med SPRYCEL (dasatinib) SPRYCEL dasatinib 1
 Värt att veta om din behandling med SPRYCEL (dasatinib) SPRYCEL dasatinib 1 Den här broschyren som du har fått av din läkare/ sjuksköterska är ett tillägg till den muntliga information som du har fått
Värt att veta om din behandling med SPRYCEL (dasatinib) SPRYCEL dasatinib 1 Den här broschyren som du har fått av din läkare/ sjuksköterska är ett tillägg till den muntliga information som du har fått
Praktisk guide om REVOLADE (eltrombopag) till PATIENTEN
 Praktisk guide om REVOLADE (eltrombopag) till PATIENTEN Praktisk guide till PATIENTEN INNEHÅLL 4 Stöd för behandling med eltrombopag 5 Stödförpackning för behandling med eltrombopag 6 Viktig information
Praktisk guide om REVOLADE (eltrombopag) till PATIENTEN Praktisk guide till PATIENTEN INNEHÅLL 4 Stöd för behandling med eltrombopag 5 Stödförpackning för behandling med eltrombopag 6 Viktig information
abbvie VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst
 VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Förekomsten av sekundär hyperparatyreos (SHPT) antyds av höga koncentrationer av paratyreoideahormon (PTH) i blodet.
VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Förekomsten av sekundär hyperparatyreos (SHPT) antyds av höga koncentrationer av paratyreoideahormon (PTH) i blodet.
Proscar. 7.8.2015, version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Proscar 7.8.2015, version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Prostatan är en körtel som endast finns
Proscar 7.8.2015, version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Prostatan är en körtel som endast finns
6.2 Offentlig sammanfattning. 6.2.1 Översikt över sjukdomens utbredning
 6.2 Offentlig sammanfattning 6.2.1 Översikt över sjukdomens utbredning Antalet vuxna med reumatoid artrit (RA) varierar mellan olika er i världen. Forskning som gjorts i norra Europa och Nordamerika tyder
6.2 Offentlig sammanfattning 6.2.1 Översikt över sjukdomens utbredning Antalet vuxna med reumatoid artrit (RA) varierar mellan olika er i världen. Forskning som gjorts i norra Europa och Nordamerika tyder
FRÅGOR OCH SVAR OM ZYTIGA (abiraterone) 2011 09 12
 FRÅGOR OCH SVAR OM ZYTIGA (abiraterone) 2011 09 12 FÖR EXTERN ANVÄNDNING (F&S om ZYTIGA är endast avsedd för media) Vad är prostatacancer? Prostatacancer uppstår när det bildas cancerceller i prostatans
FRÅGOR OCH SVAR OM ZYTIGA (abiraterone) 2011 09 12 FÖR EXTERN ANVÄNDNING (F&S om ZYTIGA är endast avsedd för media) Vad är prostatacancer? Prostatacancer uppstår när det bildas cancerceller i prostatans
Evotaz (atazanavir/kobicistat) 5. januari 2016, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Evotaz (atazanavir/kobicistat) 5. januari 2016, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är sammanfattning av riskhanteringsplanen
Evotaz (atazanavir/kobicistat) 5. januari 2016, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är sammanfattning av riskhanteringsplanen
Offentlig sammanfattning av riskhanteringsplanen för Sylvant (siltuximab)
 EMA/198014/2014 Offentlig sammanfattning av riskhanteringsplanen för Sylvant (siltuximab) Detta är en sammanfattning av riskhanteringsplanen för Sylvant som beskriver de åtgärder som bör vidtas för att
EMA/198014/2014 Offentlig sammanfattning av riskhanteringsplanen för Sylvant (siltuximab) Detta är en sammanfattning av riskhanteringsplanen för Sylvant som beskriver de åtgärder som bör vidtas för att
Dutrebis (lamivudin/raltegravir) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 EMA/198479/2015 Dutrebis (lamivudin/raltegravir) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN Detta är en sammanfattning av riskhanteringsplanen för Dutrebis, som specificerar de åtgärder som ska vidtas
EMA/198479/2015 Dutrebis (lamivudin/raltegravir) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN Detta är en sammanfattning av riskhanteringsplanen för Dutrebis, som specificerar de åtgärder som ska vidtas
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Elidel 10 mg/g kräm 8.12.2015, Version 11 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Eksem förekommer främst
Elidel 10 mg/g kräm 8.12.2015, Version 11 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Eksem förekommer främst
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VENORION 37,5 MG, 75 MG OCH 150 MG DEPOTKAPSEL, HÅRD ORION CORPORATION DATUM: 07-10-2015, VERSION 1.
 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VENORION 37,5 MG, 75 MG OCH 150 MG DEPOTKAPSEL, HÅRD ORION CORPORATION DATUM: 07-10-2015, VERSION 1.1 VI.2 VI.2.1 Delområden av en offentlig sammanfattning
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VENORION 37,5 MG, 75 MG OCH 150 MG DEPOTKAPSEL, HÅRD ORION CORPORATION DATUM: 07-10-2015, VERSION 1.1 VI.2 VI.2.1 Delområden av en offentlig sammanfattning
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Spektramox. 500 mg/125 mg filmdragerade tabletter
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Spektramox 500 mg/125 mg filmdragerade tabletter Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. - Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Spektramox 500 mg/125 mg filmdragerade tabletter Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. - Spara denna information, du kan behöva
Imatinib STADA 100 mg filmdragerade tabletter. 26.5.2015, Version V1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Imatinib STADA 100 mg filmdragerade tabletter 26.5.2015, Version V1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Imatinib STADA 100 mg filmdragerade
Imatinib STADA 100 mg filmdragerade tabletter 26.5.2015, Version V1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Imatinib STADA 100 mg filmdragerade
Viktig information om användningen av Tasigna
 Viktig information om användningen av Tasigna Viktig information om behandling med Tasigna Vad ÄR TASIGNA? TASIGNA är ett receptbelagt läkemedel som används för behandling av vuxna patienter med Philadelphiakromosompositiv
Viktig information om användningen av Tasigna Viktig information om behandling med Tasigna Vad ÄR TASIGNA? TASIGNA är ett receptbelagt läkemedel som används för behandling av vuxna patienter med Philadelphiakromosompositiv
ZAVEDOS , Version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 1 (5) ZAVEDOS 9.6.2016, Version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Akut lymfatisk leukemi (ALL)
1 (5) ZAVEDOS 9.6.2016, Version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Akut lymfatisk leukemi (ALL)
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. ARICEPT 5 mg och 10 mg filmdragerade tabletter (Donepezilhydroklorid)
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN ARICEPT 5 mg och 10 mg filmdragerade tabletter (Donepezilhydroklorid) Du och din vårdnadshavare bör noga läsa igenom denna bipacksedel innan du börjar använda detta
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN ARICEPT 5 mg och 10 mg filmdragerade tabletter (Donepezilhydroklorid) Du och din vårdnadshavare bör noga läsa igenom denna bipacksedel innan du börjar använda detta
Nucala , version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Nucala 01.02.2016, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen för Nucala, som specificerar
Nucala 01.02.2016, version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen för Nucala, som specificerar
Del VI: Sammanfattning av åtgärder i riskhanteringsplanen
 Del VI: Sammanfattning av åtgärder i riskhanteringsplanen VI.2 VI.2.1 Delar för allmän sammanfattning Information om sjukdomsförekomst Läkemedlet Dormix 12,5 och 25 mg filmdragerade tabletter är avsett
Del VI: Sammanfattning av åtgärder i riskhanteringsplanen VI.2 VI.2.1 Delar för allmän sammanfattning Information om sjukdomsförekomst Läkemedlet Dormix 12,5 och 25 mg filmdragerade tabletter är avsett
, version V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Entecavir STADA 0,5 mg och 1 mg filmdragerade tabletter 14.6.2016, version V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Entecavir Stada 0,5 mg filmdragerade
Entecavir STADA 0,5 mg och 1 mg filmdragerade tabletter 14.6.2016, version V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Entecavir Stada 0,5 mg filmdragerade
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Telmisartan/Hydrochlorothiazide ratiopharm 4.12.2014, Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
Telmisartan/Hydrochlorothiazide ratiopharm 4.12.2014, Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
Bilaga III. Ändringar av relevanta avsnitt av produktresumén och bipacksedeln
 Bilaga III Ändringar av relevanta avsnitt av produktresumén och bipacksedeln Observera: De relevant avsnitten av produktresumé och bipacksedel är resultatet av referral-proceduren. Produktinformationen
Bilaga III Ändringar av relevanta avsnitt av produktresumén och bipacksedeln Observera: De relevant avsnitten av produktresumé och bipacksedel är resultatet av referral-proceduren. Produktinformationen
Till dig som behandlas med Xarelto och ska genomgå konvertering. Patientinformation www.xarelto-patient.se
 1 Till dig som behandlas med Xarelto och ska genomgå konvertering Patientinformation www.xarelto-patient.se Konvertering en behandling som syftar till att försöka återställa ditt hjärtas normala hjärtrytm
1 Till dig som behandlas med Xarelto och ska genomgå konvertering Patientinformation www.xarelto-patient.se Konvertering en behandling som syftar till att försöka återställa ditt hjärtas normala hjärtrytm
Gynekologisk och allmän hälsodeklaration inför ev. operation
 Gynekologisk och allmän hälsodeklaration inför ev. operation 45-årig kvinna Inför tumöroperation Personnummer:......... -... Namn... Adress... Postnummer...Ort... Tel. bost... Tel. arb... Mobil/övrig telefon...
Gynekologisk och allmän hälsodeklaration inför ev. operation 45-årig kvinna Inför tumöroperation Personnummer:......... -... Namn... Adress... Postnummer...Ort... Tel. bost... Tel. arb... Mobil/övrig telefon...
BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET VILKA SKA IMPLEMENTERAS AV MEDLEMSLÄNDERNA
 BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET VILKA SKA IMPLEMENTERAS AV MEDLEMSLÄNDERNA 1/5 VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING
BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET VILKA SKA IMPLEMENTERAS AV MEDLEMSLÄNDERNA 1/5 VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING
DELOMRÅDEN AV EN OFFENTLIG SAMMANFATTNING
 EU RMP Läkemedelssubstans Bicalutamid Versionnummer 2 Datum 2 maj 2014 DEL VI: OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI: 2 DELOMRÅDEN AV EN OFFENTLIG SAMMANFATTNING Bicalutamid (CASODEX 1 )
EU RMP Läkemedelssubstans Bicalutamid Versionnummer 2 Datum 2 maj 2014 DEL VI: OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI: 2 DELOMRÅDEN AV EN OFFENTLIG SAMMANFATTNING Bicalutamid (CASODEX 1 )
Bipacksedel: Information till användaren
 Bipacksedel: Information till användaren Xylocain 5 mg/ml injektionsvätska, lösning Xylocain 10 mg/ml injektionsvätska, lösning Xylocain 20 mg/ml injektionsvätska, lösning Xylocain utan konserveringsmedel
Bipacksedel: Information till användaren Xylocain 5 mg/ml injektionsvätska, lösning Xylocain 10 mg/ml injektionsvätska, lösning Xylocain 20 mg/ml injektionsvätska, lösning Xylocain utan konserveringsmedel
En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Temozolomide Hosipra 5 mg hårda kapslar Temozolomid
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Temozolomide Hosipra 5 mg hårda kapslar Temozolomid Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. - Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Temozolomide Hosipra 5 mg hårda kapslar Temozolomid Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. - Spara denna information, du kan behöva
19.2.2014, version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Femoston 1/10 filmdragerad tablett Femoston 2/10 filmdragerad tablett Femoston Conti 1/5 filmdragerad tablett Femoston Conti 0,5/2,5 filmdragerad tablett 19.2.2014, version 1.0 OFFENTLIG SAMMANFATTNING
Femoston 1/10 filmdragerad tablett Femoston 2/10 filmdragerad tablett Femoston Conti 1/5 filmdragerad tablett Femoston Conti 0,5/2,5 filmdragerad tablett 19.2.2014, version 1.0 OFFENTLIG SAMMANFATTNING
Pregabalin Pfizer. 8.11.2013, version 10.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Pregabalin Pfizer 8.11.2013, version 10.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Epilepsi Epilepsi är en
Pregabalin Pfizer 8.11.2013, version 10.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Epilepsi Epilepsi är en
Behandling av prostatacancer
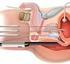 Behandling av prostatacancer Sammanfattning Prostatacancer är den vanligaste cancerformen hos män i Norden. Hög ålder, ärftlighet, viss geografisk och etnisk tillhörighet är riskfaktorer för att drabbas
Behandling av prostatacancer Sammanfattning Prostatacancer är den vanligaste cancerformen hos män i Norden. Hög ålder, ärftlighet, viss geografisk och etnisk tillhörighet är riskfaktorer för att drabbas
Artärer de ådror som för syresatt blod från lungorna ut i kroppen.
 Pressmaterial Ordlista Ablation en metod för behandling av förmaksflimmer som innebär att läkaren går in med en kateter från ljumsken till hjärtat och på elektrisk väg försöker häva störningen i hjärtats
Pressmaterial Ordlista Ablation en metod för behandling av förmaksflimmer som innebär att läkaren går in med en kateter från ljumsken till hjärtat och på elektrisk väg försöker häva störningen i hjärtats
Bipacksedel: Information till patienten
 Bipacksedel: Information till patienten Otezla 10 mg filmdragerade tabletter Otezla 20 mg filmdragerade tabletter Otezla 30 mg filmdragerade tabletter apremilast Detta läkemedel är föremål för utökad övervakning.
Bipacksedel: Information till patienten Otezla 10 mg filmdragerade tabletter Otezla 20 mg filmdragerade tabletter Otezla 30 mg filmdragerade tabletter apremilast Detta läkemedel är föremål för utökad övervakning.
2014-11-20. Namn Form Styrka Förp. Varunr AIP (SEK) AUP (SEK) Cometriq Kapsel, hård
 2014-11-20 1 (6) Vår beteckning SÖKANDE Swedish Orphan Biovitrum AB - 112 76 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, beslutar att nedanstående
2014-11-20 1 (6) Vår beteckning SÖKANDE Swedish Orphan Biovitrum AB - 112 76 Stockholm SAKEN Ansökan inom läkemedelsförmånerna BESLUT Tandvårds- och läkemedelsförmånsverket, TLV, beslutar att nedanstående
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN NeoRecormon Multidos 50 000 IE Frystorkat pulver och vätska till injektionsvätska, lösning (5000 IE/ml) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En injektionsflaska
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN NeoRecormon Multidos 50 000 IE Frystorkat pulver och vätska till injektionsvätska, lösning (5000 IE/ml) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En injektionsflaska
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Betnovat 0,1% salva Betnovat 0,1% kräm Betnovat 1 mg/ml kutan emulsion Betnovat 1 mg/ml kutan lösning
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Betnovat 0,1% salva Betnovat 0,1% kräm Betnovat 1 mg/ml kutan emulsion Betnovat 1 mg/ml kutan lösning betametason Läs noga igenom denna bipacksedel innan du börjar
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Betnovat 0,1% salva Betnovat 0,1% kräm Betnovat 1 mg/ml kutan emulsion Betnovat 1 mg/ml kutan lösning betametason Läs noga igenom denna bipacksedel innan du börjar
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Alendronat HEXAL Veckotablett 70 mg tabletter Alendronsyra
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Alendronat HEXAL Veckotablett 70 mg tabletter Alendronsyra Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. - Spara denna information,
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Alendronat HEXAL Veckotablett 70 mg tabletter Alendronsyra Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. - Spara denna information,
INFORMATION FÖR PATIENTER SOM FÅR XALKORI -BEHANDLING. Information om ALK-positiv lungcancer och läkemedelsbehandling med XALKORI
 INFORMATION FÖR PATIENTER SOM FÅR XALKORI -BEHANDLING Information om ALK-positiv lungcancer och läkemedelsbehandling med XALKORI 61890_Pfizer_Xalkori_potilaan_opas_A5_swe.indd 1 13.5.2016 13.00 FÖRORD
INFORMATION FÖR PATIENTER SOM FÅR XALKORI -BEHANDLING Information om ALK-positiv lungcancer och läkemedelsbehandling med XALKORI 61890_Pfizer_Xalkori_potilaan_opas_A5_swe.indd 1 13.5.2016 13.00 FÖRORD
Bipacksedel: Information till användaren. Imigran nässpray 10 mg och 20 mg. sumatriptan
 Bipacksedel: Information till användaren Imigran nässpray 10 mg och 20 mg sumatriptan Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för
Bipacksedel: Information till användaren Imigran nässpray 10 mg och 20 mg sumatriptan Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för
Bipacksedeln: Information till användaren. Sildenafil Anthrop 50 mg tuggtabletter Sildenafil Anthrop 100 mg tuggtabletter sildenafil
 Bipacksedeln: Information till användaren Sildenafil Anthrop 50 mg tuggtabletter Sildenafil Anthrop 100 mg tuggtabletter sildenafil Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel.
Bipacksedeln: Information till användaren Sildenafil Anthrop 50 mg tuggtabletter Sildenafil Anthrop 100 mg tuggtabletter sildenafil Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel.
Offentlig sammanfattning av riskhanteringsplanen för Repatha (evolocumab)
 EMA/577184/2015 Offentlig sammanfattning riskhanteringsplanen för Repatha (evolocumab) Detta är en sammanfattning riskhanteringsplanen (RMP) för Repatha, vilken beskriver de åtgärder som ska vidtas för
EMA/577184/2015 Offentlig sammanfattning riskhanteringsplanen för Repatha (evolocumab) Detta är en sammanfattning riskhanteringsplanen (RMP) för Repatha, vilken beskriver de åtgärder som ska vidtas för
