Guide för vårdpersonal
|
|
|
- Lucas Olofsson
- för 6 år sedan
- Visningar:
Transkript
1 Guide för vårdpersonal Användning av LEMTRADA (alemtuzumab) till patienter med skovvis förlöpande multipel skleros (RRMS) Viktig säkerhetsinformation
2
3 Innehållsförteckning 1. Introduktion till LEMTRADA 5 2. Vilka risker är förenade med användning av LEMTRADA? 7 3. Hantering av patienter som behandlas med LEMTRADA Vanliga frågor och svar 13 3
4 Översikt över LEMTRADA LEMTRADA (alemtuzumab) är indicerat för vuxna patienter med skovvis förlöpande multipel skleros (RRMS) med aktiv sjukdom som definieras av kliniska fynd eller bildfynd. Denna guideför hälso- och sjukvårdspersonal har utvecklats som en del av utbildningsprogrammet för LEMTRADA och är avsett för vårdpersonal som inleder och övervakar behandling med LEMTRADA. Denna guide är avsedd att förbättra hanteringen av LEMTRADA genom att verka för lämpliga handlingssätt. Den innehåller: 1. En beskrivning av de omedelbara och fördröjda risker som är förenade med användning av LEMTRADA och som kan uppkomma många år efter behandlingen och kan vara allvarliga eller livshotande, inklusive: > Allvarliga infektioner > Autoimmuna tillstånd > Tyreoidearubbningar > Immun trombocytopeni (ITP) > Nefropati, inklusive antiglomerulär basalmembranssjukdom 2. Rekommendationer om hur man minskar dessa risker genom lämplig patientrådgivning, säkerhetsuppföljning och behandling 3. Ett avsnitt med ofta ställda frågor. En checklista för förskrivare ska också användas första gången LEMTRADA förskrivs och vid patienternas säkerhetsuppföljningsbesök. Därtill har en patientguide och ett patientvarningskort utformats som ska ges till patienterna när behandling med LEMTRADA inleds. > Patientguiden: Läs igenom patientguiden noggrant tillsammans med patienten första gången LEMTRADA förskrivs, och regelbundet under säkerhetsuppföljningsbesök. Den är till för att informera patienter om symtom på autoimmuna tillstånd och allvarliga infektioner och för att göra patienterna medvetna om det absoluta behovet av att genomföra säkerhetsuppföljningen, vara uppmärksam på symtom och omedelbart uppsöka vård om symtom uppkommer. > Patientvarningskortet: ett förbindelseverktyg för att informera all hälso- och sjukvårdspersonal som vårdar patienter som får behandling med LEMTRADA. Patienten (eller vårdansvariga när det är ändamålsenligt) ska alltid ha med sig och visa detta kort för all hälsooch sjukvårdspersonal. Dessa material finns tillgängliga vid förfrågan på Sanofi, Läkemedelssäkerhet och information: eller tel: Observera att denna guide inte täcker alla de risker som är förenade med användning av LEMTRADA och att den inte ersätter produktresumén.
5 1> Introduktion till LEMTRADA LEMTRADA (alemtuzumab) är indicerat för vuxna patienter med skovvis förlöpande multipel skleros (RRMS) med aktiv sjukdom som definieras av kliniska fynd eller bildfynd. LEMTRADA är en monoklonal antikropp som administreras intravenöst. Den binder till CD52, en antigen som förekommer i höga nivåer på cellytan på T- och B-lymfocyter och i lägre nivåer på NK-celler, monocyter och makrofager. Den mekanism genom vilken LEMTRADA utövar dess terapeutiska effekter vid MS är inte helt klarlagd. Forskningen tyder dock på immunmodulerande effekter genom utarmning och återbildning av lymfocyter, inklusive: > Förändringar av antalet, proportionerna och egenskaperna hos vissa undergrupper av lymfocyter efter behandling. > Ökad förekomst av regulatoriska T-cellsundergrupper. > Ökad förekomst av minnes-t- och B-lymfocyter. > Övergående effekter på delar av den medfödda immuniteten (dvs. neutrofiler, makrofager, NK-celler). Minskningen av nivån av cirkulerande B- och T-celler till följd av LEMTRADA - behandling och den efterföljande återbildningen kan förklara den terapeutiska effekten. LEMTRADA ska initieras och övervakas av en neurolog med erfarenhet av behandling av multipel skleros (MS). För att minska möjliga risker med och biverkningar av LEMTRADA måste förskrivare och patienter förbinda sig till 48 månaders (4 års) säkerhetsuppföljning efter den sista LEMTRADA -infusionen. Det är viktigt att patienterna är införstådda med att de ska fortsätta med säkerhetsuppföljningen, även om de mår bra och deras MS-sjukdom är väl kontrollerad. Att skapa ett samarbete mellan din patient och hans/hennes vårdteam, tillsammans med noggrann genomgång av hur man använder verktygen i patientundervisning, hjälper din patient att: > Följa säkerhetsuppföljningsprogrammet med regelbundna tester. > Upptäcka och rapportera tecken eller symtom i god tid. > Vid behov erhålla snabb och korrekt behandling. 5
6 För mer information, se det avsnitt i denna guide som heter Hantering av patienter som behandlas med LEMTRADA. För att öka din förståelse för behandlingseffekternas varaktighet och den nödvändiga säkerhetsuppföljningens varaktighet, se Bild 1 och Tabell 1. Bild 1 - Översikt över LEMTRADA -behandling och uppföljning INITIALBEHANDLING MED TVÅ KURER Kur 1 5-dygnsbehandling 12 månader efter behandling kur 1 YTTERLIGARE BEHANDLINGSKURER VID BEHOV* Kur Minst Kur Minst Kur månader 4 efter efter 3-dygns- behandling 3-dygns- behandling 3-dygnsbehandling kur 2 behandling kur 3 behandling Påbörja blod- och urintest innan behandling Kontinuerligt pågående övervakning under fyra 4 år efter att den sista kuren avslutats *OBS En studie som följde patienter under 6 år efter första infusionen (kur 1) har visat på att majoritet av patienterna inte behöver ytterligare behandling efter de 2 inledande kurerna. Tabell 1 - Översikt över säkerhetsuppföljning för LEMTRADA Autoimmunt tillstånd Laboratorieprov Före behandling Varje månad Var tredje månad Fortsätter i 48 månader Tyreoidearubbning Funktionstester av sköldkörteln, såsom nivåer av tyreoideastimulerande hormon (TSH) X - X X ITP och andra cytopenier Fullständig blodstatus med differentialräkning X X - X Serumkreatinin X X - X Nefropatier, inklusive anti- GBM-sjukdom Urinanalys med mikroskopi X X - X 6
7 2> Vilka risker är förenade med användning av LEMTRADA? Observera att denna guide inte täcker alla de risker som är förenade med användning av LEMTRADA och att den inte ersätter produktresumén. Allvarliga infektioner Användning av LEMTRADA är förenat med risk för allvarliga infektioner. För att minimera risken är det viktigt att: > senarelägga initieringen av behandlingen hos patienter med aktiv infektion tills infektionen är utläkt > genomföra HIV-screening, utvärdera risken för både aktiv och inaktiv ( latent ) tuberkulos i enlighet med lokala riktlinjer, genomföra screening för hepatit B -virus (HBV) och hepatit C -virus (HCV) > genomföra screening för humant papillomavirus (HPV) och upprepa screeningen årligen. Överväg vaccination före behandling > slutföra vaccinationsprogram minst 6 veckor före behandling med LEMTRADA > rekommendera diet som förebygger listerios/listeria två veckor före, under och minst en månad efter infusion > behandling med profylax mot herpesinfektion ska inledas på dag 1 av behandlingen och fortsätta minst 1 månad efter varje behandling > undvik samtidig behandling med andra immunmodulerande läkemedel. Autoimmuna tillstånd LEMTRADA är förenat med risk för autoimmuna tillstånd, inklusive, i ordning av förekomst (vanligast till minst vanliga): a. Tyreoidearubbningar b. Immun trombocytopeni (ITP) c. Nefropatier, inklusive anti-gbm-sjukdom. 7
8 Dessa händelser kan vara allvarliga och leda till morbiditet och/eller mortalitet, och kan uppkomma upp till flera år efter behandlingen. Händelseuppföljning och tidig upptäckt kan förbättra utgången för patienter som drabbas av dessa händelser. Det är viktigt att noggrant följa upp laboratorievärden och vara uppmärksam på tecken och symtom. Läs igenom följande avsnitt noggrant för att få en ökad förståelse för dessa risker. a. Tyreoidearubbningar Under kliniska prövningar har autoimmuna tyreoidearubbningar, inklusive hypertyreos och hypotyreos, rapporterats. Tyreoidearubbningar var mycket vanligt förekommande i kliniska prövningar, de flesta fallen var av lindrig till måttlig svårighetsgrad och uppkom inom 48 månader efter exponeringen för LEMTRADA. Vissa fall var övergående och krävde ingen behandling. De flesta tyreoideasjukdomarna hanterades med konventionell medicinsk behandling, men vissa patienter behövde genomgå kirurgiska ingrepp. Det är viktigt att informera patienten om att de, beroende på typ av tyreoidearubbning, kan behöva livslång behandling. > Tyreoideafunktionsprover så som nivåer av tyreoideastimulerande hormon (TSH) ska kontrolleras före insättande av behandling och därefter var tredje månad i 48 månader efter den sista infusionen. Om TSH-nivåerna är onormala ska fritt T3 och T4 mätas. > Var dessutom uppmärksam på tecken och symtom på tyreoidearubbningar. > Tyreoideasjukdom utgör en särskild risk hos kvinnor som blir gravida. Obehandlad tyreoideasjukdom kan skada det ofödda och det nyfödda barnet. Särskild försiktighet ska iakttas för gravida kvinnor med Basedows sjukdom (även känd som Graves sjukdom), eftersom tyreoideastimulerande hormonreceptorantikroppar hos modern kan överföras till ett växande foster och orsaka övergående neonatal Basedows sjukdom. Den läkare och övrig vårdpersonal som är involverad i patientens graviditet måste göras medveten om den ökade risken för tyreoideasjukdom beroende på patientens LEMTRADA -behandling, och behovet av korrekt behandling av denna. 8
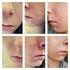
9 b. Immun trombocytopeni (ITP) Immun trombocytopeni är ett autoimmunt tillstånd vanligen förenad med autoantikroppar riktade mot trombocyterna. Det är ett kliniskt syndrom där en minskning av nivån av cirkulerande trombocyter (trombocytopeni) visar sig som att man lätt börjar blöda, har en benägenhet att få blåmärken (purpura) eller extravasation av blod från kapillärer till hud och slemhinnor (petekier). Se Bild 2 för exempel på ITP. Symtom på ITP kan inkludera (men är inte begränsade till) benägenhet för blåmärken, ökad blödningsbenägenhet, ovanligt riklig eller oregelbunden menstruation. Dessa kliniska tecken på ITP kan eventuellt uppkomma innan allvarlig blödning utvecklas. ITP kan vara en allvarlig sjukdom som leder till morbiditet och mortalitet, och kan uppkomma upp till flera år efter behandlingen. I kliniska prövningar diagnostiserades och behandlades patienter med ITP i rätt tid och svarade i de flesta fall på första linjens behandling. Det är viktigt att följa upp samtliga patienter med avseende på ITP enligt följande: > Fullständigt blodstatus med differentialräkning ska kontrolleras före insättande av behandling och därefter varje månad i 48 månader efter den sista infusionen. > Undersök patienten efter kliniska symtom på ITP. > Informera patienten om behovet av att lämna blodprover varje månad och behovet av att fortsätta under 48 månader efter sin sista infusion. > Utbilda patienten i hur man känner igen symtom på ITP och betona behovet av att förbli uppmärksam på dessa. > Vid misstänkt ITP ska lämplig medicinsk behandling sättas in omedelbart, inklusive omedelbar remittering till hematolog. Allvarlig eller utbredd blödning är livshotande och kräver omedelbar vård. Se avsnitt 3 Hantering av patienter som behandlas med LEMTRADA för viktig information om en säker användning av detta läkemedel. Den potentiella risken med fortsatt behandling med LEMTRADA efter förekomst av ITP är okänd. 9
10 Bild 2 - Exempel på ITP Purpura Detta är ett exempel på ett ben med benägenhet för eller omfattande blåmärken. Lokalisation Detta kan förekomma var som helst på patientens kropp, inte enbart på benen. Petekier Detta är ett exempel på ben med petekier och purpura. Petekier är små, spridda, nålsticksliknande prickar under huden som är röda, rosa eller lila. Lokalisation Detta kan förekomma var som helst på patientens kropp. Exempel på purpura under tungan. Lokalisation Petekier och purpura kan förekomma på alla slemhinnor, inklusive var som helst i munnen (under tungan, i gommen, på insidan av kinden, tungan, tandköttet). OBS: Dessa bilder är bara exempel på blåmärken/petekier. Patienten kan ha en mindre allvarlig typ av blåmärken/petekier än dessa bilder visar och fortfarande ha ITP. 10
11 c. Nefropatier, inklusive anti-gbm-sjukdom Nefropati, inklusive anti-gbm-sjukdom, har i sällsynta fall rapporterats efter behandling med LEMTRADA hos patienter med MS i kliniska prövningar och uppkom vanligtvis inom 39 månader efter den sista behandlingen med LEMTRADA. Kliniska manifestationer av nefropati kan omfatta förhöjt serumkreatinin, hematuri och/eller proteinuri. Även om det inte observerats i kliniska prövningar, kan alveolär blödning manifesterad som hemoptys förekomma vid anti-gbm-sjukdom (Goodpastures syndrom). Eftersom patienten kan vara asymtomatisk, är det viktigt att utföra regelbundna laboratorierprover. > Serumkreatininnivåer ska mätas innan insättande av behandling och därefter varje månad i 48 månader efter den sista infusionen. För menstruerande kvinnor ska hänsyn tas till tidpunkten för urinanalys för att undvika falskt positiva resultat. > Urinanalys och mikroskopi ska göras före insättande av behandling och därefter varje månad i 48 månader efter den sista infusionen. Efter denna period, ska ytterligare prov utföras om kliniska fynd indikativa för nefropatier förekommer. > Observation av kliniskt signifikanta förändringar i serumkreatinin jämfört med utgångsvärdet, oförklarlig hematuri och/eller proteinuri ska föranleda omedelbar ytterligare bedömning med avseende på nefropatier, inklusive remittering till nefrolog. Tidig upptäckt och behandling av nefropatier kan minska risken för dåliga behandlingsresultat. Anti-GBM-sjukdom är livshotande om den inte behandlas och kräver därför omedelbar vård. Utan omedelbar behandling kan patienten snabbt utveckla njursvikt som kräver dialys och/eller transplantation och kan vara livshotande. Rapportering av misstänkta biverkningar Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till följande: > Fimea, Biverkningsregistret, PB 55, FIMEA, eller > Sanofi Oy, pharmacovigilance.finland@sanofi.com, tel:
12 3> Hantering av patienter som behandlas med LEMTRADA > Det är mycket viktigt att patienten är införstådd med åtagandet att lämna regelbundna prover (under 48 månader efter den sista LEMTRADA -infusionen), även om patienten är asymtomatisk och dennes MS-sjukdom är under kontroll. > Du måste tillsammans med patienten planera och hantera den regelbundna säkerhetsuppföljningen. > Om patienten inte följer rekommendationerna kan det behövas ytterligare rådgivning för att lyfta fram riskerna med att missa planerade säkerhetsuppföljningsprover. > Du måste utvärdera provresultaten och vara uppmärksam på symtom på biverkningar. > Gå igenom patientguiden och bipacksedeln för LEMTRADA med din patient vid första förskrivningen och regelbundet under säkerhetsuppföljningsbesöken. Patienten måste informeras om risker och fördelar med behandlingen före behandlingen. Påminn patienten om att vara uppmärksam på symtom på autoimmuna tillstånd och att söka vård vid eventuell oro. > Uppmuntra patienten att alltid bära med sig sitt patientvarningskort. Patienterna ska visa sitt patientvarningskort till all hälso- och sjukvårdspersonal som vårdar dem oavsett orsak, och i synnerhet vid akuta sjukdomsfall. > Specialister och utrustning för snabb diagnos och hantering av de vanligaste biverkningarna, framför allt autoimmuna tillstånd och infektioner ska finnas tillgängliga. 12
13 4> Vanliga frågor och svar Beakta följande innan du förskriver LEMTRADA : Vilka laboratorieprover behöver utföras innan behandling med LEMTRADA påbörjas? De prover som behöver tas är: > Fullständigt blodstatus med differentialräkning > Serumkreatinin > Urinanalys med mikroskopi > Tyreoideafunktionsprover, t.ex. TSH. Mer information finns i Tabell 1 - Översikt över säkerhetsuppföljning för LEMTRADA. Kan jag förskriva LEMTRADA till patienter som får andra behandlingar för MS? LEMTRADA har inte administrerats för behandling av MS samtidigt med immunsuppressiva behandlingar. Som med andra immunsuppressiva behandlingar ska potentiella kombinationseffekter på patientens immunsystem tas med i beräkningen när administrering av LEMTRADA övervägs. Samtidig användning av LEMTRADA med någon av dessa behandlingar kan öka risken för immunsuppression. Sekventiell användning av LEMTRADA efter andra sjukdomsmodifierade behandlingar för MS ska utföras i enlighet med produktresumén för LEMTRADA och/eller behandlingen ifråga. Ska jag fortsätta kontrollera laboratorieprover under och efter behandling med LEMTRADA? Under hur lång tid? Ja. Provtagning påbörjas innan initiering av behandling (utgångsvärde) och proverna ska fortsätta att kontrolleras under 48 månader efter den sista infusionen. Information om vilka prover som ska kontrolleras, när och under hur lång tid finns i Översikt över säkerhetsuppföljning för LEMTRADA. Vad gör jag om min patient har en infektion när jag vill påbörja en behandlingskur med LEMTRADA? Senarelägg insättandet av behandling med LEMTRADA till patienter med aktiv infektion tills infektionen är utläkt. HIV-infektion är en kontraindikation för användning av LEMTRADA. 13
14 Behandling Hur administreras LEMTRADA och hur lång tid tar infusionen? Initial behandling med LEMTRADA administreras som intravenös infusion under två årliga behandlingskurer. Den förstabehandlingskuren består av en daglig infusion under en period av 5 på varandra följande dagar. Den andra behandlingskuren administreras 12 månader senare och består av en daglig infusion under en period av 3 på varandra följande dagar. Hos patienter med aktiv MS, som definieras av kliniska fynd eller bildfynd, kan vid behov ytterligare en tredje och fjärde behandlingskur övervägas. Dessa består då av en daglig infusion under en period av 3 på varandra följande dagar och administreras minst 12 månader efter den föregående behandlingskuren. Om en infusionsrelaterad reaktion inträffar ska lämplig symtomatisk behandling ges efter behov. Om infusionen inte tolereras väl kan infusionstiden förlängas. Om allvarliga infusionsrelaterade reaktioner inträffar, ska omedelbart utsättande av infusionen övervägas. I de kliniska prövningarna var anafylaxi eller allvarliga reaktioner som krävde utsättande av behandlingen mycket sällsynta. Resurser för behandling av anafylaxi eller allvarliga reaktioner måste finnas tillgängliga. Läkaren ska känna till patientens hjärtanamnes eftersom infusionsrelaterade reaktioner kan omfatta hjärtsymtom så som bradykardi och takykardi. Resurser för behandling av anafylaxi eller allvarliga reaktioner måste finnas tillgängliga. Finns det någon profylaktisk behandling som ska tas? Patienten ska premedicineras med kortikosteroider (1 000 mg metylprednisolon eller motsvarande) omedelbart före administrering av LEMTRADA under de första 3 dagarna i varje behandlingskur. Dessutom kan premedicinering med antihistaminer och/eller antipyretika före administrering av LEMTRADA övervägas. Oral profylax mot herpesinfektion ska administreras till alla patienter under behandlingen och under minst en månad efter behandlingen. I kliniska prövningar administrerades 200 mg aciklovir [eller motsvarande] två gånger dagligen till patienterna. Säkerhetsuppföljning av biverkningar Vilka är tecknen och symtomen på ITP? Symtom på ITP kan inkludera (men är inte begränsade till) att patienten lätt får blåmärken, petekier, spontan mukokutan blödning (t.ex. näsblödning, blodiga upphostningar), kraftigare än normalt eller oregelbunden mensblödning. Dessa kliniska tecken på ITP kan uppkomma innan allvarliga blödningar utvecklas. Lågt antal trombocyter eller kliniskt signifikanta förändringar från utgångsvärdet kan också vara ett tecken på ITP. Se Bild 2 för ytterligare detaljer. 14
15 Hur ska jag behandla en patient med misstänkt ITP? Det är viktigt att följa upp samtliga patienter med avseende på ITP så att patienten diagnostiseras och behandlas i rätt tid. Därför ska fullständigt blodstatus kontrolleras före insättande av behandling och därefter varje månad i 48 månader efter den sista infusionen. Vid misstänkt ITP ska komplett blodstatus omgående tas. Om ITP diagnostiseras ska lämplig medicinsk behandling sättas in omedelbart, inklusive omedelbar remittering till hematolog. Allvarlig eller utbredd blödning är livshotande och kräver omedelbar vård. Vilka symtom kan vara förenade med nefropati, t.ex. anti-gbm? Manifestationer av nefropati kan omfatta förhöjt serumkreatinin, hematuri och/eller proteinuri. Även om det inte observerats i kliniska prövningar, kan alveolär blödning manifesterad som hemoptys förekomma vid anti-gbm-sjukdom. Eftersom patienten kan vara asymtomatisk, är det viktigt att utföra regelbundna laboratoriebprover (serumkreatinin och urinanalys med mikroskopi). Hur ska jag behandla en patient med misstänkt nefropati? Observation av kliniskt signifikanta förändringar från utgångsvärdet av serumkreatinin och/eller proteinuri ska föranleda ytterligare utredning avseende nefropati inklusive omedelbar remiss till specialist. Tidig upptäckt och behandling av nefropatier kan minska risken för allvarligt utfall. Rådgivning gällande graviditet, preventivmedel och amning Ska kvinnliga patienter använda preventivmedel? Alfa-halveringstiden för alemtuzumab var 4 5 dagar och var jämförbar mellan behandlingskurerna och ledde till låga eller icke detekterbara serumkoncentrationer inom cirka 30 dagar efter varje behandlingskur. Därför ska fertila kvinnor använda effektiva preventivmedel under behandlingen och under 4 månader efter varje avslutad behandlingskur med LEMTRADA. Observera att en fullständig behandling med LEMTRADA består av två kurer med 12 månaders mellanrum. Fertila kvinnor ska uppmärksammas på detta och avrådas från att sluta använda preventivmedel mellan de två behandlingskurerna. Kan LEMTRADA administreras under graviditet? LEMTRADA ska administreras under graviditet endast då de potentiella fördelarna överväger den eventuella risken för fostret. Det är känt att humant IgG passerar placentabarriären. Alemtuzumab skulle därför kunna passera placentabarriären och eventuellt utgöra en risk för fostret. Det är inte känt om LEMTRADA kan orsaka fosterskador när det ges till gravida kvinnor eller om det kan påverka reproduktionsförmågan. 15
16 Tyreoidearubbningar innebär särskilda risker för gravida kvinnor. Vid obehandlad hypotyreos under graviditet föreligger en ökad risk för missfall och skador på fostret, såsom mental retardation och dvärgväxt. Hos mödrar med Graves sjukdom kan tyreoideastimulerande hormonreceptorantikroppar hos modern överföras till ett växande foster och orsaka övergående neonatal Graves sjukdom. Hur lång tid ska kvinnor vänta efter en behandlingskur med LEMTRADA om de vill skaffa barn? Eftersom kvinnor ska använda effektiva preventivmedel i 4 månader efter varje behandlingskur med LEMTRADA ska de vänta minst 4 månader innan de försöker bli gravida. Observera att en fullständig behandling med alemtuzumab består av två kurer med 12 månaders mellanrum. Fertila kvinnor ska uppmärksammas på detta och avrådas från att sluta använda preventivmedel mellan de två behandlingskurerna. Kommer LEMTRADA att påverka kvinnans eller mannens framtida fertilitet? Det finns inte tillräckliga kliniska säkerhetsdata om effekterna av LEMTRADA på fertilitet. I en delstudie på 13 manliga patienter som behandlades med alemtuzumab (behandlade med antingen 12 mg eller 24 mg) sågs inga tecken på aspermi, azoospermi, bestående minskat antal spermier, störningar av motilitet eller en ökning av morfologiska abnormiteter hos spermierna. Det är känt att CD52 förekommer i reproduktiv vävnad hos människa och gnagare. Djurdata har visat effekter på fertiliteten hos humaniserade möss, men baserat på tillgängliga data är en potentiell påverkan på humanfertilitet under exponeringen okänd (se avsnitt 5.3 i produktresumén). Bör en patient som ammar genomgå en behandlingskur med LEMTRADA? Det är inte känt om alemtuzumab utsöndras i bröstmjölk. En risk för det ammande barnet kan inte uteslutas. Amning ska därför avbrytas under varje behandlingskur med LEMTRADA samt under 4 månader efter den sista infusionen i varje behandlingskur. Dock kan fördelarna med att få immunitet genom bröstmjölk uppväga riskerna för potentiell exponering för LEMTRADA för det ammande barnet. 16 Vaccinationer Vilka överväganden ska göras avseende vaccinationer då behandling med LEMTRADA övervägs? Eftersom säkerheten vid immunisering med levande virusvacciner efter en behandlingskur med LEMTRADA inte har studerats (formellt), ska levande virusvacciner inte administreras till patienter som nyligen har fått en behandlingskur med LEMTRADA. Det rekommenderas att patienterna är fullt vaccinerade (enligt nationella riktlinjer) minst 6 veckor innan behandlingen med LEMTRADA påbörjas. Varicella zoster-virus (VZV)-vaccination ska övervägas till antikroppsnegativa patienter före behandling med LEMTRADA.
17 Anteckningar 17
18 18 Anteckningar
19
20 GZFI.LEMT a, godkänt (Fimea) Sanofi Oy tel: ,
Guide för vårdpersonal
 Guide för vårdpersonal Användning av LEMTRADA (alemtuzumab) till patienter med skovvis förlöpande multipel skleros (RRMS) Viktig säkerhetsinformation Granskad av Läkemedelsverket: Mars 2018. Detta läkemedel
Guide för vårdpersonal Användning av LEMTRADA (alemtuzumab) till patienter med skovvis förlöpande multipel skleros (RRMS) Viktig säkerhetsinformation Granskad av Läkemedelsverket: Mars 2018. Detta läkemedel
Patientguide. Viktig information till dig som påbörjar behandling med LEMTRADA
 Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Innehållsförteckning 1> Presentation av LEMTRADA? 04 2> Översikt över behandling med LEMTRADA 04 3> Biverkningar 07 4> Övrig
Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Innehållsförteckning 1> Presentation av LEMTRADA? 04 2> Översikt över behandling med LEMTRADA 04 3> Biverkningar 07 4> Övrig
Patientguide. Viktig information till dig som påbörjar behandling med LEMTRADA
 Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Innehållsförteckning 1> Vad är LEMTRADA och hur fungerar det? 3 2> Översikt över behandling med LEMTRADA 4 3> Biverkningar
Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Innehållsförteckning 1> Vad är LEMTRADA och hur fungerar det? 3 2> Översikt över behandling med LEMTRADA 4 3> Biverkningar
Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA
 Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Granskad av Läkemedelsverket: Mars 2018. Innehållsförteckning Introduktion till LEMTRADA...3 Översikt över behandling med LEMTRADA...4
Patientguide Viktig information till dig som påbörjar behandling med LEMTRADA Granskad av Läkemedelsverket: Mars 2018. Innehållsförteckning Introduktion till LEMTRADA...3 Översikt över behandling med LEMTRADA...4
FÖRSKRIVNINGSGUIDE MAVENCLAD. Riskhanteringsplan för kladribin (MAVENCLAD), version 1.0 Godkänt av Fimea
 MAVENCLAD FÖRSKRIVNINGSGUIDE RISKHANTERINGS SKOLNINGSMATERIAL - FI/CLA/1117/0051 Innehåll Introduktion till MAVENCLAD Behandlingsregimer Övervakning under behandling Antalet lymfocyter Allvarliga infektioner
MAVENCLAD FÖRSKRIVNINGSGUIDE RISKHANTERINGS SKOLNINGSMATERIAL - FI/CLA/1117/0051 Innehåll Introduktion till MAVENCLAD Behandlingsregimer Övervakning under behandling Antalet lymfocyter Allvarliga infektioner
LEMTRADA 12 mg koncentrat till infusionsvätska, lösning (alemtuzumab)
 Bipacksedel LEMTRADA 12 mg koncentrat till infusionsvätska, lösning (alemtuzumab) t Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Bipacksedel LEMTRADA 12 mg koncentrat till infusionsvätska, lösning (alemtuzumab) t Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Guide för vårdpersonal
 Guide för vårdpersonal Användning av LEMTRADA (alemtuzumab) till patienter med skovvis förlöpande multipel skleros (RRMS) Viktig säkerhetsinformation Innehållsförteckning 1> Introduktion till LEMTRADA
Guide för vårdpersonal Användning av LEMTRADA (alemtuzumab) till patienter med skovvis förlöpande multipel skleros (RRMS) Viktig säkerhetsinformation Innehållsförteckning 1> Introduktion till LEMTRADA
Riskhanteringsplan för kladribin (MAVENCLAD), version 1.0 Godkänt av Fimea PATIENTGUIDE
 MAVENCLAD PATIENTGUIDE RISKHANTERINGS SKOLNINGSMATERIAL - FI/CLA/1117/0052 Viktig information för patienter som påbörjar behandling med MAVENCLAD Innehåll Introduktion till MAVENCLAD Hur ges behandling
MAVENCLAD PATIENTGUIDE RISKHANTERINGS SKOLNINGSMATERIAL - FI/CLA/1117/0052 Viktig information för patienter som påbörjar behandling med MAVENCLAD Innehåll Introduktion till MAVENCLAD Hur ges behandling
Till dig som ska behandlas med TECENTRIQ q
 Till dig som ska behandlas med TECENTRIQ q qdetta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera nysäkerhetsinformation. Du kan hjälpa till genom
Till dig som ska behandlas med TECENTRIQ q qdetta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera nysäkerhetsinformation. Du kan hjälpa till genom
Information till dig som blivit ordinerad
 Information till dig som blivit ordinerad Vad är multipel skleros? Den här broschyren är ett komplement till den information du fått av din neurolog och MSsjuksköterska om LEMTRADA. Informationen är avsedd
Information till dig som blivit ordinerad Vad är multipel skleros? Den här broschyren är ett komplement till den information du fått av din neurolog och MSsjuksköterska om LEMTRADA. Informationen är avsedd
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
Behandlingsguide Information till patienten
 Behandlingsguide Information till patienten Viktig säkerhetsinformation för att minimera risken för immunrelaterade biverkningar Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra
Behandlingsguide Information till patienten Viktig säkerhetsinformation för att minimera risken för immunrelaterade biverkningar Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra
, version V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Entecavir STADA 0,5 mg och 1 mg filmdragerade tabletter 14.6.2016, version V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Entecavir Stada 0,5 mg filmdragerade
Entecavir STADA 0,5 mg och 1 mg filmdragerade tabletter 14.6.2016, version V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Entecavir Stada 0,5 mg filmdragerade
Komponenter till en offentlig sammanfattning. Översikt över sjukdomsepidemiologi
 VI.2 VI.2.1 Komponenter till en offentlig sammanfattning Översikt över sjukdomsepidemiologi Gauchers sjukdom är en sällsynt genetisk sjukdom orsakad av avsaknad av ett specifikt enzym i kroppen. Omkring
VI.2 VI.2.1 Komponenter till en offentlig sammanfattning Översikt över sjukdomsepidemiologi Gauchers sjukdom är en sällsynt genetisk sjukdom orsakad av avsaknad av ett specifikt enzym i kroppen. Omkring
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN LEMTRADA 12 mg koncentrat till infusionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 12 mg alemtuzumab i
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN LEMTRADA 12 mg koncentrat till infusionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 12 mg alemtuzumab i
INNEHÅLL 1. Läkemedlets namn 2. Kvalitativ och kvantitativ sammansättning 3. Läkemedelsform 4. Kliniska uppgifter 5. Farmakologiska egenskaper
 Produktresumé INNEHÅLL 1. Läkemedlets namn 2. Kvalitativ och kvantitativ sammansättning 3. Läkemedelsform 4. Kliniska uppgifter 4.1 Terapeutiska indikationer 4.2 Dosering och administreringssätt 4.3 Kontraindikationer
Produktresumé INNEHÅLL 1. Läkemedlets namn 2. Kvalitativ och kvantitativ sammansättning 3. Läkemedelsform 4. Kliniska uppgifter 4.1 Terapeutiska indikationer 4.2 Dosering och administreringssätt 4.3 Kontraindikationer
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN LEMTRADA 12 mg koncentrat till infusionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 12 mg alemtuzumab i
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN LEMTRADA 12 mg koncentrat till infusionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 12 mg alemtuzumab i
Din vägledning för. Information till patienter
 Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Patient-/vårdgivarguide
 Patient-/vårdgivarguide HEMLIBRA (emicizumab) Subkutan injektion Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du
Patient-/vårdgivarguide HEMLIBRA (emicizumab) Subkutan injektion Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du
Skärpta rekommendationer avseende risken för allvarliga överkänslighetsreaktioner vid användning av Rienso (ferumoxytol)
 8 januari 2014 Skärpta rekommendationer avseende risken för allvarliga överkänslighetsreaktioner vid användning av Rienso (ferumoxytol) Bästa hälso- och sjukvårdspersonal, I oktober 2013 skickades ett
8 januari 2014 Skärpta rekommendationer avseende risken för allvarliga överkänslighetsreaktioner vid användning av Rienso (ferumoxytol) Bästa hälso- och sjukvårdspersonal, I oktober 2013 skickades ett
Komponenter till en offentlig sammanfattning. Översikt över sjukdomsepidemiologi
 VI.2 VI.2.1 Komponenter till en offentlig sammanfattning Översikt över sjukdomsepidemiologi Gauchers sjukdom är en sällsynt genetisk sjukdom orsakad av avsaknad av ett specifikt enzym i kroppen. Omkring
VI.2 VI.2.1 Komponenter till en offentlig sammanfattning Översikt över sjukdomsepidemiologi Gauchers sjukdom är en sällsynt genetisk sjukdom orsakad av avsaknad av ett specifikt enzym i kroppen. Omkring
Naproxen Orion 25 mg/ml oral suspension , Version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Naproxen Orion 25 mg/ml oral suspension 26.10.2015, Version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Naproxen
Naproxen Orion 25 mg/ml oral suspension 26.10.2015, Version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Naproxen
KANUMA: INFORMATION FÖR SJUKVÅRDSPERSONAL
 KANUMA: INFORMATION FÖR SJUKVÅRDSPERSONAL KANUMA 2 mg/ml koncentrat till infusionsvätska (sebelipas alfa) Viktig säkerhetsinformation: Detta läkemedel är föremål för utökad övervakning. Detta kommer att
KANUMA: INFORMATION FÖR SJUKVÅRDSPERSONAL KANUMA 2 mg/ml koncentrat till infusionsvätska (sebelipas alfa) Viktig säkerhetsinformation: Detta läkemedel är föremål för utökad övervakning. Detta kommer att
Din vägledning för KEYTRUDA
 Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Behandlingsguide för patienter
 MITOXANTRON Behandlingsguide för patienter Viktig obligatorisk information om riskminimering för patienter som börjar med NOVANTRONE (mitoxantron) för behandling av högaktiv recidiverande multipel skleros
MITOXANTRON Behandlingsguide för patienter Viktig obligatorisk information om riskminimering för patienter som börjar med NOVANTRONE (mitoxantron) för behandling av högaktiv recidiverande multipel skleros
MabThera (rituximab) patientinformation
 MabThera (rituximab) patientinformation Du som lever med reumatoid artrit, RA, har antagligen redan genomgått en hel del olika behandlingsformer. Nu har din läkare ordinerat MabThera (rituximab) för din
MabThera (rituximab) patientinformation Du som lever med reumatoid artrit, RA, har antagligen redan genomgått en hel del olika behandlingsformer. Nu har din läkare ordinerat MabThera (rituximab) för din
Gul till brun viskös lösning med apelsinsmak. Partiklar från växtmaterial kan förekomma.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
Bipacksedel: Information till patienten. Teceos 13 mg beredningssats för radioaktivt läkemedel. tetranatriumbutedronat
 Bipacksedel: Information till patienten Teceos 13 mg beredningssats för radioaktivt läkemedel tetranatriumbutedronat Läs noga igenom denna bipacksedel innan du ges detta läkemedel. Den innehåller information
Bipacksedel: Information till patienten Teceos 13 mg beredningssats för radioaktivt läkemedel tetranatriumbutedronat Läs noga igenom denna bipacksedel innan du ges detta läkemedel. Den innehåller information
Din guide till YERVOY (ipilimumab)
 Detta utbildningsmaterial är obligatoriskt enligt ett villkor i godkännandet för försäljning av YERVOY TM för att ytterligare minimera särskilda risker. Din guide till YERVOY (ipilimumab) Patientbroschyr
Detta utbildningsmaterial är obligatoriskt enligt ett villkor i godkännandet för försäljning av YERVOY TM för att ytterligare minimera särskilda risker. Din guide till YERVOY (ipilimumab) Patientbroschyr
PATIENT- INFORMATIONS- BROSCHYR
 PATIENT- INFORMATIONS- BROSCHYR Valproat* (Absenor, Deprakine, Orfiril, ) Preventivmedel och graviditet: Vad du behöver veta Denna broschyr är för dig som är flicka eller kvinna och behandlas med något
PATIENT- INFORMATIONS- BROSCHYR Valproat* (Absenor, Deprakine, Orfiril, ) Preventivmedel och graviditet: Vad du behöver veta Denna broschyr är för dig som är flicka eller kvinna och behandlas med något
BILAGA III ÄNDRINGAR TILL PRODUKTRESUMÉ OCH BIPACKSEDEL
 BILAGA III ÄNDRINGAR TILL PRODUKTRESUMÉ OCH BIPACKSEDEL Dessa ändringar i produktresumé och bipacksedel är giltiga vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer medlemsstaternas
BILAGA III ÄNDRINGAR TILL PRODUKTRESUMÉ OCH BIPACKSEDEL Dessa ändringar i produktresumé och bipacksedel är giltiga vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer medlemsstaternas
XGEVA. (denosumab) PATIENTGUIDE
 XGEVA (denosumab) PATIENTGUIDE INNEHÅLL Innehållsförteckning 2 Varför får du XGEVA 3 Innan och under behandling med XGEVA 5 Graviditet och amning 8 Biverkningar av XGEVA 8 Bra att komma ihåg 10 Ge detta
XGEVA (denosumab) PATIENTGUIDE INNEHÅLL Innehållsförteckning 2 Varför får du XGEVA 3 Innan och under behandling med XGEVA 5 Graviditet och amning 8 Biverkningar av XGEVA 8 Bra att komma ihåg 10 Ge detta
FRÅGOR OCH SVAR FÖR SJUKVÅRDSPERSONAL. VFEND (vorikonazol) oralt/intravenöst
 & FRÅGOR OCH SVAR FÖR SJUKVÅRDSPERSONAL VFEND (vorikonazol) oralt/intravenöst INNEHÅLL 1 Vad är syftet med denna broschyr?... 3 2 Vad är VFEND?... 3 3 Vad behöver jag veta om den risk för fototoxicitet
& FRÅGOR OCH SVAR FÖR SJUKVÅRDSPERSONAL VFEND (vorikonazol) oralt/intravenöst INNEHÅLL 1 Vad är syftet med denna broschyr?... 3 2 Vad är VFEND?... 3 3 Vad behöver jag veta om den risk för fototoxicitet
Cortiment , version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Cortiment 26.11.2013, version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Ulcerös kolit Ulcerös kolit är
Cortiment 26.11.2013, version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Ulcerös kolit Ulcerös kolit är
VORICONAZOLE ACTAVIS (vorikonazol) oralt
 VORICONAZOLE ACTAVIS (vorikonazol) oralt Broschyr med frågor och svar för sjukvårdspersonal Innehåll 1. VAD ÄR SYFTET MED DEN HÄR BROSCHYREN?...6 2. VAD ÄR VORICONAZOLE ACTAVIS?...6 3. VAD BÖR JAG KÄNNA
VORICONAZOLE ACTAVIS (vorikonazol) oralt Broschyr med frågor och svar för sjukvårdspersonal Innehåll 1. VAD ÄR SYFTET MED DEN HÄR BROSCHYREN?...6 2. VAD ÄR VORICONAZOLE ACTAVIS?...6 3. VAD BÖR JAG KÄNNA
Patientbroschyr. Vad du bör känna till om MabThera. Viktig säkerhetsinformation för patienter som får behandling med MabThera
 Patientbroschyr Vad du bör känna till om MabThera Viktig säkerhetsinformation för patienter som får behandling med MabThera Denna broschyr innehåller viktig säkerhetsinformation. Läs MabTheras produktresumé
Patientbroschyr Vad du bör känna till om MabThera Viktig säkerhetsinformation för patienter som får behandling med MabThera Denna broschyr innehåller viktig säkerhetsinformation. Läs MabTheras produktresumé
Toctino (alitretinoin)
 PATIENTINFORMATIONSBROSCHYR Toctino (alitretinoin) Graviditetsförebyggande program TOC-FI-002-051208-D Om denna broschyr Denna broschyr innehåller viktig information rörande din behandling med Toctino
PATIENTINFORMATIONSBROSCHYR Toctino (alitretinoin) Graviditetsförebyggande program TOC-FI-002-051208-D Om denna broschyr Denna broschyr innehåller viktig information rörande din behandling med Toctino
VIKTIG SÄKERHETSINFORMATION FÖR PATIENTER SOM BEHANDLAS MED RIXATHON (RITUXIMAB)
 (RITUXIMAB) INFORMATIONSBROSCHYR FÖR PATIENTER VID ICKE-ONKOLOGISKA INDIKATIONER Detta läkemedel är föremål för utökad övervakning. rituksimabi Godkänd av Fimea, juli/2018 2 3 VAD DU BÖR VETA OM RIXATHON
(RITUXIMAB) INFORMATIONSBROSCHYR FÖR PATIENTER VID ICKE-ONKOLOGISKA INDIKATIONER Detta läkemedel är föremål för utökad övervakning. rituksimabi Godkänd av Fimea, juli/2018 2 3 VAD DU BÖR VETA OM RIXATHON
PATIENTINFORMATION FRÅN SANOFI GENZYME. Information till dig som blivit ordinerad Aubagio (teriflunomid)
 PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad Aubagio (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad Aubagio (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
ARAVA (leflunomid) Särskild säkerhetsinformation till förskrivare
 ARAVA (leflunomid) Särskild säkerhetsinformation till förskrivare Arava (leflunomid) är ett immunomodulerande antireumatiskt läkemedel (DMARD; disease-modifying antirheumatic drug) indicerat för behandling
ARAVA (leflunomid) Särskild säkerhetsinformation till förskrivare Arava (leflunomid) är ett immunomodulerande antireumatiskt läkemedel (DMARD; disease-modifying antirheumatic drug) indicerat för behandling
AMGEVITA (adalimumab)
 AMGEVITA (adalimumab) Patientkort Detta kort innehåller viktig säkerhetsinformation om AMGEVITA. Du ska: Visa kortet för läkare eller övrig hälso- och sjukvårdspersonal du träffar, för att de ska få veta
AMGEVITA (adalimumab) Patientkort Detta kort innehåller viktig säkerhetsinformation om AMGEVITA. Du ska: Visa kortet för läkare eller övrig hälso- och sjukvårdspersonal du träffar, för att de ska få veta
Läkarens guide för att bedöma och kontrollera kardiovaskulär risk vid förskrivning av Atomoxetin Mylan
 Läkarens guide för att bedöma och kontrollera kardiovaskulär risk vid förskrivning av Atomoxetin Mylan Atomoxetin Mylan är avsett för behandling av ADHD (Attention Deficit Hyperactivity Disorder) hos barn
Läkarens guide för att bedöma och kontrollera kardiovaskulär risk vid förskrivning av Atomoxetin Mylan Atomoxetin Mylan är avsett för behandling av ADHD (Attention Deficit Hyperactivity Disorder) hos barn
Din vägledning för. Information till patienter
 Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Patientinformation. Till dig som behandlas med OPDIVO (nivolumab)
 Patientinformation Till dig som behandlas med OPDIVO (nivolumab) www.bms.se Inledning Före behandling med OPDIVO Det här är en broschyr avsedd som vägledning för dig som behandlas med OPDIVO. Här får du
Patientinformation Till dig som behandlas med OPDIVO (nivolumab) www.bms.se Inledning Före behandling med OPDIVO Det här är en broschyr avsedd som vägledning för dig som behandlas med OPDIVO. Här får du
Propecia (finasterid 0,2 och 1 mg) tabletter , version 4.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Propecia (finasterid 0,2 och 1 mg) tabletter 25.4.2017, version 4.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst
Propecia (finasterid 0,2 och 1 mg) tabletter 25.4.2017, version 4.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst
Information till dig som blivit ordinerad
 PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad AUBAGIO (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad AUBAGIO (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
Accelererad eliminering av AUBAGIO. (teriflunomid)
 Accelererad eliminering av AUBAGIO (teriflunomid) Accelererad eliminering av AUBAGIO AUBAGIO är indicerat för behandling av vuxna patienter med skovvis förlöpande multipel skleros (MS). 1 Det finns en
Accelererad eliminering av AUBAGIO (teriflunomid) Accelererad eliminering av AUBAGIO AUBAGIO är indicerat för behandling av vuxna patienter med skovvis förlöpande multipel skleros (MS). 1 Det finns en
Bilaga III. Ändringar i relevanta avsnitt av produktresuméer och bipacksedlar
 Bilaga III Ändringar i relevanta avsnitt av produktresuméer och bipacksedlar 43 Ändringar som ska inkluderas i relevanta avsnitt av produktresumén för monovalenta mässlinginnehållande vacciner Avsnitt
Bilaga III Ändringar i relevanta avsnitt av produktresuméer och bipacksedlar 43 Ändringar som ska inkluderas i relevanta avsnitt av produktresumén för monovalenta mässlinginnehållande vacciner Avsnitt
VALGANCICLOVIR TEVA OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 VALGANCICLOVIR TEVA Datum: 17.7.2013, Version: 2.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst De flesta
VALGANCICLOVIR TEVA Datum: 17.7.2013, Version: 2.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst De flesta
4.1 Terapeutiska indikationer Typherix används för aktiv immunisering mot tyfoidfeber av vuxna och barn från 2 års ålder.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
Entyvio 300 mg pulver till koncentrat till infusionsvätska, lösning (vedolizumab)
 Entyvio 300 mg pulver till koncentrat till infusionsvätska, lösning (vedolizumab) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN 27.6.2014, version 1.0 VI.2 Delområden av en offentlig sammanfattning
Entyvio 300 mg pulver till koncentrat till infusionsvätska, lösning (vedolizumab) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN 27.6.2014, version 1.0 VI.2 Delområden av en offentlig sammanfattning
För patienter med reumatoid artrit. Information till dig som behandlas med RoACTEMRA
 För patienter med reumatoid artrit Information till dig som behandlas med RoACTEMRA RoACTEMRA - Behandling för patienter med RA (reumatoid artrit) Du har blivit ordinerad RoACTEMRA av din läkare. I denna
För patienter med reumatoid artrit Information till dig som behandlas med RoACTEMRA RoACTEMRA - Behandling för patienter med RA (reumatoid artrit) Du har blivit ordinerad RoACTEMRA av din läkare. I denna
Emtricitabine/Tenofovir disoproxil Stada 200 mg/245 mg filmdragerade tabletter , version 1.3
 Emtricitabine/Tenofovir disoproxil Stada 200 mg/245 mg filmdragerade tabletter 30.5.2016, version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Emtricitabine/Tenofovir
Emtricitabine/Tenofovir disoproxil Stada 200 mg/245 mg filmdragerade tabletter 30.5.2016, version 1.3 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Emtricitabine/Tenofovir
Leflunomide STADA. Version, V1.0
 Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Bilaga III. Ändringar till berörda avsnitt i produktinformation
 Bilaga III Ändringar till berörda avsnitt i produktinformation Observera: Dessa ändringar till berörda avsnitt i produktresumé och bipacksedel är resultatet av hänskjutningsförfarandet. Produktinformationen
Bilaga III Ändringar till berörda avsnitt i produktinformation Observera: Dessa ändringar till berörda avsnitt i produktresumé och bipacksedel är resultatet av hänskjutningsförfarandet. Produktinformationen
Bilaga III. Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel
 Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
Sköldkörtelsjukdom. graviditet. Ämnesomsättningsproblem före och efter förlossningen
 Sköldkörtelsjukdom och graviditet Ämnesomsättningsproblem före och efter förlossningen 2 Författare Docent Gertrud Berg, Docent Svante Jansson och Professor emeritus Ernst Nyström, vid Sahlgrenska Universitetssjukhuset,
Sköldkörtelsjukdom och graviditet Ämnesomsättningsproblem före och efter förlossningen 2 Författare Docent Gertrud Berg, Docent Svante Jansson och Professor emeritus Ernst Nyström, vid Sahlgrenska Universitetssjukhuset,
Förskrivarguide. Riskminimeringsinformation för hälso- och sjukvårdspersonal. Denna guide
 Riskminimeringsinformation för hälso- och sjukvårdspersonal Förskrivarguide YERVOY (ipilimumab) är indicerat för behandling av avancerat (icke-resektabelt eller metastaserande) melanom. 1 Denna guide Tillhandahålls
Riskminimeringsinformation för hälso- och sjukvårdspersonal Förskrivarguide YERVOY (ipilimumab) är indicerat för behandling av avancerat (icke-resektabelt eller metastaserande) melanom. 1 Denna guide Tillhandahålls
Influvac 15 mikrog HA / 0,5 ml injektionsvätska, suspension i förfylld spruta , Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Influvac 15 mikrog HA / 0,5 ml injektionsvätska, suspension i förfylld spruta 6.7.2016, Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1
Influvac 15 mikrog HA / 0,5 ml injektionsvätska, suspension i förfylld spruta 6.7.2016, Version 3.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1
Vad Pamifos är och vad det används för Vad du behöver veta innan du får Pamifos
 amifos Pamidronsyra Vad Pamifos är och vad det används för Pamifos är ett läkemedel som påverkar uppbyggnad och nedbrytning av ben. Läkemedlet tillhandahålls i form av en lösning som kan ges som långsam
amifos Pamidronsyra Vad Pamifos är och vad det används för Pamifos är ett läkemedel som påverkar uppbyggnad och nedbrytning av ben. Läkemedlet tillhandahålls i form av en lösning som kan ges som långsam
Viktiga saker att komma ihåg om din GILENYA (fingolimod) behandling
 Detta läkemedel är föremål för utökad övervakning. Viktiga saker att komma ihåg om din GILENYA (fingolimod) behandling Föräldrar/vårdnadshavare Din läkare kommer att be barnet att stanna kvar på mottagningen
Detta läkemedel är föremål för utökad övervakning. Viktiga saker att komma ihåg om din GILENYA (fingolimod) behandling Föräldrar/vårdnadshavare Din läkare kommer att be barnet att stanna kvar på mottagningen
XELJANZ. Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet.
 XELJANZ Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet. TILL DIG SOM BEHANDLAS MED XELJANZ, Din läkare har skrivit ut
XELJANZ Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet. TILL DIG SOM BEHANDLAS MED XELJANZ, Din läkare har skrivit ut
XELJANZ. Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet.
 XELJANZ Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet. TILL DIG SOM BEHANDLAS MED XELJANZ, Din läkare har skrivit ut
XELJANZ Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet. TILL DIG SOM BEHANDLAS MED XELJANZ, Din läkare har skrivit ut
SE-TER MAJ 2015
 SE-TER-15-03-01 MAJ 2015 Information till patient som ska starta behandling med AUBAGIO (teriflunomid) 14 mg en gång per dag. Hur fungerar AUBAGIO? Hur du tar AUBAGIO Kontroll av levervärden Kontroll av
SE-TER-15-03-01 MAJ 2015 Information till patient som ska starta behandling med AUBAGIO (teriflunomid) 14 mg en gång per dag. Hur fungerar AUBAGIO? Hur du tar AUBAGIO Kontroll av levervärden Kontroll av
Den här broschyren har du fått via din behandlande läkare. Bra att veta om din intravenösa infusionsbehandling med ORENCIA (abatacept)
 Den här broschyren har du fått via din behandlande läkare. Bra att veta om din intravenösa infusionsbehandling med ORENCIA (abatacept) Innehållsförteckning Om ORENCIA 3 Din behandling 7 Användbara delar
Den här broschyren har du fått via din behandlande läkare. Bra att veta om din intravenösa infusionsbehandling med ORENCIA (abatacept) Innehållsförteckning Om ORENCIA 3 Din behandling 7 Användbara delar
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Telmisartan/Hydrochlorothiazide ratiopharm 4.12.2014, Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
Telmisartan/Hydrochlorothiazide ratiopharm 4.12.2014, Version 2.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
XELJANZ. Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet.
 XELJANZ Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet. TILL DIG SOM BEHANDLAS MED XELJANZ, Din läkare har skrivit ut
XELJANZ Den här broschyren är avsedd för dig som har ordinerats XELJANZ. Du hittar mer information i bipacksedeln som medföljer läkemedlet. TILL DIG SOM BEHANDLAS MED XELJANZ, Din läkare har skrivit ut
GILENYA. LAMmars 12 PRINCIPER FÖR FÖRSKRIVNING
 GILENYA PRINCIPER FÖR FÖRSKRIVNING Patienten ska ha en säkerställd MS diagnos enligt de reviderade McDonaldskriteriererna samt ett mycket aktiv skovvis förlopp enligt gällande terapeutiska indikationer:
GILENYA PRINCIPER FÖR FÖRSKRIVNING Patienten ska ha en säkerställd MS diagnos enligt de reviderade McDonaldskriteriererna samt ett mycket aktiv skovvis förlopp enligt gällande terapeutiska indikationer:
AMGEVITA (adalimumab)
 AMGEVITA (adalimumab) Patientkort Detta kort innehåller viktig säkerhetsinformation om AMGEVITA. Du ska: Visa kortet för läkare eller övrig hälso- och sjukvårdspersonal du träffar, för att de ska få veta
AMGEVITA (adalimumab) Patientkort Detta kort innehåller viktig säkerhetsinformation om AMGEVITA. Du ska: Visa kortet för läkare eller övrig hälso- och sjukvårdspersonal du träffar, för att de ska få veta
KYPROLIS (carfilzomib)
 KYPROLIS (carfilzomib) Patientguide Kyprolis i kombination med antingen Revlimid (lenalidomid) och dexametason eller enbart dexametason är avsett för behandling av multipelt myelom hos vuxna patienter
KYPROLIS (carfilzomib) Patientguide Kyprolis i kombination med antingen Revlimid (lenalidomid) och dexametason eller enbart dexametason är avsett för behandling av multipelt myelom hos vuxna patienter
Mässling Säkerställande av immunitet hos hälso- och sjukvårdspersonal i Norrbotten
 Mässling Säkerställande av immunitet hos hälso- och sjukvårdspersonal i Norrbotten Bakgrund Mässling är en mycket smittsam virussjukdom som ger hög feber, hosta och utslag. I ungefär 20 procent av fallen
Mässling Säkerställande av immunitet hos hälso- och sjukvårdspersonal i Norrbotten Bakgrund Mässling är en mycket smittsam virussjukdom som ger hög feber, hosta och utslag. I ungefär 20 procent av fallen
Detta läkemedel är föremål för utökad övervakning. Viktiga saker att komma ihåg om din GILENYA (fingolimod) behandling
 Detta läkemedel är föremål för utökad övervakning. Viktiga saker att komma ihåg om din GILENYA (fingolimod) behandling Din läkare kommer att be dig att stanna kvar på mottagningen eller kliniken i minst
Detta läkemedel är föremål för utökad övervakning. Viktiga saker att komma ihåg om din GILENYA (fingolimod) behandling Din läkare kommer att be dig att stanna kvar på mottagningen eller kliniken i minst
Isotretinoin Actavis
 Förebyggande av graviditet och exponering av foster Patientvägledning Isotretinoin Actavis (isotretinoin) 10 mg respektive 20 mg, mjuka kapslar Isotretinoin Patientvägledning Syftet med broschyren Den
Förebyggande av graviditet och exponering av foster Patientvägledning Isotretinoin Actavis (isotretinoin) 10 mg respektive 20 mg, mjuka kapslar Isotretinoin Patientvägledning Syftet med broschyren Den
Läkarens vägledning till förskrivning av isotretinoin
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoin) Läkarens vägledning till förskrivning av isotretinoin Det förebyggande programmet mot graviditet och exponering av foster Inledning
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoin) Läkarens vägledning till förskrivning av isotretinoin Det förebyggande programmet mot graviditet och exponering av foster Inledning
Patientvägledningtvägledning
 Förebyggande av graviditet och exponering av foster Patientvägledningtvägledning (acitretin) 10 mg respektive 25 mg, hårda kapslar Syftet med broschyren Den här broschyren innehåller viktig information,
Förebyggande av graviditet och exponering av foster Patientvägledningtvägledning (acitretin) 10 mg respektive 25 mg, hårda kapslar Syftet med broschyren Den här broschyren innehåller viktig information,
Fall av nefrotiskt syndrom med olika bakomliggande nefropatier har också rapporterats.
 15 augusti 2014 Beta-interferoner: risk för trombotisk mikroangiopati och nefrotiskt syndrom Bästa hälso- och sjukvårdspersonal, Läkemedelsverket vill i samråd med Europeiska läkemedelsmyndigheten och
15 augusti 2014 Beta-interferoner: risk för trombotisk mikroangiopati och nefrotiskt syndrom Bästa hälso- och sjukvårdspersonal, Läkemedelsverket vill i samråd med Europeiska läkemedelsmyndigheten och
Patientinformation. Bendamustine medac 100 mg bendamustinhydroklorid. Pulver till koncentrat till infusionsvätska, lösning.
 Patientinformation Bendamustine medac 100 mg bendamustinhydroklorid. Pulver till koncentrat till infusionsvätska, lösning. Bendamustine medac 25 mg bendamustinhydroklorid. Pulver till koncentrat till infusionsvätska,
Patientinformation Bendamustine medac 100 mg bendamustinhydroklorid. Pulver till koncentrat till infusionsvätska, lösning. Bendamustine medac 25 mg bendamustinhydroklorid. Pulver till koncentrat till infusionsvätska,
Diane huvudversion av patientkort och checklista för förskrivare 17/12/2014. Patientinformationskort:
 Patientinformationskort: Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de
Patientinformationskort: Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de
MITOXANTRON. Patientkort. Viktig obligatorisk information om riskminimering Meda AB (A Mylan Company)
 MITOXANTRON Patientkort Viktig obligatorisk information om riskminimering 2018 Meda AB (A Mylan Company) NOVANTRONE (mitoxantron) För behandling av multipel skleros (MS) med mycket aktiva återfall förknippad
MITOXANTRON Patientkort Viktig obligatorisk information om riskminimering 2018 Meda AB (A Mylan Company) NOVANTRONE (mitoxantron) För behandling av multipel skleros (MS) med mycket aktiva återfall förknippad
graviditet Ämnesomsättningsproblem före och efter förlossning
 Sköldkörtelsjukdom och graviditet Ämnesomsättningsproblem före och efter förlossning Författare Docent Gertrud Berg, Docent Svante Jansson och Professor emeritus Ernst Nyström, vid Sahlgrenska Universitetssjukhuset,
Sköldkörtelsjukdom och graviditet Ämnesomsättningsproblem före och efter förlossning Författare Docent Gertrud Berg, Docent Svante Jansson och Professor emeritus Ernst Nyström, vid Sahlgrenska Universitetssjukhuset,
BILAGA III Ändringar av relevanta avsnitt i produktinformationen
 BILAGA III Ändringar av relevanta avsnitt i produktinformationen OBS: Dessa ändringar av relevanta avsnitt i produktresumén och bipacksedeln är resultatet av hänskjutandeförfarandet. Produktinformationen
BILAGA III Ändringar av relevanta avsnitt i produktinformationen OBS: Dessa ändringar av relevanta avsnitt i produktresumén och bipacksedeln är resultatet av hänskjutandeförfarandet. Produktinformationen
Pregabalin Pfizer. 8.11.2013, version 10.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Pregabalin Pfizer 8.11.2013, version 10.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Epilepsi Epilepsi är en
Pregabalin Pfizer 8.11.2013, version 10.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Epilepsi Epilepsi är en
Din vägledning för KEYTRUDA. (pembrolizumab) Information till patienter
 Apr 2018, ver 6 Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Apr 2018, ver 6 Din vägledning för KEYTRUDA (pembrolizumab) Information till patienter Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation.
Bipacksedel: Information till patienten
 Bipacksedel: Information till patienten Germanium(Ge-, 0,74 1,85 GBq, radionuklidgenerator germanium( 68 Ge)klorid/gallium( 68 Ga)klorid Detta läkemedel är föremål för utökad övervakning. Detta kommer
Bipacksedel: Information till patienten Germanium(Ge-, 0,74 1,85 GBq, radionuklidgenerator germanium( 68 Ge)klorid/gallium( 68 Ga)klorid Detta läkemedel är föremål för utökad övervakning. Detta kommer
Patientvägledning. Acitretin Orifarm (acitretin) 10 mg respektive 25 mg, hårda kapslar. Förebyggande av graviditet och exponering av foster
 Patientvägledning Acitretin Orifarm (acitretin) 10 mg respektive 25 mg, hårda kapslar Förebyggande av graviditet och exponering av foster 03/2018/ Syftet med broschyren Den här broschyren innehåller viktig
Patientvägledning Acitretin Orifarm (acitretin) 10 mg respektive 25 mg, hårda kapslar Förebyggande av graviditet och exponering av foster 03/2018/ Syftet med broschyren Den här broschyren innehåller viktig
BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET VILKA SKA IMPLEMENTERAS AV MEDLEMSLÄNDERNA
 BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET VILKA SKA IMPLEMENTERAS AV MEDLEMSLÄNDERNA 1/5 VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING
BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET VILKA SKA IMPLEMENTERAS AV MEDLEMSLÄNDERNA 1/5 VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING
Version 1. Godkänd av Fimea 04/2018. Riktlinjer för förskrivning mitoxantron vid behandling av MS
 Godkänd av Fimea 04/2018 Riktlinjer för förskrivning mitoxantron vid behandling av MS Inledning Dessa riktlinjer för vårdgivare har tagits fram för att informera om risken för förändrad hjärtfunktion/myokardtoxicitet
Godkänd av Fimea 04/2018 Riktlinjer för förskrivning mitoxantron vid behandling av MS Inledning Dessa riktlinjer för vårdgivare har tagits fram för att informera om risken för förändrad hjärtfunktion/myokardtoxicitet
6.11 Bilaga 11 Modell för föreslagna ytterligare riskminimeringsåtgärder (om relevant)
 6.11 Bilaga 11 Modell för föreslagna ytterligare riskminimeringsåtgärder (om relevant) 6.11.1 Vorikonazol - checklista för sjukvårdspersonal A) Minimera risken för fototoxicitet och skivepitelcancer i
6.11 Bilaga 11 Modell för föreslagna ytterligare riskminimeringsåtgärder (om relevant) 6.11.1 Vorikonazol - checklista för sjukvårdspersonal A) Minimera risken för fototoxicitet och skivepitelcancer i
Bipacksedel: Information till patienten. Nanocis 0,24 mg beredningssats för radioaktivt läkemedel rheniumsulfid
 Bipacksedel: Information till patienten Nanocis 0,24 mg beredningssats för radioaktivt läkemedel rheniumsulfid Läs noga igenom denna bipacksedel innan du får detta läkemedel. Den innehåller information
Bipacksedel: Information till patienten Nanocis 0,24 mg beredningssats för radioaktivt läkemedel rheniumsulfid Läs noga igenom denna bipacksedel innan du får detta läkemedel. Den innehåller information
Patientinformation och behandlingsdagbok
 Patientinformation och behandlingsdagbok Till dig som behandlas med (nivolumab) WWW.BMS.COM/SE Inledning Före behandling med OPDIVO Det här är en broschyr avsedd som vägledning för dig som behandlas med
Patientinformation och behandlingsdagbok Till dig som behandlas med (nivolumab) WWW.BMS.COM/SE Inledning Före behandling med OPDIVO Det här är en broschyr avsedd som vägledning för dig som behandlas med
ADMINISTRERING OCH PRAKTISKA RÅD
 ADMINISTRERING OCH PRAKTISKA RÅD Innan behandlingsstart med Tysabri (natalizumab) För att kunna påbörja behandling med Tysabri måste det finnas en genomförd MRT-undersökning som är gjord inom de tre senaste
ADMINISTRERING OCH PRAKTISKA RÅD Innan behandlingsstart med Tysabri (natalizumab) För att kunna påbörja behandling med Tysabri måste det finnas en genomförd MRT-undersökning som är gjord inom de tre senaste
Tyreoidearubbningar under graviditet och puerperium, gällande rutin
 Tyreoidearubbningar under graviditet och puerperium, gällande rutin Berörda enheter Samtliga mvc, smvc och förlossnings-/bb-avdelningar i Norrbotten. Syfte Enhetlig handläggning av tyreoidearubbningar
Tyreoidearubbningar under graviditet och puerperium, gällande rutin Berörda enheter Samtliga mvc, smvc och förlossnings-/bb-avdelningar i Norrbotten. Syfte Enhetlig handläggning av tyreoidearubbningar
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
Olysio (simeprevir) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Olysio (simeprevir) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN Detta är en sammanfattning av riskhanteringsplanen (risk management plan, RMP) för Olysio, som specificerar de åtgärder som skall vidtas
Olysio (simeprevir) OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN Detta är en sammanfattning av riskhanteringsplanen (risk management plan, RMP) för Olysio, som specificerar de åtgärder som skall vidtas
ocrelizumab PATIENTGUIDE Ocrevus vid behandling av primärprogressiv MS
 PATIENTGUIDE Ocrevus vid behandling av primärprogressiv MS Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa
PATIENTGUIDE Ocrevus vid behandling av primärprogressiv MS Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa
Praluent , Version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Praluent 08-2015, Version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen för Praluent, som specificerar
Praluent 08-2015, Version 1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen för Praluent, som specificerar
En ny behandlingsform inom RA
 En ny behandlingsform inom RA Du som lever med reumatoid artrit har antagligen redan genomgått en hel del olika behandlingsformer. Nu har din läkare ordinerat MabThera (rituximab) för din RA. Din läkare
En ny behandlingsform inom RA Du som lever med reumatoid artrit har antagligen redan genomgått en hel del olika behandlingsformer. Nu har din läkare ordinerat MabThera (rituximab) för din RA. Din läkare
Ocrevus vid behandling av skovvis MS
 PATIENTGUIDE Ocrevus vid behandling av skovvis MS Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till
PATIENTGUIDE Ocrevus vid behandling av skovvis MS Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till
Bilaga III. Ändringar till relevanta avsnitt i produktresumé och bipacksedel
 Bilaga III Ändringar till relevanta avsnitt i produktresumé och bipacksedel Observera: Ändringarna till de relevanta avsnitten i produktresumén och bipacksedeln är resultatet av referralproceduren. Produktinformationen
Bilaga III Ändringar till relevanta avsnitt i produktresumé och bipacksedel Observera: Ändringarna till de relevanta avsnitten i produktresumén och bipacksedeln är resultatet av referralproceduren. Produktinformationen
Bipacksedel: Information till patienten. Pulmocis 2 mg beredningssats för radioaktivt läkemedel. humant albumin som makroaggregat
 Bipacksedel: Information till patienten Pulmocis 2 mg beredningssats för radioaktivt läkemedel humant albumin som makroaggregat Läs noga igenom denna bipacksedel innan du får detta läkemedel. Den innehåller
Bipacksedel: Information till patienten Pulmocis 2 mg beredningssats för radioaktivt läkemedel humant albumin som makroaggregat Läs noga igenom denna bipacksedel innan du får detta läkemedel. Den innehåller
