10 mg Mjuka kapslar Oral Blister 30, 100
|
|
|
- Roland Fransson
- för 8 år sedan
- Visningar:
Transkript
1 BILAGA I FÖRTECKNING ÖVER NAMN, LÄKEMEDELSFORM, LÄKEMEDELSSTYRKOR, ADMINISTRERINGSSÄTT, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING, FÖRPACKNINGAR OCH FÖRPACKNINGSSTORLEKAR I MEDLEMSSTATERNA 1
2 Medlemsstat Innehavare av godkännande för försäljning Fantasinamn Styrka Läkemedelsform Administreringssätt Förpackning Förpackningsstorlek Österrike Roche Austria GmbH, Engelhorngasse 3, 1211 Wien ROACCUTANE «Roche» ROACCUTANE «Roche» 10 mg Mjuka kapslar Oral Blister 30, mg Mjuka kapslar Oral Blister 30, 100 Belgien N.V. Roche S.A. Rue Dantestraat 75, B-1070 Brussels Belgium Roaccutane 10 mg Mjuka kapslar Oral Blister 30, 60 Roaccutane 20 mg Mjuka kapslar Oral Blister 30, 60 Danmark Hoffmann-La Roche & Co Roaccutan 10 mg Mjuka kapslar Oral Blister 30,50, 100 Basel, Schweiz Roaccutan 20 mg Mjuka kapslar Oral Blister 30, 50, 100 Finland Roche Oy Sinimäentie 10 A FIN Espoo/Esbo, Finland Roaccutan 10 mg Mjuka kapslar Oral Blister 100 Roaccutan 20 mg Mjuka kapslar Oral Blister 100 Frankrike Roche 52, boulevard du Parc Neuilly-sur-Seine Cedex, France Roaccutane 5 mg Mjuka kapslar Oral Blister 30, 60 Roaccutane 10 mg Mjuka kapslar Oral Blister 30, 60 Roaccutane 20 mg Mjuka kapslar Oral Blister 30, 60 Tyskland Hoffmann-La Roche AG, Roaccutan 10 mg Mjuka kapslar Oral Blister 50 Emil-Barell-Straße 1, Grenzach-Wyhlen Roaccutan 20 mg Mjuka kapslar Oral Blister 50 2
3 Grekland Roche Hellas S.A., Αλαµάνας 4 & ελφών, GR Μαρούσι, Αττική, Greece ROACCUTAN ROACCUTAN 10 mg 20 mg Mjuka kapslar Mjuka kapslar Oral Oral Blister Blister Irland Roche Products Limited P.O. Box 8 Roaccutane 5 mg Mjuka kapslar Oral Blister Welwyn Garden City Hertfordshire AL7 3AY, Gula glasflaskor UK Roaccutane 20 mg Mjuka kapslar Oral Blister 56, , 60 Gula glasflaskor 100 Italien ROCHE S.p.A. Piazza Durante Milano, Italy ROACCUTAN 2.5 mg Mjuka kapslar Oral Blister 30 ROACCUTAN 10 mg Mjuka kapslar Oral Blister 30 ROACCUTAN 20 mg Mjuka kapslar Oral Blister 30 Luxemburg N.V. Roche S.A. Rue Dantestraat 75, B-1070 Brussels Belgium Roaccutane 10 mg Mjuka kapslar Oral Blister 30, 60 Roaccutane 20 mg Mjuka kapslar Oral Blister 30, 60 Portugal Roche Farmacêutica Química, Lda. Estrada Nacional 249-1, Amadora, Portugal Roaccutan 10 mg Mjuka kapslar Oral Blister 20, 50 Mjuka kapslar Roaccutan 20 mg Oral Blister 20, 50 3
4 Spanien Roche Farma S.A., c/ Roacutan 10 mg Mjuka kapslar Oral Blister 50 Josefa Valcárcel, nº 42, Madrid, Spain Roacutan 20 mg Mjuka kapslar Oral Blister 50 Nederländerna Roche Nederland B.V., Roaccutane 10 mg Mjuka kapslar Oral Blister 30 Nijverheidsweg 38, 3641 RR Mijdrecht, Nederland Roaccutane 20 mg Mjuka kapslar Oral Blister 30 Storbritannien Roche Products Limited 40 Broadwater Road Roaccutane 5 mg Mjuka kapslar Oral Blister Welwyn Garden City Hertfordshire AL7 3AY, Gula glasflaskor UK Roaccutane 20 mg Mjuka kapslar Oral Blister 56, , 60 Gula glasflaskor 100 4
5 Medlemsstat Innehavare av godkännande för försäljning Island F. Hoffman La-Roche Ltd. Postfach CH-4002 Basel Fantasinamn Styrka Läkemedelsform Administreringssätt Förpackning Förpackningsstorlek Roaccutan 10 mg Mjuka kapslar Oral Blister 50 Roaccutan 20 mg Mjuka kapslar Oral Blister 50 5
6 BILAGA II EMEA:SVETENSKAPLIGA SLUTSATSER OCH SKÄLEN TILL ÄNDRING AV PRODUKTRESUMÉN 6
7 VETENSKAPLIGA SLUTSATSER ÖVERGRIPANDE SAMMANFATTNING AV DEN VETENSKAPLIGA UTVÄRDERINGEN AV ROACCUTAN MED SYNONYMER (se bilaga I) Isotretinoin (13-cis-retinoinsyra), den verksamma substansen i Roaccutan, är en retinoidförening och ett derivat av A-vitamin. Roaccutankapslar är en oral formulering av isotretinoin som används för systemisk behandling av akne. Liksom alla andra retinoider är isotretinoin teratogent och är för undvikande av kongenitala defekter kontraindicerat under graviditet. Roaccutan registrerades i EU-medlemsstaterna (utom Sverige [och Norge], där läkemedlet saluförs under särskild licens) från och med Skälet till artikel 30-hänskjutandet av Roaccutan var att läkemedlet till följd av skiljaktiga nationella beslut inte har samma produktresumé i alla medlemsstaterna. De viktigaste av de avdelningar som skulle harmoniseras var Terapeutiska indikationer, Dosering och administreringssätt, Kontraindikationer, Varningar och försiktighetsmått och Biverkningar. På grund av den höga risken för kongenitala defekter föreslog innehavaren av godkännande för försäljning ett harmoniserat riskhanteringsprogram med syftet att se till att fertila kvinnor inte är gravida när de påbörjar behandling med Roaccutan och inte heller blir gravida under behandlingen eller under minst en månad efter det att denna avslutats. Kvalitetsfrågor CPMP ansåg inte att det fanns några väsentliga kvalitetsfrågor att diskutera, och de farmaceutiska uppgifterna i produktresumén har harmoniserats med undantag av de avdelningar som måste införas nationellt av medlemsstaterna när dessa genomför den harmoniserade produktresumén. Innehavaren ombads att kommentera de olika tillgängliga styrkorna och förpackningsstorlekarna mot bakgrund av riskhanteringsprogrammet. Beslutet om vilka styrkor och förpackningsstorlekar som i framtiden skall förekomma i EU beror direkt på det riskhanteringsprogram som parterna slutgiltigt enas om. Detta beslut kan fattas i en andra etapp, efter det aktuella harmoniseringsförfarandet. Effektfrågor Att läkemedlet har effekt anses vara styrkt, men däremot ifrågasattes behandlingspopulationen. CPMP observerade att motiveringen för användningen som förstahandsbehandling vid allvarlig akne inte byggde på formella kliniska prövningar utan på kliniskt verksamma läkares publicerade åsikter. Med tanke på att indikationerna bör avspegla nytta risk-förhållandet för isotretinoin i den avsedda populationen, och med hänsyn tagen till den teratogena risken och andra allvarliga biverkningar med anknytning till isotretinoin, rekommenderade CPMP följande indikation: Allvarliga former av akne (till exempel acne nodularis, acne conglobata eller akne som riskerar att orsaka permanent ärrbildning) som är resistenta mot adekvata kurer av standardbehandling med systemiska antibakteriella läkemedel och lokalbehandling. På vuxna bör behandlingen med isotretinoin inledas vid en dygnsdos på 0,5 mg/kg. Behandlingssvaret på isotretinoin liksom vissa av biverkningarna är dosrelaterade och varierar mellan patienter. Detta innebär att det krävs individuell anpassning av dosen under behandlingens gång. För de flesta patienter ligger dygnsdosen i intervallet 0,5 1,0 mg/kg. Den långsiktiga remissions- och relapsfrekvensen har närmare samband med den totala tillförda dosen än med vare sig behandlingstiden eller dygnsdosen. Det har visats att man inte kan förvänta sig att läkemedlet skall göra någon mer betydande ytterligare nytta efter en kumulerad behandlingsdos på mg/kg. Behandlingstiden beror av den individuella dygnsdosen. En behandlingskur på veckor räcker normalt för att åstadkomma remission. Säkerhetsfrågor 7
8 Den viktigaste säkerhetsfrågan rörde utformningen av de rekommendationer i produktresumén som skall garantera att fertila kvinnor inte är gravida när de påbörjar behandling med isotretinoin och inte heller blir gravida under behandlingen eller under minst en månad efter det att denna avslutats. Till grund för diskussionen låg innehavarens förslag till harmoniserat graviditetsförebyggande program. I detta sammanhang beaktade CPMP följande: - Förskrivning av (oralt) isotretinoin till fertila kvinnor bör ske bara med tillämpning av strikta graviditetsförebyggande åtgärder som stöds av innehavarens graviditetsförebyggande program. Detta gäller även kvinnor som för närvarande inte är sexuellt aktiva, såvida inte den förskrivande läkaren anser att det finns mycket starka skäl att anta att det saknas risk för graviditet. - Isotretinoin är kontraindicerat för fertila kvinnor såvida inte alla villkoren nedan är uppfyllda: Hon har allvarlig akne (till exempel acne nodularis, acne conglobata eller akne som riskerar att orsaka permanent ärrbildning) som är resistent mot adekvata kurer av standardbehandling med systemiska antibakteriella läkemedel och lokalbehandling. Hon förstår den teratogena risken. Hon förstår behovet av ytterst noggrann uppföljning på månatlig basis. Hon förstår och accepterar behovet av att utan avbrott använda effektiva preventivmedel under en månad före behandlingsstarten, under hela behandlingstiden och under en månad efter det att behandlingen avslutats. Åtminstone en och helst två olika preventivmetoder som kompletterar varandra, inbegripet en barriärmetod, bör användas. Även om hon har amenorré måste hon följa alla råden om effektiva preventivmedel. Hon bör ha förmågan att använda effektiva preventivmedel på ett korrekt sätt. Hon har informerats om och förstår de potentiella konsekvenserna av en graviditet liksom behovet av att snabbt uppsöka läkare om det föreligger risk för graviditet. Hon förstår behovet av att göra graviditetstester före behandlingen, under denna och fem veckor efter det att den har avslutats samt accepterar att genomgå sådana tester. Hon har bekräftat att hon har förstått de risker och de nödvändiga försiktighetsmått som är knutna till användningen av isotretinoin. - Isotretinoin bör förskrivas enbart av eller under överinseende av läkare som har expertkunskap om användningen av systemiska retinoider för behandling av allvarlig akne och helt förstår de risker och övervakningskrav som finns i samband med isotretinoinbehandling. - Fullständig patientinformation om de teratogena riskerna och de strikta graviditetsförebyggande åtgärderna bör ges till alla patienter, både manliga och kvinnliga. - För att hjälpa förskrivande läkare, apotekare och patienter att undvika att foster exponeras för isotretinoin kommer innehavaren att tillhandahålla utbildningsmaterial som befäster varningarna om isotretinoins teratogenicitet, ger råd om preventivmedelsanvändningen innan behandlingen inleds och ger vägledning om behovet av graviditetstester. - Preventivmedelsanvändningen, graviditetstesterna och läkarbesöken bör följa specifika rekommendationer som lämnas i produktresumén. - Recepten på isotretinoin till fertila kvinnor bör begränsas till 30 dagars behandling, och för fortsatt behandling krävs ett nytt recept. I idealfallet bör graviditetstestet, utfärdandet av receptet och utlämnandet av isotretinoin ske samma dag. Utlämnandet av isotretinoin bör ske senast sju dagar efter det att receptet utfärdades. - Patienterna bör instrueras att aldrig ge detta läkemedel till någon annan person och att återlämna eventuella oanvända kapslar till sitt apotek vid behandlingens slut. - Patienterna bör inte ge blod under behandlingen med isotretinoin eller under en månad efter det att denna avslutats, på grund av den potentiella risken för en gravid blodmottagares foster. 8
9 - Innehavaren måste åta sig att inte dela ut några gratisprover av läkemedlet. De övergripande principerna för det graviditetsförebyggande programmet måste anges i produktresumén, medan de närmare detaljerna behöver anpassas till lokala regler. Därför krävde CPMP att innehavaren skulle komma överens med de behöriga nationella myndigheterna om dessa närmare detaljer för det graviditetsförebyggande programmet och att innehavaren måste genomföra detta program nationellt. Detta krav har beskrivits mer utförligt i en bilaga till yttrandet med rubriken Villkor för godkännandet för försäljning. Dessutom bör de periodiska säkerhetsuppdateringsrapporterna (PSUR) lämnas in årligen. Innehavaren bör förse CPMP, referensmedlemsstaten och de berörda medlemsstaterna med en graviditetsredogörelse, inbegripet en rapport om det graviditetsförebyggande programmet och en samlad bedömning av gravida personers exponering för läkemedlet samt utfallet för dessa. Sådana redogörelser lämnas in var sjätte månad de första två åren efter Europeiska kommissionens beslut och varje år därefter. Rapporten bör ge information om de åtgärder som vidtagits för att se till att det graviditetsförebyggande programmet fungerar väl och för att bedöma om så är fallet. Dessutom krävde CPMP följande: - Företaget skall, som uppföljningsåtgärd, till CPMP lämna in en redogörelse med förslag till uppdatering av avdelningarna Varningar och försiktighetsmått och Biverkningar med avseende på psykiatriska störningar, senast två månader efter CPMP:s yttrande. - Inom ramen för bedömningen av PSUR bör referensmedlemsstaten se över följande biverkningar: ögonsjukdomar, rodnad, blåmärken (utgjutningar), oregelbunden menstruation, palpitationer och takykardi samt eventuella tecken på interaktion med karbamazepin. Alla delar av avdelningarna 4 och 5 i produktresumén har harmoniserats under förfarandet. Överväganden i fråga om nytta och risk På grundval av den dokumentation som redovisats av innehavaren av godkännande för försäljning, däribland förslaget om att ett graviditetsförebyggande program skall genomföras, och sin egen vetenskapliga diskussion fann CPMP att nytta risk-förhållandet för Roaccutan (med synonymer) är gynnsamt för de överenskomna indikationerna. SKÄL TILL ÄNDRING AV PRODUKTRESUMÉN CPMP förordar ändring av de godkännanden för försäljning avseende Roaccutan med synonymer (se bilaga I) för vilka produktresumén återfinns i bilaga III, med beaktande av följande: - Det hänskjutna ärendet avsåg harmonisering av produktresuméerna. - Den produktresumé som föreslagits av innehavarna av godkännande för försäljning har bedömts på grundval av den dokumentation som redovisats, däribland förslaget till ett graviditetsförebyggande program, och den vetenskapliga diskussionen i CPMP. 9
10 BILAGA III PRODUKTRESUMÉ 10
11 1. LÄKEMEDLETS NAMN <Roaccutane och associerade namn><2,5 mg><5 mg><10 mg><20 mg> mjuka kapslar (Se Bilaga I Implementeras nationellt) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje mjuk kapsel innehåller <2,5 mg><5 mg><10 mg><20 mg> isotretinoin (Se Bilaga I Implementeras nationellt) Beträffande hjälpämnen se LÄKEMEDELSFORM Kapslar, mjuka. 4. KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer Svåra former av akne (såsom nodulär akne, konglobat akne eller akne med risk för permanent ärrbildning) som inte kontrolleras med adekvat standardbehandling med systemiska antibakteriella medel och lokalbehandling. 4.2 Dosering och administreringssätt Isotretinoin får endast förskrivas av eller under överinseende av läkare som har expertkunskap gällande användande av systemiska retinoider för behandling av svår akne och som har full kännedom om de risker som föreligger vid behandling med isotretinoin och vilka krav som ställs på övervakning. Kapslarna skall intagas i samband med måltid en eller två gånger dagligen. Vuxna inklusive ungdomar och äldre: Isotretinoinbehandling bör inledas med en dos på 0,5 mg/kg dagligen. Det terapeutiska svaret på isotretinoin och vissa biverkningar är dosrelaterade och varierar från patient till patient. Detta gör att en individuell dosjustering kan bli nödvändig under behandlingens gång. För de flesta patienter varierar dosen mellan 0,5-1,0 mg/kg per dag. Långsiktig förbättrings- och återfallsfrekvens kan tillskrivas den totalt administrerade dosen snarare än behandlingstiden eller den dagliga dosen. Ingen väsentlig ytterligare behandlingsvinst har kunnat påvisas med en kumulativ dos som överstiger mg/kg. Behandlingens varaktighet beror på den individuella dagliga dosen. En behandlingskur på veckor är vanligtvis tillräcklig för att uppnå förbättring. Hos majoriteten av patienterna inträffar fullständig utläkning av aknen med en enda behandlingskur. Om ett uppenbart återfall inträffar kan ytterligare en behandlingskur med isotretinoin övervägas med samma dagliga dos och kumulativa behandlingsdos. Eftersom ytterligare förbättring av aknen kan iakttas upp till 8 veckor efter avslutad behandling bör inte en ytterligare kur övervägas förrän åtminstone denna tidsperiod har passerat. Patienter med svår njurinsufficiens 11
12 Hos patienter med svår njurinsufficiens skall behandlingen inledas med en lägre dos (t.ex. 10 mg/dag). Dosen kan sedan ökas upp till 1 mg/kg/dag eller tills patienten uppnår maximalt tolererbar dos (se avsnitt 4.4 Varningar och försiktighetsmått ). Barn Isotretinoin är inte indicerat vid behandling av förpubertal akne och rekommenderas inte för patienter yngre än 12 år. Patienter med intolerans Hos patienter som uppvisar svår intolerans mot den rekommenderade dosen kan behandlingen fortsättas med en lägre dos, vilket medför en längre behandlingstid och en högre risk för återfall. För att kunna erhålla maximal effekt hos dessa patienter bör behandlingen i normala fall fortsätta med högsta tolererade dos. 4.3 Kontraindikationer Isotretinoin är kontraindicerat för gravida eller ammande kvinnor. (se avsnitt 4.6 Graviditet och amning ). Isotretinoin är kontraindicerat för fertila kvinnor såvida inte alla villkor i Program för att förhindragraviditet uppfylls (se avsnitt 4.4 Varningar och försiktighetsmått ). Isotretinoin är även kontraindicerat för patienter Med leverinsufficiens Med mycket förhöjda blodlipidvärden Med hypervitaminos A Med överkänslighet mot isotretinoin eller något av hjälpämnena Som samtidigt behandlas med tetracykliner (se avsnitt 4.5 Interaktioner med andra läkemedel och övriga interaktioner ) 4.4 Varningar och försiktighetsmått Program för att förhindra graviditet Detta läkemedel är TERATOGENT Isotretinoin är kontraindicerat för fertila kvinnor såvida inte samtliga följande villkor i Program för att förhindra graviditet uppfylls: Hon har svår akne (såsom nodulär akne, konglobat akne eller akne med risk för permanent ärrbildning) som inte kontrolleras med adekvat standardbehandling med systemiska antibakteriella medel och lokalbehandling (se avsnitt 4.1 Terapeutiska indikationer ). Hon är införstådd med den teratogena risken. Hon är införstådd med behovet av ytterst noggrann uppföljning en gång i månaden. Hon är införstådd med och accepterar kravet på att använda effektiva preventivmedel utan avbrott från 1 månad före behandlingens start, under hela behandlingen och minst till och med 1 månad efter behandlingens upphörande. Minst en och helst två kompletterande preventivmetoder inklusive en barriärmetod skall användas. Även om hon har amenorré måste hon rätta sig efter samtliga anvisningar om effektiv födelsekontroll. Hon måste vara kapabel att följa effektiva preventivtekniska åtgärder. Hon är informerad om och förstår de potentiella följderna av en graviditet och nödvändigheten av en omedelbar läkarkontakt om det föreligger risk för graviditet. Hon förstår och accepterar behovet av att genomgå graviditetstest före, under och fem veckor efter avslutad behandling. Hon har bekräftat att hon förstått riskerna och de nödvändiga försiktighetsåtgärder som är förenade med användningen av isotretinoin. 12
13 Dessa villkor gäller även kvinnor som för närvarande inte är sexuellt aktiva om inte förskrivaren bedömer att det finns övertygande skäl som vittnar om att det inte finns någon risk för graviditet. Förskrivaren måste säkerställa att: Patienten följer villkoren för att förhindra graviditet som anges ovan, inklusive bekräftelse på att hon förstår innehållet på ett adekvat sätt. Patienten har bekräftat ovan nämnda villkor. Patienten har använt minst en och helst två effektiva preventivmedelsmetoder innefattande en barriärmetod i minst en månad före behandlingens start och fortsätter att använda effektiva preventivmedel under hela behandlingsperioden och i minst en månad efter avslutad behandlingen. Negativa resultat av graviditetstest har erhållits före, under och fem veckor efter avslutad behandling. Datum för och resultat av graviditetstest skall dokumenteras. Födelsekontroll Kvinnliga patienter måste få uttömmande information om preventivmedel och bör remitteras till preventivmedelsrådgivning om de inte redan använder sig av effektiva preventivmedel. Som lägsta krav måste fertila kvinnor använda minst en effektiv preventivmedelsmetod. Helst skall patienten använda två kompletterande preventivmedelsmetoder varav en bör vara en barriärmetod. Preventivmedelsanvändningen skall fortsätta i minst en månad efter att behandlingen med isotretinoin avslutats, detta gäller även patienter med amenorré. Graviditetstest I enlighet med lokal praxis rekommenderas att graviditetstest med en lägsta känslighet på 25 miu/ml genomförs på kliniken de 3 första dagarna i menstruationscykeln enligt följande. Före behandlingen: För att utesluta möjligheten för en eventuell graviditet innan patienten påbörjar en preventivmedelsbehandling rekommenderas att ett första graviditetstest genomförs på kliniken och att datum och resultat för testet registreras. Hos patienter med oregelbundna menstruationer bör val av tidpunkt för graviditetstestet anpassas efter patientens sexuella aktivitet och tas cirka tre veckor efter att patienten senast hade oskyddat samlag. Förskrivaren skall instruera patienten i antikonception. Ett graviditetstest utfört på kliniken skall också genomföras i samband med att isotretinoin förskrivs eller högst tre dagar innan besöket hos förskrivaren. Testet ska genomföras först när patienten använt effektiva preventivmedel i minst 1 månad. Detta test skall säkerställa att patienten inte är gravid när behandlingen med isotretinoin påbörjas. Uppföljningsbesök Uppföljningsbesöken bör planeras med 28 dagars mellanrum. Behovet av upprepade månatliga graviditetstest utförda på kliniken bör bedömas i enlighet med lokal praxis med hänsyn tagen till patientens sexuella aktivitet och tidigare menstruationsanamnes (onormala menstruationer, överhoppade menstruationer eller amenorré). I aktuella fall bör upprepade graviditetstest genomföras samma dag som förskrivningsbesöket eller högst tre dagar innan besöket hos förskrivaren. Behandlingens slut Fem veckor efter avslutad behandling bör kvinnor genomgå ett sista graviditetstest för att utesluta graviditet. Förskrivnings- och utlämningssrestriktioner Förskrivning av isotretinoin till fertila kvinnor bör begränsas till 30-dagars behandling och en fortsättning av behandlingen kräver ny förskrivning. I idealfallet sker graviditetstest, förskrivning och utlämning av isotretinoin på samma dag. Utlämning av isotretinoin bör ske inom maximalt sju dagar efter att receptet förskrivits. 13
14 Manliga patienter Det finns inget som tyder på att fertiliteten hos, eller avkomman till, manliga patienter skulle påverkas av isotretinoinanvändning. Manliga patienter bör dock påminnas om att de inte får lämna ut sin medicin till någon annan, särskilt inte till kvinnor. Ytterligare försiktighetsåtgärder Patienten skall instrueras att aldrig ge detta läkemedel till någon annan person och att återlämna eventuellt oanvända kapslar till apoteket vid avslutad behandling. Patienten får inte lämna blod under pågående behandling samt minst 1 månad efter utsättning av isotretinoin eftersom det föreligger en potentiell risk för fosterskada hos gravida som får blodtransfusion. Utbildningsmaterial För att hjälpa förskrivare, apotekspersonal och patienter att undvika fetal exponering av isotretinoin kommer innehavaren av försäljningstillståndet att tillhandahålla ett utbildningsmaterial som understryker varningarna om isotretinoins teratogenicitet, ger råd om preventivmedel innan behandlingen samt ger vägledning om behovet av graviditetstest. Fullständig patientinformation om den teratogena risken och de strikta graviditetsförebyggande åtgärderna i Program för att förhindra graviditet skall ges av läkare till alla patienter, både manliga och kvinnliga. Psykiska besvär Depression, psykotiska symtom och i sällsynta fall självmordsförsök och självmord har rapporterats hos patienter som behandlas med isotretinoin (se avsnitt 4.8 Biverkningar ). Särskild försiktighet skall iakttas för patienter med depression i anamnesen och alla patienter skall observeras efter tecken på depression och vid behov remitteras till lämplig behandling. Att sätta ut isotretinoin kan emellertid vara otillräckligt för att lindra symtomen och ytterligare psykiatrisk eller psykologisk utredning kan därför bli nödvändig. Problem i hud och underhud Akut försämring av aknen framträder då och då under den initiala behandlingen men avklingar under fortsatt behandling, vanligtvis inom 7 10 dagar. Normalt krävs ingen dosjustering. Exponering för intensivt solljus eller UV-strålning bör undvikas. Vid behov bör solskyddsmedel med hög skyddsfaktor på minst 15 användas. Aggressiv kemisk dermabrasio och kutan laserbehandling bör undvikas hos patienter som behandlas med isotretinoin och upp till 5-6 månader efter avslutad behandling på grund av risken för hypertrofisk ärrbildning i atypiska områden och i mer sällsynta fall postinflammatorisk hyper- eller hypopigmentering i de behandlade områdena. Vaxdepilering bör undvikas hos isotretioninbehandlade patienter och upp till minst 6 månader efter behandlingens slut på grund av risken för stripping av epidermis. Samtidig administrering av isotretinoin och topikala keratolytiska eller exfoliativa anti-aknemedel bör undvikas pga eventuellt ökad lokal irritation. Patienten bör rådas att använda mjukgörande salva eller kräm samt läppbalsam från behandlings start eftersom isotretinoin ofta orsakar torrhet i hud och läppar. Ögonbesvär Torra ögon, grumling av hornhinnan, försämrat mörkerseende och keratit försvinner vanligtvis när behandlingen sätts ut. Torra ögon kan lindras genom applicering av en smörjande ögonsalva eller tårsubstitut. Känslighet mot kontaktlinser förekommer och kan medföra att patienten måste använda glasögon under behandlingen. 14
15 Försämrat mörkerseende har också rapporterats och besvären har hos vissa patienter uppkommit plötsligt (se avsnitt 4.7 Effekter på förmågan att framföra fordon och använda maskiner ). Patienter som upplever synrubbningar bör remitteras till en specialist för oftalmologisk bedömning. Det kan bli nödvändigt att sätta ut isotretinoin. Muskuloskeletala och bindvävsbesvär Myalgi, artralgi och förhöjda kreatinfosfokinasvärden i serum har rapporterats hos patienter som använder isotretinoin, särskilt hos dem som utövar kraftig fysisk aktivitet (se avsnitt 4.8 Biverkningar ). Benförändringar, inklusive prematur epifysslutning hyperostos och förkalkning av senor och ligament har uppstått efter flera års användande av mycket höga doser isotretionin vid behandling av keratiniseringsbesvär. Dosnivåer, behandlingens längd och total kumulativ dos hos dessa patienter överskred vanligtvis vida de som rekommenderas vid behandling av akne. Ökat intrakraniellt tryck Fall med ökat intrakraniellt tryck har rapporterats, av vilka några inkluderade samtidig användning av tetracykliner (se avsnitten 4.3 Kontraindikationer och 4.5 Interaktioner med andra läkemedel och övriga interaktioner ). Tecken och symtom på ökat intrakraniellt tryck innefattar huvudvärk, illamående och kräkningar, synrubbningar och papillödem. Patienter som utvecklar ökat intrakraniellt tryck skall omedelbart avsluta isotretinoinbehandlingen. Leverpåverkan Leverenzymerna bör kontrolleras före behandling, 1 månad efter behandlingens start och därefter var tredje månad såvida inte tätare kontroller är kliniskt motiverat. Övergående och reversibel förhöjning av levertransaminasnivåer har rapporterats. I många fall har dessa förändringar hållit sig inom det normala intervallet och återgått till basnivåer under behandling. I händelse av ihållande kliniskt relevant förhöjning av transaminasnivåerna skall dosreduktion eller utsättning av behandlingen övervägas. Njurinsufficiens Njurinsufficiens och njursvikt påverkar inte isotretinoins farmakokinetik. Därför kan isotretinoin ges till patienter med njurinsufficiens. Det rekommenderas dock att patienterna får starta med en låg dos och titreras upp till maximalt tolererbar dos (se avsnitt 4.2 Dosering och administreringssätt ). Lipidmetabolism Serumlipider (fastevärden) bör kontrolleras före behandling, 1 månad efter behandlingens start och därefter var tredje månad såvida inte tätare kontroller är kliniskt motiverat. Förhöjda serumlipidvärden återgår vanligtvis till det normala vid dosminskning eller utsättning av behandlingen och kan också svara på dietåtgärder. Isotretionin har förknippats med förhöjda plasmatriglyceridnivåer. Isotretinoin skall sättas ut om hypertriglyceridemi inte kan kontrolleras på en acceptabel nivå eller om symtom på pankreatit uppstår (se avsnitt 4.8 Biverkningar ). Nivåer som överstiger 800 mg/dl eller 9 mmol/l förknippas ibland med akut pankreatit, vilket kan vara ett livshotande tillstånd. Gastrointestinala rubbningar Isotretinoin har satts i samband med inflammatorisk tarmsjukdom (t.ex. regional ileit) hos patienter utan tidigare anamnes av magtarmrubbningar. Patienter som upplever svår (hemorragisk) diarré skall omedelbart avbryta behandlingen med isotretinoin. Allergiska reaktioner Anafylaktiska reaktioner har rapporterats i sällsynta fall, ibland efter tidigare lokal behandling med retinoider. Allergiska kutana reaktioner har rapporterats sällan. Allvarliga fall av allergisk vaskulit, ofta med purpura (blåmärken och röda fläckar) på extremiteter och extrakutant engagemang har rapporterats. Svåra allergiska reaktioner gör det nödvändigt att avbryta behandlingen och kräver noggrann övervakning. 15
16 Högriskpatienter Patienter med diabetes, fetma, alkoholism eller rubbad lipidmetabolism och som genomgår behandling med isotretinoin kan behöva tätare kontroller av serumvärden för lipider och/eller blodglukos. Förhöjt fasteblodsocker har rapporterats och nya fall av diabetes har diagnostiserats under isotretinoinbehandling. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Patienter bör inte äta vitamin A i kombination med isotretinoin på grund av risken att utveckla hypervitaminos A. Fall med ökat intrakraniellt tryck (pseudotumor cerebri) har rapporterats vid samtidig användning av isotretinoin och tetracykliner. Samtidig behandling med tetracykliner måste därför undvikas (se avsnitt 4.3 Kontraindikationer och avsnitt 4.4 Varningar och försiktighetsmått ). 4.6 Graviditet och amning Graviditet är en absolut kontraindikation vid behandling med isotretinoin (se avsnitt 4.3 Kontraindikationer ). Om graviditet trots försiktighetsåtgärder inträffar under pågående behandling med isotretinoin eller under den efterföljande månaden föreligger en stor risk för mycket svår och allvarlig missbildning av fostret. De fetala missbildningar som förknippas med exponering för isotretinoin inkluderar missbildningar i det centrala nervsystemet (hydrocefalus, cerebellär missbildning/abnormitet, mikrocefali), ansiktsdysmorfi, gomspalt, missbildningar av ytterörat (avsaknad av ytteröra, små eller inga yttre hörselgångar), ögonabnormiteter (mikroftalmi), kardiovaskulära abnormiteter (konotrunkala missbildningar som Fallots tetrad, transposition av de stora blodkärlen, septumdefekter), tymus- och bisköldkörtelabnormiteter. Det förekommer också ökad incidens av spontana aborter. Skulle graviditet uppstå hos en kvinna som behandlas med isotretinoin, måste behandlingen avslutas och patienten ska remitteras till en läkare som är specialist i eller som har erfarenhet av teratologi för bedömning och rådgivning. Amning: Isotretinoin är ytterst lipofilt, varför passage av isotretinoin till bröstmjölk är sannolik. På grund av biverkningsrisken hos modern och det exponerade barnet är användning av isotretinoin hos ammande mödrar kontraindicerat. 4.7 Effekter på förmågan att framföra fordon och använda maskiner Ett antal fall av försämrat mörkerseende har uppstått under användning av isotretinoin och har i sällsynta fall bestått efter behandlingen (se avsnitt 4.4 Varningar och försiktighetsmått och avsnitt 4.8 Biverkningar ). Eftersom besvären kan komma plötsligt hos vissa patienter bör patienter informeras om denna eventuella risk och uppmanas att vara försiktiga vid framförande av fordon eller hantering av maskiner. 4.8 Biverkningar Följande symtom är de vanligaste rapporterade biverkningarna med isotretinoin: torrhet i slemhinnor t.ex. av läppar (keilit), näsans slemhinna (epistaxis) och ögonen (konjunktivit), torrhet i huden. Vissa biverkningar som associeras med användning av isotretinoin är dosrelaterade. Biverkningarna är vanligtvis reversibla efter dosjustering eller utsättning av behandlingen men vissa kan bestå efter att behandlingen har avslutats. 16
17 Infektioner: Mycket sällsynta ( 1/10 000) Sjukdomstillstånd i blodet och det lymfatiska systemet: Mycket vanliga ( 1/10) Vanlig ( 1/100, <1/10) Mycket sällsynta( 1/10 000) Rubbningar i immunsystemet: Sällsynta ( 1/10 000,<1/1000) Nutritionsrubbningar och ämnesomsättningssjukdomar: Mycket sällsynt ( 1/10 000) Psykiska sjukdomar: Sällsynta ( 1/10 000,<1/1000) Mycket sällsynta ( 1/10 000) Sjukdomar i nervsystemet: Vanlig ( 1/100, <1/10) Mycket sällsynta ( 1/10 000) Sjukdomar i ögat: Mycket vanliga ( 1/10) Mycket sällsynta ( 1/10 000) Sjukdomar i örat och labyrinten: Mycket sällsynta ( 1/10 000) Kärlsjukdomar: Mycket sällsynta ( 1/10 000) Sjukdomar i andningsorgan, bröstkorg och mediastinum: Vanliga ( 1/100, <1/10) Mycket sällsynta ( 1/10 000) Mag-tarmkanalens sjukdomar: Mycket sällsynta ( 1/10 000) Lever- och gallsjukdomar: Mycket vanliga ( 1/10) Mycket sällsynta ( 1/10 000) Hudens och underhudens sjukdomar: Mycket vanliga ( 1/10) Sällsynta ( 1/10 000,<1/1000) Mycket sällsynta ( 1/10 000) Grampositiv (mukokutan) bakteriell infektion Anemi, Förhöjd sänka, Trombocytopeni, Trombocytos Neutropeni Lymfadenopati Allergisk hudreaktion, Anafylaktiska reaktioner, Överkänslighet Diabetes mellitus, Hyperurikemi Depression Onormalt beteende, Psykotiska besvär, Självmordsförsök, Självmord Huvudvärk Ökat intrakraniellt tryck, Kramper, Dåsighet Blefarit, Konjunktivit, Torra ögon, Ögonirritation Dimsyn, Katarakt, Färgblindhet (defekter i färgseendet), Kontaktlinsintolerans, Korneal opacitet, Försämrat mörkerseende, Keratit, Papillödem (som tecken på förhöjt intrakraniellt tryck), Fotofobi Nedsatt hörsel Vaskulit (t ex Wegeners granulomatos, allergisk vaskulit) Epistaxis, Torrhet i näsan, Nasofaryngit Bronkospasm (särskilt hos patienter med astma), Heshet Kolit, Ileit, Torrhet i halsen, Gastrointestinal blödning, Hemorragisk diarré och inflammatorisk tarmsjukdom, Illamående, Pankreatit (se avsnitt 4.4 Varningar och försiktighetsmått ) Förhöjda transaminaser (se avsnitt 4.4 Varningar och försiktighetsmått ) Hepatit Keilit, Dermatit, Torr hud, Begränsad exfoliation, Klåda, Erytematöst utslag, Skör hud (och risk för friktionstrauma) Alopeci Acne fulminans, Försämrad akne (uppblossad akne), Erytem (i ansiktet), Exantem, Hårproblem, Hirsutism, Nagelförtvining, Paronyki, Ljuskänslighetsreaktion, Pyogent granulom, Hyperpigmentering i huden, Ökad svettning 17
18 Sjukdomar i muskulo-skeletala systemet och bindväven: Mycket vanliga ( 1/10) Mycket sällsynta ( 1/10 000) Artralgi, Myalgi, Ryggsmärta (särskilt ungdomar) Artrit, Kalcinos (förkalkning av ligament och senor), prematur epifysslutning, Exostos (hyperostos), Minskad bentäthet, Tendinit Njur- och urinvägssjukdomar: Mycket sällsynta ( 1/10 000) Glomerulonefrit Allmänna symtom/fynd vid administrationsstället: Mycket sällsynta ( 1/10 000) Granulationsvävnad (ökad bildning), Sjukdomskänsla Utredningar: Mycket vanliga ( 1/10) Vanliga ( 1/100, <1/10) Mycket sällsynta ( 1/10 000) Förhöjda blodtriglycerider, Minskat HDL-värde, Förhöjt blodkolesterol, Förhöjt blodglukos, Hematuri, Proteinuri Förhöjt blodkreatinfosfokinas * Biverkningsfrekvensen beräknades ur poolade kliniska försöksdata från 824 patienter och utifrån data efter marknadsföring av produkten Överdosering Isotretinoin är ett derivat av vitamin A. Trots att den akuta toxiciteten är låg kan tecken på hypervitaminos A uppträda vid oavsiktlig överdosering. Tecken på akut vitamin A-förgiftning inkluderar svår huvudvärk, illamående eller kräkningar, dåsighet, irritabilitet och klåda. Tecken och symtom på avsiktlig eller oavsiktlig överdosering med isotretinoin är troligtvis de samma. Symtomen förmodas vara reversibla och avklingar utan att behandling är nödvändig. 5. FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: Medel mot akne för systemisk användning, ATC-kod: D10BA01 Verkningsmekanism Isotretinoin är en stereoisomer av all-trans-retinoinsyra (tretinoin). Den exakta verkningsmekanismen av isotretinoin är ännu inte helt klarlagd men det har fastställts att förbättring i den kliniska bilden av svår akne associeras till hämning av talgkörtelaktiviteten och en histologiskt påvisad reduktion av talgkörtlarnas storlek. Vidare har en dermal anti-inflammatorisk effekt av isotretinoin kunnat fastställas. Effekt Ökad förhorning av talgkörtelns epitel leder till avstötning av korneocyter i körtelgången samt blockering av keratin och talgöverskott. Detta följs av komedonbildning och så småningom inflammatoriska lesioner. Isotretinoin hämmar proliferation av sebocyter och tycks verka på akne genom att återställa differentieringen. Talg är det huvudsakliga substratet för tillväxt av Propionibacterium acnes och reducerad talgproduktion hämmar på så vis den bakteriella koloniseringen av körtelgången. 5.2 Farmakokinetiska uppgifter Absorption Absorptionen av isotretinoin från magtarmkanalen varierar och är dos-linjär i det terapeutiska intervallet. Den absoluta biotillgängligheten av isotretinoin har inte fastställts eftersom det verksamma ämnet inte finns tillgängligt som intravenös beredning för humant bruk men extrapolering från försök på hund tyder på en relativt låg och variabel systemisk biotillgänglighet. Biotillgängligheten fördubblas om isotretinoin intas tillsammans med föda jämfört med om det tas på fastande mage. 18
19 Distribution Isotretinoin är i stor utsträckning bundet till plasmaproteiner, i huvudsak albumin (99,9 %). Distributionsvolymen för isotretinoin är inte fastställd hos människa eftersom isotretinoin inte finns tillgängligt som intravenös beredning för humant bruk. Det finns knapphändig information tillgänglig rörande vävnadsdistribution av isotretinoin hos människa. Koncentrationer av isotretinoin i epidermis är endast hälften av den i serum. Plasmakoncentrationer av isotretinoin är ungefär 1,7 gånger koncentrationen i helblod på grund av dålig penetrering av isotretinoin i röda blodkroppar. Metabolism Efter oral administrering av isotretinoin har tre huvudsakliga metaboliter identifierats i plasma: 4-oxoisotretinoin, tretinoin, (all-trans-retinoinsyra) och 4-oxo-tretinoin. Dessa metaboliter har visat biologisk aktivitet i flera in vitro test. 4-oxo-isotretinoin har i en klinisk studie visat sig bidra signifikant till isotretinoins effekt (reduktion i talgutsöndringshastighet trots icke mätbara plasmanivåer av isotretinoin och tretinoin). Andra mindre metaboliter är t.ex. glukuronidkonjugat. Den huvudsakliga metaboliten 4-oxo-isotretinoin uppnår plasmakoncentrationer vid steady-state som är 2,5 gånger högre än ursprungssubstansens. Isotretinoin och tretinoin (all-trans-retinoinsyra) metaboliseras reversibelt (interkonverteras) och metabolismen av tretinoin är därför förbunden med den för isotretinoin. Det har uppskattats att 20-30% av en isotretinoindos metaboliseras genom isomerisering. Enterohepatisk cirkulation kan spela en betydelsefull roll i farmakokinetiken av isotretinoin hos människa. Metabolismstudier in vitro visar att flera CYP-enzymer finns inblandade i metabolismen av isotretinoin till 4-oxo-isotretinoin och tretinoin. Ingen enskild isoform förefaller ha en dominerande roll. Isotretinoin och dess metaboliter påverkar inte CYP-aktiviteten i någon högre grad. Eliminering Efter oral administrering av radioaktivtmärkt isotretinoin återfanns ungefär lika stora dosfraktioner i urin och faeces. Efter oral administrering av isotretinoin är den slutgiltiga halveringstiden för elimination av oförändrad substans hos patienter med akne i medeltal 19 timmar. Den slutgiltiga halveringstiden för elimination av 4-oxo-isotretinoin är längre med ett medelvärde på 29 timmar. Isotretinoin är en fysiologisk retinoid och endogena retinoidkoncentrationer uppnås inom cirka två veckor efter isotretinoinbehandlingens slut. Farmakokinetik hos särskilda patientgrupper Eftersom isotretinoin är kontraindicerat hos patienter med nedsatt leverfunktion är informationen om kinetiken av isotretinoin begränsad för denna patientgrupp. Njursvikt reducerar inte plasmaclearance av isotretinoin eller 4-oxo-isotretinoin signifikant. 5.3 Prekliniska säkerhetsuppgifter Akut toxicitet Den akuta orala toxiciteten hos isotretinoin har fastställts i olika djurslag. LD 50 är ungefär 2000 mg/kg för kanin, cirka 3000 mg/kg för mus och över 4000 mg/kg för råtta. Kronisk toxicitet En långtidsstudie på råtta som pågick i över två år (isotretinoindoserna 2, 8 och 32 mg/kg/dag) visade tecken på partiellt håravfall och förhöjda plasmatriglycerider för de högre doserna. Biverkningsspektra för isotretinoin hos gnagare påminner därmed om det för vitamin A men innefattar inte den kraftiga vävnads- och organförkalkning som observerats med vitamin A hos råtta. Levercellförändringar som observerats med vitamin A förekom inte med isotretinoin. Alla observerade biverkningar som förekommer vid hypervitaminos A-syndrom var spontant reversibla efter att isotretinoin sattes ut. Även försöksdjur med dålig allmänstatus hade i stort sett återhämtat sig inom 1-2 veckor. 19
20 Teratogenicitet Liksom andra vitamin A-derivat har isotretinoin visat sig vara teratogent och embryotoxiskt i djurförsök. På grund av den teratogena potentialen hos isotretinoin finns det terapeutiska konsekvenser vid administrering till fertila kvinnor (se avsnitt 4.3 Kontraindikationer, avsnitt 4.4 Varningar och försiktighetsmått och avsnitt 4.6 Graviditet och amning ). Fertilitet Isotretinoin i terapeutiska doser påverkar inte antal, rörlighet eller morfologi hos spermier och äventyrar inte embryots bildning eller utveckling om det är mannen som använder isotretinoin. Mutagenicitet Isotretinoin har inte visat sig vara mutagent eller karcinogent i in vitro respektive in vivo djurförsök. 6. FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen (Se Bilaga I Implementeras nationellt) 6.2 Blandbarhet Ej relevant. 6.3 Hållbarhet <3 år><26 månader> (Implementeras nationellt) 6.4 Särskilda förvaringsanvisningar Förvaras vid högst 25 C. <Förvara kapslarna i blisterförpackningen och sedan i ytterkartongen. Ljuskänsligt. Fuktkänsligt.> (Se Bilaga I Implementeras nationellt) 6.5 Förpackningstyp och innehåll (Se Bilaga I Implementeras nationellt) Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras. 6.6 Anvisningar för användning och hantering <samt destruktion> Inga särskilda anvisningar. 7. INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING (Se Bilaga I Implementeras nationellt) 8. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 20
21 9. DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE 10. DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN 21
22 BILAGA IV VILLKOR FÖR GODKÄNNANDET FÖR FÖRSÄLJNING 22
23 Medlemsstaternas behöriga nationella myndigheter skall se till att innehavaren av godkännande för försäljning uppfyller följande villkor. 1. Förskrivning av (oralt) isotretinoin till fertila kvinnor bör ske bara med tillämpning av strikta graviditetsförebyggande åtgärder som stöds av innehavarens graviditetsförebyggande program. Detta gäller även kvinnor som för närvarande inte är sexuellt aktiva, såvida inte den förskrivande läkaren anser att det finns mycket starka skäl att anta att det saknas risk för graviditet. Innehavaren måste komma överens med de behöriga nationella myndigheterna om de närmare detaljerna för det graviditetsförebyggande programmet och måste genomföra detta program nationellt. 2. Innehavaren måste se till att läkare och apotekare har informerats om den teratogena risken och om det graviditetsförebyggande programmet. Det graviditetsförebyggande programmet består av tre delar. a. Utbildningsprogram: Ökade insikter hos både patienter och läkare om de teratogena riskerna. Bättre information till kvinnliga patienter, ökad medvetenhet hos dessa och tydligare bekräftelse från deras sida av att de förstår riskerna. b. Reglering av behandlingen: Innehavaren bör förse de förskrivande läkarna med ett lämpligt utbildningsmaterial (se nedan) som de kan ge till patienterna. Medicinskt övervakade graviditetstester före behandlingen, under denna och fem veckor efter det att den avslutats. Användning, innan behandlingen påbörjas, av minst en effektiv preventivmetod och helst två olika preventivmetoder som kompletterar varandra, inbegripet en barriärmetod. c. Reglering av distributionen: Restriktioner i fråga om utlämning av läkemedlet. Utlämning av läkemedel för 30 dagars behandling. Receptet giltigt i sju dagar. 3. Innehavaren måste ge de förskrivande läkarna informationen att om en kvinna som behandlas med isotretinoin blir gravid, måste behandlingen avbrytas och patienten remitteras för bedömning och rådgivning till en läkare som är specialiserad på eller har erfarenhet av teratologi. Den förskrivande läkaren bör omedelbart rapportera varje fall av graviditet och misstänkt embryo- eller fosterexponering hos en behandlad patient till den behöriga myndigheten och till innehavaren. Varje fall av graviditet eller misstänkt embryo- eller fosterexponering hos en behandlad patient som kommer till innehavarens kännedom bör av innehavaren omedelbart och under alla omständigheter senast 15 kalenderdagar efter mottagandet av informationen rapporteras till den behöriga myndigheten i den medlemsstat inom vars territorium händelsen inträffat. Alla fall av exponering bör övervakas noga och följas upp med användning av ett särskilt formulär som tar upp all relevant information. Denna information bör minst omfatta tidpunkten för graviditetens början, graviditetens status, efterlevnaden av det graviditetsförebyggande programmet (preventivmedelsanvändning, graviditetstester, patientinformation osv.), riskfaktorer och graviditetens utfall. Innehavaren måste, under perioden mellan CPMP:s yttrande och kommissionens beslut, komma överens med CPMP om hur detta formulär för uppföljning skall se ut. 4. För att hjälpa förskrivande läkare, apotekare och patienter att undvika att foster exponeras för isotretinoin måste innehavaren komma överens med de behöriga nationella myndigheterna om innehållet i följande broschyrer: 23
24 En vägledning i förskrivning av isotretinoin, riktad till läkare. En vägledning i utlämning av isotretinoin, riktad till apotekare. En checklista för förskrivning till kvinnliga patienter. En broschyr med patientinformation. En broschyr om preventivmedelsanvändning. Ett formulär där kvinnliga patienter bekräftar att de har fått information osv. (i den mån detta krävs på platsen). De ovannämnda utbildningsmaterialen bör strikt uppfylla kraven i produktresumén och bipacksedeln och det graviditetsförebyggande program som bestämts i samråd med den behöriga myndigheten. 5. Innehavaren måste till EMEA lämna in en utförlig rapport om det nationella genomförandet av det graviditetsförebyggande programmet i alla medlemsstaterna, sex månader efter Europeiska kommissionens beslut. I rapporten bör innehavaren beskriva de förfaranden och bedömningskriterier man infört för att se till att det graviditetsförebyggande programmet får avsedd effekt. 6. De periodiska säkerhetsuppdateringsrapporterna (PSUR) skall lämnas in årligen. Innehavaren bör förse EMEA, referensmedlemsstaten och de berörda medlemsstaterna med en graviditetsredogörelse, inbegripet en rapport om det graviditetsförebyggande programmet med anknytning till isotretinoin och en samlad bedömning av gravida personers exponering för läkemedlet samt utfallet för dessa. Sådana redogörelser lämnas in var sjätte månad de första två åren efter Europeiska kommissionens beslut och varje år därefter. Rapporten bör ge information om de åtgärder som vidtagits för att se till att det graviditetsförebyggande programmet fungerar väl och för att bedöma om så är fallet. 7. Innehavaren måste åta sig att inte dela ut några gratisprover av läkemedlet. 24
Läkarens vägledning till förskrivning av isotretinoin
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoin) Läkarens vägledning till förskrivning av isotretinoin Det förebyggande programmet mot graviditet och exponering av foster Inledning
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoin) Läkarens vägledning till förskrivning av isotretinoin Det förebyggande programmet mot graviditet och exponering av foster Inledning
10 mg Mjuka kapslar Oral Blister 30, 100
 BILAGA I FÖRTECKNING ÖVER NAMN, LÄKEMEDELSFORM, LÄKEMEDELSSTYRKOR, ADMINISTRERINGSSÄTT, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING, FÖRPACKNINGAR OCH FÖRPACKNINGSSTORLEKAR I MEDLEMSSTATERNA CPMP/2846/03
BILAGA I FÖRTECKNING ÖVER NAMN, LÄKEMEDELSFORM, LÄKEMEDELSSTYRKOR, ADMINISTRERINGSSÄTT, INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING, FÖRPACKNINGAR OCH FÖRPACKNINGSSTORLEKAR I MEDLEMSSTATERNA CPMP/2846/03
Huvudutbildningsmaterial EU. Isotretinoin 10 mg respektive 20 mg, mjuka kapslar
 Version Nr 2.0 Datum 08.12.2015 Ersätter version 1.0 Datum 03.09.2013 Ref. RMP Version nr 4.0 19-08-2013 Huvudutbildningsmaterial EU Isotretinoin 10 mg respektive 20 mg, mjuka kapslar 1 Innehåll 1. Läkarens
Version Nr 2.0 Datum 08.12.2015 Ersätter version 1.0 Datum 03.09.2013 Ref. RMP Version nr 4.0 19-08-2013 Huvudutbildningsmaterial EU Isotretinoin 10 mg respektive 20 mg, mjuka kapslar 1 Innehåll 1. Läkarens
84, 90, 100, 112, 120, 84, 90, 100, 112, 120, 168 & 180 168 & 180
 BILAGA I LISTA ÖVER NAMN, FARMACEUTISK FORM, STYRKA PÅ DEN MEDICINSKA PRODUKTEN, ADMINISTRERINGSVÄG, SÖKANDE, INNEHAVARE AV MARKNADSRÄTTIGHETER, FÖRPACKNING OCH FÖRPACKNINGSSTORLEKAR I VARJE MEDLEMSSTAT
BILAGA I LISTA ÖVER NAMN, FARMACEUTISK FORM, STYRKA PÅ DEN MEDICINSKA PRODUKTEN, ADMINISTRERINGSVÄG, SÖKANDE, INNEHAVARE AV MARKNADSRÄTTIGHETER, FÖRPACKNING OCH FÖRPACKNINGSSTORLEKAR I VARJE MEDLEMSSTAT
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 1 (3) 17 februari 2016 isotretinoin Version: 4.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Det finns flera
1 (3) 17 februari 2016 isotretinoin Version: 4.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information om sjukdomsförekomst Det finns flera
PRODUKTRESUMÉ. 600 mg brustablett innehåller 138,8 mg natrium, motsvarande 7% av WHOs högsta rekommenderat
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
4.3 Kontraindikationer Överkänslighet mot ketokonazol eller mot något hjälpämne som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
4.1 Terapeutiska indikationer Typherix används för aktiv immunisering mot tyfoidfeber av vuxna och barn från 2 års ålder.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller: Dextran 70 1,0 mg och hypromellos
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller: Dextran 70 1,0 mg och hypromellos
BILAGA III Ändringar av relevanta avsnitt i produktinformationen
 BILAGA III Ändringar av relevanta avsnitt i produktinformationen OBS: Dessa ändringar av relevanta avsnitt i produktresumén och bipacksedeln är resultatet av hänskjutandeförfarandet. Produktinformationen
BILAGA III Ändringar av relevanta avsnitt i produktinformationen OBS: Dessa ändringar av relevanta avsnitt i produktresumén och bipacksedeln är resultatet av hänskjutandeförfarandet. Produktinformationen
Hjälpämnen med känd effekt: Natrium: Varje brustablett innehåller 195,43 mg natrium (8,52 mmol natrium). Sackaros.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Acetylcystein Alternova 200 mg brustabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 brustablett innehåller acetylcystein 200 mg. Hjälpämnen med känd effekt: Natrium:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Acetylcystein Alternova 200 mg brustabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 brustablett innehåller acetylcystein 200 mg. Hjälpämnen med känd effekt: Natrium:
Bilaga III. Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel
 Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
PRODUKTRESUMÉ. Barn: Glukosamin Pharma Nord skall inte ges till barn och ungdomar under 18 år.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
Gul till brun viskös lösning med apelsinsmak. Partiklar från växtmaterial kan förekomma.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
Endosbehållare ska kasseras omedelbart efter användning. Oanvänt innehåll ska ej sparas.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Oculac 50 mg/ml ögondroppar, lösning i endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller 50 mg povidon K25. För fullständig förteckning över hjälpämnen,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Oculac 50 mg/ml ögondroppar, lösning i endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller 50 mg povidon K25. För fullständig förteckning över hjälpämnen,
Hjälpämnen med känd effekt: Laktosmonohydrat motsvarande mg vattenfri laktos per tablett.
 1. LÄKEMEDLETS NAMN Lyngonia, filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje filmdragerad tablett innehåller: 361 509 mg extrakt (som torrt extrakt) från Arctostaphylos uva-ursi
1. LÄKEMEDLETS NAMN Lyngonia, filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje filmdragerad tablett innehåller: 361 509 mg extrakt (som torrt extrakt) från Arctostaphylos uva-ursi
- lindra lättare ledsmärta. - lindra lättare matsmältningsbesvär, såsom uppblåsthet och gaser samt tillfällig aptitförlust.
 1. LÄKEMEDLETS NAMN Harpatinum, mjuk kapsel 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje kapsel innehåller: 225 mg extrakt (som torrt extrakt) från Harpagophytum procumbens DC. och/eller Harpagophytum
1. LÄKEMEDLETS NAMN Harpatinum, mjuk kapsel 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje kapsel innehåller: 225 mg extrakt (som torrt extrakt) från Harpagophytum procumbens DC. och/eller Harpagophytum
BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET SOM SKALL GENOMFÖRAS AV MEDLEMSSTATERNA
 BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET SOM SKALL GENOMFÖRAS AV MEDLEMSSTATERNA 1 Medlemsstaterna måste garantera att alla villkor eller begränsningar
BILAGA VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE EN SÄKER OCH EFFEKTIV ANVÄNDNING AV LÄKEMEDLET SOM SKALL GENOMFÖRAS AV MEDLEMSSTATERNA 1 Medlemsstaterna måste garantera att alla villkor eller begränsningar
Farmaceutens vägledning till utlämning av isotretinoin
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoin) Farmaceutens vägledning till utlämning av isotretinoin Det förebyggande programmet mot graviditet och exponering av foster Inledning
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoin) Farmaceutens vägledning till utlämning av isotretinoin Det förebyggande programmet mot graviditet och exponering av foster Inledning
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN. Cleari 0,12mg/ml ögondroppar, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Cleari 0,12mg/ml ögondroppar, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Nafazolinhydroklorid 0,12 mg/ml Hjälpämne(n) med känd effekt: bensalkoniumklorid 0,1
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Cleari 0,12mg/ml ögondroppar, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Nafazolinhydroklorid 0,12 mg/ml Hjälpämne(n) med känd effekt: bensalkoniumklorid 0,1
PRODUKTRESUMÉ. Hjälpämne med känd effekt: sorbitol, flytande (icke-kristalliserande); 1 ml sirap innehåller 495,6 mg sorbitol (E 420).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Mucohelix, sirap 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml (1,18 g) Mucohelix innehåller 8,25 mg torrt extrakt av Hedera helix L. (murgröna), folium motsvarande
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Mucohelix, sirap 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml (1,18 g) Mucohelix innehåller 8,25 mg torrt extrakt av Hedera helix L. (murgröna), folium motsvarande
PRODUKTRESUMÉ. Vuxna och barn (från 12 år ): 2-4 tuggtabletter efter måltid och vid sänggående (högst fyra gånger per dygn).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Galieve Peppermint tuggtablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tuggtablett innehåller: Natriumalginat Natriumvätekarbonat Kalciumkarbonat 250 mg 133,5 mg
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Galieve Peppermint tuggtablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tuggtablett innehåller: Natriumalginat Natriumvätekarbonat Kalciumkarbonat 250 mg 133,5 mg
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glucosine 625 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller glukosaminsulfat-natriumklorid-komplex motsvarande 625 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glucosine 625 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller glukosaminsulfat-natriumklorid-komplex motsvarande 625 mg glukosamin
PRODUKTRESUMÉ. Ett gram ögonsalva innehåller fusidinsyrahemihydrat motsvarande fusidinsyra 10 mg.
 1 LÄKEMEDLETS NAMN Fucithalmic 1% ögonsalva PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram ögonsalva innehåller fusidinsyrahemihydrat motsvarande fusidinsyra 10 mg. Hjälpämne med känd
1 LÄKEMEDLETS NAMN Fucithalmic 1% ögonsalva PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram ögonsalva innehåller fusidinsyrahemihydrat motsvarande fusidinsyra 10 mg. Hjälpämne med känd
Denna information är avsedd för vårdpersonal.
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN NorLevo 1,5 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller 1,5 mg levonorgestrel. Hjälpämne: varje tablett
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN NorLevo 1,5 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller 1,5 mg levonorgestrel. Hjälpämne: varje tablett
4.1 Terapeutiska indikationer Säsongsbunden och perenn allergisk rinit samt vasomotorisk rinit. Symtomatisk behandling vid näspolypos.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rhinocort Turbuhaler 100 mikrogram/dos näspulver. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Budesonid 100 mikrogram/dos. 3 LÄKEMEDELSFORM Näspulver. 4 KLINISKA UPPGIFTER
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rhinocort Turbuhaler 100 mikrogram/dos näspulver. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Budesonid 100 mikrogram/dos. 3 LÄKEMEDELSFORM Näspulver. 4 KLINISKA UPPGIFTER
Patientinformation från Hudkliniken i Östergötland. Läs igenom denna produktinformation noggrant innan du börjar använda läkemedlet.
 Isotretinoin Patientinformation från Hudkliniken i Östergötland Läs igenom denna produktinformation noggrant innan du börjar använda läkemedlet. Spara denna produktinformation. Du kan komma att behöva
Isotretinoin Patientinformation från Hudkliniken i Östergötland Läs igenom denna produktinformation noggrant innan du börjar använda läkemedlet. Spara denna produktinformation. Du kan komma att behöva
Isotretinoin 10 mg och 20 mg kapslar
 Sida 1 (6) Isotretinoin 10 mg och 20 mg kapslar Isotretinoin innehåller den aktiva substansen isotretinoin som tillhör en grupp läkemedel som kallas retinoider vilka är besläktade med A-vitamin. Den minskar
Sida 1 (6) Isotretinoin 10 mg och 20 mg kapslar Isotretinoin innehåller den aktiva substansen isotretinoin som tillhör en grupp läkemedel som kallas retinoider vilka är besläktade med A-vitamin. Den minskar
En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
4.3 Kontraindikationer Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Basiron AC Wash 5% gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram gel innehåller bensoylperoxid 50 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Basiron AC Wash 5% gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram gel innehåller bensoylperoxid 50 mg. För fullständig förteckning över hjälpämnen, se avsnitt
Toctino (alitretinoin)
 PATIENTINFORMATIONSBROSCHYR Toctino (alitretinoin) Graviditetsförebyggande program TOC-FI-002-051208-D Om denna broschyr Denna broschyr innehåller viktig information rörande din behandling med Toctino
PATIENTINFORMATIONSBROSCHYR Toctino (alitretinoin) Graviditetsförebyggande program TOC-FI-002-051208-D Om denna broschyr Denna broschyr innehåller viktig information rörande din behandling med Toctino
1 LÄKEMEDLETS NAMN Dalacin 10 mg/ml kutan emulsion
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Dalacin 10 mg/ml kutan emulsion 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan emulsion innehåller: Klindamycin-2-fosfat motsvarande klindamycin 10 mg. För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Dalacin 10 mg/ml kutan emulsion 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan emulsion innehåller: Klindamycin-2-fosfat motsvarande klindamycin 10 mg. För fullständig
PRODUKTRESUMÉ. En tablett innehåller 625 mg glukosamin (som glukosaminhydroklorid).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Glucomed 625 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 625 mg glukosamin (som glukosaminhydroklorid). För fullständig förteckning
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Glucomed 625 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 625 mg glukosamin (som glukosaminhydroklorid). För fullständig förteckning
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg benzydaminhydroklorid motsvarande 2,68 mg benzydamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zyx apelsin & honung 3 mg sugtablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg benzydaminhydroklorid motsvarande 2,68 mg benzydamin. Hjälpämnen
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zyx apelsin & honung 3 mg sugtablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg benzydaminhydroklorid motsvarande 2,68 mg benzydamin. Hjälpämnen
4.1 Terapeutiska indikationer Behandling av seborroisk dermatit i hårbotten och pityriasis capitis (mjällbildning).
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ketoconazol Actavis 20 mg/g schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g schampo innehåller ketokonazol 20 mg För fullständig förteckning över hjälpämnen, se
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ketoconazol Actavis 20 mg/g schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g schampo innehåller ketokonazol 20 mg För fullständig förteckning över hjälpämnen, se
med känslig hud bör rekommenderas att använda gelen en gång dagligen före sänggåendet.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Basiron AC 5% gel Basiron AC 10% gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram gel innehåller bensoylperoxid 50 mg respektive 100 mg. Hjälpämne med känd effekt:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Basiron AC 5% gel Basiron AC 10% gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram gel innehåller bensoylperoxid 50 mg respektive 100 mg. Hjälpämne med känd effekt:
Hjälpämne med känd effekt: 1 ml innehåller 0,125 mg benzalkoniumklorid.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Lastin 0,5 mg/ml ögondroppar, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Azelastinhydroklorid 0,05% (0,5 mg/ml). Varje droppe innehåller 0,015 mg azelastinhydroklorid.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Lastin 0,5 mg/ml ögondroppar, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Azelastinhydroklorid 0,05% (0,5 mg/ml). Varje droppe innehåller 0,015 mg azelastinhydroklorid.
ÄNDRINGAR SOM SKA INKLUDERAS I DE RELEVANTA AVSNITTEN I PRODUKTRESUMÉN FÖR NIMESULID-INNEHÅLLANDE LÄKEMEDEL (SYSTEMISKA FORMULERINGAR)
 BILAGA III 1 ÄNDRINGAR SOM SKA INKLUDERAS I DE RELEVANTA AVSNITTEN I PRODUKTRESUMÉN FÖR NIMESULID-INNEHÅLLANDE LÄKEMEDEL (SYSTEMISKA FORMULERINGAR) Tillägg är kursiverade och understrukna, raderingar är
BILAGA III 1 ÄNDRINGAR SOM SKA INKLUDERAS I DE RELEVANTA AVSNITTEN I PRODUKTRESUMÉN FÖR NIMESULID-INNEHÅLLANDE LÄKEMEDEL (SYSTEMISKA FORMULERINGAR) Tillägg är kursiverade och understrukna, raderingar är
3 LÄKEMEDELSFORM Vit till benvit, oval tablett märkt med kolv och skål, skåra och 10 på en sida, slät på den andra sidan.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Clarityn 10 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller 10 mg loratadin. Mängden laktosmonohydrat i en 10 mg loratadintablett är 71,3
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Clarityn 10 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje tablett innehåller 10 mg loratadin. Mängden laktosmonohydrat i en 10 mg loratadintablett är 71,3
Isotretinoin Actavis
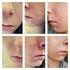 Förebyggande av graviditet och exponering av foster Patientvägledning Isotretinoin Actavis (isotretinoin) 10 mg respektive 20 mg, mjuka kapslar Isotretinoin Patientvägledning Syftet med broschyren Den
Förebyggande av graviditet och exponering av foster Patientvägledning Isotretinoin Actavis (isotretinoin) 10 mg respektive 20 mg, mjuka kapslar Isotretinoin Patientvägledning Syftet med broschyren Den
BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL. Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid
 BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer
BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
4.3 Kontraindikationer Överkänslighet mot den aktiva substansen, famciklovir eller mot något hjälpämne i som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectavir 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectavir kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol, propylenglykol.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectavir 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectavir kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol, propylenglykol.
PRODUKTRESUMÉ. För att förbättra perifer och cerebral vaskulär cirkulation. För förbättring av matthet, slöhet och allmänt medvetande hos hundar.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Canergy vet. 100 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller: Aktiv substans: Propentofyllin 100 mg
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Canergy vet. 100 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller: Aktiv substans: Propentofyllin 100 mg
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN. Isotretinoin Orifarm 10 mg kapslar, mjuka Isotretinoin Orifarm 20 mg kapslar, mjuka
 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje
PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje
4.1 Terapeutiska indikationer Soluvit tillgodoser det dagliga behovet av vattenlösliga vitaminer vid intravenös nutrition.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Soluvit pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 flaska innehåller: Motsvarande: Tiaminnitrat 3,1 mg Tiamin (vitamin B 1 ) 2,5
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Soluvit pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 flaska innehåller: Motsvarande: Tiaminnitrat 3,1 mg Tiamin (vitamin B 1 ) 2,5
För användning på hud. Krämen appliceras med ett rent finger på det påverkade hudområdet.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectatone 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectatone kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol. För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectatone 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectatone kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol. För fullständig
PRODUKTRESUMÉ. Poliovirus typ 1 (Brunhilde), typ 2 (MEF-1) och typ 3 (Saukett), förökat i Vero-celler, är renat och inaktiverat.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN VeroPol, injektionsvätska, lösning i förfylld spruta 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Per dos = 0,5 ml: Poliovirus typ 1, inaktiverat Poliovirus typ 2, inaktiverat
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN VeroPol, injektionsvätska, lösning i förfylld spruta 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Per dos = 0,5 ml: Poliovirus typ 1, inaktiverat Poliovirus typ 2, inaktiverat
PRODUKTRESUMÉ. Vuxna och barn över 10 år: 1 spraydos i vardera näsborren vid behov, högst 3 gånger dagligen i högst 10 dagar.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zymelin Mentol, 1 mg/ml nässpray, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Xylometazolinhydroklorid 1 mg/ml (En dos innehåller 140 mikrogram). För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zymelin Mentol, 1 mg/ml nässpray, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Xylometazolinhydroklorid 1 mg/ml (En dos innehåller 140 mikrogram). För fullständig
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Addaven innehåller: 1 ml 1 ampull (10 ml) Ferrikloridhexahydrat 0,54 mg 5,40
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Addaven innehåller: 1 ml 1 ampull (10 ml) Ferrikloridhexahydrat 0,54 mg 5,40
Innehållet är sterilt tills endosbehållaren bryts. För att undvika kontaminering får behållarens spets inte beröras.
 Produktresumé (SPC): Denna text är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Zaditen 0,25 mg/ml, ögondroppar, lösning endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 0,4 ml innehåller 0,138
Produktresumé (SPC): Denna text är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Zaditen 0,25 mg/ml, ögondroppar, lösning endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 0,4 ml innehåller 0,138
Pediatrisk population Effekt och säkerhet av ketoprofen vid behandling av barn har inte fastställts.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Siduro 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Siduro 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
4.1 Terapeutiska indikationer Användes för att lösa upp urinsyrastenar och för att förhindra deras nybildning.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Renapur granulat. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 g granulat innehåller kaliumnatriumvätecitrat (6:6:3:5) 97,108 g. Hjälpämne med känd effekt: para-orange
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Renapur granulat. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 g granulat innehåller kaliumnatriumvätecitrat (6:6:3:5) 97,108 g. Hjälpämne med känd effekt: para-orange
4.2 Dosering och administreringssätt Dosering 1 droppe 4 gånger dagligen med början första dagen efter kirurgi.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller diklofenaknatrium 1 mg. Hjälpämne med känd effekt: bensalkoniumklorid
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller diklofenaknatrium 1 mg. Hjälpämne med känd effekt: bensalkoniumklorid
Aktiv substans 1 kapsel à 25 mg innehåller: Klindamycinhydroklorid 29 mg motsvarande klindamycin 25 mg (vit/gul kapsel).
 PRODUKTRESUMÉ 1 DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Antirobe vet. 25 mg hårda kapslar, hund och katt Antirobe vet. 75 mg hårda kapslar, hund och katt Antirobe vet. 150 mg hårda kapslar, hund Antirobe
PRODUKTRESUMÉ 1 DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Antirobe vet. 25 mg hårda kapslar, hund och katt Antirobe vet. 75 mg hårda kapslar, hund och katt Antirobe vet. 150 mg hårda kapslar, hund Antirobe
BILAGA III ÄNDRINGAR TILL PRODUKTRESUMÉ OCH BIPACKSEDEL
 BILAGA III ÄNDRINGAR TILL PRODUKTRESUMÉ OCH BIPACKSEDEL Dessa ändringar i produktresumé och bipacksedel är giltiga vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer medlemsstaternas
BILAGA III ÄNDRINGAR TILL PRODUKTRESUMÉ OCH BIPACKSEDEL Dessa ändringar i produktresumé och bipacksedel är giltiga vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer medlemsstaternas
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
Huddesinfektion i syfte att avdöda mikroorganismer samt förebygga infektion och/eller kolonisation.
 PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Hibiscrub 40 mg/ml kutan lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan lösning innehåller: klorhexidindiglukonat 40 mg. För fullständig förteckning
PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Hibiscrub 40 mg/ml kutan lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan lösning innehåller: klorhexidindiglukonat 40 mg. För fullständig förteckning
Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat, cetostearylalkohol, propylenglykol.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Karbamid Evolan 50 mg/g kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g kräm innehåller karbamid (urea) 50 mg. Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Karbamid Evolan 50 mg/g kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g kräm innehåller karbamid (urea) 50 mg. Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat,
PRODUKTRESUMÉ. Isotretinoin Actavis 10 mg: Ljuslila, ovala, mjuka gelatinkapslar innehållande en gul/orange
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Isotretinoin Actavis 10 mg mjuka kapslar Isotretinoin Actavis 20 mg mjuka kapslar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje kapsel innehåller 10 mg isotretinoin.
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Isotretinoin Actavis 10 mg mjuka kapslar Isotretinoin Actavis 20 mg mjuka kapslar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje kapsel innehåller 10 mg isotretinoin.
PRODUKTRESUMÉ. Ljusbrun tablett med bruna prickar, rund och konvex smaksatt tablett med kryssformad brytskåra på ena sidan.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Metrobactin vet 250 mg tabletter för hund och katt Metrobactin vet 500 mg tabletter för hund och katt 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Metrobactin vet 250 mg tabletter för hund och katt Metrobactin vet 500 mg tabletter för hund och katt 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Artrox 625 mg filmdragerad tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin. Hjälpämne
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Artrox 625 mg filmdragerad tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin. Hjälpämne
Denna information är avsedd för vårdpersonal. Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En endosbehållare (0,3 ml) innehåller
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En endosbehållare (0,3 ml) innehåller
Ibaflin används för behandling av följande sjukdomstillstånd hos hund:
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN 30 mg tabletter för hund 150 mg tabletter för hund 300 mg tabletter för hund 900 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN 30 mg tabletter för hund 150 mg tabletter för hund 300 mg tabletter för hund 900 mg tabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett
Denna information är avsedd för vårdpersonal.
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Loratadin Sandoz 10 mg munsönderfallande tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En munsönderfallande tablett innehåller 10
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Loratadin Sandoz 10 mg munsönderfallande tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En munsönderfallande tablett innehåller 10
Lindring av inflammation och smärta vid både akuta och kroniska sjukdomar i muskler, leder och skelett hos hundar.
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Metacam 1 mg tuggtabletter för hund Metacam 2,5 mg tuggtabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tuggtablett innehåller: Aktiv substans:
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Metacam 1 mg tuggtabletter för hund Metacam 2,5 mg tuggtabletter för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tuggtablett innehåller: Aktiv substans:
Delområden av en offentlig sammanfattning
 EU RMP alitretinoin v8 maj 2014 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst I telefon- och e-postundersökningar bland vuxna i Nord- och Centraleuropa uppgav 6
EU RMP alitretinoin v8 maj 2014 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst I telefon- och e-postundersökningar bland vuxna i Nord- och Centraleuropa uppgav 6
En tablett innehåller 10 mg loratadin. Hjälpämnen med känd effekt: mängden laktosmonohydrat i en 10 mg loratadintablett är 75 mg.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Loratadin Apofri 10 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 10 mg loratadin. Hjälpämnen med känd effekt: mängden laktosmonohydrat
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Loratadin Apofri 10 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 10 mg loratadin. Hjälpämnen med känd effekt: mängden laktosmonohydrat
Orala retinoider är mycket teratogena och ska inte användas under graviditet.
 16- Aug-2018 Retinoider (acitretin, adapalen, alitretinoin, bexaroten, isotretinoin, tazaroten och tretinoin) Uppdatering avseende teratogenicitet och neuropsykiatriska störningar Säkerhetsinformation
16- Aug-2018 Retinoider (acitretin, adapalen, alitretinoin, bexaroten, isotretinoin, tazaroten och tretinoin) Uppdatering avseende teratogenicitet och neuropsykiatriska störningar Säkerhetsinformation
Bipacksedel: Information till användaren. Clarityn 10 mg tabletter loratadin
 Bipacksedel: Information till användaren Clarityn 10 mg tabletter loratadin Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig. - Spara
Bipacksedel: Information till användaren Clarityn 10 mg tabletter loratadin Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig. - Spara
4.1 Terapeutiska indikationer Loratadin Hexal är avsett för symptomatisk behandling av allergisk rinit och kronisk idiopatisk urtikaria.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Loratadin HEXAL 10 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 10 mg loratadin Beträffande hjälpämnen se 6.1. 3 LÄKEMEDELSFORM Tablett
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Loratadin HEXAL 10 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 10 mg loratadin Beträffande hjälpämnen se 6.1. 3 LÄKEMEDELSFORM Tablett
PRODUKTRESUMÉ. Vid besvär från andningsvägarna rekommenderas medicinsk rådgivning om symtomen inte förbättras.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bisolvon 8 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: bromhexinhydroklorid 8 mg Hjälpämnen: laktosmonohydrat 74 mg För fullständig
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bisolvon 8 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: bromhexinhydroklorid 8 mg Hjälpämnen: laktosmonohydrat 74 mg För fullständig
PRODUKTRESUMÉ. 1. LÄKEMEDLETS NAMN Bion Tears 1 mg/ml + 3 mg/ml ögondroppar, lösning, endosbehållare
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bion Tears 1 mg/ml + 3 mg/ml ögondroppar, lösning, endosbehållare 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller 1 mg dextran 70 och 3 mg hypromellos.
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Bion Tears 1 mg/ml + 3 mg/ml ögondroppar, lösning, endosbehållare 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller 1 mg dextran 70 och 3 mg hypromellos.
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Provera 10 mg tabletter
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Provera 5 mg tabletter Provera 10 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller medroxiprogesteronacetat 5 mg resp. 10 mg. Hjälpämnen med
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Provera 5 mg tabletter Provera 10 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller medroxiprogesteronacetat 5 mg resp. 10 mg. Hjälpämnen med
PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING. Denna produkt innehåller 20 mg guaifenesin i varje ml.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Nipenesin 20 mg/ml sirap 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Denna produkt innehåller 20 mg guaifenesin i varje ml. Hjälpämnen med känd effekt: Etanol 0,0519 ml/ml
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Nipenesin 20 mg/ml sirap 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Denna produkt innehåller 20 mg guaifenesin i varje ml. Hjälpämnen med känd effekt: Etanol 0,0519 ml/ml
PRODUKTRESUMÉ. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 suppositorium innehåller: Prednisolonkaproat 1,3 mg, cinkokainhydroklorid 1 mg.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Scheriproct 1,3 mg/1 mg suppositorium 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 suppositorium innehåller: Prednisolonkaproat 1,3 mg, cinkokainhydroklorid 1 mg. För
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Scheriproct 1,3 mg/1 mg suppositorium 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 suppositorium innehåller: Prednisolonkaproat 1,3 mg, cinkokainhydroklorid 1 mg. För
Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig.
 Källa: FASS Bipacksedel: Information till användaren Clarityn 10 mg Tabletter Loratadin Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för
Källa: FASS Bipacksedel: Information till användaren Clarityn 10 mg Tabletter Loratadin Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för
4.1 Terapeutiska indikationer Lindrig och medelsvår ulcerös kolit. Proktit och proktosigmoidit.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pentasa 1 g rektalsuspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 ml innehåller 1 g mesalazin (5-aminosalicylsyra). Beträffande hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pentasa 1 g rektalsuspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 ml innehåller 1 g mesalazin (5-aminosalicylsyra). Beträffande hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM
Denna produktresumé används även som bipacksedel
 PRODUKTRESUMÉ Denna produktresumé används även som bipacksedel 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Antisedan vet 5 mg/ml injektionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv
PRODUKTRESUMÉ Denna produktresumé används även som bipacksedel 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Antisedan vet 5 mg/ml injektionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv
Barn 2-10 år: Zymelin 0,5 mg/ml: 1 spraydos i varje näsborre högst 3 gånger dagligen i högst 5 dagar.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zymelin 0,5 mg/ml nässpray, lösning. Zymelin 1 mg/ml nässpray, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Xylometazolinhydroklorid 0,5 mg/ml och 1 mg/ml. (1 dos
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zymelin 0,5 mg/ml nässpray, lösning. Zymelin 1 mg/ml nässpray, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Xylometazolinhydroklorid 0,5 mg/ml och 1 mg/ml. (1 dos
84, 90, 100, 112, 120, 84, 90, 100, 112, 120, 168 & & 180
 BILAGA I LISTA ÖVER NAMN, FARMACEUTISK FORM, STYRKA PÅ DEN MEDICINSKA PRODUKTEN, ADMINISTRERINGSVÄG, SÖKANDE, INNEHAVARE AV MARKNADSRÄTTIGHETER, FÖRPACKNING OCH FÖRPACKNINGSSTORLEKAR I VARJE MEDLEMSSTAT
BILAGA I LISTA ÖVER NAMN, FARMACEUTISK FORM, STYRKA PÅ DEN MEDICINSKA PRODUKTEN, ADMINISTRERINGSVÄG, SÖKANDE, INNEHAVARE AV MARKNADSRÄTTIGHETER, FÖRPACKNING OCH FÖRPACKNINGSSTORLEKAR I VARJE MEDLEMSSTAT
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Finacea 15 % gel. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Finacea 15 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra. Hjälpämnen med känd effekt: 1 mg bensoesyra/g gel 0,12 g propylenglykol/g
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Finacea 15 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra. Hjälpämnen med känd effekt: 1 mg bensoesyra/g gel 0,12 g propylenglykol/g
VALGANCICLOVIR TEVA OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 VALGANCICLOVIR TEVA Datum: 17.7.2013, Version: 2.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst De flesta
VALGANCICLOVIR TEVA Datum: 17.7.2013, Version: 2.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst De flesta
PRODUKTRESUMÉ. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 dos (=0,5 ml) innehåller: Aluminiumhydroxidhydrat motsvarande aluminium
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ditebooster injektionsvätska, suspension i förfylld spruta. Difteri och tetanusvaccin (adsorberad, reducerat innehåll av antigen). 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ditebooster injektionsvätska, suspension i förfylld spruta. Difteri och tetanusvaccin (adsorberad, reducerat innehåll av antigen). 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Patientvägledning. Acitretin Orifarm (acitretin) 10 mg respektive 25 mg, hårda kapslar. Förebyggande av graviditet och exponering av foster
 Patientvägledning Acitretin Orifarm (acitretin) 10 mg respektive 25 mg, hårda kapslar Förebyggande av graviditet och exponering av foster 03/2018/ Syftet med broschyren Den här broschyren innehåller viktig
Patientvägledning Acitretin Orifarm (acitretin) 10 mg respektive 25 mg, hårda kapslar Förebyggande av graviditet och exponering av foster 03/2018/ Syftet med broschyren Den här broschyren innehåller viktig
Patientvägledningtvägledning
 Förebyggande av graviditet och exponering av foster Patientvägledningtvägledning (acitretin) 10 mg respektive 25 mg, hårda kapslar Syftet med broschyren Den här broschyren innehåller viktig information,
Förebyggande av graviditet och exponering av foster Patientvägledningtvägledning (acitretin) 10 mg respektive 25 mg, hårda kapslar Syftet med broschyren Den här broschyren innehåller viktig information,
6-12 år: 2,5-5 ml (2-4 mg) 3 gånger dagligen. 1-5 år: 2,5 ml (2 mg) 3 gånger dagligen.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhex 0,8 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller: Bromhexinhydroklorid 0,8 mg. Hjälpämnen med känd effekt: Sorbitol
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhex 0,8 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller: Bromhexinhydroklorid 0,8 mg. Hjälpämnen med känd effekt: Sorbitol
Bipacksedel: Information till användaren. Clarityn 1 mg/ml sirap loratadin
 Bipacksedel: Information till användaren Clarityn 1 mg/ml sirap loratadin Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig. Ta alltid
Bipacksedel: Information till användaren Clarityn 1 mg/ml sirap loratadin Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig. Ta alltid
PRODUKTRESUMÉ. En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Glucosamine Navamedic 625 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin. För
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Glucosamine Navamedic 625 mg tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin. För
BIPACKSEDEL FÖR. Efex vet 10 mg tuggtabletter för katt och hund Efex vet 40 mg tuggtabletter för hund Efex vet 100 mg tuggtabletter för hund
 BIPACKSEDEL FÖR Efex vet 10 mg tuggtabletter för katt och hund Efex vet 40 mg tuggtabletter för hund Efex vet 100 mg tuggtabletter för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING
BIPACKSEDEL FÖR Efex vet 10 mg tuggtabletter för katt och hund Efex vet 40 mg tuggtabletter för hund Efex vet 100 mg tuggtabletter för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING
PRODUKTRESUMÉ VETERINÄRMEDICINSKA LÄKEMEDEL
 PRODUKTRESUMÉ VETERINÄRMEDICINSKA LÄKEMEDEL 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Canidryl 100 mg tabletter, för hund. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans Karprofen 100,0
PRODUKTRESUMÉ VETERINÄRMEDICINSKA LÄKEMEDEL 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Canidryl 100 mg tabletter, för hund. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans Karprofen 100,0
Pediatrisk population Säkerheten och effekten av ketoprofengel hos barn har inte fastställts.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Orudis 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Orudis 2,5 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller 25 mg ketoprofen För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM
Hjälpämnen med känd effekt: Metylhydroxibensoat (E218): 0,72-1,44 mg (4-8 puffar) och etanol: mg (4-8 puffar)
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Coldamin 1,5 mg/ml munhålespray, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 puff av sprayen innehåller cirka 0.27 mg bensydaminhydroklorid 1 ml av sprayen innehåller
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Coldamin 1,5 mg/ml munhålespray, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 puff av sprayen innehåller cirka 0.27 mg bensydaminhydroklorid 1 ml av sprayen innehåller
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glufan 625 mg filmdragerad tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin. Hjälpämne:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glufan 625 mg filmdragerad tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 750 mg glukosaminhydroklorid motsvarande 625 mg glukosamin. Hjälpämne:
4.1 Terapeutiska indikationer Säsongbunden och perenn allergisk rinit samt vasomotorisk rinit.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Flutide Nasal 50 mikrogram/dos nässpray, suspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos innehåller 50 mikrogram flutikasonpropionat. Beträffande hjälpämnen,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Flutide Nasal 50 mikrogram/dos nässpray, suspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos innehåller 50 mikrogram flutikasonpropionat. Beträffande hjälpämnen,
Bipacksedel: Information till användaren. Pamol 500 mg filmdragerade tabletter. paracetamol
 Bipacksedel: Information till användaren Pamol 500 mg filmdragerade tabletter paracetamol Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig
Bipacksedel: Information till användaren Pamol 500 mg filmdragerade tabletter paracetamol Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Bromhexin ABECE 1,6 mg/ml oral lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhexin ABECE 0,8 mg/ml oral lösning Bromhexin ABECE 1,6 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Bromhexin Abece 0,8 mg/ml oral lösning 1 ml innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Bromhexin ABECE 0,8 mg/ml oral lösning Bromhexin ABECE 1,6 mg/ml oral lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Bromhexin Abece 0,8 mg/ml oral lösning 1 ml innehåller:
Loratadin STADA. Läs mer om avregistrerade läkemedel Bipacksedel: Information till användaren. 10 mg tabletter Loratadin
 Läs mer om avregistrerade läkemedel Bipacksedel: Information till användaren Loratadin STADA 10 mg tabletter Loratadin Läs noga igenom denna bipacksedel innan du böjar ta detta läkemedel. Den innehåller
Läs mer om avregistrerade läkemedel Bipacksedel: Information till användaren Loratadin STADA 10 mg tabletter Loratadin Läs noga igenom denna bipacksedel innan du böjar ta detta läkemedel. Den innehåller
PRODUKTRESUMÉ. Varje medicinskt plåster innehåller 10 % metylsalicylat (105 mg) och 3 % levomentol (31,5 mg).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Salonpas, 105 mg/31,5 mg, medicinskt plåster metylsalicylat/levomentol 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje medicinskt plåster innehåller 10 % metylsalicylat
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Salonpas, 105 mg/31,5 mg, medicinskt plåster metylsalicylat/levomentol 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje medicinskt plåster innehåller 10 % metylsalicylat
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN. Florselect vet 300 mg/ml injektionsvätska, lösning, för nötkreatur och svin.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Florselect vet 300 mg/ml injektionsvätska, lösning, för nötkreatur och svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Florselect vet 300 mg/ml injektionsvätska, lösning, för nötkreatur och svin. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv
