Fullmaktsstadganden 30 a i läkemedelslagen (395/1987), sådan som den lyder ändrad genom lagen 773/2009
|
|
|
- Sara Ekström
- för 7 år sedan
- Visningar:
Transkript
1 Föreskrift 1 (9) och anvisning 4/ Dnr 449/ /2009 Produktfel Fullmaktsstadganden 30 a i läkemedelslagen (395/1987), sådan som den lyder ändrad genom lagen 773/2009 Föreskriften innehåller också en anvisningsdel, som kan meddelas utan särskilda fullmaktsstadganden i lagen. Målgrupper Innehavarna av försäljningstillstånd Läkemedelsfabrikerna Läkemedelspartiaffärerna Institutet för hälsa och välfärd Livsmedelssäkerhetsverket Finlands Röda Kors Blodtjänst Apoteken Filialapoteken Sjukhusapoteken Läkemedelscentralerna Militärapoteket Giltighetstid Föreskriften och anvisningen träder i kraft den 1 januari 2010 och de är giltiga tills vidare. Norm som upphävs Läkemedelsverkets föreskrift 3/2004 Lääkealan turvallisuus- ja kehittämiskeskus Säkerhets- och utvecklingscentret för läkemedelsområdet Finnish Medicines Agency Mannerheimvägen 103b, Helsingfors PB 55, Helsingfors Tfn (09) Fax (09) kirjaamo@fimea.fi FO-nummer
2 2 (9) Innehållsförteckning Föreskrift Allmänt Klassificeringen av produktfel Anmälan till myndigheter Produktfel som hör till klass Övriga produktfel Anmälan till andra myndigheter... 6 Anvisning Ansvar Beredskap Handläggning av produktfel Tillbakadragning Informering... 8 Gemensamma bestämmelser som gäller för föreskriften och anvisningen Handledning och rådgivning Ikraftträdande... 8
3 3 (9) Föreskrift 1. Allmänt Vid framställningen av läkemedel kan det trots kvalitetssäkringsåtgärder uppstå fel varvid läkemedel som inte uppfyller kvalitetskraven eller som kan vara skadliga för läkemedelsanvändarna släpps ut för konsumtion. Med produktfel avses en kvalitetsavvikelse i ett humanläkemedel, ett veterinärmedicinskt läkemedel eller en läkemedelsförpackning som har överlåtits från en läkemedelsfabrik eller som framställts på och överlåtits från ett apotek, ett sjukhusapotek, en läkemedelscentral eller ett militärapotek. Produktfelet kan gälla en hel sats, en del av en sats eller en enskild förpackning. Denna föreskrift gäller produktfelssituationer. Föreskriften tillämpas också i situationer där CEP-certifikatet (Certificate of the European Pharmacopoeia) för en läkemedelssubstans eller ett hjälpämne som ingår i ett läkemedelspreparat inte längre är i kraft eller där en plats där läkemedel framställs inte uppfyller kraven för god tillverkningssed för läkemedel (GMP). Vidare tillämpas föreskriften i fall av läkemedelsförfalskningar som upptäcks i den lagliga läkemedelsdistributionskedjan. Innehavarna av försäljningstillstånd och läkemedelspartiaffärerna ska till Säkerhets- och utvecklingscentret för läkemedelsområdet meddela aktuella uppgifter om de personer som sköter handläggningen av produktfelsfall, samt deras kontaktuppgifter. Anmälan görs på en blankett som finns på Säkerhets- och utvecklingscentret för läkemedelsområdets webbplats ( 2. Klassificeringen av produktfel Produktfel klassificeras enligt den risk läkemedlen utsätter användaren för. Klassificeringen styr valet av rätt dimensionerade åtgärder och hur de genomförs. Klassificeringen av produktfel kräver sakkunskap och en bedömning av risken från fall till fall. Innehavaren av försäljningstillståndet ansvarar för att bedöma risken och klassificera produktfelet. Apoteken, sjukhusapoteken, läkemedelscentralerna och militärapoteken ansvarar för klassificeringen av preparat som de själva framställer. Klass 1 Produktfel som är eller kan vara livshotande eller kan ge upphov till allvarlig hälsorisk. Exempel: - innehållet i förpackningen motsvarar inte märkningarna på förpackningen - mikrobiologisk kontamination av ett sterilt preparat
4 4 (9) - kemisk eller fysikalisk kontamination som ger upphov till allvarliga följer Produktfel i klass 1 ska omedelbart anmälas till Säkerhets- och utvecklingscentret för läkemedelsområdet som i sin tur är skyldigt att rapportera produktfelet internationellt till de övriga läkemedelstillsynsmyndigheterna, samtidigt som åtgärderna i Finland inleds. Klass 2 Produktfel som är eller kan vara skadliga för läkemedelsanvändaren, eller som påverkar genomförandet av läkemedelsterapin, men som inte hör till klass 1. Exempel: - fel i det tryckta förpackningsmaterialet - bipacksedeln saknas eller är bristfällig - mikrobiologisk, kemisk eller fysikalisk kontamination - preparatet motsvarar inte kvalitetskraven (exempelvis halt, stabilitet, fyllningsmängd) - läckande förpackning (exempelvis cytotoxiska preparat, preparat med kaftig verkan, barnsäkra förpackningar) Produktfel i klass 2 ska omedelbart anmälas till Säkerhets- och utvecklingscentret för läkemedelsområdet som i sin tur är skyldigt att inom en överenskommen tid rapportera produktfelet internationellt till de övriga läkemedelstillsynsmyndigheterna. Klass 3 Produktfel som sannolikt inte medför väsentlig hälsorisk för användaren men som på annat sätt gör det motiverat att dra de felaktiga preparaten från marknaden. Exempel: - felaktig eller bristfällig förpackning - ofarlig orenhet som kan ses med blotta ögat Produktfel i klass 3 ska omedelbart anmälas till Säkerhets- och utvecklingscentret för läkemedelsområdet som vid behov rapporterar produktfelet internationellt till de övriga läkemedelstillsynsmyndigheterna. Övriga produktfel Produktfel som inte förorsakar hälsorisk för läkemedlets användare eller risk för genomförandet av läkemedelsterapin. Exempel: - betydelselös tryckfel - betydelselös avvikelse i förpackningens utseende Övriga produktfel ska anmälas till Säkerhets- och utvecklingscentret för läkemedelsområdet kalenderhalvårsvis senast den 31 januari och den 31 juli.
5 5 (9) 3. Anmälan till myndigheter 3.1 Produktfel som hör till klass 1-3 Alla produktfel som hör till klass 1 3 ska anmälas till Säkerhets- och utvecklingscentret för läkemedelsområdet efter att de nödvändiga åtgärder som fallet kräver har vidtagits. Produktfelen ska anmälas per telefon eller e-post. Aktuella kontaktuppgifter och en elektronisk blankett för anmälan finns på Säkerhets- och utvecklingscentret för läkemedelsområdets webbplats ( Information som lämnas muntligen ska också ges skriftligen. Följande uppgifter om produktfel ska anmälas: - läkemedelspreparatets namn, styrka, läkemedelsform och förpackningsstorlek - produktfelets klass - datum då produktfelet har konstaterats - det observerade felet och felets omfattning - kända skador - bedömning av eventuella risker för läkemedelssäkerheten - satsnummer - andra eventuella uppgifter som behövs för individualisering av preparatet - satsstorlek (mängd tillverkad i Finland eller importerad till Finland) och lagersaldo - information om eventuell export av preparatet till andra länder - vidtagna och planerade åtgärder - innehavare av försäljningstillståndet, läkemedelstillverkare och läkemedelspartiaffären som sköter distributionen i Finland - kontaktuppgifter för personen som sköter ärendet Om en enskild uppgift saknas får det inte fördröja anmälan. De åtgärder som produktfelet föranleder ska inledas även om man inte omedelbart får kontakt med myndigheterna. 3.2 Övriga produktfel Ett sammandrag av produktfelen, som inte hör till klass 1-3, ska anmälas till Säkerhets- och utvecklingscentret för läkemedelsområdet kalenderhalvårsvis senast den 31 januari och den 31 juli. Anmälningen ska sändas per e-post till Säkerhets- och utvecklingscentret för läkemedelsområdet (epostadress kirjaamo@fimea.fi). Anmälning ska grupperas enligt läkemedelspreparat. Följande uppgifter ska förevisas i anmälningen: - läkemedelspreparatets namn, styrka, läkemedelsform och förpackningsstorlek - datum då produktfelet har konstaterats - det observerade felet och felets omfattning - vidtagna korrigerande och förebyggande åtgärder samt deras tidpunkt
6 6 (9) 3.3 Anmälan till andra myndigheter Om produktfelet gäller ett läkemedelspreparat som har fått försäljningstillstånd genom det centrala förfarandet ska innehavaren av försäljningstillståndet utom med Säkerhets- och utvecklingscentret för läkemedelsområdet också ta kontakt med Europeiska läkemedelsmyndigheten (EMA; kontaktuppgifter på EMA:s webbplats Om ett produktfel observeras i en läkemedelssats som har exporterats ska det förutom till Säkerhets- och utvecklingscentret för läkemedelsområdet också utan dröjsmål anmälas till läkemedelstillsynsmyndigheterna och distributörerna i mottagarlandet. Anvisning 4. Ansvar Ansvaret för handläggningen av produktfel ligger i första hand hos innehavaren av försäljningstillståndet. Apotek, sjukhusapotek, läkemedelscentraler och militärapotek har i första hand ansvar för handläggning av produktfel gällande läkemedel som de själva framställer. Alla näringsidkare i läkemedelsbranschen ansvarar för sin del för de åtgärder som föranleds av observerade produktfel hos läkemedel som de framställer, importerar, distribuerar eller överlåter för konsumtion, samt för att åtgärderna är ändamålsenliga. Säkerhets- och utvecklingscentret för läkemedelsområdet övervakar att de åtgärder som vidtas i fall av produktfel är tillräckliga och ändamålsenliga. Om de instanser eller personer som är ansvariga för produktfelet försummar eller underdimensionerar åtgärderna kan Säkerhets- och utvecklingscentret för läkemedelsområdet enligt 101 i läkemedelslagen förbjuda att den felaktiga eller misstänkt felaktiga läkemedelssatsen distribueras, säljs eller överlåts för konsumtion. 5. Beredskap Alla näringsidkare i läkemedelsbranschen försäkrar sig för sin del om att fall av produktfel handläggs effektivt och ändamålsenligt. Tillräcklig beredskap finns för att handlägga fall, oberoende av tidpunkt. Åtgärderna och informationen planeras och anvisningar finns för dem. Anvisningarna utvärderas och uppdateras regelbundet. Personalen utbildas i att följa anvisningarna. 6. Handläggning av produktfel De eventuella skador som produktfel förorsakar läkemedelsanvändarna förhindras eller begränsas till minsta möjliga omfattning. I samband med åtgärderna beaktas också andra medföljda verkningar, exempelvis inverkan på livsmedelssäkerheten. Distributionen och försäljningen av felaktiga
7 7 (9) läkemedel stoppas och vid behov redan sålda läkemedel dras bort från konsumtion. Information ges så som situationen förutsätter. Då man misstänker ett produktfel som är eller kan vara livshotande eller kan förorsaka läkemedelsanvändaren allvarlig skada kan man redan innan produktfelet har bekräftats tvingas inleda åtgärderna utifrån tillgängliga uppgifter och en bedömning av risken. De åtgärder som vidtas på grund av produktfel dokumenteras i den ordning de genomförs. Alla händelser, åtgärder och personer som är involverade i handläggningen av fallet kan vid behov spåras. Orsaken till produktfelet utredas. Möjligheten att motsvarande fel förekommer i andra läkemedelssatser utredas och nödvändiga åtgärder vidtas. Motsvarande fel förhindras genom korrigerande åtgärder. Bevaringstiden för dokumentationen över hanteringen av produktfel är minst fem år, om inte längre bevaringstid föreskrivits annanstans. 7. Tillbakadragning Utgångspunkten är att läkemedel hos vilka det har observerats produktfel av klass 1 3 dras från försäljning och distribution. Då man överväger att dra ett läkemedelspreparat från marknaden utredes om det leder till störningar i tillgången på läkemedlet och vilka effekter det har på genomförandet av patienternas läkemedelsterapi. Om man blir tvungen att dra alla satser av det aktuella läkemedlet från marknaden skulle innehavaren av försäljningstillståndet utan dröjsmål vidta åtgärder för att en ny sats som uppfyller kvalitetskraven ska fås till försäljning. Apoteken skulle förvissa sig om att informationen om produktfel når föreståndare för de filialapotek och medicinskåp som lyder under apoteken. Om ett apotek levererar läkemedel till social- och hälsovårdens verksamhetsenheter även dessa informeras om produktfelen. I social- och hälsovårdens verksamhetsenheter tillbakadragningen genomförs också på avdelningarna och i andra enheter. Felaktiga läkemedel dras bort från veterinärmedicinska sjukhus, veterinärstationer och enskilda veterinärer. Då läkemedlet dras tillbaka eller andra åtgärder som föranleds av situationen vidtas säkerställer man att alla lagringsplatser har beaktats. De avlägsnade produkterna avskiljas från resten av lagret genom tillräckliga karantänåtgärder.
8 8 (9) 8. Informering I fall av produktfel skulle man alltid ombesörja att informationen är tillräcklig och ges tillräckligt tidigt. Innehavaren av försäljningstillståndet har i första hand ansvar för informerandet av produktfelen och de vidtagna åtgärderna åt distributörerna på parti- och minutnivå samt i vissa fall även åt andra aktörer inom hälsovården. Utöver ett eventuellt meddelande per telefon ges information också skriftligen. Meddelandet skulle sändas till Säkerhets- och utvecklingscentret för läkemedelsområdet på förhand. I meddelandet framgås klart att det gäller ett produktfel som förutsätter omedelbara åtgärder. I meddelandet ingås följande uppgifter: - I rubriken ordet produktfel och produktfelets klass - Läkemedelspreparatets namn, styrka, läkemedelsform och förpackningsstorlek - De satsnummer som meddelandet gäller - Andra eventuella uppgifter som behövs för individualisering av preparatet - Det observerade felet - Nödvändiga åtgärder - Eventuell tilläggsinformation som bedöms vara nödvändig (exempelvis uppgifter om tillgången på läkemedlet) - Kontaktuppgifter för personen som sköter ärendet Meddelandet ska inte kombineras med annan information. Gemensamma bestämmelser som gäller för föreskriften och anvisningen 9. Handledning och rådgivning Säkerhets- och utvecklingscentret för läkemedelsområdet ger på begäran råd och handledning om tillämpningen av denna föreskrift och anvisning och om handläggningen av produktfel. 10. Ikraftträdande Föreskriften och anvisningen träder i kraft Överdirektör Sinikka Rajaniemi Överprovisor Sami Paaskoski
9 9 (9) Distribution Innehavarna av försäljningstillstånd Läkemedelsfabrikerna Läkemedelspartiaffärerna Institutet för hälsa och välfärd Livsmedelssäkerhetsverket Finlands Röda Kors Blodtjänst Apoteken Filialapoteken Sjukhusapoteken Läkemedelscentralerna Militärapoteket För kännedom Läkemedelsindustrin Apoteksvarugrossisterna Rinnakkaislääketeollisuus Suomen Lääkerinnakkaistuojat Veterinärmedicinimportörerna Finlands Apotekareförbund Finlands Farmaciförbund Finlands Provisorförening Finlands Veterinärförbund Finlands Kommunförbund Helsingfors universitet, farmaceutiska fakulteten Helsingfors universitet, veterinärmedicinska fakulteten Kuopio universitet, farmaceutiska fakulteten Åbo Akademi, matematisk-naturvetenskapliga fakulteten, enheten för farmaci
Föreskrift och anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet
 Föreskrift och anvisning x.x.2019 Dnr 007540/00.01.02/2018 X/2019 Föreskrift och anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet UNDERRÄTTANDE OM PRODUKTFEL OCH MISSTANKAR OM LÄKEMEDELSFÖRFALSK-
Föreskrift och anvisning x.x.2019 Dnr 007540/00.01.02/2018 X/2019 Föreskrift och anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet UNDERRÄTTANDE OM PRODUKTFEL OCH MISSTANKAR OM LÄKEMEDELSFÖRFALSK-
/2013 GOD DISTRIBUTIONSSED FÖR LÄKEMEDEL. Föreskrift dd.mm.åååå Dnr / /2013
 Föreskrift dd.mm.åååå Dnr 000396/00.01.02/2013 /2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDEL Lääkealan turvallisuus- ja kehittämiskeskus
Föreskrift dd.mm.åååå Dnr 000396/00.01.02/2013 /2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDEL Lääkealan turvallisuus- ja kehittämiskeskus
5/2013 GOD DISTRIBUTIONSSED FÖR LÄKEMEDEL. Föreskrift 4.12.2013 Dnr 000396/00.01.02/2013
 Föreskrift 4.12.2013 Dnr 000396/00.01.02/2013 5/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDEL Lääkealan turvallisuus- ja kehittämiskeskus
Föreskrift 4.12.2013 Dnr 000396/00.01.02/2013 5/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDEL Lääkealan turvallisuus- ja kehittämiskeskus
1/2013 KVALITETSKONTROLLAVGIFT. Föreskrift / /2012. Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet
 Föreskrift 9.1.2013 4998/03.01.01/2012 1/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet KVALITETSKONTROLLAVGIFT Fullmaktsbestämmelser Läkemedelslagen (395/1987) 84 b 2 mom.
Föreskrift 9.1.2013 4998/03.01.01/2012 1/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet KVALITETSKONTROLLAVGIFT Fullmaktsbestämmelser Läkemedelslagen (395/1987) 84 b 2 mom.
ANMÄLAN OM BIVERKNINGAR. Målgrupper Personer med rätt att förskriva eller expediera läkemedel
 Anvisning 27.2.2017 6895/00.01.02/2016 1/2017 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM BIVERKNINGAR Målgrupper Personer med rätt att förskriva eller expediera läkemedel
Anvisning 27.2.2017 6895/00.01.02/2016 1/2017 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM BIVERKNINGAR Målgrupper Personer med rätt att förskriva eller expediera läkemedel
Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM LÄKEMEDELSBIVERKNINGAR
 Anvisning 22.5.2013 3428/03.01.01/2012 2/2013 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM LÄKEMEDELSBIVERKNINGAR Målgrupper Personer med rätt att förskriva eller expediera
Anvisning 22.5.2013 3428/03.01.01/2012 2/2013 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM LÄKEMEDELSBIVERKNINGAR Målgrupper Personer med rätt att förskriva eller expediera
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD TILLVERKNINGSSED FÖR LÄKEMEDEL. Läkemedelsverkets föreskrift 5/2007.
 Föreskrift 12.12.2012 3824/03.01.01/2012 5/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD TILLVERKNINGSSED FÖR LÄKEMEDEL Bemyndiganden Läkemedelslag (395/1987) 9 3 mom.,
Föreskrift 12.12.2012 3824/03.01.01/2012 5/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD TILLVERKNINGSSED FÖR LÄKEMEDEL Bemyndiganden Läkemedelslag (395/1987) 9 3 mom.,
ANMÄLAN OM LÄKEMEDELSBIVERKNINGAR. Målgrupper Personer med rätt att förskriva eller expediera läkemedel
 Anvisning x.x.2017 6895/00.01.02/2016 x/2017 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM LÄKEMEDELSBIVERKNINGAR Målgrupper Personer med rätt att förskriva eller expediera
Anvisning x.x.2017 6895/00.01.02/2016 x/2017 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM LÄKEMEDELSBIVERKNINGAR Målgrupper Personer med rätt att förskriva eller expediera
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet SÄKERHETSÖVERVAKNING AV LÄKEMEDEL
 Föreskrift 22.5.2013 3427/03.01.01/2012 4/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet SÄKERHETSÖVERVAKNING AV LÄKEMEDEL Bemyndiganden Läkemedelslagen (395/1987) 30 c 3
Föreskrift 22.5.2013 3427/03.01.01/2012 4/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet SÄKERHETSÖVERVAKNING AV LÄKEMEDEL Bemyndiganden Läkemedelslagen (395/1987) 30 c 3
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet PARALLELLIMPORT AV LÄKEMEDELSPREPARAT
 Föreskrift 12.2.2014 3952/03.01.2012 4/2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet PARALLELLIMPORT AV LÄKEMEDELSPREPARAT Bemyndiganden Läkemedelslagen (395/1987) 2 4 mom.,
Föreskrift 12.2.2014 3952/03.01.2012 4/2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet PARALLELLIMPORT AV LÄKEMEDELSPREPARAT Bemyndiganden Läkemedelslagen (395/1987) 2 4 mom.,
FÖRESKRIFT X/2011 X.X.2011
 FÖRESKRIFT X/2011 X.X.2011 Dnr 2713/03.01.01/2010 SÄKERHETSÖVERVAKNING AV LÄKEMEDEL Fullmaktsstadganden Läkemedelslagen (395/1987) 30 7 moment, sådana dessa bestämmelser lyder ändrade genom lag 773/2009
FÖRESKRIFT X/2011 X.X.2011 Dnr 2713/03.01.01/2010 SÄKERHETSÖVERVAKNING AV LÄKEMEDEL Fullmaktsstadganden Läkemedelslagen (395/1987) 30 7 moment, sådana dessa bestämmelser lyder ändrade genom lag 773/2009
ANMÄLAN OM BIVERKNINGAR HOS LÄKE- MEDELSPREPARAT SOM ADMINISTRERATS TILL DJUR
 Anvisning dd.mm.åååå 000327/00.01.02/2014 1/2014 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM BIVERKNINGAR HOS LÄKE- MEDELSPREPARAT SOM ADMINISTRERATS TILL DJUR Lääkealan
Anvisning dd.mm.åååå 000327/00.01.02/2014 1/2014 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM BIVERKNINGAR HOS LÄKE- MEDELSPREPARAT SOM ADMINISTRERATS TILL DJUR Lääkealan
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet. Säkerhetsövervakning av veterinärmedicinska läkemedel
 Föreskrift 15.6.2012 1801/03.01.01/2012 1/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet Säkerhetsövervakning av veterinärmedicinska läkemedel Bemyndiganden 30 7 mom. i läkemedelslagen
Föreskrift 15.6.2012 1801/03.01.01/2012 1/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet Säkerhetsövervakning av veterinärmedicinska läkemedel Bemyndiganden 30 7 mom. i läkemedelslagen
1/2014 ANMÄLAN OM BIVERKNINGAR HOS LÄKEME- DELSPREPARAT SOM ADMINISTRERATS TILL DJUR. Anvisning / /2014
 Anvisning 28.5.2014 000327/00.01.02/2014 1/2014 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM BIVERKNINGAR HOS LÄKEME- DELSPREPARAT SOM ADMINISTRERATS TILL DJUR Lääkealan
Anvisning 28.5.2014 000327/00.01.02/2014 1/2014 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet ANMÄLAN OM BIVERKNINGAR HOS LÄKEME- DELSPREPARAT SOM ADMINISTRERATS TILL DJUR Lääkealan
Läkemedelslagen (395/1987) 2 4 mom., 23 a 3 mom., 25 3 mom., 28 och 30 a sådana de lyder i lag 773/2009.
 Fimea Föreskrift x/2010 xx.xx.2010 Dnr 1673/03.01.01/2010 Parallellimport av läkemedelspreparat Bestämmelser om bemyndigande Läkemedelslagen (395/1987) 2 4 mom., 23 a 3 mom., 25 3 mom., 28 och 30 a sådana
Fimea Föreskrift x/2010 xx.xx.2010 Dnr 1673/03.01.01/2010 Parallellimport av läkemedelspreparat Bestämmelser om bemyndigande Läkemedelslagen (395/1987) 2 4 mom., 23 a 3 mom., 25 3 mom., 28 och 30 a sådana
1 (8) Föreskrift 1/ Dnr 6187/ /2010. Serviceställe för apotek. Bemyndiganden
 Föreskrift 1/2011 1 (8) 22.2.2011 Dnr 6187/03.01.01/2010 Serviceställe för apotek Bemyndiganden Läkemedelslagen (395/1987) 52 a 4 mom. och 57 3 mom. såsom den lyder i lag 1112/2010 Målgrupp Apotek Giltighetstid
Föreskrift 1/2011 1 (8) 22.2.2011 Dnr 6187/03.01.01/2010 Serviceställe för apotek Bemyndiganden Läkemedelslagen (395/1987) 52 a 4 mom. och 57 3 mom. såsom den lyder i lag 1112/2010 Målgrupp Apotek Giltighetstid
Föreskrift nr 2/2010 X.X.2010 SÄKERHETSÖVERVAKNING AV VETERINÄRMEDICINSKA LÄKEMEDEL
 Dnr 3042/03.01.01/2010 Föreskrift nr 2/2010 X.X.2010 SÄKERHETSÖVERVAKNING AV VETERINÄRMEDICINSKA LÄKEMEDEL Bemyndigande 30 7 mom. i läkemedelslagen (395/1987), ändrad genom lag 773/2009 Målgrupper Läkemedelsfabriker
Dnr 3042/03.01.01/2010 Föreskrift nr 2/2010 X.X.2010 SÄKERHETSÖVERVAKNING AV VETERINÄRMEDICINSKA LÄKEMEDEL Bemyndigande 30 7 mom. i läkemedelslagen (395/1987), ändrad genom lag 773/2009 Målgrupper Läkemedelsfabriker
5/2019 GOD TILLVERKNINGSSED FÖR LÄKEMEDEL. Föreskrift / /2018
 Föreskrift 15.3.2019 007349/00.01.02/2018 5/2019 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD TILLVERKNINGSSED FÖR LÄKEMEDEL Lääkealan turvallisuus- ja kehittämiskeskus Säkerhets-
Föreskrift 15.3.2019 007349/00.01.02/2018 5/2019 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD TILLVERKNINGSSED FÖR LÄKEMEDEL Lääkealan turvallisuus- ja kehittämiskeskus Säkerhets-
FÖRESKRIFT 6/2007 28.11.2007 EXPEDIERING AV MEDICINSKA GASER FRÅN LÄKEMEDELSFABRIK OCH LÄKEMEDELSPARTIAFFÄR
 FÖRESKRIFT 6/2007 28.11.2007 EXPEDIERING AV MEDICINSKA GASER FRÅN LÄKEMEDELSFABRIK OCH LÄKEMEDELSPARTIAFFÄR Fullmaktsstadganden 95 läkemedelslagen Målgrupper Tillverkarna av medicinska gaser Importörerna
FÖRESKRIFT 6/2007 28.11.2007 EXPEDIERING AV MEDICINSKA GASER FRÅN LÄKEMEDELSFABRIK OCH LÄKEMEDELSPARTIAFFÄR Fullmaktsstadganden 95 läkemedelslagen Målgrupper Tillverkarna av medicinska gaser Importörerna
/2013 EXPEDIERING AV LÄKEMEDEL MOT ETT EUROPEISKT RECEPT. Föreskrift pp.kk.vvvv Dnro
 Föreskrift pp.kk.vvvv Dnro /2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet EXPEDIERING AV LÄKEMEDEL MOT ETT EUROPEISKT RECEPT Lääkealan turvallisuus- ja kehittämiskeskus Säkerhets-
Föreskrift pp.kk.vvvv Dnro /2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet EXPEDIERING AV LÄKEMEDEL MOT ETT EUROPEISKT RECEPT Lääkealan turvallisuus- ja kehittämiskeskus Säkerhets-
Foreskift fran Sakerhets- och utvecklingscentret for lakemedelsomradet
 26.4.2017 Dnr Fimea 004690/00.01.02/2016 1/2017 Foreskift fran Sakerhets- och utvecklingscentret for lakemedelsomradet TILLSTANDS OCH ANMALNINGSFORFARANDE VID OBLIGATORISK LAGRING AV LAKEMEDEL Laakealanturvallisuus-jakehittamiskeskus
26.4.2017 Dnr Fimea 004690/00.01.02/2016 1/2017 Foreskift fran Sakerhets- och utvecklingscentret for lakemedelsomradet TILLSTANDS OCH ANMALNINGSFORFARANDE VID OBLIGATORISK LAGRING AV LAKEMEDEL Laakealanturvallisuus-jakehittamiskeskus
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet EXPEDIERING AV LÄKEMEDEL MOT ETT EUROPEISKT RECEPT
 Föreskrift 23.1.2014 Dnr 000493/00.01.02/2013 1/2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet EXPEDIERING AV LÄKEMEDEL MOT ETT EUROPEISKT RECEPT Lääkealan turvallisuus- ja
Föreskrift 23.1.2014 Dnr 000493/00.01.02/2013 1/2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet EXPEDIERING AV LÄKEMEDEL MOT ETT EUROPEISKT RECEPT Lääkealan turvallisuus- ja
/2014 TILLVERKNING AV LÄKEMEDEL SOM AN- VÄNDS FÖR AVANCERAD TERAPI (ATMP) FÖR BEHANDLING AV EN ENSKILD PATIENT. Föreskrift dd.mm.
 s Föreskrift dd.mm.åååå Dnr /2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet TILLVERKNING AV LÄKEMEDEL SOM AN- VÄNDS FÖR AVANCERAD TERAPI (ATMP) FÖR BEHANDLING AV EN ENSKILD
s Föreskrift dd.mm.åååå Dnr /2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet TILLVERKNING AV LÄKEMEDEL SOM AN- VÄNDS FÖR AVANCERAD TERAPI (ATMP) FÖR BEHANDLING AV EN ENSKILD
LÄKEMEDEL FÖR MÄNNISKOR OCH DJUR BLOD- OCH VÄVNADSPREPARAT ÖVERVAKNING AV AKTÖRERNA INOM LÄKEMEDELSOMRÅDET
 Vi upprätthåller och förbättrar befolkningens hälsa GENOM ATT ÖVERVAKA OCH UTVECKLA LÄKEMEDELSBRANSCHEN Vi övervakar och utvecklar läkemedelsbranschen samt främjar rationell läkemedelsanvändning med fokus
Vi upprätthåller och förbättrar befolkningens hälsa GENOM ATT ÖVERVAKA OCH UTVECKLA LÄKEMEDELSBRANSCHEN Vi övervakar och utvecklar läkemedelsbranschen samt främjar rationell läkemedelsanvändning med fokus
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet
 Föreskrift 29.1.2014 Dnro 000306/00.01.02/2013 2/2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet KVALITETS- OCH SÄKERHETSKRAV FÖR ORGANDONATIONS- OCH TRANS- PLANTATIONSVERKSAMHET
Föreskrift 29.1.2014 Dnro 000306/00.01.02/2013 2/2014 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet KVALITETS- OCH SÄKERHETSKRAV FÖR ORGANDONATIONS- OCH TRANS- PLANTATIONSVERKSAMHET
Föreskrift 1/2010 1/(8)
 Föreskrift 1/2010 1/(8) Anmälan, som bör göras av tillverkaren vid risksituationer berörande hälso- och sjukvårdsprodukter och -utrustning Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning
Föreskrift 1/2010 1/(8) Anmälan, som bör göras av tillverkaren vid risksituationer berörande hälso- och sjukvårdsprodukter och -utrustning Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning
TILLVERKARENS ANMÄLAN OM RISKSITUATION I SAMBAND MED PRODUKTER OCH UTRUSTNING FÖR HÄLSO- OCH SJUKVÅRD
 ANVISNING 5/2005 20.12.2005 Dnro 1903/01/2005 TILLVERKARENS ANMÄLAN OM RISKSITUATION I SAMBAND MED PRODUKTER OCH UTRUSTNING FÖR HÄLSO- OCH SJUKVÅRD Fullmaktsbestämmelser Lagen om produkter och utrustning
ANVISNING 5/2005 20.12.2005 Dnro 1903/01/2005 TILLVERKARENS ANMÄLAN OM RISKSITUATION I SAMBAND MED PRODUKTER OCH UTRUSTNING FÖR HÄLSO- OCH SJUKVÅRD Fullmaktsbestämmelser Lagen om produkter och utrustning
Utkast till föreskrift x/2011
 Utkast till föreskrift x/2011 1 (6) x.x.2011 Dnr 6187/03.01.01/2010 Serviceställen för apotek Bemyndiganden Målgrupp Giltighetstid Läkemedelslagen (395/1987) 52 a 4 mom. och 57 3 mom. såsom den lyder i
Utkast till föreskrift x/2011 1 (6) x.x.2011 Dnr 6187/03.01.01/2010 Serviceställen för apotek Bemyndiganden Målgrupp Giltighetstid Läkemedelslagen (395/1987) 52 a 4 mom. och 57 3 mom. såsom den lyder i
Expediering av medicinska gaser från läkemedelsfabrik och läkemedelspartiaffär. Läkemedelsverkets föreskrift 6/2007
 Föreskrift 7/2010 1 (5) 26.11.2010 Dnro 4531/03.01.01/2010 Expediering av medicinska gaser från läkemedelsfabrik och läkemedelspartiaffär Bemyndigande 95 i läkemedelslagen (395/1987), ändrad genom lag
Föreskrift 7/2010 1 (5) 26.11.2010 Dnro 4531/03.01.01/2010 Expediering av medicinska gaser från läkemedelsfabrik och läkemedelspartiaffär Bemyndigande 95 i läkemedelslagen (395/1987), ändrad genom lag
FÖRESKRIFT 4/2007 16.11.2007 GOD DISTRIBUTIONSSED FÖR LÄKEMEDELSPARTIHANDELN. Läkemedelslagen 34 3 mom och 35 a 2 mom.
 FÖRESKRIFT 4/2007 16.11.2007 GOD DISTRIBUTIONSSED FÖR LÄKEMEDELSPARTIHANDELN Fullmaktsstadganden Målgrupper Giltighetstid Norm som upphävs Läkemedelslagen 34 3 mom och 35 a 2 mom. Läkemedelspartiaffärerna
FÖRESKRIFT 4/2007 16.11.2007 GOD DISTRIBUTIONSSED FÖR LÄKEMEDELSPARTIHANDELN Fullmaktsstadganden Målgrupper Giltighetstid Norm som upphävs Läkemedelslagen 34 3 mom och 35 a 2 mom. Läkemedelspartiaffärerna
X/2017 Säkerhets- och utvecklingscentret för läkemedelsområdet Fimeas föreskrift
 Föreskrift xx.xx.xxxx Dnr Fimea 004690/00.01.02/2016 X/2017 Säkerhets- och utvecklingscentret för läkemedelsområdet Fimeas föreskrift TILLSTÅNDSS OCH ANMÄLNINGSFÖRFARANDE VID OBLIGATORISK LAGRING AV LÄKEMEDEL
Föreskrift xx.xx.xxxx Dnr Fimea 004690/00.01.02/2016 X/2017 Säkerhets- och utvecklingscentret för läkemedelsområdet Fimeas föreskrift TILLSTÅNDSS OCH ANMÄLNINGSFÖRFARANDE VID OBLIGATORISK LAGRING AV LÄKEMEDEL
5/2014 TILLVERKNING AV LÄKEMEDEL SOM AN- VÄNDS FÖR AVANCERAD TERAPI (ATMP) FÖR BEHANDLING AV EN ENSKILD PATIENT
 Föreskrift 19.12.2014 Dnr 002646/00.01.00/2014 5/2014 TILLVERKNING AV LÄKEMEDEL SOM AN- VÄNDS FÖR AVANCERAD TERAPI (ATMP) FÖR BEHANDLING AV EN ENSKILD PATIENT Lääkealan turvallisuus- ja kehittämiskeskus
Föreskrift 19.12.2014 Dnr 002646/00.01.00/2014 5/2014 TILLVERKNING AV LÄKEMEDEL SOM AN- VÄNDS FÖR AVANCERAD TERAPI (ATMP) FÖR BEHANDLING AV EN ENSKILD PATIENT Lääkealan turvallisuus- ja kehittämiskeskus
Social- och hälsovårdsministeriets förordning
 Social- och hälsovårdsministeriets förordning om Säkerhets- och utvecklingscentret för läkemedelsområdets avgiftsbelagda prestationer Given i Helsingfors den 28 januari 2010 I enlighet med social- och
Social- och hälsovårdsministeriets förordning om Säkerhets- och utvecklingscentret för läkemedelsområdets avgiftsbelagda prestationer Given i Helsingfors den 28 januari 2010 I enlighet med social- och
1/2015 ANVÄNDNINGEN AV EN GEMENSAM LOGO- TYP I APOTEKETS WEBBTJÄNST. Föreskrift 17.06.2015 Dnr Fimea 001783/00.01.02/2015
 Föreskrift 17.06.2015 Dnr Fimea 001783/00.01.02/2015 1/2015 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet ANVÄNDNINGEN AV EN GEMENSAM LOGO- TYP I APOTEKETS WEBBTJÄNST Lääkealan
Föreskrift 17.06.2015 Dnr Fimea 001783/00.01.02/2015 1/2015 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet ANVÄNDNINGEN AV EN GEMENSAM LOGO- TYP I APOTEKETS WEBBTJÄNST Lääkealan
Föreskrift 4/2010 1/(6)
 Föreskrift 4/2010 1/(6) Anmälan från yrkesmässiga användare om riskhändelser i samband med produkter och utrustning för hälso- och sjukvård Bemyndigande Målgrupper Giltighetstid Lagen om produkter och
Föreskrift 4/2010 1/(6) Anmälan från yrkesmässiga användare om riskhändelser i samband med produkter och utrustning för hälso- och sjukvård Bemyndigande Målgrupper Giltighetstid Lagen om produkter och
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDELSPARTIHANDELN
 Föreskrift 13.12.2012 3616/03.01.01/2012 4/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDELSPARTIHANDELN Bemyndiganden Läkemedelslag (395/1987)
Föreskrift 13.12.2012 3616/03.01.01/2012 4/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet GOD DISTRIBUTIONSSED FÖR LÄKEMEDELSPARTIHANDELN Bemyndiganden Läkemedelslag (395/1987)
Avisning från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE
 Anvisning 28.05.2013 000091/00.01.02/2013 1/2013 Avisning från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE Målgrupper
Anvisning 28.05.2013 000091/00.01.02/2013 1/2013 Avisning från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE Målgrupper
Dnr 4848/ /2010. De som utför kliniska prövningar av veterinärläkemedel
 Föreskrift 3/2010 1 (12) 30.12.2010 Dnr 4848/03.01.01/2010 Kliniska prövningar av veterinärläkemedel Bemyndigande Målgrupp Giltighetstid Norm som hävs 88 a 4 mom. i läkemedelslagen (395/1987), ändrad genom
Föreskrift 3/2010 1 (12) 30.12.2010 Dnr 4848/03.01.01/2010 Kliniska prövningar av veterinärläkemedel Bemyndigande Målgrupp Giltighetstid Norm som hävs 88 a 4 mom. i läkemedelslagen (395/1987), ändrad genom
Social- och hälsovårdsministeriets förordning
 Social- och hälsovårdsministeriets förordning om Säkerhets- och utvecklingscentret för läkemedelsområdets avgiftsbelagda prestationer Utfärdad i Helsingfors den 27 mars 2014 I enlighet med social- och
Social- och hälsovårdsministeriets förordning om Säkerhets- och utvecklingscentret för läkemedelsområdets avgiftsbelagda prestationer Utfärdad i Helsingfors den 27 mars 2014 I enlighet med social- och
Läkemedelsverkets föreskrifter (2012:19) om parallellimporterade läkemedel
 Läkemedelsverkets föreskrifter (2012:19) om parallellimporterade läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna version
Läkemedelsverkets föreskrifter (2012:19) om parallellimporterade läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna version
Expediering av läkemedel
 Föreskrift x/2011 1 (22) x.x.2011 Expediering av läkemedel Bemyndiganden Läkemedelslagen (395/1987) 57 3 mom., 57 a, 61 6 mom. och 65 3 mom., av dem 57 3 mom. sådan det lyder i lag 1112/2010, 57 a sådan
Föreskrift x/2011 1 (22) x.x.2011 Expediering av läkemedel Bemyndiganden Läkemedelslagen (395/1987) 57 3 mom., 57 a, 61 6 mom. och 65 3 mom., av dem 57 3 mom. sådan det lyder i lag 1112/2010, 57 a sådan
Jord- och skogsbruksministeriets förordning om veterinärers läkemedelsjournal
 JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING 22/14 Datum Dnr 17.11.2014 2164/14/2014 Ikraftträdelse- och giltighetstid 1.12.2014 - tillsvidare Upphäver Jord- och skogsbruksministeriets förordning om veterinärernas
JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING 22/14 Datum Dnr 17.11.2014 2164/14/2014 Ikraftträdelse- och giltighetstid 1.12.2014 - tillsvidare Upphäver Jord- och skogsbruksministeriets förordning om veterinärernas
ÄNDRINGAR I DET ELEKTRONISKA RECEPTET OCH PRECISERING AV VERKSAMHETSMODELLEN FR.O.M. 01.11.2015
 Anvisning 8/2015 1(5) ÄNDRINGAR I DET ELEKTRONISKA RECEPTET OCH PRECISERING AV VERKSAMHETSMODELLEN FR.O.M. 01.11.2015 Målgrupper Giltighetstid Tillhandahållare av offentliga social- och hälsovårdstjänster
Anvisning 8/2015 1(5) ÄNDRINGAR I DET ELEKTRONISKA RECEPTET OCH PRECISERING AV VERKSAMHETSMODELLEN FR.O.M. 01.11.2015 Målgrupper Giltighetstid Tillhandahållare av offentliga social- och hälsovårdstjänster
Föreskrift 2/2010 1/(7)
 Föreskrift 2/2010 1/(7) Anmälan till produktregistret gällande produkter och utrustning för hälso- och sjukvård Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning för hälso- och sjukvård
Föreskrift 2/2010 1/(7) Anmälan till produktregistret gällande produkter och utrustning för hälso- och sjukvård Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning för hälso- och sjukvård
Lag. RIKSDAGENS SVAR 145/2010 rd. Regeringens proposition med förslag till lag om ändring av läkemedelslagen. Ärende. Beredning i utskott.
 RIKSDAGENS SVAR 145/2010 rd Regeringens proposition med förslag till lag om ändring av läkemedelslagen Ärende Regeringen har till riksdagen överlämnat sin proposition med förslag till lag om ändring av
RIKSDAGENS SVAR 145/2010 rd Regeringens proposition med förslag till lag om ändring av läkemedelslagen Ärende Regeringen har till riksdagen överlämnat sin proposition med förslag till lag om ändring av
PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL
 Regeringens proposition till riksdagen med förslag till lag om ändring av läkemedelslagen PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I denna proposition föreslås att läkemedelslagen ändras. Avsikten är att genom
Regeringens proposition till riksdagen med förslag till lag om ändring av läkemedelslagen PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I denna proposition föreslås att läkemedelslagen ändras. Avsikten är att genom
Läkemedelsverkets föreskrift 4/2006
 Föreskrift 6/2011 1 (21) 20.12.2011 Dnr 4562/03.01.01/2011 Tillverkning av läkemedel på apotek Bemyndiganden Läkemedelslagen (395/1987) 12 2 mom. 16, 60 2 mom. och 61 6 mom. sådan 12 2 mom. lyder i lagen
Föreskrift 6/2011 1 (21) 20.12.2011 Dnr 4562/03.01.01/2011 Tillverkning av läkemedel på apotek Bemyndiganden Läkemedelslagen (395/1987) 12 2 mom. 16, 60 2 mom. och 61 6 mom. sådan 12 2 mom. lyder i lagen
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88517075HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88517075HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÄR FORTSATT NÄSTAN OFÖRÄNDRAD
 1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÄR FORTSATT NÄSTAN OFÖRÄNDRAD SAMMANFATTNING Försäljningen av mikrobläkemedel för djur har under början av 2010-talet varit relativt jämn. Från år 2014 till
1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÄR FORTSATT NÄSTAN OFÖRÄNDRAD SAMMANFATTNING Försäljningen av mikrobläkemedel för djur har under början av 2010-talet varit relativt jämn. Från år 2014 till
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE
 Föreskrift 28.05.2013 000091/00.01.02/2013 3/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE Bemyndiganden
Föreskrift 28.05.2013 000091/00.01.02/2013 3/2013 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE Bemyndiganden
Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE
 Anvisning 09.02.2019 0007544/00.01.02/2018 1/2019 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE Målgrupper
Anvisning 09.02.2019 0007544/00.01.02/2018 1/2019 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet LÄKEMEDELSPREPARATETS BIPACKSEDEL OCH MÄRKNING AV FÖRSÄLJNINGSEMBAL- LAGE Målgrupper
Föreskrift 1 (21) xx.xx / /2011
 Föreskrift 1 (21) xx.xx.2011 Dnr 4562/03.01.01/2011 Tillverkning av läkemedel på apotek Bemyndiganden Läkemedelslagen (395/1987) 12 2 mom. 16, 60 2 mom. och 61 6 mom. sådan 12 2 mom. lyder i lagen 1112/2010
Föreskrift 1 (21) xx.xx.2011 Dnr 4562/03.01.01/2011 Tillverkning av läkemedel på apotek Bemyndiganden Läkemedelslagen (395/1987) 12 2 mom. 16, 60 2 mom. och 61 6 mom. sådan 12 2 mom. lyder i lagen 1112/2010
FINLANDS FÖRFATTNINGSSAMLING
 FINLANDS FÖRFATTNINGSSAMLING Utgiven i Helsingfors den 7 maj 2013 330/2013 Lag om ändring av läkemedelslagen Utfärdad i Helsingfors den 3 maj 2013 I enlighet med riksdagens beslut upphävs i läkemedelslagen
FINLANDS FÖRFATTNINGSSAMLING Utgiven i Helsingfors den 7 maj 2013 330/2013 Lag om ändring av läkemedelslagen Utfärdad i Helsingfors den 3 maj 2013 I enlighet med riksdagens beslut upphävs i läkemedelslagen
Jord- och skogsbruksministeriets förordning om veterinärernas bokföring över medicinsk behandling
 JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING nr 8/VLA/2008 Datum Dnr 16.12.2008 2843/01/2008 Ikraftträdande 1.1.2009 Bemyndigande Lag om medicinsk behandling av djur (617/1997) 44 Läkemedelslag (395/1987,
JORD- OCH SKOGSBRUKSMINISTERIET FÖRORDNING nr 8/VLA/2008 Datum Dnr 16.12.2008 2843/01/2008 Ikraftträdande 1.1.2009 Bemyndigande Lag om medicinsk behandling av djur (617/1997) 44 Läkemedelslag (395/1987,
FINLANDS FÖRFATTNINGSSAMLING
 FINLANDS FÖRFATTNINGSSAMLING Utgiven i Helsingfors den 28 december 2012 898/2012 Social- och hälsovårdsministeriets förordning om läkemedelsprisnämndens avgiftsbelagda prestationer Utfärdad i Helsingfors
FINLANDS FÖRFATTNINGSSAMLING Utgiven i Helsingfors den 28 december 2012 898/2012 Social- och hälsovårdsministeriets förordning om läkemedelsprisnämndens avgiftsbelagda prestationer Utfärdad i Helsingfors
FINLANDS FÖRFATTNINGSSAMLING
 FINLANDS FÖRFATTNINGSSAMLING 2009 Utgiven i Helsingfors den 23 oktober 2009 Nr 773 794 INNEHÅLL Nr Sidan 773 Lag om ändring av läkemedelslagen... 4537 774 Lag om ändring av lagen om produkter och utrustning
FINLANDS FÖRFATTNINGSSAMLING 2009 Utgiven i Helsingfors den 23 oktober 2009 Nr 773 794 INNEHÅLL Nr Sidan 773 Lag om ändring av läkemedelslagen... 4537 774 Lag om ändring av lagen om produkter och utrustning
Svensk författningssamling
 Svensk författningssamling Förordning om ändring i läkemedelsförordningen (2006:272); SFS 2012:347 Utkom från trycket den 11 juni 2012 utfärdad den 31 maj 2012. Regeringen föreskriver 1 i fråga om läkemedelsförordningen
Svensk författningssamling Förordning om ändring i läkemedelsförordningen (2006:272); SFS 2012:347 Utkom från trycket den 11 juni 2012 utfärdad den 31 maj 2012. Regeringen föreskriver 1 i fråga om läkemedelsförordningen
RP 128/2015 rd. Propositionen hänför sig till den kompletterande budgetpropositionen för 2016 och avses bli behandlad i samband med den.
 Regeringens proposition till riksdagen med förslag till komplettering av regeringens proposition med förslag till lagar om ändring och temporär ändring av sjukförsäkringslagen, ändring av lagen om ändring
Regeringens proposition till riksdagen med förslag till komplettering av regeringens proposition med förslag till lagar om ändring och temporär ändring av sjukförsäkringslagen, ändring av lagen om ändring
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet
 Föreskrift 13.01.2016 Dnro Fimea 004378/00.01.00/2015 1/2016 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet OM YTTERLIGARE INFORMATION OM ORGANGIVAREN SOM REGISTRERAS VID ORGANDONATIONSVERKSAMHET
Föreskrift 13.01.2016 Dnro Fimea 004378/00.01.00/2015 1/2016 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet OM YTTERLIGARE INFORMATION OM ORGANGIVAREN SOM REGISTRERAS VID ORGANDONATIONSVERKSAMHET
EXEMPELFÖRPACKNINGEN NYSSTOPP
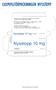 EXEMPELFÖRPACKNINGEN NYSSTOPP BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Nysstopp 10 mg tabletter cetirizin Läs noga igenom denna bipacksedel innan du börjar använda läkemedlet eftersom den innehåller viktiga
EXEMPELFÖRPACKNINGEN NYSSTOPP BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Nysstopp 10 mg tabletter cetirizin Läs noga igenom denna bipacksedel innan du börjar använda läkemedlet eftersom den innehåller viktiga
Social- och hälsovårdsministeriets förordning
 Social- och hälsovårdsministeriets förordning om Säkerhets- och utvecklingscentret för läkemedelsområdets avgiftsbelagda prestationer I enlighet med social- och hälsovårdsministeriets beslut föreskrivs
Social- och hälsovårdsministeriets förordning om Säkerhets- och utvecklingscentret för läkemedelsområdets avgiftsbelagda prestationer I enlighet med social- och hälsovårdsministeriets beslut föreskrivs
1/2012 APOTEKETS MEDICINSKÅP. Anvisning 13.12.2012 Dnr 3835/03.01.01/2012. Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet
 Anvisning 13.12.2012 Dnr 3835/03.01.01/2012 1/2012 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet APOTEKETS MEDICINSKÅP Målgrupper Apotek Ikraftträdande Denna anvisning träder i
Anvisning 13.12.2012 Dnr 3835/03.01.01/2012 1/2012 Anvisning från Säkerhets- och utvecklingscentret för läkemedelsområdet APOTEKETS MEDICINSKÅP Målgrupper Apotek Ikraftträdande Denna anvisning träder i
19.12.2011 Dnr 3473/03.03.01/2011
 Föreskrift 5/2011 1 (23) 19.12.2011 Dnr 3473/03.03.01/2011 Expediering av läkemedel Bemyndiganden Läkemedelslagen (395/1987) 57 3 mom., 57 a, 61 6 mom. och 65 3 mom., av dem 57 3 mom. sådant det lyder
Föreskrift 5/2011 1 (23) 19.12.2011 Dnr 3473/03.03.01/2011 Expediering av läkemedel Bemyndiganden Läkemedelslagen (395/1987) 57 3 mom., 57 a, 61 6 mom. och 65 3 mom., av dem 57 3 mom. sådant det lyder
Detaljhandel med nikotinläkemedel
 Detaljhandel med nikotinläkemedel Vägledning till Läkemedelsverkets föreskrifter (LVFS 2008:2) om detaljhandel med nikotinläkemedel; för verksamhetsutövare (version 3, juni 2009) Postadress/Postal address:
Detaljhandel med nikotinläkemedel Vägledning till Läkemedelsverkets föreskrifter (LVFS 2008:2) om detaljhandel med nikotinläkemedel; för verksamhetsutövare (version 3, juni 2009) Postadress/Postal address:
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel; Utkom från trycket den 15 november
Biverkningar av läkemedel märkta med en svart triangel med spetsen nedåt övervakas...
 Page 1 of 5 PUBLICERAD I NUMMER 3/2016 LÄKEMEDELSBIVERKNINGAR Biverkningar av läkemedel märkta med en svart triangel med spetsen nedåt övervakas särskilt noggrant Kirsti Villikka / Skriven 7.10.2016 /
Page 1 of 5 PUBLICERAD I NUMMER 3/2016 LÄKEMEDELSBIVERKNINGAR Biverkningar av läkemedel märkta med en svart triangel med spetsen nedåt övervakas särskilt noggrant Kirsti Villikka / Skriven 7.10.2016 /
Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel
 Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
FORTSATT MINSKNING I TOTALFÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR
 1 (6) FORTSATT MINSKNING I TOTALFÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR SAMMANFATTNING Försäljningen av mikrobläkemedel för djur har varit tämligen jämn under första halvan av 2010-talet, men år 2015
1 (6) FORTSATT MINSKNING I TOTALFÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR SAMMANFATTNING Försäljningen av mikrobläkemedel för djur har varit tämligen jämn under första halvan av 2010-talet, men år 2015
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av humanläkemedel; Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen.
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel som används på djur; LVFS
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av läkemedel som används på djur; LVFS
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m.
 Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518026HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Gemensamma författningssamlingen avseende hälso- och sjukvård, socialtjänst, läkemedel, folkhälsa m.m. ISSN 2002-1054, Artikelnummer 88518026HSLF Utgivare: Chefsjurist Pär Ödman, Socialstyrelsen Läkemedelsverkets
Datasekretessbeskrivning Receptcentret
 1 Personuppgiftsansvarig Namn Folkpensionsanstalten Postadress PB 450 Postnummer 00056 Telefon 020 634 11 Besöksadress Nordenskiöldsgatan 12, 00250 Helsingfors 2 Person som sköter registerärenden eller
1 Personuppgiftsansvarig Namn Folkpensionsanstalten Postadress PB 450 Postnummer 00056 Telefon 020 634 11 Besöksadress Nordenskiöldsgatan 12, 00250 Helsingfors 2 Person som sköter registerärenden eller
Datasekretessbeskrivning Receptarkivet
 1 Personuppgiftsansvarig Namn Folkpensionsanstalten Postadress PB 450 Postnummer 00056 Telefon 020 634 11 Besöksadress Nordenskiöldsgatan 12, 00250 Helsingfors 2 Person som sköter registerärenden eller
1 Personuppgiftsansvarig Namn Folkpensionsanstalten Postadress PB 450 Postnummer 00056 Telefon 020 634 11 Besöksadress Nordenskiöldsgatan 12, 00250 Helsingfors 2 Person som sköter registerärenden eller
Att sälja receptfria läkemedel i butik
 Att sälja receptfria läkemedel i butik Egenkontrollprogram Mallen för detta egenkontrollprogram följer kapitelindelningen i Läkemedelsverkets vägledning Att sälja receptfria läkemedel i butik som går att
Att sälja receptfria läkemedel i butik Egenkontrollprogram Mallen för detta egenkontrollprogram följer kapitelindelningen i Läkemedelsverkets vägledning Att sälja receptfria läkemedel i butik som går att
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2001:12) om säkerhetsövervakning av läkemedel;
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Gunnar Alvan Föreskrifter om ändring i Läkemedelsverkets föreskrifter (LVFS 2001:12) om säkerhetsövervakning av läkemedel;
Föreskrift 3/2010 1/(8)
 Föreskrift 3/2010 1/(8) Kliniska undersökningar med produkter och utrustning för hälso- och sjukvård Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning för hälso- och sjukvård (629/2010/2010),
Föreskrift 3/2010 1/(8) Kliniska undersökningar med produkter och utrustning för hälso- och sjukvård Bemyndigande Målgrupper Giltighetstid Lagen om produkter och utrustning för hälso- och sjukvård (629/2010/2010),
FINLANDS FÖRFATTNINGSSAMLING
 FINLANDS FÖRFATTNINGSSAMLING 2006 Utgiven i Helsingfors den 22 januari 2006 Nr 22 INNEHÅLL Nr Sidan 22 Lag om ändring av läkemedelslagen... 81 Nr 22 Lag om ändring av läkemedelslagen Given i Helsingfors
FINLANDS FÖRFATTNINGSSAMLING 2006 Utgiven i Helsingfors den 22 januari 2006 Nr 22 INNEHÅLL Nr Sidan 22 Lag om ändring av läkemedelslagen... 81 Nr 22 Lag om ändring av läkemedelslagen Given i Helsingfors
Läkemedelsverket, tillsyn och tillstånd
 Läkemedelsverket, tillsyn och tillstånd Maria Ingevaldsson, läkemedelsinspektör Bengt Persson, farmaceutisk utredare SFNM:s vårmöte 2013-05-16, Kalmar 1 En statlig, i huvudsak avgiftsfinansierad, myndighet
Läkemedelsverket, tillsyn och tillstånd Maria Ingevaldsson, läkemedelsinspektör Bengt Persson, farmaceutisk utredare SFNM:s vårmöte 2013-05-16, Kalmar 1 En statlig, i huvudsak avgiftsfinansierad, myndighet
Prövningsläkemedel kvalitet och spårbarhet. Presentationsupplägg. Bedömning av prövningsläkemedel
 Prövningsläkemedel kvalitet och spårbarhet Cecilia Vellby, farmaciutredare Enheten för kliniska prövningar och licenser Presentationsupplägg Bedömning av prövningsläkemedel Kemisk/farmaceutisk kvalitet
Prövningsläkemedel kvalitet och spårbarhet Cecilia Vellby, farmaciutredare Enheten för kliniska prövningar och licenser Presentationsupplägg Bedömning av prövningsläkemedel Kemisk/farmaceutisk kvalitet
FINLANDS FÖRFATTNINGSSAMLING
 FINLANDS FÖRFATTNINGSSAMLING 2009 Utgiven i Helsingfors den 29 oktober 2009 Nr 801 808 INNEHÅLL Nr Sidan 801 Riksdagens beslut om ändring av 3 iinstruktionen för riksdagens bankfullmäktigeledamöter.. 4617
FINLANDS FÖRFATTNINGSSAMLING 2009 Utgiven i Helsingfors den 29 oktober 2009 Nr 801 808 INNEHÅLL Nr Sidan 801 Riksdagens beslut om ändring av 3 iinstruktionen för riksdagens bankfullmäktigeledamöter.. 4617
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Föreskrifter om ändring av Läkemedelsverkets föreskrifter (LVFS 2008:1) om tillstånd
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om handel med vissa receptfria läkemedel LVFS 2009:20
Läkemedelsverkets författningssamling ISSN 1101-5225 Ansvarig utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om handel med vissa receptfria läkemedel LVFS 2009:20
Rutin för handläggning av missförhållande, så kallad lex Sara
 Rutin för handläggning av missförhållande, så kallad lex Sara Äldre och personer med funktionshinder med omsorger från Socialförvaltningen ska få en god vård alternativt få gott stöd och god service och
Rutin för handläggning av missförhållande, så kallad lex Sara Äldre och personer med funktionshinder med omsorger från Socialförvaltningen ska få en god vård alternativt få gott stöd och god service och
FÖRESKRIFT X/2007 UTKAST. Läkemedelslagen 52 4 mom. och 57 2 mom.
 FÖRESKRIFT X/2007 UTKAST MEDICINSKÅP Fullmaktsstadganden Läkemedelslagen 52 4 mom. och 57 2 mom. Målgrupp Apoteken Giltighetstid 1.1.2008 31.12.2012 Norm som upphävs Föreskrift 6/2002; 5.12.2012 2 INNEHÅLLSFÖRTECKNING
FÖRESKRIFT X/2007 UTKAST MEDICINSKÅP Fullmaktsstadganden Läkemedelslagen 52 4 mom. och 57 2 mom. Målgrupp Apoteken Giltighetstid 1.1.2008 31.12.2012 Norm som upphävs Föreskrift 6/2002; 5.12.2012 2 INNEHÅLLSFÖRTECKNING
Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel;
 Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver 1 med stöd av 4 kap. 6-7 samt 10 kap. 5 läkemedelsförordningen
Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; beslutade den xxxx. LVFS 2012:XX Utkom från trycket den Läkemedelsverket föreskriver 1 med stöd av 4 kap. 6-7 samt 10 kap. 5 läkemedelsförordningen
Läkemedelsverkets föreskrifter (LVFS 2010:4) om tillverkning av extemporeläkemedel 1
 Läkemedelsverkets föreskrifter (LVFS 2010:4) om tillverkning av extemporeläkemedel 1 Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna
Läkemedelsverkets föreskrifter (LVFS 2010:4) om tillverkning av extemporeläkemedel 1 Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna
FINLANDS FÖRFATTNINGSSAMLING
 FINLANDS FÖRFATTNINGSSAMLING Utgiven i Helsingfors den 1 september 2011 Lag om ändring av lagen om transport av farliga ämnen Utfärdad i Helsingfors den 26 augusti 2011 I enlighet med riksdagens beslut
FINLANDS FÖRFATTNINGSSAMLING Utgiven i Helsingfors den 1 september 2011 Lag om ändring av lagen om transport av farliga ämnen Utfärdad i Helsingfors den 26 augusti 2011 I enlighet med riksdagens beslut
Namn på försäljningsstället: Gatuadress: Postadress: Telefonnummer, inkl. riktnummer: E-post: Ägarens firmanamn (AB/HB/enskild firma etc.
 Egenkontrollprogram handel med vissa receptfria läkemedel Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Lag (2009:730) om handel med vissa receptfria läkemedel
Egenkontrollprogram handel med vissa receptfria läkemedel Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Lag (2009:730) om handel med vissa receptfria läkemedel
Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet SJUKHUSAPOTEKENS OCH LÄKEMEDELS- CENTRALERNAS VERKSAMHET
 Föreskrift 18.12.2012 1016/03.01.01/2012 6/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet SJUKHUSAPOTEKENS OCH LÄKEMEDELS- CENTRALERNAS VERKSAMHET Bemyndiganden Läkemedelslagen
Föreskrift 18.12.2012 1016/03.01.01/2012 6/2012 Föreskrift från Säkerhets- och utvecklingscentret för läkemedelsområdet SJUKHUSAPOTEKENS OCH LÄKEMEDELS- CENTRALERNAS VERKSAMHET Bemyndiganden Läkemedelslagen
Läkemedelsverkets författningssamling
 Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Läkemedelsverkets författningssamling ISSN 1101-5225 Utgivare: Generaldirektör Christina Rångemark Åkerman Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel; LVFS 2012:14 Utkom från
Svensk författningssamling
 Svensk författningssamling Lag om ändring i lagen (2009:366) om handel med läkemedel Utfärdad den 14 juni 2018 Publicerad den 21 juni 2018 Enligt riksdagens beslut 1 föreskrivs i fråga om lagen (2009:366)
Svensk författningssamling Lag om ändring i lagen (2009:366) om handel med läkemedel Utfärdad den 14 juni 2018 Publicerad den 21 juni 2018 Enligt riksdagens beslut 1 föreskrivs i fråga om lagen (2009:366)
2. Nuläge. l. Inledning rd - RP 374. Regeringens proposition till Riksdagen med förslag till lag om ändring av läkemedelslagen
 1992 rd - RP 374 Regeringens proposition till Riksdagen med förslag till lag om ändring av läkemedelslagen PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I propositionen föreslås att läkemedelslagen skall ändras
1992 rd - RP 374 Regeringens proposition till Riksdagen med förslag till lag om ändring av läkemedelslagen PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I propositionen föreslås att läkemedelslagen skall ändras
1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÖKADE NÅGOT
 1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÖKADE NÅGOT Försäljningen av mikrobläkemedel avsedda för djur har varit föremål för uppföljning i Finland från och med 1995 1. Förbrukningsuppgifterna baserar
1 (5) FÖRSÄLJNINGEN AV MIKROBLÄKEMEDEL FÖR DJUR ÖKADE NÅGOT Försäljningen av mikrobläkemedel avsedda för djur har varit föremål för uppföljning i Finland från och med 1995 1. Förbrukningsuppgifterna baserar
Läkemedelsverkets föreskrifter (LVFS 2014:8) om partihandel med läkemedel
 Läkemedelsverkets föreskrifter (LVFS 2014:8) om partihandel med läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna version
Läkemedelsverkets föreskrifter (LVFS 2014:8) om partihandel med läkemedel Detta dokument har sammanställts i informationssyfte. Kontrollera därför alltid texten mot den tryckta versionen. Denna version
Licens. Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens. (Version 1, september 2018)
 Licens Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens (Version 1, september 2018) Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Licens Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2018:25) om licens (Version 1, september 2018) Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address:
Senaste version av SOSFS 2011:5. Socialstyrelsens föreskrifter och allmänna råd om lex Sarah
 Detta är den senaste internetversionen av författningen. Här presenteras föreskrifter och allmänna råd i konsoliderad form, det vill säga med alla gällande bestämmelser och rekommendationer från grundförfattningen
Detta är den senaste internetversionen av författningen. Här presenteras föreskrifter och allmänna råd i konsoliderad form, det vill säga med alla gällande bestämmelser och rekommendationer från grundförfattningen
RP 91/2018 rd. Regeringens proposition till riksdagen med förslag till lag om ändring av 6 kap. i sjukförsäkringslagen
 Regeringens proposition till riksdagen med förslag till lag om ändring av 6 kap. i sjukförsäkringslagen PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I denna proposition föreslås det att sjukförsäkringslagen ändras.
Regeringens proposition till riksdagen med förslag till lag om ändring av 6 kap. i sjukförsäkringslagen PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I denna proposition föreslås det att sjukförsäkringslagen ändras.
RP 163/2005 rd. I propositionen föreslås att lagen om Utvecklingscentralen
 RP 163/2005 rd Regeringens proposition till Riksdagen med förslag till lag om ändring av 3 i lagen om Utvecklingscentralen för läkemedelsbehandling PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I propositionen
RP 163/2005 rd Regeringens proposition till Riksdagen med förslag till lag om ändring av 3 i lagen om Utvecklingscentralen för läkemedelsbehandling PROPOSITIONENS HUVUDSAKLIGA INNEHÅLL I propositionen
Ämnesstudierna består av fem undervisningshelheter. Inom dessa behandlas främst följande ämnen:
 Farmaci MÅLSÄTTNING Utbildningen som leder till farmaceutexamen strävar till att ge studeranden färdigheter inom läkemedelsförsörjningens alla delområden. Framförallt strävar utbildningen till att främja
Farmaci MÅLSÄTTNING Utbildningen som leder till farmaceutexamen strävar till att ge studeranden färdigheter inom läkemedelsförsörjningens alla delområden. Framförallt strävar utbildningen till att främja
ANMÄLAN OM TANDIMPLANTAT TILL IMPLANTATREGISTRET
 ANVISNING 2 /2004 30.12.2004 ANMÄLAN OM TANDIMPLANTAT TILL IMPLANTATREGISTRET Fullmaktsbestämmelser Lagen om riksomfattande personregister inom hälsovården 3 Målgrupper Tandläkare Sjukvårdsdistrikt Olika
ANVISNING 2 /2004 30.12.2004 ANMÄLAN OM TANDIMPLANTAT TILL IMPLANTATREGISTRET Fullmaktsbestämmelser Lagen om riksomfattande personregister inom hälsovården 3 Målgrupper Tandläkare Sjukvårdsdistrikt Olika
