Information. Årgång 19 NummeR 3 maj Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård ny rekommendation...
|
|
|
- Niklas Bengtsson
- för 7 år sedan
- Visningar:
Transkript
1 Information från Läkemedelsverket Årgång 19 NummeR 3 maj 2008 ny rekommendation... 7 Patienter med luftvägsinfektioner är vanliga inom primärvården i de nordiska länderna, där de utgör % av alla konsultationer. Bland patienter som söker för luftvägsinfektioner har omkring 25 % nedre luftvägsinfektion (NLI), vilket ofta definieras som akut sjukdom med hosta, feber och minst ett annat nedre luftvägssymtom. Antibiotika vid NLI ska bara användas på strikta indikationer. Åderlåtningsschema från Dalarna, senare delen av 1800-talet. Åderlåtning var länge en flitigt använd behandling mot lunginflammation. Att metoden gör mer skada än nytta vid nedre luftvägsinfektioner hade dock den österrikiske läkaren Joseph Dietl visat redan år Foto: Länsmuseet Gävleborg Kortkort UVI-rek på kort...3 Nedre urinvägsinfektion (UVI) är en av de vanligaste infektionerna i svensk primärvård. I detta nummer bifogas en snabbguide till antibiotikaval och de viktigaste slutsatserna från Läkemedelsverkets och Stramas expertmöte från Förorenat Klexane dras in...4 Läkemedelsverket beslutade den 23 april att dra in de förorenade tillverkningssatser av Klexane som upptäckts i Sverige. Mängden förorening är låg och indragningen gjordes av försiktighetsskäl. Hearing om Subutexmissbruk...5 Det finns ett tilltagande missbruk av Subutex och förstahandsvalet vid behandling av opioidberoende bör därför vara Suboxone. Biverkningsnytt Rapporterade psykiatriska biverkningar av Acomplia en genomgång Läkemedelsverket vill uppmärksamma förskrivare och sjukvårdspersonal på förekomsten av rapporterade allvarliga psykiatriska biverkningar hos patienter behandlade med Acomplia (rimonabant). Nya läkemedel Isentress (raltegravir) ProMeris/ProMeris Duo (metaflumizon respektive metaflumizon/amitraz) LFN informerar Information från Läkemedelsverket NN:2004 Läkemedelsverkets webbplats
2 Innehåll Observanda Varsågod kortkort UVI-rek på kort... 3 Förorenat Klexane dras in... 4 Hearing om Subutexmissbruk... 5 Substansen tramadol nu narkotikaklassad på samma sätt som kodein och dextropropoxifen.6 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Ny rekommendation... 7 Bakgrundsdokumentation Nedre luftvägsinfektion hos vuxna epidemiologi och etiologi Pneumoni hos barn etiologi och epidemiologi Pneumoni hos vuxna i öppen vård Pneumoni hos barn i öppen vård: Riktlinjer för farmakoterapi Akut bronkit/luftrörskatarr Akut bronkit hos barn etiologi och epidemiologi Akuta exacerbationer av KOL och kronisk bronkit skall de antibiotikabehandlas? Symtomatisk behandling av hosta i samband med infektioner i luftvägarna Vaccination mot influensa och pneumokocker som prevention mot luftvägsinfektioner Mikrobiologisk diagnostik av nedre luftvägsinfektioner, särskilt öppenvården Bakteriologisk diagnostik av nedre luftvägsinfektioner inom öppenvården Point of care testing in lower respiratory tract infections the role of the CRP test Biverkningsnytt Rapporterade psykiatriska biverkningar av Acomplia en genomgång Läkemedelsmonografier Isentress (raltegravir) Veterinärmedicinska läkemedel ProMeris/ProMeris Duo (metaflumizon respektive metaflumizon/amitraz) Läkemedelsförmånsnämnden informerar Cancerläkemedlet Tasigna beviljas subvention Sänkta priser för läkemedelskopior sparade fem miljarder Nexium subventioneras för barn Cervarix beviljas begränsad subvention Blodtrycksgenomgång kan ge årlig besparing på 400 miljoner kronor En mängd läkemedel får begränsad subvention Snabbguide till LFN:s beslut Blanketter Anmälan rapportering Medicintekniska avvikelse Biverkningsblankett Vad skall rapporteras Rapportering av läkemedelsbiverkningar Information från Läkemedelsverket Box 26, Uppsala Telefon Telefax E-post: tidningsredaktion@mpa.se Ansvarig utgivare: Gunnar Alvan Redaktion: Fredrik Brounéus, Kristina Bergström, Christina Brandt, Christina Hambn och Martina Tedenborg Ytterligare exemplar kan rekvireras från: Kommunikationsenheten, Medicinsk information ISSN Alfa Print AB Information från Läkemedelsverket 3:2008
3 Varsågod kortkort UVI-rek på kort I mars 2007 publicerades i Information från Läkemedelsverket en ny rekommendation för behandling av nedre urinvägsinfektion (UVI) hos kvinnor. Rekommendationen var resultatet av ett expertmöte som Läkemedelsverket anordnat i samarbete med Strama (Strategigruppen för Rationell Antibiotikaanvändning och Minskad Antibiotikaresistens). Med detta nummer av Information från Läkemedelsverket bifogas ett pappkort med en snabbguide till antibiotikaval och de viktigaste slutsatserna från behandlingsrekommendationen. Nedre UVI är en av de vanligaste infektionerna i svensk primärvård och står för en stor del av antibiotikaförskrivningen i Sverige. Antibiotikaresistensen är lägre i Sverige än i de flesta andra länder, men för att behålla denna gynnsamma position är det avgörande att rätt antibiotika förskrivs vid rätt tillfälle. Det bifogade pappkortet är en del i Läkemedelsverkets och Stramas uppföljning av behandlingsrekommendationen för nedre UVI hos kvinnor. Kortfakta om nedre urinvägsinfektion I svensk primärvård utgör nedre urinvägsinfektion (UVI) drygt 10 % av alla infektioner. Uppskattningsvis 10 % av svenska kvinnor över 18 år får antibiotikabehandling för minst en nedre UVI per år, vilket motsvarar cirka kvinnor. Av dessa får % ytterligare en eller flera infek tioner under det följande året. Nedre UVI är i de allra flesta fall ofarligt och cirka 30 % av patienterna blir symtomfria utan behand ling efter en vecka. Behandling med antibiotika syftar i första hand till att förkorta tiden med symtom. Antibiotikaresistensen är lägre i Sverige och övriga Norden än i de flesta andra länder. Även om antibiotikaresistensen hos urinvägspatogena bakterier i Sverige ökar, finns fortfarande urinvägsantibiotika för vilka resistensen är låg. Inflödet av multiresistenta bakte rier från utlandet ökar. Valet av empirisk behandling av nedre UVI måste därför regelbundet omprövas. Information från Läkemedelsverket 3:2008 3
4 Observanda Förorenat Klexane dras in Läkemedelsverket beslutade den 23 april att dra in de förorenade tillverkningssatser av Klexane som upptäckts i Sverige. Mängden förorening är låg och indragningen gjordes av försiktighetsskäl. Under januari och februari 2008 drog läkemedelsföretaget Baxter in de flesta av sina heparinprodukter från den amerikanska marknaden efter rapporter om allvarliga biverkningar. I början av mars 2008 meddelade den amerikanska läkemedelsmyndigheten FDA att biverkningarna misstänktes bero på en okänd förorening, som kunde detekteras med hjälp av nya analysmetoder som de publicerade på sin hemsida. Läkemedelsverket begärde då att de läkemedelsföretag som sålde heparinprodukter i Sverige skulle undersöka dessa. Vissa tillverkningssatser av det lågmolekylära heparinet Klexane visade sig innehålla en liten mängd förorening av samma slag som hittats i USA. Läkemedelsverket beslutade därför den 23 april av försiktighetsskäl att dessa satser skulle dras in. Läkemedelsverket bedömer att det inte varit någon risk för allvarliga reaktioner hos patienten när förorenat Klexane getts subkutant, men har tidigare avrått från intravenös användning av det förorenade läkemedlet. Föroreningen består i översulfaterat kondroitinsulfat. Det finns inte några svenska rapporter om att någon har drabbats av allvarliga biverkningar på grund av föroreningen. De tillverkningssatser av Klexane som inte dras in innehåller ingen förorening och kan användas enligt de godkända indikationerna. Klexane används för att behandla allvarliga akuta sjukdomstillstånd som till exempel hjärtinfarkt och propp i lungans blodkärl. Vårdgivare som misstänker en biverkning uppmanas att anmäla den på sedvanligt sätt till Regionalt Biverkningscentrum. Sök läkemedelsfakta 4 Information från Läkemedelsverket 3:2008
5 Observanda Hearing om Subutexmissbruk Det finns ett tilltagande missbruk av Subutex (bubrenorfin) och förstahandsvalet vid behandling av opioidberoende bör därför vara Suboxone (bubrenorfin/naloxon). Det kom man fram till vid en hearing som Läkemedelsverket och Socialstyrelsen anordnade tidigare i vår. På grund av rapporter om tilltagande missbruksproblem med Subutex (buprenorfin) sammankallade Läkemedelsverket och Socialstyrelsen en hearing den 13 mars 2008 på Arlanda. Slutsatser från denna hearing: Det finns ett tilltagande missbruk av Subutex, med vissa regionala skillnader. Distributionsvägarna för missbruket av Subutex är oklara. Betydande tullbeslag visar att smuggling från andra länder utgör en källa, men läckage från missbruksvården kan inte uteslutas. Missbruket kan antingen ske i berusningssyfte, för att behandla abstinens eller bruk i väntan på tillträde på behandling. För att komma till rätta med missbruksrisken har företaget som marknadsför Subutex lanserat det nyligen registrerade Suboxone, som har en 20 % tillsats av den rena opioidantagonisten naloxon. I regel eliminerar naloxontillsatsen intravenöst missbruk, men då naloxon har teratogena effekter får Suboxone inte ges åt gravida. Med Suboxone som förstahandsmedel, utom i fall med hög opioidtolerans då metadon är indicerat, reduceras misstanken att illegalt åtkommet buprenorfin härrör från missbruksvården. Rekommendation När metadon inte är indicerat initialt bör Suboxone (buprenorfin/naloxon) utgöra förstahandsbehandling, utom vid graviditet. Skulle abstinensbesvär uppkomma när man skiftat över från Subutex till samma buprenorfindos i Suboxone, kan i först hand en mindre höjning av Suboxonedosen prövas. I vissa av dessa fall får man återgå till Subutex eller skifta över patienten till metadon. Patienter som är under behandling med Subutex, men där farhågor om läckage föreligger, och skulle föranleda kontrollåtgärder, kan med fördel erbjudas att sättas över på Subuxone. Patienter som är välinställda och välfungerande på Subutex bör ej sättas över på Suboxone. Följande personer deltog i hearingen: Professor Hannu Alho, Department of Mental Health and Alcohol Research, Helsinki Docent Bo Bergman, Läkemedelsverket Assistent Kristina Bergström, Läkemedelsverket Överläkare Olof Blix, Beroendeenheten/Psykiatriska kliniken, Jönköping Verksamhetschef, Docent Stefan Borg, Beroendecentrum, Stockholm Utredare Abit Dundar, Socialstyrelsen Professor Lars Gunne, Läkemedelsverket Programchef, Med dr Leif Grönblad, Metadonenheten, Akademiska sjukhuset Docent Marcus Heilig, National Institute on Alcohol Abuse and Alcoholism, USA Dr Anders Håkansson, Klinisk alkoholforskning, Lunds Universitet Professor Jan Liliemark, Läkemedelsverket Psykolog Lars Lundell, Beroendekliniken, Göteborg Verksamhetschef, Chefsöverläkare Carl-Gustaf Olofsson, Psykiatriska kliniken, Skellefteå Verksjurist Pål Resare, Socialstyrelsen Överläkare Christian Simonsberg, Beroendekliniken, Göteborg Klinisk utredare, Överläkare Hans Sjögren, Läkemedelsverket Vårdenhetschef Karina Stein, Beroendekliniken, Göteborg Verksamhetschef Tommy Strandberg, Beroendecentrum stab, Örebro Medicinalråd Claes Tollin, Socialstyrelsen Information från Läkemedelsverket 3:2008 5
6 Observanda Substansen tramadol nu narkotikaklassad på samma sätt som kodein och dextropropoxifen Narkotikaklassificeringen av tramadol föranleddes i första hand av risken för beroende och missbruk. Klassificeringen likställer i det avseendet substansen med de båda svaga opioiderna kodein och dextropropoxifen. Särskild receptblankett behöver dock inte användas vid förskrivning av tramadolpreparat. Sedan den 1 februari 2008 är den smärtstillande substansen tramadol narkotikaklassad. De båda andra svaga opioiderna kodein och dextropropoxifen (DXP) är sedan decennier tillbaka narkotikaklassade. Att tramadol på Läkemedelsverkets förslag nu narkotikaklassats beror i första hand på att patienter som använder läkemedel innehållande tramadol allt oftare hamnar i ett beroende. Även ett rent missbruk av preparatet har rapporterats i ökande omfattning. Detta i kombination med den kraftigt ökande försäljningen under senare år gjorde att Läkemedelsverket ansåg att det fanns anledning att likställa dessa substanser med avseende på narkotikaklassificering och att uppmärksamma förskrivare på risken för läkemedelsberoende alternativt missbruk. Klassificeringen gäller substansen inte beredningarna Liksom läkemedelsberedningar innehållande kodein och DXP är läkemedelsberedningar innehållande tramadol undantagna narkotikaklassificering. Bered- ningar innehållande DXP och kodein måste förskrivas på särskild receptblankett detta krav gäller dock inte för beredningar innehållande tramadol. Anledningen är att tramadol har varit den minst belastade av de tre svaga opioiderna ur beroende- och missbrukssynpunkt beroendeproblematiken har varit utbredd för kodein, och DXP har orsakat ett stort antal dödsfall. Genom att inte kräva särskild receptblankett för tramadolpreparat har Läkemedelsverket försökt minska andelen patienter som behandlas med kodein och DXP. DXP-relaterade dödsfall har minskat påtagligt i takt med den minskade försäljningen; år 2000 rapporterades 205 fall jämfört med 56 år Information från Läkemedelsverket 3:2008
7 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Den november 2007 anordnades en workshop om farmakologisk behandling av nedre luftvägsinfektioner i samarbete mellan Läkemedelsverket och Strama (Strategigruppen för Rationell Antibiotikaanvändning och Minskad Antibiotikaresistens). Patienter med luftvägsinfektioner är vanliga inom primärvården, där de utgör % av alla konsultationer i de nordiska länderna. Bland patienter som söker för luftvägsinfektioner har omkring 25 % nedre luftvägsinfektion, vilket ofta definieras som akut sjukdom med hosta, feber och minst ett annat nedre luftvägssymtom (sputumproduktion, dyspné, väsande andning och bröstsmärta). Huvudbudskap Antibiotika vid nedre luftvägsinfektioner ska bara användas på strikta indikationer. För en patient med oklar nedre luftvägsinfektion utan allmänpåverkan rekommenderas aktiv exspektans alternativt fördröjd antibiotikaförskrivning. Ingen dokumenterad nytta föreligger av antibiotikabehandling vid akut bronkit oavsett om bronkiten orsakats av virus, mykoplasma eller klassiska bakterier. Antibiotika är inte heller indicerat vid akuta exacerbationer av kronisk bronkit/kol utan missfärgade upphostningar. Lungröntgen behöver sällan utföras initialt, inte heller kontroll av CRP. Om CRP kontrolleras ska värdet alltid bedömas i relation till sjukdomsdurationen. Betalaktamantibiotika skall doseras tre gånger dagligen till både barn och vuxna. Vid utebliven förbättring hos barn efter tre dygns penicillinbehandling kan man byta till erytromycin om misstanke om mykoplasmapneumoni föreligger. Epidemiologi Mellan 1 % och 10 % av befolkningen i europeiska länder söker årligen sjukvård för samhällsförvärvad nedre luftvägsinfektion. Omkring % av dem har lunginflammation (pneumoni). Incidensen av nedre luftvägsinfektioner är som högst under vintermånaderna. Influensavirus är ett viktigt etiologiskt agens. Figur 1 ger en bild av förekomst och utbredning av olika typer av luftvägsinfektioner. Den årliga incidensen av samhällsförvärvad pneumoni hos vuxna har uppmätts till cirka 1 % och ökar med stigande ålder. Hos barn är luftvägsinfektioner inklusive pneumoni den ledande orsaken till sjuklighet. I de få studier som finns, anges frekvensen pneumonier till 3 4 % per år under de första fem åren och därefter 1 2 % hos äldre barn. Det är viktigt att identifiera patienterna med pneumoni, eftersom det finns en avsevärd morbiditet och dessutom en viss mortalitet bland dessa patienter. Figur 1. Isberget av samhällsförvärvad luftvägsinfektion, nedre luftvägsinfektion och pneumoni. Information från Läkemedelsverket 3:2008 7
8 Etiologi Frekvensen av olika etiologiska agens som rapporterats i nordiska studier av nedre luftvägsinfektioner hos vuxna framgår av Tabell I. De stora variationerna för samma agens i olika studier sammanhänger bland annat med vilka patienter som studeras (till exempel ålderssammansättning, patientunderlag), vilken mikrobiologisk metodik som används och den aktuella epidemiska situationen. Dessutom är studiernas längd av betydelse för att jämna ut epidemiologiska variationer mellan årstider och år. Vuxna Akut bronkit orsakas huvudsakligen av virus medan pneumoni vanligen orsakas av bakterier, se Tabell I. Streptococcus pneumoniae är den vanligaste orsaken till pneumoni hos vuxna i både öppen och sluten vård. S. pneumoniae och Haemophilus influenzae är vanliga orsaker i alla åldersgrupper. Mycoplasma pneumoniae-infektion är vanligare i yngre åldrar men kan förekomma i alla åldersgrupper. Incidensen av M. pneumoniae varierar med toppar med några års mellanrum och är vanligare i öppen än i sluten vård. Tuberkulos är en viktig differentialdiagnos, i synnerhet vid långvarig hosta om patienten tillhör riskgrupp som till exempel personer som exponerats för tuberkulos från känt indexfall eller som växt upp i område med hög tuberkulosförekomst. Notera att cirka två tredjedelar av exacerbationer av kroniskt obstruktiv lungsjukdom har infektiös orsak. Virus och bakterier är ungefär lika vanliga agens och dubbelinfektion är dessutom ofta förekommande. Vanligaste bakteriella agens är H. influenzae, S. pneumoniae och Moraxella catarrhalis. Rhinovirus är vanliga virusagens. Barn Incidensen av viruspneumonier är högre hos förskolebarn än hos vuxna. Hos barn under två år dominerar RS-virus. Incidensen av bakteriella pneumonier är dock lika hög som hos vuxna. Bland bakterier dominerar S. pneumoniae, som förekommer vid en tredjedel av alla infektioner, följt av H. influenzae. M. pneumoniae är vanligare bland äldre barn. Samtidig virus- och bakterieetiologi kan påvisas hos 20 %, huvudsakligen i åldern ett till fyra år. Fördelningen av patogener vid pneumoni hos barn varierar avsevärt med årstiden. De patogener som är vanligaste orsak till pneumoni hos barn har varit desamma i olika delar av världen sedan lång tid tillbaka. Den relativa fördelningen mellan patogenerna varierar dock avsevärt med årstid och ålder samt vaccinationsinsatser. Variationen mellan öppen och sluten vård är mindre uttalad än hos vuxna. Om något dominerar virusinfektioner i sluten vård, troligtvis till följd av att de yngsta barnen drabbas hårdast. De virus och bakterier som förorsakar pneumoni kan också ge lindrig luftvägsinfektion. Förekomst av bakterier i nasofarynx hos barn med nedre luftvägsinfektion utgör inget bevis för att dessa orsakar den nedre luftvägsinfektionen, eftersom bärarskap av bakterie i nasofarynx är vanligt. Vid obstruktiva andningsbesvär hos barn dominerar rhinovirus, RS-virus och influensavirus. Genesen varierar vid olika tidpunkter under året. Mikrobiologisk diagnostik Trots optimerad provtagning och tillgång till olika diagnostiska metoder lyckas man sällan fastställa orsakande mikroorganism i mer än hälften av fallen. Bra snabbdiagnostik anpassad för öppen vård saknas. Virologisk diagnostik på nasofarynxsekret är av värde för att fastställa de första lokala fallen av RSVoch influensainfektioner i början av epidemierna varje år. Odling är den vanligaste metoden att fastställa förekomst av S. pneumoniae, H. influenzae och M. catarrhalis i luftvägarna och en förutsättning för att påvisa antibiotikaresistens. Bakterieodling från sputum eller nasofarynx bör övervägas hos vuxna patienter Tabell I. Luftvägspatogener identifierade i studier av vuxna patienter med nedre luftvägsinfektion. Ej Röntgeninfiltrat Röntgeninfiltrat Röntgeninfiltrat Patogen Öppenvård (nordiska studier) (%) Öppenvård (nordiska studier) (%) Slutenvård (svenska studier) (%) Streptococcus pneumoniae Haemophilus influenzae Moraxella catarrhalis Staphylococcus aureus Mycoplasma pneumoniae Chlamydophila spp Legionella spp Luftvägsvirus Ingen patogen påvisad Information från Läkemedelsverket 3:2008
9 med säker eller sannolik pneumoni, i synnerhet efter vistelse i områden med hög förekomst av antibiotikaresistenta bakterier och vid terapisvikt. Aktuellt resistensläge för utvalda luftvägspatogener hittas via Serologi kräver parade sera och har därför sällan någon plats i rutindiagnostiken. För M. pneumoniae är molekylärbiologiska metoder, till exempel PCR, att föredra. Provtagning för PCR-test kan utföras i nasofarynx eller orofarynx med en torr bomullspinne. Köldagglutinintest ska inte användas i diagnostiken av M. pneumoniae på grund av låg sensitivitet och specificitet. Snabbtester Det finns ett flertal snabbtester på marknaden för fastställande av etiologi vid luftvägsinfektioner. En del av dem bygger på antikroppspåvisning och andra på antigenpåvisning. Bland dessa bör man välja tester som påvisar antigen, eftersom antikroppstester vanligen kräver parade sera för att ge en acceptabel nivå på diagnostiken. Bland snabbtester för luftvägsvirus finns antigentester för detektion av RSV och influensavirus från nasofarynxsekret. Då diagnostik av RSV och influensavirus endast rekommenderas i början av säsongen, är behovet av snabbtester i öppenvården för dessa virus mycket begränsat. De bakteriella snabbtester som är mest etablerade är antigentester för påvisande av legionella och pneumokocker från urinprover. Testerna är inte validerade på öppenvårdspatienter. Slutsats Mikrobiologisk diagnostik är ofta av begränsat värde för den akuta handläggningen vid nedre luftvägsinfektioner i öppenvård. Bakterieodling från sputum (vuxna och barn) eller nasofarynx (enbart vuxna) bör dock övervägas hos patienter med säker eller sannolik pneumoni. Farmakologisk översikt Symtomatisk behandling av hosta vid nedre luftvägsinfektioner Det finns nästan ingen modern dokumentation av hostdämpande läkemedel som fyller kriterier för GCP (Good Clinical Practice). Äldre studier av opiatderivat har rapporterat effekt på torrhosta, vilken dock har ifrågasatts i en modern översikt. Två aktuella studier har inte kunnat påvisa effekt (Evidensgrad 1). Vid symtomatisk hostdämpande behandling är placeboeffekten påtaglig (Evidensgrad 2). För slemlösande medel saknas evidens för den slemlösande effekten. Även här är placeboeffekten sannolikt stor. Således saknas evidens för rekommendation av farmakologisk behandling av hosta i samband med luftvägsinfektioner. Profylaktisk behandling mot nedre luftvägsinfektioner Vaccination mot influensa Den enskilt viktigaste åtgärden för att begränsa morbiditet och mortalitet i influensa utgörs av årlig vaccination med aktuellt vaccin av de medicinska riskgrupperna. De influensavacciner som finns på marknaden i Sverige idag är inaktiverade tri-valenta split- eller subunit-vacciner. Tri-valent innebär att vaccinet innehåller två influensa A-stammar samt en influensa B-stam. För en utförlig beskrivning av olika influensavacciners sammansättning, immunogenicitet och säkerhet hänvisas till Läkemedelsverkets behandlingsrekommendationer för influensa, Detta dokument innehåller även information om vaccination av barn samt profylax med antivirala läkemedel. Även om skyddseffekten mot influensainfektion är ofullständig har ett stort antal studier visat att vaccination kan minska risken för allvarliga komplikationer och död i samband med influensa (Evidensgrad 2). Vaccination rekommenderas därför i första hand för de personer som löper en ökad risk för sådana allvarliga sjukdomsförlopp. Randomiserade studier ger stöd för att influensavaccinering av vårdpersonal reducerar den totala dödligheten hos äldre som långtidsvårdas på sjukhus eller motsvarande (Evidensgrad 2). Skyddseffekten mot klinisk influensa hos unga friska personer är liten, bara cirka 15 %, och frånvaron från arbete/skola reduceras endast marginellt (Evidensgrad 1). Rekommendationer Årlig influensavaccination rekommenderas till personer som har förhöjd risk att drabbas av komplikationer som följd av influensasjukdomen (Rekommendationsgrad B). De patientgrupper som omfattas är framför allt de som är 65 år gamla eller oavsett ålder har någon av följande underliggande riskfaktorer: sjukhemsboende eller motsvarande, kronisk hjärtsjukdom och då framför allt hjärtsvikt, kronisk lungsjukdom, instabil diabetes mellitus och andra metabola sjukdomar, kronisk njursvikt, cancersjukdom eller gravt nedsatt immunförsvar. Vaccination mot pneumokockinfektion Det finns för närvarande två tillgängliga pneumokockvacciner. Ett 23-valent vaccin (PPV23) som innehåller kapselpolysackaridantigen från vardera av 23 olika pneumokockserotyper, vilka tillsammans orsakar cirka 90 % av all invasiv pneumokocksjukdom Ett proteinkonjugerat vaccin (PCV7) som är bättre immunogent hos små barn finns registrerat sedan några år. Vaccinet innehåller de sju serotyper som under 1990-talet var vanligast hos Information från Läkemedelsverket 3:2008 9
10 små barn i USA. Pneumokockstammar av dessa sju typer är också de som oftast uppvisar nedsatt känslighet mot penicillin och andra antibiotika. Nya typer av konjugatvacciner, innehållande tio respektive 13 serotyper, är i slutstadiet av kliniska prövningar. Vaccination av vuxna med PPV23 leder i regel till en bra immunstimulering, även hos äldre personer (Evidensgrad 2). Efter en primär pneumokockvaccination med PPV23 sjunker antikroppshalten gradvis och når ursprungsnivån efter tre till tio år, beroende bland annat på patientens ålder (Evidensgrad 2). Vid en första revaccination svarar äldre patienter något sämre än vid primovaccinationen, men majoriteten får en signifikant antikroppsstegring mot flertalet serotyper (Evidensgrad 2). Allvarliga biverkningar är mycket ovanliga (Evidensgrad 2). Det 23-valenta vaccinet ger ett cirka 50-procentigt skydd mot invasiv pneumokocksjukdom (IPS) hos äldre och kroniskt sjuka personer (Evidensgrad 2). Vaccinet ger också ett gott skydd mot IPS hos splenektomerade patienter (Evidensgrad 2), medan övertygande bevis för skyddseffekt saknas hos övriga grupper av immunsupprimerade (Evidensgrad 2), inklusive hiv-infekterade patienter (Evidensgrad 1). Det 7-valenta konjugerade vaccinet ger en mycket god antikroppsstegring hos barn (Evidensgrad 1) och är ett säkert vaccin med främst lokala biverkningar, framför allt sveda och ömhet vid vaccinationsstället (Evidensgrad 1). Inga riktigt allvarliga biverkningar finns rapporterade. Stora randomiserade studier har visat att vaccination av barn med PCV7 ger en > 90-procentig skyddseffekt mot IPS orsakad av någon av de sju ingående serotyperna, samt en cirka procentig skyddseffekt mot röntgenverifierad pneumoni (Evidensgrad 1). Rekommendationer Vaccination med det 23-valenta pneumokockvaccinet rekommenderas till immunkompetenta vuxna och barn över fem års ålder med ökad risk för pneumokockinfektion (Rekommendationsgrad B). De patientgrupper som innefattas är framför allt personer som är > 65 år gamla, samt de som oavsett ålder är sjukhemsboende eller motsvarande, har kronisk hjärt-lungsjukdom, cerebrovaskulär sjukdom, kronisk leversjukdom, diabetes mellitus, demens, epilepsi eller likvorré. Vidare bör patienter med funktionell eller anatomisk aspleni vaccineras. Revaccination en gång rekommenderas till splenektomerade och bör övervägas till övriga grupper, när det gått > 5 år sedan primovaccinationen (Rekommendationsgrad B). Det 7-valenta konjugerade pneumokockvaccinet rekommenderas till barn < 5 års ålder (Rekommendationsgrad A). Socialstyrelsen har föreslagit att vaccinet införlivas i barnvaccinationsprogrammet. Översikt över antibiotika Antibiotika vid nedre luftvägsinfektioner skall bara användas på strikta indikationer. Penicilliner Fenoximetylpenicillin (PcV) har god aktivitet mot fullt känsliga pneumokocker men har dålig effekt mot H. influenzae. Preparatet har kort halveringstid (30 min) och bör därför doseras minst tre gånger per dygn. Pneumokocker med nedsatt känslighet är inte väl åtkomliga med PcV-behandling. Sådana stammar förefaller enligt undersökningar utförda via Referensgruppen för Antibiotikafrågor (RAF) förekomma hos 7 8 % av undersökta isolat i Sverige idag. För stammar som isolerats från blod är siffran 2 4 %. Biverkningsprofilen för PcV är gynnsam liksom för andra penicilliner. Påverkan på normalfloran är liten. Amoxicillin har god aktivitet mot känsliga och intermediärt känsliga pneumokocker samt mot icke beta-laktamasproducerande H. influenzae i nedre luftvägarna. Vid behandling av pneumokocker med MIC 0,5 1,0 mg/l rekommenderas en hög dos (1 gram 3). Preparatet har en relativt kort halveringstid (60 min) och bör därför doseras tre gånger per dygn. Allvarliga biverkningar är ovanliga men selektion av resistenta gramnegativa bakterier i tarm och luftvägar förekommer. Amoxicillin ska därför användas sparsamt. Till skillnad mot amoxicillin har amoxicillin-klavulansyra god effekt mot betalaktamas producerande H. influenzae, M. catarrhalis och S. aureus (ej MRSA). Diarré är vanligare än för amoxicillin och sannolikt är den ekologiska störningen större. Cefalosporiner Cefalosporinbehandling är en riskfaktor för selektion av multiresistenta bakterier, inklusive pneumokocker och ESBL-producerande gramnegativa tarmbakterier. ESBL (Extended Spectrum Beta-Lactamases) är enzymer som medför resistens mot de betalaktamasstabila penicillinerna men också mot de flesta betalaktamasresistenta cefalosporinerna. Antibiotika-associerad diarré, inklusive Clostridium difficile-associerad diarré förekommer oftare vid behandling med cefalosporiner än med orala penicilliner. Doxycyklin Preparatet har god aktivitet mot pneumokocker, H. influenzae, M. catarrhalis, Chlamydophila pneumoniae och M. pneumoniae. En successivt ökande resistens hos pneumokocker har dock noterats (för närvarande cirka 7 %). Doxycyklin förknippas med fotosensibilisering och diarréer. Trimetoprim-sulfa Trimetoprim-sulfa har god klinisk aktivitet mot pneumokocker, H. influenzae, M. catarrhalis och flertalet gramnegativa enterobakterier i nedre luftvägarna. Resistensprevalensen har under det senaste decenniet successivt ökat hos både pneumokocker (nu cirka 10 Information från Läkemedelsverket 3:2008
11 9 %), H. influenzae (nu cirka 13 %) och övriga gramnegativa bakterier. Allergi mot trimetoprim-sulfa är relativt vanligt förekommande och kan vara en allvarlig biverkan. Makrolider och klindamycin Erytromycin uppvisar god aktivitet mot pneumokocker, M. catarrhalis, C. pneumoniae och M. pneumoniae i nedre luftvägarna men har dålig effekt mot H. influenzae. Ökande resistens har noterats hos pneumokocker (för närvarande cirka 7 % i Sverige). Stammar som har nedsatt känslighet för penicillin är i större utsträckning också erytromycinresistenta än penicillinkänsliga stammar. Azitromycin uppvisar samma in vitro-aktivitet som erytromycin, men den mycket långa halveringstiden medför stor risk för resistensselektion. Klindamycin uppvisar god klinisk aktivitet mot makrolidkänsliga pneumokocker samt mot S. aureus i nedre luftvägarna. Klindamycinbehandling medför ökad risk för C. difficile-associerad diarré. Fluorokinoloner Preparaten i denna grupp tillhör inte förstahands- eller andrahandsalternativen vid behandling av nedre luftvägsinfektioner. Nedre luftvägsinfektioner hos vuxna Definitioner av diagnoserna pneumoni, akut bronkit och akut exacerbation av kronisk bronkit/kol som omfattas av behandlingsrekommendationerna för vuxna finns i Faktaruta 1. Det är inte möjligt eller motiverat att i öppenvård lungröntga alla patienter med symtom från de nedre luftvägarna. Differentialdiagnostiken mellan pneumoni och akut bronkit måste därför oftast baseras på anamnes och kliniska fynd. Man kan få vägledning av anamnes och status, men det finns ingen kombination av kliniska fynd som med säkerhet kan differentiera mellan dessa diagnoser. Anamnes och status kan ge hållpunkter för en behandlingskrävande pneumoni men avsaknad av statusfynd kan inte säkert utesluta diagnosen. Hos åldriga patienter kan nedsatt allmäntillstånd vara enda symtom på pneumoni. Auskultationsfynd i form av krepitationer/rassel har visat sig ha osäker korrelation till röntgenfynd. Likväl kan lateral andningskorrelerad smärta och tydliga ensidiga auskultationsfynd i kombination med övrig klinisk bild ge ett tillräckligt underlag för att ställa diagnosen pneumoni. Om CRP ingår i bedömningen måste värdet bedömas i relation till sjukdomsdurationen. Vid virusinfektioner är CRP nivåerna högst dag 3 4 varefter de vid okomplicerat förlopp sjunker till < 10 mg/l efter 7 10 dagar (Evidensgrad 2). Sannolik akut bronkit En opåverkad patient med hosta, utan känd KOL, kronisk bronkit eller astma, och utan fokala kliniska auskultationsfynd har sannolikt akut bronkit. Orent andningsljud bilateralt är vanligt. Förekomst av missfärgade upphostningar saknar i dessa fall värde som indikator för behandlingskrävande bakteriell infektion. Mätning av CRP behövs inte för diagnos. För dessa patienter, som ofta har en besvärande hosta, finns ingen dokumenterad nytta av antibiotikabehandling (Rekommendationsgrad A). Hostan varar normalt cirka tre veckor men kan pågå ytterligare några veckor. Vid misstanke på obstruktivitet bör spirometri utföras alternativt PEF mätas. Behandling med bronkdilaterande läkemedel kan ges på prov. Sannolik pneumoni En påverkad patient med statusfynd som takypné (> 20/min) eller takykardi (> 120/min) och typisk klinisk bild enligt Faktaruta 1 har sannolikt pneumoni (Evidensgrad 2). Oklar nedre luftvägsinfektion Vid mindre tydlig klinisk bild men CRP > 100 mg/l är diagnosen pneumoni också sannolik (Evidensgrad 2). Även vid nedre luftvägsinfektion med symtom som feber, hosta och dyspné > 1 vecka och CRP > 50 mg/l är pneumoni vanligt. Dessa patienter bör som regel antibiotikabehandlas (Rekommendationsgrad B). Vid CRP-värden på < 20 mg/l är en behandlingskrävande pneumoni osannolik om patienten har mer än 24 timmars sjukdomsanamnes (Evidensgrad 2). Värden på CRP däremellan ger inte tydlig diagnostisk vägledning. Om patienten inte är allmänpåverkad kan i första hand exspektans med förnyad kontakt eller fördröjd antibiotikaförskrivning rekom- Faktaruta 1. Definitioner. Pneumoni (lunginflammation): Symtom/statusfynd förenliga med akut nedre luftvägsinfektion i kombination med lungröntgenförändringar talande för denna sjukdom. Symtom talande för pneumoni är feber, hosta, dyspné, nytillkommen uttalad trötthet och andningskorrelerad bröstsmärta. Statusfynd talande för diagnosen är fokalt nedsatta andningsljud, fokala biljud (rassel/ ronki) och dämpning vid perkussion. Akut bronkit (luftrörskatarr): Nytillkommen hosta med eller utan slembildning som led i en luftvägsinfektion och där hostan inte är orsakad av annan bakomliggande lungsjukdom. Orent andningsljud bilateralt är vanligt förekommande hos dessa patienter. Lätt obstruktivitet är inte ovanligt. Lungröntgen är definitionsmässigt normal. Akut exacerbation av kronisk bronkit/kol: Episodiskt förekommande försämring av grundsjukdomen som karakteriseras av ett eller flera av symtomen ökad dyspné, ökad sputumvolym och ökad sputumpurulens. Information från Läkemedelsverket 3:
12 menderas (Rekommendationsgrad D). Lungröntgen bör övervägas framför allt för patienter med allvarliga bakomliggande sjukdomar (Rekommendationsgrad D). Övriga differentialdiagnostiska överväganden Infektiösa Tuberkulos Kikhosta Icke infektiösa Lungemboli Hjärtsvikt Astma bronkiale Lungcancer Allvarlighetsbedömning vid pneumoni Vid pneumoni bör en allvarlighetsbedömning göras enligt CRB-65 (se Figur 2) (Rekommendationsgrad D). Mätning av syrgasmättnaden med pulsoximeter kan i utvalda fall också ingå och dokumenteras. Vid syrgasmättnad < 92 % hos en tidigare lungfrisk pa- tient bör denne remitteras akut till sjukhus (Rekommendationsgrad D). Akuta exacerbationer av kronisk bronkit/kol Diagnosen akut exacerbation är rent klinisk och förutsätter kunskap om att kronisk bronkit/kol föreligger (se bakgrundsdokumentationen). En akut exacerbation kännetecknas av ett eller flera av följande symtom: nytillkomna missfärgade upphostningar, ökad mängd upphostningar och ökad dyspné. Missfärgade upphostningar är korrelerat till fynd av bakterier och höga bakterietal. Sputumodling krävs inte för diagnos. Vid akut försämring av kronisk bronkit/kol bör en klinisk värdering av svårighetsgraden utföras. Baserat på denna bedömning kan patientens exacerbation kategoriseras som lindrig medelsvår, svår eller livshotande (Tabell I). Patienter med svåra exacerbationer är i allmänhet sjukhusfall. Figur 2. Allvarlighetsbedömning med CRB-65. CRB-65 poäng Vårdnivå Tabell I. Vägledning för klinisk värdering av svårighetsgraden vid akut försämring av KOL. Lindrig medelsvår exacerbation Svår exacerbation Livshotande exacerbation Allmänpåverkan Obetydlig lindrig Påverkad, cyanos, ödem Konfusion koma Dyspné Obetydlig besvärande ansträngningsdyspné Vilodyspné Uttalad vilodyspné Andningsfrekvens < 25/min > 25/min Hjärtfrekvens < 110/min > 110/min Saturation (luftandning) 90 % < 90 % < 90 % Blodgas Behöver vanligen ej mätas po 2 < 8,0 kpa pco 2 6,5 kpa po 2 < 6,5 kpa pco 2 9,0 kpa ph < 7,3 12 Information från Läkemedelsverket 3:2008
13 Tabell II. Handläggning av vuxna patienter med nedre luftvägsinfektion som söker i öppenvård. Symtom och status talande för: Sannolik akut bronkit Sannolik pneumoni Oklar nedre luftvägsinfektion CRP - - För pneumoni talar CRP > 100 mg/l CRP > 50 mg/l efter 1 v Exacerbation av kronisk bronkit/kol - Mikrobiologisk diagnostik - Överväg odling från sputum eller nasofarynx Mot pneumoni talar: CRP < 20 mg/l - - Lungröntgen - - Övervägs vid hög ålder eller allvarlig bakomliggande sjukdom Spirometri Rökare; KOL? Kliniska tecken på obstruktivitet; astma?, KOL? Antibiotikabehandling - Penicillin V Vid typ 1-allergi: doxycyklin Överväg penicillin V till patient med allmänpåverkan, CRP talande för pneumoni eller lunginfiltrat. Överväg exspektans med förnyad kontakt, eventuellt fördröjd antibiotikaförskrivning till övriga. Rökprevention Ja Ja Ja Ja Remiss till sjukhus Patient som uppfattas som allvarligt sjuk - Patient som uppfattas som allvarligt sjuk. Övervägs vid CRB-65 1* - Om uppgift saknas Amoxicillin, doxycyklin eller trimetoprim-sulfa Svår/livshotande exacerbation * Nytillkommen konfusion, andningsfrekvens 30/min, blodtryck systoliskt < 90 eller diastoliskt 60 eller ålder 65 år. Handläggning av febril nedre luftvägsinfektion hos vuxna Den rekommenderade handläggningen av vuxna patienter med nedre luftvägsinfektioner som söker i öppenvård sammanfattas i Tabell II. Behandling av akut bronkit Patienter med akut bronkit har ingen nytta av antibiotikabehandling. Detta gäller oavsett om bronkiten orsakats av virus, mykoplasma eller klassiska bakterier (Rekommendationsgrad A). Det är viktigt med noggrann information om normalförloppet och för rökare råd om rökstopp (Rekommendationsgrad A). Behandling av pneumoni Förstahandsmedel vid pneumoni är penicillin V 1 g 3 i 7 dagar (Rekommendationsgrad B). Vid terapisvikt eller typ 1-allergi mot penicillin rekommenderas doxycyklin i sju dagar (200 mg dag 1 3, därefter 100 mg 1) (Rekommendationsgrad D). Behandling av akuta exacerbationer av kronisk bronkit/kol De patienter som har nytta av antibiotikabehandling är de med missfärgade upphostningar tillsammans med ökad mängd upphostningar och/eller ökad dyspné (Rekommendationsgrad B). Vid exacerbationer av kronisk bronkit, lindrig och medelsvår KOL bör i första hand amoxicillin 500 mg 3, doxycyklin (200 mg dag 1 3, därefter 100 mg 1), eller trimetoprim-sulfa 160/800 mg 2 användas (Rekommendationsgrad B). Behandlingen ges i fem till sju dagar. Om missfärgade upphostningar saknas är antibiotikabehandling som regel inte indicerad (Rekommendationsgrad B). Uppföljning av akut bronkit/pneumoni För patienter som bedömts ha akut bronkit är rutinmässig uppföljning inte indicerad (Rekommendationsgrad D). Vid recidiverande akut bronkit bör spirometri i efterförloppet övervägas. Rutinmässig uppföljning är inte heller nödvändig vid akut exacerbation av kronisk bronkit/kol (Rekommendationsgrad B). Vid oförändrat purulenta upphostningar fyra till fem dagar efter insatt antibiotikabehandling bör eventuellt byte till annat antibiotikum föregås av sputumodling. Vid pneumoni och oklar nedre luftvägsinfektion uppmanas patienten oavsett om antibiotikabehand- Information från Läkemedelsverket 3:
14 ling inletts eller inte att i normalfallet ta förnyad kontakt inom två till tre dagar om inte förbättring skett. Vid utebliven förbättring efter tre dagars penicillinbehandling: Överväg utredning med lungröntgen om detta inte gjorts. Om diagnosen kvarstår och misstanke om mykoplasmapneumoni föreligger kan man byta till doxycyklin. Om försämring skett bör infektionsklinik kontaktas. Vid pneumoni är det ofta lämpligt att göra en uppföljning efter cirka sex veckor antingen i form av ett kort läkarbesök eller i form av en telefonkontakt, för att efterhöra hur patienten mår. Om luftvägssymtom kvarstår bör en lungröntgen utföras och spirometri övervägas, vilket framför allt gäller rökare över år (Rekommendationsgrad C). Rökare bör ges råd om rökstopp (Rekommendationsgrad A). Nedre luftvägsinfektioner hos barn Luftvägsinfektioner hos barn är vanliga. Barn i förskoleåldern har i genomsnitt sex till tio luftvägsinfektioner per år med en medelduration om en vecka. Hosta i samband med infektionen varar inte sällan i några veckor men avtar successivt. Det rör sig då oftast om en akut bronkit som orsakas av virus. Ett barn med hosta av oförändrad eller ökad intensitet bör bedömas efter en månad, tidigare om andra symtom tillkommer. Hos barn upp till två år förekommer ofta obstruktiva andningsbesvär i anslutning till övre luftvägsinfektioner. Barnen har ingen eller obetydlig feber men är ofta ordentligt andningspåverkade. Vid auskultation hörs tydliga ronki och inhalationsbehandling med bronkdilaterande läkemedel har ofta viss effekt i detta läge. Barn som inte påtagligt förbättras av luftrörsvidgande behandling och är fortsatt allmänpåverkade remitteras till barnklinik. Antibiotika är inte indicerat vid obstruktiv bronkit om det inte samtidigt finns tecken till en behandlingskrävande bakteriell infektion (Rekommendationsgrad B). Barn med pneumoni har i början ofta inte hosta eller andra luftvägssymtom. När man undersöker barn med akut feber av oklar orsak och påverkat allmäntillstånd ska man därför titta och lyssna efter tecken på pneumoni. För små barn med oklar feber är de kliniska tecknen på specifik infektion ofta svårtolkade, och därför är den viktigaste uppgiften utanför sjukhus att bedöma barnets allmäntillstånd. Differentialdiagnostiska överväganden I gränslandet mellan övre och nedre luftvägsinfektion finns övre luftvägsinfektion med hosta. Hos barn är det vanligt att hosta förekommer i samband med övre luftvägsinfektion. Dessa barn har förkylningssymtom som dominerande inslag. De är opåverkade men kan ha feber. Förutom snuvan finner man inget uppenbart patologiskt i status och provtagning för till exempel CRP bör inte ske. Behandling med antibiotika är inte indicerad (Rekommendationsgrad B). Astma är den dominerande orsaken till långdragen hosta hos barn. Andra infektiösa orsaker till hosta hos barn är pertussis och mera sällsynt tuberkulos, där risken på grund av smitta från patienten eller patientens smittkälla bör uppmärksammas. Handläggning av febril nedre luftvägsinfektion hos barn Den rekommenderade initiala handläggningen av barn med nedre luftvägsinfektioner som söker i öppenvård sammanfattas i Tabell III (barn sex månader till sex år) och IV (barn > 6 år). Nedre luftvägsinfektion utan misstanke om pneumoni En del barn får en besvärlig hosta i samband med nedre luftvägsinfektion. Hostan är det dominerande symtomet och ofta är det hostan som föranleder läkarbesöket. Hostan, som finns hela dygnet, brukar vålla mest obehag nattetid. Dessa barn kan ha feber men är ofta afebrila. Vid undersökning av barnen kan det finnas liksidiga biljud på lungorna. Takypné (se Tabell III) eller andra tecken på påverkat allmäntillstånd finns inte. Ingen ytterligare provtagning med CRP är indicerad och behandling med antibiotika är inte befogad (Rekommendationsgrad B). Ge råd att återkomma vid påverkat allmäntillstånd, ökande andningsbesvär eller svårigheter att få i sig vätska. Nedre luftvägsinfektion med möjlig pneumoni Barnen är ofta trötta och har feber, men är inte slöa. Hosta kan förekomma. Andningsfrekvensen är ofta 30 50/minut hos barn yngre än ett år, samt andetag per minut hos barn äldre än ett år, det vill säga på gränsen till takypné. De har dock sällan thorakala indragningar vid andning. De dricker och kissar bra. Den kliniska bedömningen är avgörande för ställningstagande till svårighetsgraden. Undantagsvis kan CRP analyseras (se nedan). Barn < 6 månader med misstänkt pneumoni bör bedömas i samråd med barnläkare. Nedre luftvägsinfektion med svår pneumoni Dessa barn är ordentligt påverkade i sitt allmäntillstånd. De är slöa och har inte sällan kraftiga thorakala indragningar. Takypné är regel, det vill säga andningsfrekvens över 50 hos barn yngre än ett år samt över 40 hos barn äldre än ett år. Hosta behöver inte vara framträdande. Ofta dricker och kissar barnen dåligt. Oxygenmättnad ( saturation ) kan vara nedsatt. Dessa barn ska remitteras vidare till barnklinik och ytterligare diagnostik i primärvården är inte indicerat. Diagnostiska hjälpmedel i mellangruppen ( möjlig pneumoni ) där kliniken inte ger tillräcklig vägledning för behandlingsbeslut Den kliniska bilden är avgörande vid bedömning av den nedre luftvägsinfektionens svårighetsgrad. CRP kan ge viss vägledning om patienten har mer än 24 timmars sjukdomsanamnes. Flera välgjorda studier visar dock att sambandet mellan CRP och svårighetsgrad av bakteriell nedre luftvägsinfektion är svagt (Evidensgrad 2). CRP kan inte heller differentiera 14 Information från Läkemedelsverket 3:2008
15 mellan bakterier och virus (Evidensgrad 2). CRP ska därför användas restriktivt. Om CRP > 80: Överväg att behandla med antibiotika. Om CRP < 10: Avstå från behandling med antibiotika. Om CRP 10 80: Ge råd om skärpt observation och att söka åter vid försämring. Överväg telefonkontakt/återbesök och eventuellt nytt CRP efter ett till två dygn. Analys av leukocyter ger sällan vägledning om agens vid diagnostik av pneumonier i öppenvård. Lungröntgen kan inte differentiera mellan virus och bakterieorsakad pneumoni och har ingen plats i utredningen i öppenvård. Behandling av nedre luftvägsinfektioner Pneumoni är den allvarligaste luftvägsinfektionen hos barn, och det är viktigt att ge effektiv behandling. Fenoximetylpenicillin (pcv) i 3 doser/dag är tillräckligt vid okomplicerad pneumoni, men adekvata serumkoncentrationer kan vara svåra att uppnå vid behandling med oral suspension på grund av sämre absorption samt risk för att hela dosen inte intas som avsett ( läckage ) (Evidensgrad 5). Dosen bör därför vara hög. Vid infektion med pneumokocker med nedsatt känslighet för penicilliner och vid infektion med H. influenzae kan mixtur amoxicillin vara ett alternativ. Mixtur amoxicillin absorberas bättre Tabell III. När ska vi misstänka pneumoni hos barn sex månader till sex år? (Rekommendationsgrad D). Allmäntillstånd (AT) Andningsfrekvens (normalt: < 1år: < 50/minut; =/> 1 år: < 40/minut) Tabell IV. När ska vi misstänka pneumoni hos barn > 6 år? (Rekommendationsgrad D). Allmäntillstånd (AT) Ingen misstanke Möjlig pneumoni Svår pneumoni Huvudkriterier Övre luftvägssymtom Trött, men ger god Påverkat AT och opåverkat AT kontakt Normal Ofta nära övre normalgränsen Förhöjd (takypné) Indragningar Inga Inga eller måttliga Kraftiga Dricker och kissar Bra Ganska bra Dåligt Oxygenmättnad ( saturation ) > 95 % > 92 % < 92 % Tilläggskriterier Kroppstemperatur < 38 o C Oftast < 39,5 o C Oftast > 39 o C Hjärtfrekvens (normalt: < 1 år: < 160/minut; > 1 år: < 136/minut) Normal Oftast normal Förhöjd (takykardi) För diagnosen svår pneumoni är ett av huvudkriterierna tillräckligt. Alla barn med svår pneumoni remitteras till barnklinik. Ingen misstanke Möjlig pneumoni Svår pneumoni Huvudkriterier Övre luftvägssymtom Trött, men ger god Påverkat AT och opåverkat AT kontakt Andning Normal Mild andfåddhet kan förekomma Subjektiva andningsbesvär; andningsfrekvens > 30/minut Indragningar Inga Inga eller måttliga Kraftiga Dricker och kissar Bra Ganska bra Dåligt Oxygenmättnad ( saturation ) > 95 % > 92 % < 92 % Tilläggskriterier Kroppstemperatur < 38 o C Oftast < 39,5 o C Oftast > 39 o C Hjärtfrekvens (normalt: 6 12 år: < 136/minut; > 12 år: < 111/minut) Normal Oftast normal Förhöjd (takykardi) För diagnosen svår pneumoni är ett huvudkriterium tillräckligt. Alla barn med tecken till svår pneumoni remitteras till barnklinik. Information från Läkemedelsverket 3:
16 från tarmen, är mindre proteinbundet och har längre halveringstid och bättre smak än pcv. En tillräcklig serumkoncentration av fri (antibakteriellt aktiv) drog uppnås därför lättare med amoxicillin än med pcv, men detta medel selekterar penicillinresistenta bakterier i signifikant större utsträckning än pcv. Amoxicillin ska därför användas sparsamt. Det doseras tre gånger dagligen (Rekommendationsgrad A). Den vanligaste orsaken till utebliven effekt av antibiotikabehandling hos förskolebarn är att det rör sig om en virusinfektion eller blandinfektion där viruskomponenten ännu inte läkt. Vid gott allmäntillstånd kan man därför expektera i detta läge. Mykoplasma: Den kliniska effekten av antibiotikabehandling vid nedre luftvägsinfektioner hos barn orsakade av M. pneumoniae skiljer sig inte åt vid behandling med makrolidantibiotika jämfört med andra antibiotika och placebokontrollerade studier saknas. Mot denna bakgrund rekommenderas vid behov av antibiotikabehandling i första hand penicillin V. Vid utebliven förbättring efter tre dagars penicillinbehandling kan ytterligare utredning med till exempel lungröntgen övervägas. Misstänker man mykoplasma kan man byta till erytromycin. Uppdelning av dygnsdosen på tre till fyra gånger anges minska risken för gastrointestinala biverkningar (Rekommendationsgrad D). Hos skolbarn är M. pneumoniae vanlig orsak till pneumoni och kan under vissa år orsaka upp till en tredjedel av pneumonierna. Penicillinallergi: Många barn har haft utslag vid penicillinbehandling. En noggrann anamnes utesluter oftast typ 1-allergi mot penicillin men vid skälig misstanke på sådan kan man behandla pneumonin med erytromycin eller klindamycin (Rekommendationsgrad A). I Tabell V sammanfattas rekommendationerna för antibiotika vid pneumoni hos barn. Vätska och oxygen De svårt sjuka patienter som väntar på ambulanstransport bör få parenteral vätska (till exempel Ringeracetat) och oxygen för att minska andningsarbetet och upprätthålla en oxygensaturation > 92 %. Tabell V. Behandling av pneumoni hos barn med antibiotika per os. Observera att penicillindoserna är högre än vad som tidigare rekommenderats. Ålder Förstahandsval Val vid pc-allergi eller infektion med mykoplasma eller klamydia Små barn som kräver mixtur < cirka 5 år Äldre barn som kan ta tabletter > cirka 5 år PcV (fenoximetylpenicillin) oral suspension 20 mg/kg 3 i 7 dagar eller amoxicillin oral suspension 15 mg/kg 3 i 5 dagar PcV-tabletter 12,5 mg/kg 3 i 7 dagar Erytromycin Barn < 35 kg: 10 mg/kg 4 i 7 dagar Barn > 35 kg: 0,5 g 4 i 7 dagar Kvalitetsgradering av evidens (efter NHS Research and Developement, 1999; 1 a Systematisk analys av randomiserade kontrollerade studier med homogenicitet 1 b Minst en stor randomiserad kontrollerad studie 1 c Allt eller intet uppfylls när alla patienter dog innan behandlingen blev tillgänglig men några överlever med behandlingen, eller några överlevde utan behandling men med behandling överlever alla 2 a Systematisk analys av kohortstudier med homogenicitet 2 b Individuella kohortstudier inklusive randomiserade kontrollerade studier med lågt bevisvärde (låg kvalitet, vida konfidensintervall, låg inklusion av vissa subgrupper i en studie etc.) 2 c Utfallsstudier ( Outcomes Research ) 3 a Systematisk analys av fall-kontrollstudier med homogenicitet 3 b Individuella fall-kontrollstudier 4 Fallserier med fall-kontrollstudier och kohortstudier med låg kvalitet 5 Expertsynpunkter utan kritiska analyser eller baserade på fysiologi etc. Gradering av rekommendationer A Baseras på evidensgrad 1a, b eller c B Baseras på evidensgrad 2a, b och c samt 3a och b C Baseras på evidensgrad 4 D Baseras på evidensgrad 5 16 Information från Läkemedelsverket 3:2008
17 Deltagarlista Deltagarnas jävsförhållanden kan erhållas från Läkemedelsverket. Distriktsläkare Malin André Vårdcentralen Britsarvet Västra Järnvägsgatan Falun Överläkare, Docent Inge Axelsson Barn/ungdomskliniken Östersunds sjukhus Östersund Assistent Kristina Bergström Läkemedelsverket Box Uppsala Professor Otto Cars STRAMA Solna Överläkare Bengt Christensson Infektionskliniken Visby Lasarett Visby Professor Charlotta Edlund Läkemedelsverket Box Uppsala Överläkare, Docent Margareta Eriksson Barnakuten Q8:00 Astrid Lindgrens sjukhus Karolinska Universitetssjukhuset/Solna Stockholm Senior expert Barbro Gerdén Läkemedelsverket Box Uppsala Överläkare, Verksamhetschef Lennart Hansson VO Lung- och allergisjukdomar Hjärt- och lungdivisionen Universitetssjukhuset i Lund Lund Distriktsläkare Katarina Hedin Vårdcentralen Ryd Hantverksgatan Ryd Överläkare, Docent Jonas Hedlund Infektionskliniken Karolinska Universitetssjukhuset/Solna Stockholm Överläkare, Docent Hans Holmberg Infektionskliniken Universitetssjukhuset i Örebro Örebro Professor Mats Kalin Infektionskliniken Karolinska Universitetssjukhuset/Solna Stockholm Farmaceut Karin Klintberg Läkemedelsverket Box Uppsala Professor Sven Larsson Avd för Internmedicin/lungmed-allergologi Sahlgrenska Universitetssjukhuset Göteborg Professor Hasse Melbye Institutt for samfunnsmedisin Universitetet i Tromsø 9037 Tromsø Norge Överläkare, Docent Åsa Melhus Avd för klinisk Mikrobiologi Akademiska sjukhuset Uppsala Professor Sigvard Mölstad Primärvårdens FoU-enhet Jönköping Distriktsläkare Christer Norman Salems Vårdcentral Rönninge Överläkare Ingemar Qvarfordt Infektionshygien vid bakteriologiska laboratoriet Sahlgrenska Universitetssjukhuset Guldhedsgatan Göteborg Bitr Överläkare Maria Rotzén Östlund Klinisk mikrobiologi Karolinska Universitetssjukhuset/Solna Stockholm Överläkare, Docent Johan Struwe STRAMA Solna Specialistläkare, Med Dr Kristoffer Strålin Infektionskliniken Universitetssjukhuset i Örebro Örebro Smittskyddsläkare, Docent Åke Örtqvist Smittskyddsenheten Norrbacka Stockholm Information från Läkemedelsverket 3:
18 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Bakgrundsdokumentation Artiklar publicerade under rubriken Bakgrundsdokumentation är författarens enskilda manuskript. Budskapet i dessa delas därför inte alltid av expertgruppen i sin helhet. Nedre luftvägsinfektion hos vuxna epidemiologi och etiologi Kristoffer Strålin Epidemiologi Patienter med luftvägsinfektioner är vanliga inom primärvården, där de utgör % av alla konsultationer i de nordiska länderna (1). Bland patienter som söker för luftvägsinfektioner har omkring 25 % nedre luftvägsinfektion (2,3), vilket ofta definieras som akut sjukdom med hosta och minst ett annat nedre luftvägssymtom (sputumproduktion, dyspné, väsande andning och bröstsmärta) (4). Incidensen av nedre luftvägsinfektion är som högst under vintermånaderna. Nedre luftvägsinfektion kan indelas i tre huvudgrupper: lunginflammation (pneumoni), akut bronkit, samt exacerbation av kronisk bronkit/kroniskt obstruktiv lungsjukdom (KOL). Mellan 1 % och 10 % av befolkningen i europeiska länder söker årligen sjukvård för samhällsförvärvad nedre luftvägsinfektion (5,6). Av dem har cirka % pneumoni (2,7,8). Den årliga incidensen av samhällsförvärvad pneumoni har uppmätts till cirka 1 % (9 11), med relativ incidensökning med stigande ålder (9,10) % av vuxna pneumonipatienter sjukhusvårdas (8 11). I Figur 1 illustreras propor- tionerna av olika typer av luftvägsinfektioner som ett isberg. Som framgår av figuren är pneumoni den allvarligaste huvudgruppen av nedre luftvägsinfektion. I moderna studier har mortaliteten vid pneumoni rapporterats vara 0 0,5 % i öppenvård (10,12,13) och 3,5 6 % vid sjukhusvård på svensk infektionsklinik (14 18). Före introduktionen av antibiotikabehandling var pneumonimortaliteten betydligt högre (19,20). För icke-pneumonisk nedre luftvägsinfektion i öppenvård är mortaliteten mycket låg (7). Då pneumoni är ett potentiellt allvarligt tillstånd som oftast orsakas av bakterier (se nedan) finns för pneumoni klar indikation för behandling med antibiotika (4). För exacerbation av kronisk bronkit/ KOL finns en relativ behandlingsindikation för vissa undergrupper (4). Behandlingsindikation saknas däremot helt för okomplicerad akut bronkit i öppenvård (4). Ur prognos- och behandlingssynvinkel är det därmed angeläget att identifiera fallen med pneumoni bland patienterna med nedre luftvägsinfektion. Vid pneumoni är själva lungparenkymet inflammerat och konsoliderat (Figur 2A). Vid akut bronkit och Figur 1. Isberget av samhällsförvärvad luftvägsinfektion, nedre luftvägsinfektion och pneumoni hos vuxna. Antal inom parentes är estimerade relativa proportioner av patienter, baserade på aktuella nordiska studier (2,3,8,10,18). 18 Information från Läkemedelsverket 3:2008
19 exacerbation av kronisk bronkit/kol är inflammationen istället lokaliserad till bronkerna och bronkträdet (Figur 2B). I realiteten är det svårt att dra en skarp gräns mellan pneumoni och icke-pneumonisk nedre luftvägsinfektion. Lungröntgen används ofta för att identifiera pneumoni genom att påvisa konsoliderat lungparenkym (4,13,21). I öppenvård, där man inte har tillgång till röntgen, kan den kliniska bilden ge viss vägledning (2,21). Hög feber, frossa, takykardi, takypné, hypoxi och fokala auskultationsfynd talar för pneumoni, medan låg måttlig temperaturstegring i kombination med övre luftvägssymtom (halsont och snuva) talar emot pneumoni (21,22). Tuberkulos Tuberkulos utgör en viktig differentialdiagnos hos patienter med nedre luftvägsinfektion, i synnerhet vid långvarig hosta om patienten tillhör en riskgrupp (23). Etiologi De rapporterade frekvenserna av olika mikrobiologiska agens varierar mycket mellan olika studier av patienter med nedre luftvägsinfektion (Tabell I och II). De stora variationerna för samma agens i olika studier beror bland annat på vilka patientgrupper och åldersgrupper som studerats, vilka mikrobiologiska metoder som använts och hur resultaten av dessa har tolkats, samt på den epidemiologiska situationen i samband med respektive studie. Pneumoni Pneumoni är oftast en bakteriell infektion, där antibiotika som regel behövs för läkning (20,24). Tabell I visar frekvensen av olika etiologiska agens som rapporterats i nordiska studier av vuxna öppenvårdspatienter med pneumoni. Noteras bör att man i studierna av Berntsson (25), Melbye (2) och Jokinen (26) i huvudsak använt serologiska metoder för att identifiera etiologiska agens. I fem svenska studier av sjukhusvårdade pneumonipatienter (14,16,17,27,28) påvisades Streptococcus pneumoniae hos %, Haemophilus influenzae hos 4 14 %, Staphylococcus aureus hos 1 2 %, Moraxella catarrhalis hos 1 2 %, Mycoplasma pneumoniae hos 5 14 %, Chlamydophila spp. hos 1 3 %, Legionella spp. hos 1 4 % och luftvägsvirus hos 5 21 %. Hos % av patienterna påvisades inget etiologiskt agens. S. pneumoniae är den vanligaste etiologin till pneumoni i både öppen och sluten vård, och är också den mest frekvent identifierade etiologin vid pneumoni med dödlig utgång (29). De rapporterade frekvenserna av H. influenzae är högre i de senare svenska studierna (13,28) än i de tidigare studierna (16,25). Denna skillnad beror sannolikt till stor del på att olika populationer och olika diagnostiska metoder använts. I utodlade sputumodlingar från pneumonipatienter vid infektionskliniken i Örebro påvisades H. influenzae hos 13 % (16) och hos 16 % (28), det vill säga i relativt likvärdig frekvens. Medan S. pneumoniae och H. influenzae är vanliga etiologier i alla åldersgrupper, är det framför allt personer under 50 års ålder som insjuknar i pneumoni orsakad av M. pneumoniae (14,17,27). M. pneumo niae är vanligare i öppen än i sluten vård och incidensen varierar cykliskt med incidenstoppar med några års Figur 2. Schematisk illustration av inflammationens lokalisation vid pneumoni (A, lungparenkymet inflammerat), respektive akut bronkit/exacerbation av kronisk bronkit/kol (B, bronker och bronkträdet inflammerade). Noteras bör att patienter med pneumoni ibland kan ha inflammation av både lungparenkym och bronker (illustration av M Bergman/K Strålin). Information från Läkemedelsverket 3:
20 mellanrum (30). Chlamydophila pneumoniae kommer ofta som utbrott med ojämna intervall (31, 32). Vid infektion med M. pneumoniae och C. pneumoniae varierar kliniken från lindrig övre luftvägsinfektion till pneumoni (32,33). Pneumoni med M. pneumoniae och C. pneumoniae i öppenvård är sannolikt många Tabell I. Etiologiska agens identifierade i nordiska studier av vuxna öppenvårdspatienter med nedre luftvägsinfektion med lungröntgeninfiltrat. Patogen Berntsson 1986 (25) (Sverige, n = 54) Antal (%) Melbye 1992 (2) (Norge, n = 19) Antal (%) Jokinen 2001 (26) (Finland, n = 169) Antal (%) Lagerström 2003 (13) (Sverige, n = 82) Antal (%) Holm 2007 (8) (Danmark, n = 48) Antal (%) Totalt * Andel (%) Streptococcus pneumoniae 5 (9) 1 (5,2) 62 (37) 26 (32) 7 (15) 101/372 (27) Haemophilus influenzae 6 (12) EA 7 (4,1) 23 (28) 2 (4,2) 38/353 (11) Moraxella EA EA 3 (1,8) 4 (4,9) 0 7/299 (2,3) catarrhalis Staphylococcus EA EA EA 0 1 (2,1) 1/130 (0,8) aureus Mycoplasma 20 (37) 2 (11) 23 (14) 15 (18) 4 (8,3) 64/372 (17) pneumoniae Chlamydophila 2 (4) 3 (16) 15 (8,9) 5 (6,1) 0 25/372 (6,7) spp. Legionella spp. 0 0 EA Luftvägsvirus 7 (13) 7 (37) 13 (7,7) 13 (16) 6 (13) 46/372 (12) Ingen patogen påvisad 22 (41) ES 76 (45) 20 (24) 27 (56) 145/353 (41) EA, Ej analyserat. * Patienter där analys utförts. Tabell II. Mikrobiologiska agens identifierade i nordiska studier av vuxna öppenvårdspatienter med nedre luftvägsinfektion utan lungröntgeninfiltrat. Patogen Melbye 1992 (2) (Norge, n = 98) Antal (%) gånger självläkande, då patienterna ofta tillfrisknar under behandling med β-laktamantibiotika (34). Fynd av flera mikrobiologiska patogener hos samma pneumonipatient förekommer i varierande frekvens (13,16,17,26), men den kliniska betydelsen av detta är oklar. Bakteriell pneumoni kan ibland före- Lagerström 2003 (13) (Sverige, n = 95) Antal (%) Holm 2007 (8) (Danmark, n = 316) Antal (%) Totalt * Andel (%) Streptococcus pneumoniae 8 (8,2) 21 (22) 16 (5,1) 45/509 (8,8) Haemophilus influenzae EA 14 (15) 13 (4,1) 27/411 (6,6) Moraxella catarrhalis EA 11 (12) 4 (1,3) 15/411 (3,6) Mycoplasma pneumoniae 5 (5,1) 2 (2,1) 7 (2,2) 14/509 (2,8) Chlamydophila pneumoniae 0 5 (5,3) 2 (0,6) 7/509 (1,4) Legionella spp Rhinovirus EA EA 34 (11) 34/316 (11) Influensavirus (A+B) 11 (11) 15 (16) 33 (10) 59/509 (12) Parainfluensavirus 5 (5,1) EA 2 (0,6) 7/414 (1,7) RS-virus 11 (11) 2 (2,1) 15 (4,7) 28/509 (5,5) Adenovirus 1 (1,0) 3 (3,2) 0 4/509 (0,8) Ingen patogen påvisad ES 47 (49) 192 (61) 239/411 (58) EA Ej analyserat. * Patienter där analys utförts. 20 Information från Läkemedelsverket 3:2008
21 gås av nedre luftvägsinfektion orsakad av virus (35). I många studier av vuxna pneumonipatienter påvisas luftvägsvirus hos > 10 % av fallen (2,8,13,14,25,27). Akut bronkit Akut bronkit är oftast en självläkande virusinfektion (36,37), för vilken antibiotika normalt inte påverkar läkningsförloppet (38,39). Dominansen av virus framkommer tydligt i de nordiska studierna av patienter med nedre luftvägsinfektion utan lungröntgeninfiltrat (Tabell II). I en välgjord brittisk studie (37) av öppenvårdspatienter med akut bronkit (n = 80) och åldersmatchade kontroller (n = 49) påvisades luftvägsvirus hos 63 % av patienterna och hos 12 % av kontrollerna. Rhinovirus var den mest frekvent identifierade patogenen (33 % av patienterna och 2 % av kontrollerna). Bland 60 patienter med akut bronkit som hostade upp sputum, påvisades luftvägsbakterier i sputumodling hos sju patienter (12 %). Bakteriefynd hos en patient med akut bronkit i öppenvård utgör i sig ingen indikation för antibiotikabehandling. Exacerbation av kronisk bronkit och KOL Både virus, bakterier och andra faktorer kan orsaka exacerbation av kronisk bronkit och KOL (40). Diagnostiken försvåras av att många patienter med kronisk bronkit/kol har positiv sputumodling även under stabila perioder (41). En metaanalys (42) visade en liten fördel (definierat som kortare sjukdomsduration) för antibiotika jämfört med placebo vid exacerbation. Bakterieorsakad exacerbation visar sig ofta med ökad sputumpurulens tillsammans med ökad sputumvolym och/eller dyspné (43). De vanligaste bakteriefynden är H. influenzae, S. pneumoniae och M. catarrhalis (40). Resistensutveckling Den höga incidensen av luftvägsinfektioner i samhället gör att antibiotikaanvändningen i denna sjukdomsgrupp sannolikt har stor betydelse för den aktuella resistenssituationen (44). Tydliga samband har setts mellan nationell användning av antibiotika och utbredning av resistens hos luftvägspatogener (45,46,47). Sverige har, i ett europeiskt perspektiv, en låg frekvens av S. pneumoniae med nedsatt känslighet för penicillin (47). Det rapporterade antalet fall av sådana isolat har varit stabilt i Sverige under de senaste åren (48). Andelen fall med nedsatt penicillinkänslighet bland invasiva pneumokockisolat har också legat relativt stabilt mellan 2 % och 4 % (48). I ett nationellt svenskt övervakningssystem, som baseras på konsekutiva kliniska pneumokockisolat, i huvudsak från nasofarynxodling, har man dock noterat en successiv ökning av andelen isolat med nedsatt känslighet för penicillin, från 4 % 1997 till 6,7 % 2006 (48). Under samma tidsperiod har man även noterat en ökning av andelen pneumokockisolat med resistens mot erytromycin (2 % 7,2 %), tetracyklin (3 % 7 %) och trimetoprim-sulfa (4,5 % 9,2 %) (48). Mer information om aktuellt resistensläge hos våra luftvägspatogener finns tillgängligt på För att stoppa den pågående resistensutvecklingen bland luftvägspatogener har en oberoende internationell grupp (44) slagit fast att antibiotikabehandling måste begränsas till de typer av luftvägsinfektioner, där bakterier dominerar som etiologi. Gruppen rekommenderar vidare att man, för diagnoser där indikation för behandling finns, om möjligt bör använda antibiotika som har förmåga att eradikera bakterier utan att driva fram resistens (44). Exempel på ett sådant antibiotikum är penicillin vid pneumokockpneumoni. Studier talar för att azitromycin (45) och perorala cefalosporiner (49) är särskilt benägna att driva fram resistens hos S. pneumoniae. På senare år har man även uppmärksammat negativa effekter av antibiotika avsedda för luftvägsinfektioner på bakteriepopulationer utanför luftvägarna (50). Bruk av kinoloner och parenterala cefalosporiner har kopplats till infektioner med Clostridium difficile (18,51) och extended-spektrum β-laktamas (ESBL) producerande Gramnegativa bakterier (52,53). Kinolonbruk har även kopplats till infektioner med meticillin-resistenta Staphylococcus aureus (MRSA) (50,54). Då vi i Sverige har tilltagande problem med både ESBL (55) och MRSA (56) är rekommendationen i Svenska Infektionsläkarföreningens vårdprogram för pneumoni 2007 (57) att man bör var restriktiv med användandet av kinoloner och cefalosporiner. Referenser 1. Grimsmo A, Hagman E, Faiko E, et al. Patients, diagnoses and processes in general practice in the Nordic countries. An attempt to make data from computerised medical records available for comparable statistics. Scand J Prim Health Care 2001;19(2): Melbye H, Berdal BP, Straume B, et al. Pneumonia a clinical or radiographic diagnosis? Etiology and clinical features of lower respiratory tract infection in adults in general practice. Scand J Infect Dis 1992;24(5): André M, Schwan A, Odenholt I. The use of CRP tests in patients with respiratory tract infections in primary care in Sweden can be questioned. Scand J Infect Dis 2004;36(3): Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005;26(6): Ward DJ, Ayres JG. Pneumonia and acute bronchitis. Eur Respir Mon 2000;15: Macfarlane J, Holmes W, Gard P, et al. Prospective study of the incidence, aetiology and outcome of adult lower respiratory tract illness in the community. Thorax 2001;56(2): Macfarlane J. Lower respiratory tract infection and pneumonia in the community. Semin Respir Infect 1999;14(2): Holm A, Nexoe J, Bistrup LA, et al. Aetiology and prediction of pneumonia in lower respiratory tract infection in primary care. Br J Gen Pract 2007;57(540): Woodhead MA, Macfarlane JT, McCracken JS, et al. Prospective study of the aetiology and outcome of pneumonia in the community. Lancet 1987;1(8534): Jokinen C, Heiskanen L, Juvonen H, et al. Incidence of community-acquired pneumonia in the population of four municipalities in eastern Finland. Am J Epidemiol 1993;137(9): Information från Läkemedelsverket 3:
22 11. Garibaldi RA. Epidemiology of community-acquired respiratory tract infections in adults. Incidence, etiology, and impact. Am J Med 1985;78(6B): Woodhead M. Management of pneumonia in the outpatient setting. Semin Respir Infect 1998;13(1): Lagerström F, Bader M, Foldevi M, et al. Microbiological etiology in clinically diagnosed community-acquired pneumonia in primary care in Örebro, Sweden. Clin Microbiol Infect 2003;9(7): Burman LÅ, Trollfors B, Andersson B, et al. Diagnosis of pneumonia by cultures, bacterial and viral antigen detection tests, and serology with special reference to antibodies against pneumococcal antigens. J Infect Dis 1991;163(5): Hedlund J, Örtqvist Å, Ahlqvist T, et al. Management of patients with community-acquired pneumonia treated in hospital in Sweden. Scand J Infect Dis 2002;34(12): Holmberg H. Aetiology of community-acquired pneumonia in hospital treated patients. Scand J Infect Dis 1987;19(5): Örtqvist Å, Hedlund J, Grillner L, et al. Aetiology, outcome and prognostic factors in community-acquired pneumonia requiring hospitalization. Eur Respir J 1990;3(10): Lidman C, Burman LG, Lagergren A, et al. Limited value of routine microbiological diagnostics in patients hospitalized for community-acquired pneumonia. Scand J Infect Dis 2002;34(12): Heffron R. Pneumonia with special reference to pneumococcus lobar pneumonia. New York: The Commonwealth Fund; Evans GM, Gaisford WF. Treatment of pneumonia with 2-pyridine. Lancet 1938;2: Metlay JP, Kapoor WN, Fine MJ. Does this patient have community-acquired pneumonia? Diagnosing pneumonia by history and physical examination. JAMA 1997;278(17): Nolt BR, Gonzales R, Maselli J, et al. Vital-sign abnormalities as predictors of pneumonia in adults with acute cough illness. Am J Emerg Med 2007;25(6): Kunimoto D, Long R. Tuberculosis: still overlooked as a cause of community-acquired pneumonia how not to miss it. Respir Care Clin N Am 2005;11(1): Austrian R, Gold J. Pneumococcal bacteremia with especial reference to bacteremic pneumococcal pneumonia. Ann Intern Med 1964;60: Berntsson E, Lagergård T, Strannegård Ö, et al. Etiology of community-acquired pneumonia in out-patients. Eur J Clin Microbiol 1986;5(4): Jokinen C, Heiskanen L, Juvonen H, et al. Microbial etiology of community-acquired pneumonia in the adult population of 4 municipalities in eastern Finland. Clin Infect Dis 2001;32(8): Berntsson E, Blomberg J, Lagergård T, et al. Etiology of community-acquired pneumonia in patients requiring hospitalization. Eur J Clin Microbiol 1985;4(3): Strålin K. Diagnostic methods for bacterial etiology in adult community-acquired pneumonia (PhD thesis). Linköping: Linköping University; Fine MJ, Smith MA, Carson CA, et al. Prognosis and outcomes of patients with community-acquired pneumonia. A metaanalysis. JAMA 1996;275(2): Lind K, Benzon MW, Jensen JS, et al. A seroepidemiological study of Mycoplasma pneumoniae infections in Denmark over the 50-year period Eur J Epidemiol 1997;13(5): Boman J, Allard A, Persson K, et al. Rapid diagnosis of respiratory Chlamydia pneumoniae infection by nested touchdown polymerase chain reaction compared with culture and antigen detection by EIA. J Infect Dis 1997;175(6): Ekman MR, Grayston JT, Visakorpi R, et al. An epidemic of infections due to Chlamydia pneumoniae in military conscripts. Clin Infect Dis 1993;17(3): Balassanian N, Robbins FC. Mycoplasma pneumoniae infection in families. N Engl J Med 1967;277(14): Mills GD, Oehley MR, Arrol B. Effectiveness of beta lactam antibiotics compared with antibiotics active against atypical pathogens in non-severe community acquired pneumonia: metaanalysis. BMJ 2005;330(7489): Bakaletz LO. Viral potentiation of bacterial superinfection of the respiratory tract. Trends Microbiol 1995;3(3): Lieberman D, Ben-Yaakov M, Lazarovich Z, et al. Infectious aetiologies in elderly patients hospitalised with non-pneumonic lower respiratory tract infection. Age Ageing 2003;32(1): Creer DD, Dilworth JP, Gillespie SH, et al. Aetiological role of viral and bacterial infections in acute adult lower respiratory tract infection (LRTI) in primary care. Thorax 2006;61(1): Little P, Rumsby K, Kelly J, et al. Information leaflet and antibiotic prescribing strategies for acute lower respiratory tract infection: a randomized controlled trial. JAMA 2005;293(24): Smucny J, Fahey T, Becker L, et al. Antibiotics for acute bronchitis. Cochrane Database Syst Rev 2004(4):CD White AJ, Gompertz S, Stockley RA. Chronic obstructive pulmonary disease. 6: The aetiology of exacerbations of chronic obstructive pulmonary disease. Thorax 2003;58(1): Sethi S, Evans N, Grant BJ, et al. New strains of bacteria and exacerbations of chronic obstructive pulmonary disease. N Engl J Med 2002;347(7): Saint S, Bent S, Vittinghoff E, et al. Antibiotics in chronic obstructive pulmonary disease exacerbations. A meta-analysis. JAMA 1995;273(12): Anthonisen NR, Manfreda J, Warren CP, et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106(2): Ball P, Baquero F, Cars O, et al. Antibiotic therapy of community respiratory tract infections: strategies for optimal outcomes and minimized resistance emergence. J Antimicrob Chemother 2002;49(1): Barkai G, Greenberg D, Givon-Lavi N, et al. Community prescribing and resistant Streptococcus pneumoniae. Emerg Infect Dis 2005;11(6): Bronzwaer SL, Cars O, Buchholz U, et al. A European study on the relationship between antimicrobial use and antimicrobial resistance. Emerg Infect Dis 2002;8(3): Goossens H, Ferech M, Vander Stichele R, et al. Outpatient antibiotic use in Europe and association with resistance: a crossnational database study. Lancet 2005;365(9459): Olsson-Liljequist B, Henriques Normark B, Struwe J, et al. Streptococcus pneumoniae: Annual Resistance Surveillance and Quality Control (RSQC) programme. In: Cars O, Olsson-Liljequist B, editors. Swedres 2006, A report on Swedish Antibiotic utilisation and resistance in human medicine. Solna: Smittskyddsinstitutet; 2006: Baquero F. Trends in antibiotic resistance of respiratory pathogens: an analysis and commentary on a collaborative surveillance study. J Antimicrob Chemother 1996;38(Suppl A): Paterson DL. Collateral damage from cephalosporin or quinolone antibiotic therapy. Clin Infect Dis 2004;38(Suppl 4): McCusker ME, Harris AD, Perencevich E, et al. Fluoroquinolone use and Clostridium difficile-associated diarrhea. Emerg Infect Dis 2003;9(6): Ena J, Arjona F, Martinez-Peinado C, et al. Epidemiology of urinary tract infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Urology 2006;68(6): Urbanek K, Kolar M, Loveckova Y, et al. Influence of thirdgeneration cephalosporin utilization on the occurrence of ES- BL-positive Klebsiella pneumoniae strains. J Clin Pharm Ther 2007;32(4): LeBlanc L, Pepin J, Toulouse K, et al. Fluoroquinolones and risk for methicillin-resistant Staphylococcus aureus, Canada. Emerg Infect Dis 2006;12(9): Information från Läkemedelsverket 3:2008
23 55. Cars O, Olsson-Liljequist B, Lundh K. Short summary of Swedres 2005, a report on Swedish antibiotic utilisation and resistance. Euro Surveill 2007;12(3): Stenhem M, Örtqvist Å, Ringberg H, et al. Epidemiology of methicillin-resistant Staphylococcus aureus (MRSA) in Sweden , increasing incidence and regional differences. BMC Infect Dis 2006;6: Goscinski G, Hedlund J, Holmberg H, et al. Vårdprogram för samhällsförvärvad pneumoni. In: Svenska Infektionsläkarföreningen; Available online at Pneumoni hos barn etiologi och epidemiologi Margareta Eriksson Sammanfattning Epidemiologisk variation av olika virus, bakterier och mykoplasma bestämmer vid sidan av ålder etiologi vid pneumoni hos barn. Med sned åldersfördelning och i tiden korta studier kan man alltså nå olika resultat vad gäller till exempel den procentuella betydelsen av RSV eller pneumokocker. En ideal studie bör täcka flera år för att kompensera för variationer i RSV-säsongsvariationer respektive storlek på influensautbrott. Det vanligaste bakteriefyndet i alla åldrar och under alla säsonger är pneumokocker. Vid sidan av detta dominerar virus hos de yngsta barnen. Luftvägsinfektioner inklusive pneumoni är den ledande orsaken till sjuklighet hos barn. All diskussion av pneumoni hos barn, frekvens, etiologi och epidemiologi, är naturligtvis beroende av hur pneumoni definieras. I flertalet studier har man använt sig av typiska kliniska symtom. I behandlingsstudier har man ofta krävt lungröntgenförändrig och om man studerat bakteriella infektioner alveolära infiltrat (1,2,3,4). Frekvensen är högst hos unga barn. Det finns få populationsbaserade studier som kunnat mäta frekvensen. I de få studier som finns anges frekvensen till 3 4 % per år under de första fem åren och därefter 1 2 % hos äldre barn (5,6). Den högre frekvensen pneumoni förorsakas av virusinfektioner medan frekvensen bakteriella infektioner är mer konstant mellan olika åldersgrupper (7). Enligt den diagnos/ receptundersökning som utförts under vecka 47, utgör pneumoni endast 3 % av luftvägsdiagnoser hos barn på en allmänläkarmottagning. I vårt land sjukhusvårdas varje år 0,4 0,2 % av alla barn. Studier över etiologin till pneumoni är förutom definition också beroende på vilka metoder man använder för att fastställa etiologin, allt från odling till PCR. Tidigare ansåg man att förekomst av virus i nasofarynx också var liktydigt med etiologi men det är möjligt att vi delvis kan komma att få ändra denna uppfattning. Förekomst av bakterier i nasofarynx hos barn utgör inget etiologiskt bevis. Bakterier i blododling kan påvisas hos endast 2 3 % av alla barn med pneumoni (1,2). Vid såväl virus- som bakterie- inklusive mykoplasmaetiologi har studier som senare legat till grund för rekommendationer om empirisk behandling ofta använt serologi med hjälp av parade sera (8,9). Ytterligare ett sätt att indirekt undersöka etiologi är placebokontrollerade studier av ett vaccin eller ett specifikt antibiotikum. Som exempel kan nämnas en stor vaccinationsstudie med niovalent pneumokockvaccin som genomförts i Sydafrika. Man fann där att fler luftvägsinfektioner (som kliniskt bedömts som pneumonier) kunde förebyggas än de som enbart hade alveolära infiltrat (10). Pneumokocker som etiologi hade alltså undervärderats (11). Samma vanligt förekommande virus och bakterier som förorsakar pneumoni förorsakar också lindrig luftvägsinfektion i samma populationer i Sverige och resten av världen. Många studier har utförts i västvärlden under perioden med ovan nämnda metodik, det vill säga direktpåvisning av virus och serologi för påvisande av virus, bakterier respektive mykoplasma. I Tabell I presenteras den procentuella fördelningen av olika etiologier. Här jämförs en studie från S:t Görans barnklinik fördelat på olika vårdformer med resultaten av tolv andra studier. Dessa tolv studier omfattar barn i såväl sluten- som sjukhusansluten öppenvård. Såväl åldersfördelning som den studerade perioden har varierat men omfattat åtminstone ett år (1,2,4,11,12). Att på detta sätt presentera procentuella fördelningar ger ett felaktigt intryck. Säsongsvariationens stora betydelse i ovan nämnda undersökning framgår av Figur 1, där man också kan se variationen av olika RS-säsonger. Vid sidan av säsongsvariationen påverkas den procentuella fördelningen av åldern på barn som inkluderats, det vill säga att etiologin för de individuella barnen, speciellt vad gäller virus och mykoplasma, aldrig överensstämmer med översiktstabellen. I Tabell II visas virus respektive bakterier i olika åldersgrupper från samma Stockholmsmaterial. De mest smittsamma virus såsom RS-virus och influensa drabbar tidigt i livet vilket leder till att virusinfektioner som etiologi kommer att dominera hos de yngsta barnen. Senare i livet då vi fått ett immunologiskt minne för de mest smittsamma virusen kommer bakterieetiologi att dominera. Bland virus Information från Läkemedelsverket 3:
24 Tabell I. Procentuell fördelning av olika agens vid pneumoni hos barn. 15 studier S:t Göran (n = 367) Röntgenförändring Inga (%) Öppenvård (%) Slutenvård (%) Intensivvård (%) n = n = 54 n = 229 n = 128 n = 10 Virus RSV Influensa A, B Adenovirus Parainfluensa Övrigt Bakterier Pneumokocker H. influenzae Moraxella catarrhalis 3 10 Mykoplasma Klamydia Virus + bakterier Okänd Tabell II. Procentuell fördelning av olika agens i olika åldergrupper (S:t Göran ). > 1 år år år 188 > 6 år 89 Virus Bakterier Virus + bakterier Mycoplasma pneumoniae Okänd Figur 1. Säsongsvariation av pneumoni och genes hos barn S:t Göran Information från Läkemedelsverket 3:2008
25 dominerar RS-virus, influensa, parainfluensa och adenovirus. Bland bakterier dominerar pneumokocker som orsakar en tredjedel av alla infektioner följt av Haemophilus influenzae. Mykoplasma förekommer hos en tredjedel av barnen över fem år. Samtidig virus- och bakterieinfektion förekommer hos 20 %, huvudsakligen i åldern ett till fyra år. Hos cirka 20 % förblev etiologin okänd. I studier med ännu fler fynd har man även inkluderat till exempel rhinovirus där sambandet ännu så länge är oklart. Annan sjukdom och miljöfaktorer som till exempel astma och passiv rökning påverkar inte etiologin vid luftvägsinfektioner, däremot kan man se att infektionerna kan bli allvarligare. Mykoplasma som etiologi är i flertalet studier ovanligt hos förskolebarn men ökar upp till en tredjedel bland äldre skolbarn. Ett antal studier från grupper med specialintresserade forskare, som använder flera diagnostiska metoder, har dock rapporterat betydligt högre frekvens (9,13). Även i studier ofta med huvudsyfte att studera behandlingseffekter med preparat som har effekt mot såväl bakterier som mykoplasma finner man hög frekvens av mykoplasma (8). Det är dock tveksamt om man verkligen inkluderat samtliga barn och verkligen studerat etiologin vid samhällsförvärvad pneumoni hos barn (många centra med få barn totalt). Det är dock ingen tvekan om att mykoplasma tidvis är en viktig orsak till svår pneumoni hos barn samtidigt som flertalet infektioner är mindre allvarliga även om långvarig hosta är vanlig. Ett sätt att studera betydelsen av mykoplasma är att titta på behandlingsstudier. I en Cochrane-review kunde man bland barn med pneumoni, däribland ett antal med mykoplasma, ej finna någon skillnad i läkningsförlopp mellan behandling med en makrolid som täckte mykoplasma eller ett jämförelsepreparat, oftast ett betalaktamantibiotika, som alltså ej täcker mykoplasma (14). Mykoplasma är i hälften av fallen en del av en dubbelinfektion med såväl andra virus som bakterier. Vilken etiologi som då har störst betydelse är svårt att uttala sig om. Dubbelinfektioner mellan virus och bakterier har ägnats en ökad uppmärksamhet under senare år. Man har funnit detta hos cirka 20 %. I Tabell III visas vad vi fann i Stockholmsområdet under 1980-talet. I den sydafrikanska vaccinationsstudien där man använde vaccinskydd som etiologisk markör för pneumokocker kunde man visa att samtidigt virus ofta kunde påvisas (15). Intressant nog var dubbelinfektion mindre vanligt vid RS-virus vilket stämmer med ett flertal studier som visat att samtidiga bakterieinfektioner är ovanligt hos små barn med RSV-bronkiolit. Ännu så länge saknas dock studier som bedömer betydelsen av blandad etiologi. Behöver man behandla den bakteriella komponenten? Kan klinisk bild eller röntgen hjälpa till att bedöma etiologi? Det är ingen tvekan om att det finns typiska kliniska bilder respektive typiska röntgenologiska förändringar. I stora studier har man dock inte kunnat visa att de är tillräckligt specifika. Kliniska fynd sammanhängde med låg ålder och relativ lungomognad såsom takypné, och andningsinsufficiens med behov av såväl slutenvård som intensivvård är vanligt då även virusinfektion är som vanligast. Yngre barn har mer lymfoid vävnad i sina lungor. Inflammation av den lymfoida vävnaden leder till interstitiella infiltrat. Hos yngre barn där virusetiologi dominerar fann vi en ökad frekvens av interstitiella infiltrat. Då vi analyserade båda faktorerna, ålder och röntgenbild, fann vi att ålder var en viktigare faktor än etiologin vad gällde förekomst av interstitiella respektive alveolära infiltrat (16). Referenser 1. Lichenstein R, Suggs AH, Campbell J. Pediatric pneumonia. Emerg Med Clin N Am 2003;21: Pelton SI, Hammerschlag MR. Overcoming current obstacles in the management of bacterial community-acquired pneumonia in ambulatory children. Clin Pediatr 2005;44: Clark Julia E, Hammal Donna, Spencer David, et al. Children with pneumonia how do they present and how are they managed? Arch Dis Child 2007;92: Hale Katherine A, Isaacs David. Antibiotics in childhood pneumonia. Paediatr Resp Rev 2006;2: Tabell III. Kombination av patogener hos 367 barn med pneumoni i norra Stockholm (procentuell fördelning av olika virus vid samtidig bakterieetiologi). Virus Pneum (112) HI (36) Ej påvisad RSV (92) 25 (27) 10 (11) 56 (52) Influensa A (21) 8 (38) 2 (10) 12 (57) Influensa B (10) 2 (20) 8 (80) Parainfluensa (41) 14 (34) 7 (17) 20 (49) Adenovirus (34) 14 (41) 4 (12) 17 (50) Mykoplasma (26) 11 (42) 1 (4) 14 * (54) Inget fynd 49 (44) 17 (47) * tre i kombination med andra virus. Information från Läkemedelsverket 3:
26 Foy H, Cooney M, Maletzky A, et al. Incidence and etiology of pneumonia, croup and bronchiolitis in preschool children belonging to a prepaid medical care group over a four-year period. Am J Epidemiol 1973;97: Murphy T, Henderson F, Clyde W, et al. Pneumonia: an eleven-year study in a pediatric practice. Am J Epidemiol 1981;113: Davies H, Matlow A, Petric M, et al. Prospective comparative study of viral, bacterial and atypical organisms identified in pneumonia and bronchiolitis in hospitalized Canadian infants 1996;15: Block S, Hedrick J, Hammerschlag M R, et al. Mycoplasma pneumoniae and Chlamydia pneumoniae in pediatric community-acquired pneumonia; comparative efficacy and safety of clarithromcyn vs. erythromycin ethylsuccinate. Pediatr Infect Dis J 1995;14: Principi N, Esposito S. Emerging role of Mycoplasma pneumoniae and Chlamydia pneumoniae in paediatric respiratorytract infections. Lancet Infectious Diseases 2001;1: Madhi S A, Klugman K P. World Health Organisation definition of radiologically-confirmed pneumonia may underestimate the true public health value of conjugate pneumococcal vaccines. Vaccine 2007:25; Obaro Stephen K, Madhi Shabir A. Bacterial pneumonia vaccines and childhood pneumonia: are we winning, refining, or redefining? Lancet Infect Dis 2006;6: Juvén T, Mersola J, Waris M, et al. Etiology of communityacquired pneumonia in 254 hospitalized children. Pediatr Infect Dis J 2000;19: Esposito S, Bosis S, Faelli N, et al. Role of atypical bacteria and azithromycin therapy for children with recurrent respiratory tract infections. Pediatr Infect Dis J 2005;24: Gavranich JB, Chang AB. Antibiotics for community acquired lower respiratory tract infections (LRTI) secondary to Mycoplasma pneumoniae in children (Review). The Cochrane Library Madhi SA, Klugman KP. A role for streptococcus pneumoniae in virus-associated pneumonia. Nature Medicine 2004:8; Pneumoni hos vuxna i öppen vård Jonas Hedlund, Hans Holmberg, Sigvard Mölstad Incidens Incidensen av pneumoni uppskattas i västvärlden till 5 11/1000 invånare och år. Incidensen är högst hos vuxna över 75 år och det förekommer en betydande årsvariation (1,2,3). Flertalet (58 78 %) av patienterna med pneumoni sköts i öppen vård (1,3,4,5) och hos dessa är mortaliteten låg (6 9). Etiologi Studier som fokuserat på etiologin till pneumoni handlagd i öppen vård är relativt sparsamt förekommande. Resultaten varierar påtagligt beroende på patienturval och vilka diagnostiska analyser som använts (1,7 17). I en brittisk studie (1) fann man i en oselekterad patientgrupp en stor andel pneumokockinfektioner (36 %) vilka företrädesvis diagnostiserades med antigendetektion på sputum, växt av Haemophilus influenzae i sputum hos 10 %, och hos 1 % fann man positiv serologi för mykoplasmainfektion. I en svensk studie genomförd på 54 patienter med röntgenverifierad pneumoni som handlagts vid infektionsmottagningen på Östra Sjukhuset i Göteborg (10) fann man mykoplasma hos 37 % av patienterna (serologi), pneumokocker hos 9 % (nasofarynxodling) och Haemophilus influenzae hos 12 % (serologi). Sputumodling eller antigendetektion av pneumokocker utfördes ej. I denna studie var dock tio patienter redan antibiotikabehandlade, många var remitterade och medianåldern var låg, cirka 30 år. Det är välkänt att mykoplasma som etiologi till pneumoni är mindre vanligt över 50 års ålder (11). I en läkemedelsstudie på patienter med nedre luftvägsinfektion i öppen vård i Holland fann man i sputumodlingar Haemophilus influenzae + Haemophilus parainfluenzae hos nio (30 %) av 30 patienter med lunginfiltrat (12). I en svensk studie från Varberga Vårdcentral i Örebro (8) erhölls spontant eller inducerat sputum från 72 % och nasofarynxodling från alla 82 studerade patienter med röntgeninfiltrat. Antigendetektion utfördes ej. Ingen av patienterna (medianålder 53 år) var antibiotikabehandlade vid inklusionen. Pneumokocker var vanligaste etiologi, 32 %, men Haemophilus influenzae noterades hos nästan lika många, 28 %, (23 % i sputum) och mykoplasma (serologi) hos 18 % av patienterna. Mykoplasma förekom praktiskt taget bara under studiens sista år, en årsvariation som är välkänd från tidigare studier. I en nyligen publicerad studie på patienter med nedre luftvägsinfektioner i Danmark odlades och utfördes PCR på sputum (9). Hos 48 patienter med röntgenverifierad pneumoni påvisades agens hos 44 % varav pneumokocker hos sju (15 %), Haemophilus influenzae hos 4 %, mykoplasma hos 8 % och olika virus hos 13 %. Hos patienter utan infiltrat påvisades virus hos 26 %. Relativt många studier har försökt sammanställa anamnestiska och framför allt kliniska data som skulle tala för en specifik etiologi men man har ej funnit några tydliga samband (18,19). Flera författare har försökt konstruera algoritmer talande för en specifik bakteriell genes alternativt diskriminerande mot en viral dito utan övertygande resultat (11,19 22). Graffelman (23) gjorde en förenklad algoritm för att prediktera bakteriell nedre luftvägsinfektion med följande variabler som hade positiv respektive negativ korrelation till bakteriell etiologi; feber +1, ömmande cervikala lgll +1, huvudvärk +1, diarré 1, rinit 1. Ett sammanlagt värde på +1 gav en sensitivitet på 91 %, specificitet på 47 % och en ROC-kurva på 0,77; CI 0,67 0,87. Icke desto mindre finns det empiriskt (men således ej validerat) en del anamnestiska uppgif- 26 Information från Läkemedelsverket 3:2008
27 ter och statusfynd som man sannolikt kan få en viss vägledning av, se Tabell I. Nya diagnostiska metoder av etiologi Snabbtest (Binax NOW) för påvisande av pneumokockantigen i urin finns sedan några år tillgängligt. Sensitiviteten är dock relativt låg, 54 %, jämfört med blododlingsnegativa fall inlagda på sjukhus (24) och testet är inte utvärderat på ett rent öppenvårdsmaterial. PCR-metoder för påvisande av mykoplasma (25), C. pneumoniae (26) och Legionella (27) i luftvägssekret används alltmer på sjukhus men tar i praktiken fortfarande några dagar att få svar på och är förenat med en relativt hög kostnad. Snabba och mindre kostsamma analyser för påvisande av virala och bakteriella agens i luftvägssekret utvecklas dock successivt. Snabbtest för antigendetektion av influensavirus i nässekret finns kommersiellt tillgängligt. Testerna har visat högre specificitet än sensitivitet (28) men kan vid positivt utfall möjliggöra en återhållsamhet med antibiotika (29). Serologiska tester, helst med parade sera (akut och konvalescens) kan fortfarande ha en plats för diagnostik av mykoplasma, C. pneumoniae, Legionella, influensa och RS-virus. En hög antikroppstiter mot mykoplasma i akutserum efter en veckas sjukdom kan indikera infektion med detta agens. Snabbköld/köldantikroppar har ingen plats i diagnostiken på grund av låg sensitivitet och specificitet. Diagnostik Fynd av inflammatoriska förändringar på lungröntgen är golden standard för diagnostik av pneumoni i studiesammanhang. Det föreligger dock svårigheter vid bedömningen av lungröntgen (30) och konventionell röntgen har en lägre känslighet än CT (31). Någon absolut sanning eller facit utgör således inte en konventionell röntgen. Vid diagnostik av pneumoni i öppen vård utförs sällan en akut lungröntgen utan diagnosen ställs kliniskt. Ett akut insjuknande i hosta och feber och någon form av auskultationsfynd, oftast rassel/krepitationer och ibland bröstsmärta med eller utan dyspné har varit inklusionskriterier i öppenvårdsstudier där läkaren har misstänkt pneumoni. Korrelationen till positiva lungröntgenfynd är då mycket varierande, % (8,23,32,33). Vid lungauskultation föreligger en betydande interobserver variation (34), auskultationsfynd stämmer ibland inte lobmässigt med röntgenfynd (35), och det finns sammantaget ingen kombination av kliniska fynd som med god sensitivitet och specificitet kan ge grund för en pneumonidiagnos (36,37). I en dansk studie (9) inkluderades 364 patienter med nedre luftvägsinfektioner i öppen vård. I en grupp med auskultationsfynd och minst två av tilläggskriterierna feber > 37,9 C vid besöket eller föregående dygn, dyspné eller hosta, takypné (> 21/ min), konfusion eller sjukdomskänsla hade 19 % av patienterna pneumoni enligt röntgen. I en svensk öppenvårdsstudie visade sig 46 % av 177 patienter som fyra erfarna distriktsläkare och en AT-läkare bedömde ha pneumoni uppvisa röntgenfynd överensstämmande med denna diagnos (8). Inklusionskriterierna i den studien var: 1. feber (> 38 C) och hosta mindre än en vecka eller 2. torrhosta i en till fyra veckor med eller utan feber. Därtill minst ett av följande symtom eller statusfynd: a. lateral andningskorrelerad bröstsmärta, b. rassel eller ronchi vid auskultation, c. uppfattad som påtagligt sjuk. Alla patienter bedömdes kunna behandlas i hemmet. Enligt Lieberman (36) kunde en läkare med anamnes och kliniska fynd i handläggningen av febrila nedre luftvägsinfektioner i daglig praxis utesluta pneumoni med hög säkerhet (negativt prediktivt värde 97 %), men det positivt prediktiva värdet var bara 27 % och många patienter som inte hade pneumoni erhöll antibiotika. Graffelman (38) konkluderar att inga modeller baserade på anamnes och klinisk information säkert kan prediktera pneumoni. Samtliga testade modeller som gav hög sensitivitet gav låg specificitet och vice versa. Därtill kommer att äldre patienter dessutom ofta har mer ospecifika symtom och kan sakna feber (39). Således förekommer det både en betydande överdiagnostik men sannolikt också en viss underdiagnostik av pneumoni i öppen vård. Tabell I. Anamnes och statusfynd som kan associeras till viss etiologi. Luftvägsinfektion inom familjen vuxna barn Epidemi i samhället Rökning Fågelkontakt Utlandsvistelse Frossa och därefter andningskorrelerad smärta Hosta före feber Torrhosta Mykoplasma, C. pneumoniae Pneumokocker, Haemophilus influenzae Influensa, mykoplasma Haemophilus influenzae C. psittaci Legionella, pc-resistenta pneumokocker Pneumokocker Mykoplasma Influensa, mykoplasma Information från Läkemedelsverket 3:
28 Man har i flera studier funnit att mätning av en inflammationsparameter i blodet, företrädesvis CRP, skulle utgöra en hjälp till den kliniska diagnostiken både genom att ett förhöjt värde, > 50 mg/l skulle stödja diagnosen pneumoni (40,35) men också att ett lågt värde, < 20 mg/l (41), eller < 11 mg/l (42) skulle kunna utesluta pneumoni. I en svensk studie fann man dock att mycket låga CRP-värden inte kunde utesluta en röntgenverifierad pneumoni (43), och i en nyligen publicerad metaanalys har värdet av CRPbestämning vid nedre luftvägsinfektion ifrågasatts (44). I Lagerströms studie var dock medianvärdet av CRP hos de 82 patienter som hade positiv röntgen 65 mg/l, jämfört med 13 mg/l hos 95 patienter med negativ röntgen, så ett förhöjt CRP kan ge ett visst stöd för diagnosen pneumoni (43). Bestämning av procalcitonin i serum har i några studier utförda på sjukhus visats vara av visst värde (45,46) men metoden hade inga fördelar jämfört med CRP i Holms öppenvårdsstudie (47). Allvarlighetsbedömning Bland patienter med pneumoni som söker på en öppenvårdsmottagning kan svårighetsgraden av sjukdomen variera från en lindrig och självbegränsande infektion till ett livshotande tillstånd. Vid handläggning av pneumoni i öppen vård måste därför den läkare som möter patienten på mottagningen ta ställning till om det finns behov av remittering till sjukhus för inläggning eller om patienten primärt kan skötas inom öppenvården. Flera prognostiska modeller har visat sig vara kopplade till ökad mortalitet hos patienter med pneumoni, men ingen enskild faktor kan användas för att prediktera död (48,41). Genom att kombinera olika riskfaktorer har flera prognostiska modeller utarbetats. Bruk av dessa modeller har visat sig minska antalet inläggningar (49) och minska sjukvårdskostnaderna (50). Flera av dessa modeller är dock komplicerade att använda i kliniskt bruk. I enlighet med rekommendationer från Svenska Infektionsläkarföreningen ( förordar vi användning av CRB-65 (51), vilket är ett rent kliniskt index som använder sig av fyra olika prognostiska markörer. Detta index bör ses som ett hjälpmedel, men ersätter inte den kliniska bedömningen. CRB-65 är endast utvärderat för icke immunsupprimerade patienter och är huvudsakligen studerat bland sjukhusvårdade patienter med röntgenverifierad pneumoni (51 54). I en av dessa studier (53) gjordes en subgruppsanalys för patienter som behandlades av privatpraktiserande läkare i öppen vård (n = 482). Man fann lägre mortalitet vid motsvarande CRB-65 poäng jämfört med patienter som remitterats till sjukhus. Andelen patienter med allvarlig pneumoni (2 4 CRB-65 poäng) var dock endast 2 % i subgruppsanalysen. CRB-65 Confusion: nytillkommen desorientering/sänkt medvetandegrad. Respiration: andningsfrekvens 30/min. Blodtryck: systoliskt blodtryck < 90 mm Hg och/eller diastoliskt blodtryck 60 mm Hg. 65: Ålder 65 år. Varje uppfylld CRB-65 markör ger 1 poäng. Uppfyllda poäng adderas och en summa på 0 4 poäng erhålles (Figur 1). Hos patienter som uppvisar noll CRB-65-poäng är mortaliteten låg (0 1 %) (51 54) och dessa behöver som regel inte sjukhusvårdas av medicinska skäl. Vid beslut om behandling i öppen vård skall patientens egna önskemål och sociala situation beaktas. Hos patienter med ett CRB-65-poäng är mortaliteten högre (0 14 %) (51 54) och dessa patienter bör ofta initialt vårdas på sjukhus. Behandling i öppen vård med noggrann uppföljning kan övervägas som alternativ. Hos patienter med två CRB-65-poäng är mortaliteten % (51 54). Dessa patienter bör som regel vårdas på sjukhus. Hos patienter med tre till CRB-65 poäng Vårdnivå Figur 1: Allvarhetsbedömning med CRB Information från Läkemedelsverket 3:2008
29 fyra CRB-65-poäng är mortaliteten mycket hög (23 55 %) (51 54). Dessa patienter kräver omedelbar transport till sjukhus för inläggning, eventuellt intensivvård. Antibiotikaval Både pcv och amoxicillin har god effekt mot pneumokocker. Amoxicillin har även god effekt mot Haemophilus influenzae medan pcv har otillräcklig effekt på Haemophilus influenzae enligt Svenska referensgruppen för antibiotikafrågor (RAF) ( Detta beror på att amoxicillin har en lägre brytpunkt (0,5 mg/l), än pcv (4 mg/l), för Haemophilus influenzae samt att amoxicillin har farmakokinetiska fördelar som bättre resorption och mindre proteinbindning (Tabell II). Den höga frekvensen av Haemophilus influenzae (28 %) i öppenvårdsstudien från Örebro (8), skulle tala för att empirisk behandling av pneumoni borde vara effektiv mot såväl pneumokocker som Haemophilus influenzae. Några randomiserade studier som jämför den kliniska effekten av amoxicillin och pcv finns inte. Men en klinisk erfarenhet är att insatt behandling med pcv ibland behöver bytas till exempelvis amoxicillin. Amoxicillin är det orala penicillin som rekommenderas i första hand vid behandling av pneumoni i öppen vård av bland andra British Thoracic Society (48). PcV har dock biverkningsmässiga fördelar och sannolikt ekologiska fördelar jämfört med amoxicillin och så länge pcv-resistenta pneumokocker (MIC 2 mg/l) är ovanliga i Sverige bör man sannolikt hålla kvar pcv som förstahandsval vid pneumoni i öppen vård. Om det finns stark misstanke på infektion med atypiska agens, eller vid anamnes på penicillinallergi kan doxycyklin (55,56,57) vara ett alternativ. Det bör dock betonas att mykoplasma- och C. pneumoniaeinfektioner ofta är lindriga och självläkande, och i en metaanalys av patienter med icke allvarlig pneumoni (58) såg man ingen bättre effekt av tetracyklin eller makrolider jämfört med penicilliner som inte har någon effekt mot dessa bakterier. Doxycyklin har betydligt bättre effekt mot Haemophilus influenzae än makrolidpreparaten, inklusive klaritromycin. Ett observandum är dock att man bland konsekutiva kliniska pneumokockisolat i Sverige, i huvudsak från nasofarynx hos barn, har funnit en ökning av stammar med nedsatt känslighet mot såväl penicillin, tetracyklin, som erytromycin (59,52). Uppföljning I samband med den akuta sjukdomen bör man fråga om eventuell rökning och understryka vikten av att sluta röka. Uppföljning per telefon inom två till tre dagar för att förvissa sig om att en viss förbättring skett är lämpligt. Helst skall en uppföljning dessutom ske efter cirka fyra veckor antingen i form utav ett kort läkarbesök, alternativt bara en telefonkontakt (60). Vid kvarstående luftvägssymtom bör en lungröntgen utföras sex till åtta veckor efter insjuknandet vilket framför allt gäller rökare över år (1). Kvarstående/ökade besvär jämfört med innan insjuknandet 30 dagar efter den akuta infektionen i form av trötthet, hosta, andfåddhet eller bröstsmärtor är sannolikt mer vanligt än man tidigare trott och förekom hos % av patienterna i två amerikanska studier där man aktivt frågat efter besvär (61,62). Referenser 1. Woodhead MA, Macfarlane JT, McCracken JS, et al. Prospective study of the aetiology and outcome of pneumonia in the community. Lancet 1987;1(8534): Foy HM, Cooney MK, Allan I, et al. Rates of pneumonia during influenza epidemics in Seattle, 1964 to JAMA 1979;241(3): Jokinen C, Heiskanen L, Juvonen H, et al. Incidence of community-acquired pneumonia in the population of four municipalities in eastern Finland. Am J Epidemiol 1993;137(9): Guest JF, Morris A. Community-acquired pneumonia: the annual cost to the National Health Service in the UK. Eur Respir J 1997;10(7): Tabell II. Farmakokinetiska aspekter på fenoximetylpenicillin (PcV) och amoxicillin. Information från Läkemedelsverket 3:
30 5. Foy HM, Cooney MK, McMahan R, et al. Viral and mycoplasmal pneumonia in a prepaid medical care group during an eight-year period. Am J Epidemiol 1973;97(2): Woodhead M. Management of pneumonia in the outpatient setting. Semin Respir Infect 1998;13(1): Almirall J, Morato I, Riera F, et al. Incidence of communityacquired pneumonia and Chlamydia pneumoniae infection: a prospective multicentre study. Eur Respir J 1993;6(1): Lagerstrom F, Bader M, Foldevi M, et al. Microbiological etiology in clinically diagnosed community-acquired pneumonia in primary care in Orebro, Sweden. Clin Microbiol Infect 2003;9(7): Holm A, Nexoe J, Bistrup LA, et al. Aetiology and prediction of pneumonia in lower respiratory tract infection in primary care. Br J Gen Pract 2007;57(540): Berntsson E, Blomberg J, Lagergard T, et al. Etiology of community-acquired pneumonia in patients requiring hospitalization. Eur J Clin Microbiol 1985;4(3): Holmberg H, Bodin L, Jonsson I, et al. Rapid aetiological diagnosis of pneumonia based on routine laboratory features. Scand J Infect Dis 1990;22(5): Hopstaken RM, Stobbering EE, Knottnerus JA, et al. Clinical items not helpful in differentiating viral from bacterial lower respiratory tract infections in general practice. J Clin Epidemiol 2005;58(2): Marrie TJ, Peeling RW, Fine MJ, et al. Ambulatory patients with community-acquired pneumonia: the frequency of atypical agents and clinical course. Am J Med 1996;101(5): Blanquer J, Blanquer R, Borras R, et al. Aetiology of community acquired pneumonia in Valencia, Spain: a multicentre prospective study. Thorax 1991;46(7): Jokinen C, Heiskanen L, Juvonen H, et al. Microbial etiology of community-acquired pneumonia in the adult population of 4 municipalities in eastern Finland. Clin Infect Dis 2001;32(8): Everett MT. Major chest infection managed at home. Practitioner 1983;227(1385): Shaw AB, Fry J. Acute infections of the chest in general practice. Br Med J 1955;2(4956): Fang GD, Fine M, Orloff J, et al. New and emerging etiologies for community-acquired pneumonia with implications for therapy. A prospective multicenter study of 359 cases. Medicine (Baltimore) 1990;69(5): Farr BM, Kaiser DL, Harrison BD, et al. Prediction of microbial aetiology at admission to hospital for pneumonia from the presenting clinical features. British Thoracic Society Pneumonia Research Subcommittee. Thorax 1989;44(12): Ruiz-Gonzalez A, Falguera M, Vives M, et al. Communityacquired pneumonia: development of a bedside predictive model and scoring system to identify the aetiology. Respir Med 2000;94(5): Bohte R, Hermans J, van den Broek PJ. Early recognition of Streptococcus pneumoniae in patients with community-acquired pneumonia. Eur J Clin Microbiol Infect Dis 1996;15(3): Hopstaken RM, Stobberingh EE, Knottnerus JA, et al. Clinical items not helpful in differentiating viral from bacterial lower respiratory tract infections in general practice. J Clin Epidemiol 2005;58(2): Graffelman AW, Knuistingh Neven A, le Cessie S, et al. Pathogens involved in lower respiratory tract infections in general practice. Br J Gen Pract 2004;54(498): Strålin K, Kaltoft MS, Konradsen HB, et al. Comparison of two urinary antigen tests for establishment of pneumococcal etiology of adult community-acquired pneumonia. J Clin Microbiol 2004;42(8): Daxboeck F, Krause R, Wenisch C. Laboratory diagnosis of Mycoplasma pneumoniae infection. Clin Microbiol Infect 2003;9(4): Dowell SF, Peeling RW, Boman J, et al. Standardizing Chlamydia pneumoniae assays: recommendations from the Centers for Disease Control and Prevention (USA) and the Laboratory Centre for Disease Control (Canada). Clin Infect Dis 2001;33(4): Bernander S, Hanson HS, Johansson B, et al. A nested polymerase chain reaction for detection of Legionella pneumophila in clinical specimens. Clin Microbiol Infect 1997;3(1): Hurt AC, Alexander R, Hibbert J, et al. Performance of six influenza rapid tests in detecting human influenza in clinical specimens. J Clin Virol 2007;39(2): Falsey AR, Murata Y, Walsh EE. Impact of rapid diagnosis on management of adults hospitalized with influenza. Arch Intern Med 2007;167(4): Melbye H, Dale K. Interobserver variability in the radiographic diagnosis of adult outpatient pneumonia. Acta Radiol 1992;33(1): Lahde S, Jartti A, Broas M, et al. HRCT findings in the lungs of primary care patients with lower respiratory tract infection. Acta Radiol 2002;43(2): Melbye H, Straume B, Aasebo U, et al. Diagnosis of pneumonia in adults in general practice. Relative importance of typical symptoms and abnormal chest signs evaluated against a radiographic reference standard. Scand J Prim Health Care 1992;10(3): Macfarlane J. Lower respiratory tract infection and pneumonia in the community. Semin Respir Infect 1999;14(2): Wipf JE, Lipsky BA, Hirschmann JV, et al. Diagnosing pneumonia by physical examination: relevant or relic? Arch Intern Med 1999;159(10): Osmer JC, Cole BK. The stethoscope and roentgenogram in acute pneumonia. South Med J 1966;59(1): Lieberman D, Shvartzman P, Korsonsky I, et al. Diagnosis of ambulatory community-acquired pneumonia. Comparison of clinical assessment versus chest X-ray. Scand J Prim Health Care 2003;21(1): Metlay JP, Kapoor WN, Fine MJ. Does this patient have community-acquired pneumonia? Diagnosing pneumonia by history and physical examination. JAMA 1997;278(17): Graffelman AW, le Cessie S, Knuistingh Neven A, et al. Can history and exam alone reliably predict pneumonia? J Fam Pract 2007;56(6): Metlay JP, Schulz R, Li YH, et al. Influence of age on symptoms at presentation in patients with community-acquired pneumonia. Arch Intern Med 1997;157(13): Melbye H, Straume B, Brox J. Laboratory tests for pneumonia in general practice: the diagnostic values depend on the duration of illness. Scand J Prim Health Care 1992;10(3): Hopstaken RM, Muris JW, Knottnerus JA, et al. Contributions of symptoms, signs, erythrocyte sedimentation rate, and C-reactive protein to a diagnosis of pneumonia in acute lower respiratory tract infection. Br J Gen Pract 2003;53(490): Almirall J, Bolibar I, Toran P, et al. Contribution of C-reactive protein to the diagnosis and assessment of severity of community-acquired pneumonia. Chest 2004;125(4): Lagerstrom F, Engfeldt P, Holmberg H. C-reactive protein in diagnosis of community-acquired pneumonia in adult patients in primary care. Scand J Infect Dis 2006;38(11,12): van der Meer V, Neven AK, van den Broek PJ, et al. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ 2005;331(7507): Hedlund J, Hansson LO. Procalcitonin and C-reactive protein levels in community-acquired pneumonia: correlation with etiology and prognosis. Infection 2000;28(2): Christ-Crain M, Jaccard-Stolz D, Bingisser R, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial. Lancet 2004;363(9409): Information från Läkemedelsverket 3:2008
31 47. Holm A, Pedersen SS, Nexoe J, et al. Procalcitonin versus C-reactive protein for predicting pneumonia in adults with lower respiratory tract infection in primary care. Br J Gen Pract 2007;57(540): BTS Guidelines for the Management of Community Acquired Pneumonia in Adults. Thorax 2001;56(Suppl 4):IV Yealy DM, Auble TE, Stone RA, et al. Effect of increasing the intensity of implementing pneumonia guidelines: a randomized, controlled trial. Ann Intern Med 2005;143(12): Orrick JJ, Segal R, Johns TE, et al. Resource use and cost of care for patients hospitalised with community acquired pneumonia: impact of adherence to infectious diseases society of america guidelines. Pharmacoeconomics 2004;22(11): Lim WS, van der Eerden MM, Laing R, et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax 2003;58(5): Barlow G, Nathwani D, Davey P. The CURB65 pneumonia severity score outperforms generic sepsis and early warning scores in predicting mortality in community-acquired pneumonia. Thorax 2007;62(3): Bauer TT, Ewig S, Marre R, et al. CRB-65 predicts death from community-acquired pneumonia. J Intern Med 2006;260(1): Capelastegui A, Espana PP, Quintana JM, et al. Validation of a predictive rule for the management of community-acquired pneumonia. Eur Respir J 2006;27(1): Ailani RK, Agastya G, Mukunda BN, et al. Doxycycline is a cost-effective therapy for hospitalized patients with communityacquired pneumonia. Arch Intern Med 1999;159(3): Cunha BA. Doxycycline for community-acquired pneumonia. Clin Infect Dis 2003;37(6): Johnson JR. Doxycycline for treatment of community-acquired pneumonia. Clin Infect Dis 2002;35(5): Mills GD, Oehley MR, Arrol B. Effectiveness of beta lactam antibiotics compared with antibiotics active against atypical pathogens in non-severe community acquired pneumonia: meta-analysis. BMJ 2005;330(7489): Smittskyddsinstitutet. Swedres 2006 : A Report on Swedish antibiotic utilisation and resistance in human medicine (homepage on the Internet) (cited Oct). Available from: SWEDRE-2006.pdf. 60. Holmberg H, Kragsbjerg P. Association of pneumonia and lung cancer: the value of convalescent chest radiography and follow-up. Scand J Infect Dis 1993;25(1): Metlay JP, Atlas SJ, Borowsky LH, et al. Time course of symptom resolution in patients with community-acquired pneumonia. Respir Med 1998;92(9): Fine MJ, Stone RA, Singer DE, et al. Processes and outcomes of care for patients with community-acquired pneumonia: results from the Pneumonia Patient Outcomes Research Team (PORT) cohort study. Arch Intern Med 1999;159(9): Pneumoni hos barn i öppen vård: Riktlinjer för farmakoterapi Katarina Hedin, Inge Axelsson, Mattias Eknefelt Sammanfattning Få studier är gjorda på barn i öppen vård med samhällsförvärvad pneumoni. I de studier som är gjorda är det svårt att skilja svåra pneumonier från lindriga och klarhet om etiologiskt agens (virus eller bakterier) saknas ofta. Inte heller inklusionskriteriena är lika. Detta gör att det är svårt att dra säkra slutsatser om antibiotikas effekt vid behandling av pneumoni. Det finns i PubMed ingen studie som jämför penicillin V med andra antibiotika vid pneumoni hos barn och man har inte kunnat visa att makrolidantibiotika har bättre effekt än penicillin vid mykoplasmainfektioner hos barn. Vid behandling med penicillin ska detta doseras tre gånger dagligen för att få god terapeutisk effekt. Studier på optimal behandlingstid saknas för penicillin V. Bakgrund Pneumoni är globalt den stora barnadödaren. Omkring två miljoner barn dör årligen i pneumoni fler än i AIDS, malaria och mässling tillsammans (1). I Nordeuropa kan en allmänläkare med listade patienter förväntas träffa cirka 13 barn med pneumoni per år, de flesta under fem års ålder (2). Incidensen av pneumoni är 36/1 000 invånare i åldergruppen < 5 år och 16/1 000 invånare för barn i åldern 5 14 år enligt en finsk populationsbaserad studie (3). I Jönköpings län varierade incidensen av pneumoni + nedre luftvägsinfektion UNS hos barn upp till 18 års ålder från 4/1 000 till 40/1 000 mellan olika kommuner (4), troligen mycket på grund av olika kriterier för diagnoserna. Metod För att ta reda på vilka läkemedel som kan vara aktuella vid behandling av pneumoni hos barn i öppen vård gjordes litteratursökningar i oktober PubMed söktes för pneumonia ; Limits: Meta- Analysis, Practice Guideline, All Child: 0 18 years. Clinical evidence ( och the Cochrane Library ( söktes för pneumonia. De brittiska riktlinjerna (2) grundar sig på omfattande, systematiska översikter och har varit en huvudkälla för oss. Diagnostik av pneumoni hos barn De kliniska symtomen på pneumoni är ofta divergerande. En klassisk beskrivning har varit plötslig debut av feber, takypné och ibland (men inte alltid) hosta. Information från Läkemedelsverket 3:
32 Dessa symtom kan föregås av en relativt mild övre luftvägsinfektion karaktäriserad av låggradig feber och rhinorré. Symtomatologin vid samhällsförvärvad pneumoni hos barn har inte studerats systematiskt (5). Oftast är det utifrån kliniska symtom som presenteras inte möjligt att identifiera det etiologiska agens som orsakar infektionen (5 8). Det finns inte heller någon gold standard för diagnostik av pneumoni hos barn. WHO har utarbetat kriterier för diagnostik av pneumoni till hälsoarbetare i u-länder (9,10). De som ska användas för att ställa diagnosen pneumoni kliniskt i u-länder är snabb andningsfrekvens (takypné), definierat som 60 andetag/minut hos spädbarn < 2 månader; 50 andetag per minut hos barn två månader till ett år och 40 andetag per minut hos barn ett till fem år gamla, samt närvaro av torakala indragningar (11). Hos barn under fem år är hosta och svårigheter att andas två tecken som gör att man bör misstänka pneumoni. Feber är inte användbart i identifikationen av pneumoni. Hos barn i åldersgruppen två månader till fyra år är snabb andning ett bättre tecken än auskultatoriska fynd (12). Hos barn yngre än fem år ger takypné definierat enligt WHO den högsta sensitiviteten (74 %) och specificiteten (67 %) vid radiologiskt diagnostiserad pneumoni. Tidigt i sjukdomsförloppet < 3 dagar är de mindre specifika (13). Andra sätter åldersgränsen lägre. De menar att hos barn äldre än 36 månader är inte takypné och indragningar sensitiva tecken. Svårigheter att andas är hos dessa ett bättre mått än andningsfrekvens. Barn kan ha pneumoni och andningsfrekvens < 40 per minut (2). Bedömning av svårighetsgrad Svårighetsgraden av pneumoni hos barn i öppen vård behöver bedömas för att få svar på två frågor: 1. Behöver barnet antibiotikum? 2. Behöver barnet remitteras till barnklinik? Svårighetsgraden på pneumoni baseras framför allt på den kliniska bilden (Faktaruta 1). Vid försök att differentiera mellan lindrig och svår pneumoni hjälper olika diagnostika oss föga. En studie på barn som remitterats till sjukhus för pneumoni visar att pyrexi > 38 grader inte var associerat med svårighetsgraden på pneumonin. Inte heller CRPvärde eller lobära infiltrat på röntgen var associerat med svårighetsgraden. Däremot hade barn med perihilära förändringar oftare en svårare sjukdom och dyspné (14). Faktaruta 1. Tecken på pneumoni: takypné (andningsfrekvens > 50/minut hos barn < 1 år, > 40/min hos barn > 1år) subjektiva andningsbesvär (äldre barn). Indikationer för akut remiss till barnklinik vid pneumoni: barn < 6 månader gamla kvidande eller gnyende andning ( grunting ) kraftiga indragningar mellan revbenen och/eller i jugulum cyanos eller SaO < 92 % 2 dricker dåligt eller kräks upp drycken svår dehydrering (när kissade barnet senast?) omtöckning tecken på sepsis: påverkat allmäntillstånd ( toxiskt utseende), extremt blek eller blåblek, slapp muskeltonus. Behöver barnet antibiotikum? En av de största svårigheterna vid pneumoni är att avgöra om det rör sig om en bakteriell pneumoni som ska behandlas med antibiotika eller om en virusorsakad pneumoni då behandling med antibiotika inte är till nytta. Inte heller för diagnostik av bakteriell infektion är de patientnära analyserna konklusiva. Varken CRP-värde (15 21) eller leukocytantal hjälper oss i differentieringen mellan bakterie- och virusorsakade pneumonier (6,17,18,21,22). Röntgenologisk diagnostik kan inte skilja mellan en bakteriell och virusutlöst pneumoni enligt en Cochrane-review (23). Det finns även studier av prokalcitonin och interleukin-6. Inte heller dessa analyser verkar vägleda oss i diagnostiken (19). I en ny metaanalys omfattande barn < 19 år med pneumoni hade 41 % bakteriell eller blandad pneumoni. Om CRP var högre än mg/l (olika gräns i olika studier) steg andelen bakteriella eller blandade pneumonier till 64 %. Stegrat CRP är alltså ett svagt tecken på bakteriell genes (47). De brittiska riktlinjerna för pneumoni godkänner att man avstår från att sätta in antibiotika när pneumonin är mild, även om man tror att den är bakteriell (2). En Cochrane-review menar dock att det är policy att behandla alla pneumonier eftersom det för närvarande saknas tester som tillräckligt tillförlitligt kan utesluta bakteriell genes (24). I Sverige har vi rekommenderat antibiotika till alla fall av pneumoni, även om vi vet att de flesta fall hos små barn orsakas av virus (25,26). Vid osäkra tecken på pneumoni hos ett opåverkat barn bör man dock inte förskriva antibiotika. Början till lunginflammation är en vanlig men olämplig indikation för antibiotika. 32 Information från Läkemedelsverket 3:2008
33 Behöver barnet remitteras till barnklinik? Kriterier för remiss finns i faktarutan som i huvudsak grundar sig på de brittiska riktlinjerna (2). Vi tror att svenska allmänläkare i stor utsträckning använder liknande kriterier. Det fungerar bra och allvarliga felbedömningar är sällsynta. Fråga föräldrarna hur de uppfattar barnets tillstånd. Har spädbarnet svårt att suga från bröst eller flaska? Måltiden är spädbarnets arbetsprov, det arbetsammaste hon gör! Matvägrar det äldre barnet? Kräks hon? När kissade hon senast (dehydrering!)? Har hon tappat vikt? Fråga det större barnet om det är tungt att andas. Låt det lilla barnet sitta i mammas eller pappas knä. Lungauskultation är av ringa värde för att bedöma hur svårt sjukt barnet är. Iaktta istället barnet noga och lyssna på ljud som hörs utan stetoskop: grunting = gnyende, kvidande utandning wheezing = pipande utandning stridor = väsande inandning. Stridor är tecken till högt (extratorakalt) hinder, inte till pneumoni. Börja iaktta barnet medan det har kläderna på. Känn på muskeltonus och fontanell, titta efter näsvingespel och tecken till dehydrering. Av faktarutan framgår vad mer som man ska titta efter. Mät SaO 2 om du konstaterat dyspné. Agitation kan vara tecken på hypoxi! Pulsoximeter ska finnas på alla läkarmottagningar. Alla läkare och sjuksköterskor ska kunna använda dem. Man kan kontrollera att pulsoximetern ger tillförlitliga värden genom att sätta sensorn på sig själv. Låt sedan föräldern ta av barnets kläder och titta efter indragningar och hudfärg. Lyssna till sist med stetoskop. Många barn blir lugnare om det är ett tunt linne mellan huden och det kalla stetoskopet. Provtagning är inte nödvändig för att bedöma om barnet ska remitteras eller inte. Non-invasiv mätning av SaO 2 är bättre! Vilket antibiotikum ska väljas? Vid behandling av bakteriella pneumonier hos barn är nästan aldrig den etiologiska diagnosen känd då beslut om terapi tas. Valet av antibiotika baseras därför på prevalensen av olika patogener vid olika åldrar och på associationen mellan specifika patogen och klinisk bild. En Cochrane-review innehåller en jämförelse av olika antibiotikas effekt vid behandling av samhällsförvärvad pneumoni. Denna genomgång innehåller studier på både peroral och intravenös behandling samt studier från industrialiserade länder och utvecklingsländer (24). För svensk primärvårds del är studier från industrialiserade länder och peroral terapi mest relevanta och sammanfattas nedan och i Tabell I. Läkemedelstudier på barn i öppen vård med pneumoni I en Cochrane-genomgång över studier på barn i öppen vård med pneumoni har man jämfört penicillinbaserade antibiotika med makrolider utan att finna någon skillnad i effekt (6,27,28). Inte heller mellan olika makrolider finns det någon skillnad i effekt (6,28,29,30). Azitromycin är ökänt för att framkalla multiresistens hos bakterier (31,32). Det ska därför aldrig användas som första eller andra linjens antibiotikum utan bara för speciella fall. Azitromycin används mycket lite i svensk primärvård (33) och det är helt riktigt och önskvärt. Det är angeläget att användningen ligger kvar på denna låga nivå. I Cochrane-sammanställningen har man även jämfört penicillinbaserade antibiotika med cefalosporiner utan att heller här finna några skillnader i effekt (24,34). En senare publicerad studie har inte heller kunnat påvisa någon skillnad i effekt då kinoloner jämfördes med penicillinbaserade antibiotika och makrolid (35). Enligt Cochrane-sammanställningen (24) var det vid genomgången svårt att skilja ut svåra pneumonier från lindriga och klarhet om etiologiskt agens (virus eller bakterier) saknades ofta. Inte heller inklusionskriterierna var lika. Detta gör att det är svårt att dra säkra slutsatser om antibiotikas effekt vid behandling av pneumoni. En annan Cochrane-översikt visar att det inte heller vid nedre luftvägsinfektioner orsakade av Mycoplasma pneumoniae hos barn finns tillräckligt med evidens för att dra slutsatser om effekten av antibiotikabehandling. Den kliniska effekten skiljer sig inte åt vid behandling med makrolidantibiotika jämfört med andra antibiotika och placebokontrollerade studier saknas (36). Tabell I. Jämförelse mellan effekten (efficacy) av olika antibiotika i öppen vård (peroral behandling) vid samhällsförvärvad pneumoni hos barn enligt en Cochrane-översikt (24). Likvärdiga Skillnader azitromycin och erytromycin azitromycin och co-amoxiklavulansyra azitromycin och amoxicillin penicillin iv och amoxicillin po cefpodoxim och co-amoxiklavulansyra amoxicillin bättre än co-trimoxazole (Pakistan) co-amoxiklavulansyra bättre än amoxicillin (Nigeria) Information från Läkemedelsverket 3:
34 Dosering Svenska behandlingsrekommendationer vid pneumoni hos barn i öppen vård i dag baseras på begränsade kliniska studier och på beprövad erfarenhet. Fenoximetylpenicillin är förstahandspreparat vid behandling av många luftvägsinfektioner (37,38), vid pneumoni i dosen 12,5 mg/kg kroppsvikt och dostillfälle. I Sverige har det varit vanligt att ge pcv i två dagliga doser, men sedan ett par år tillbaka rekommenderas detta inte längre (39). För att få tillräckligt lång tid med koncentrationer över MIC-värdet och därmed god klinisk effekt behöver betalaktamantibioitika doseras tre gånger dagligen (40,41). Vid infektion med pneumokocker med nedsatt känslighet för penicilliner och vid infektion med H. influenzae kan mixtur amoxicillin vara ett alternativ. Mixtur amoxicillin absorberas bättre från tarmen, är mindre proteinbundet och har längre halveringstid och bättre smak än pcv. En tillräcklig serumkoncentration av fri (antibakteriellt aktiv) drog uppnås därför lättare med amoxicillin än med pcv. Tyvärr selekterar amoxicillin pc-resistenta bakterier i signifikant större utsträckning än pcv (42). Amoxicillin ska därför användas sparsamt. Det doseras tre gånger dagligen. Behandlingens form och behandlingstidens längd Två randomiserade studier omfattande över barn med pneumoni kunde inte visa någon tendens till fördel för intravenöst versus peroralt antibiotikum. I den större undersökningen jämfördes penicillin intravenöst med amoxicillin per oralt (43). Om barnet tar emot och inte kräks upp medicinen så finns inte behov av antibiotikum intravenöst annat än i mycket allvarliga fall. En svensk multicenterstudie med jämförelse av fem och tio dagars peroral behandling med fenoximetylpenicillin planeras. Behandling med antivirala medel Influensa och RSV Incidensen av influensa bland barn i öppen vård i Sverige är inte känd. Behovet av sjukhusvård av de minsta barnen är markant högre i RSV-epidemier än i influensaepidemier (43). Indikationerna för sjukhusvård är oftast dehydrering, utredning och observation. Spädbarn och förskolebarn med influensa har ofta både luftvägssymtom och diarré samtidigt. Föräldrarna har ofta också influensa och är oftast mer allmänpåverkade än de små barnen. Vid influensa är oseltamivir (Tamiflu) förstahandsmedlet. (44). För övriga luftvägsvirus finns inte antiviral behandling i öppen vård. Oxygen Om SaO 2 stadigvarande är mindre än 92 % ska barnet remitteras till barnklinik och extra oxygen via grimma eller mask ska ges under färden. Gasen bör vara an- fuktad. En systematisk översikt i USA har tolkats som att hjärnan hos ett barn kan få hypoxiska skador redan vid SaO 2 = % som alltså skulle vara en för låg gräns för tillförsel av extra oxygen (45,46). Vi bör följa den amerikanska debatten men den rekommenderade gränsen för extra oxygen bör tills vidare ligga kvar på SaO 2 = 92 %. Uppföljning Rutinmässig klinisk undersökning rekommenderas inte efter en pneumoni utan föräldrar uppmanas istället höra av sig om barnet inte blir helt friskt. Påpeka att barn ofta hostar i en till två månader efter en viruspneumoni som förstört cilierna i luftvägarna. Kontrollröntgen av lungorna görs bara om den initiala röntgenundersökningen visat atelektas eller ett runt infiltrat (som kan dölja en tumör) samt om kvarstående symtom finns. Patient med recidiverande pneumonier ska remitteras till barnläkare för utredning. Glöm inte risken för tbc hos riskgrupper. Referenser 1. Wardlaw T, White-Johansson E, Hodge M. Pneumonia: The forgotten killer of children. New York and Genève: UNICEF/ WHO; Report No: ISBN British Thoracic Society Guidelines for the Management of Community Acquired Pneumonia in Childhood. Thorax 2002;57(Suppl 1): Jokinen C, Heiskanen L, Juvonen H, et al. Incidence of community-acquired pneumonia in the population of four municipalities in eastern Finland. Am J Epidemiol 1993;137(9): Eknefelt M. Nedre luftvägsinfektioner hos barn i öppen vård. In. Jönköping; McCracken GH, Jr. Diagnosis and management of pneumonia in children. Pediatr Infect Dis J 2000;19(9): Wubbel L, Muniz L, Ahmed A, et al. Etiology and treatment of community-acquired pneumonia in ambulatory children. Pediatr Infect Dis J 1999;18(2): McIntosh ED. Paediatric infections: prevention of transmission and disease-implications for adults. Vaccine 2005;23(17,18): Hale KA, Isaacs D. Antibiotics in childhood pneumonia. Paediatr Respir Rev 2006;7(2): Atkinson M, Yanney M, Stephenson T, et al. Effective treatment strategies for paediatric community-acquired pneumonia. Expert Opin Pharmacother 2007;8(8): Anonymous. Technical bases for the WHO recommendations on pneumonia in children at first-level health facilities. WHO/ ARI/ [cited 2007 oktober 4th]; Available from: ari_91_20/en/index.html 11. Serious infections in young infants in developing countries: rationale for a multicenter study. The WHO Young Infants Study Group. Pediatr Infect Dis J 1999;18(Suppl 10): Leventhal JM. Clinical predictors of pneumonia as a guide to ordering chest roentgenograms. Clin Pediatr (Phila) 1982;21(12): Palafox M, Guiscafre H, Reyes H, et al. Diagnostic value of tachypnoea in pneumonia defined radiologically. Arch Dis Child 2000;82(1): Clark JE, Hammal D, Spencer D, et al. Children with pneumonia: how do they present and how are they managed? Arch Dis Child 2007;92(5): Information från Läkemedelsverket 3:2008
35 15. Korppi M, Heiskanen-Kosma T, Leinonen M. White blood cells, C-reactive protein and erythrocyte sedimentation rate in pneumococcal pneumonia in children. Eur Respir J 1997;10(5): Gendrel D, Raymond J, Moulin F, et al. Etiology and response to antibiotic therapy of community-acquired pneumonia in French children. Eur J Clin Microbiol Infect Dis 1997;16(5): Clements H, Stephenson T, Gabriel V, et al. Rationalised prescribing for community acquired pneumonia: a closed loop audit. Arch Dis Child 2000;83(4): Drummond P, Clark J, Wheeler J, et al. Community acquired pneumonia-a prospective UK study. Arch Dis Child 2000;83(5): Toikka P, Irjala K, Juven T, et al. Serum procalcitonin, C- reactive protein and interleukin-6 for distinguishing bacterial and viral pneumonia in children. Pediatr Infect Dis J 2000;19(7): Heiskanen-Kosma T, Korppi M. Serum C-reactive protein cannot differentiate bacterial and viral aetiology of community-acquired pneumonia in children in primary healthcare settings. Scand J Infect Dis 2000;32(4): Esposito S, Blasi F, Bellini F, et al. Mycoplasma pneumoniae and Chlamydia pneumoniae infections in children with pneumonia. Mowgli Study Group. Eur Respir J 2001;17(2): Peltola V, Mertsola J, Ruuskanen O. Comparison of total white blood cell count and serum C-reactive protein levels in confirmed bacterial and viral infections. J Pediatr 2006;149(5): Swingler GH, Zwarenstein M. Chest radiograph in acute respiratory infections in children. Cochrane Database Syst Rev 2005(3):CD Kabra SK, Lodha R, Pandey RM. Antibiotics for community acquired pneumonia in children. Cochrane Database Syst Rev 2006;3:CD McIntosh K. Community-acquired pneumonia in children. N Engl J Med 2002;346(6): Ostapchuk M, Roberts DM, Haddy R. Community-acquired pneumonia in infants and children. Am Fam Physician 2004;70(5): Harris JA, Kolokathis A, Campbell M, et al. Safety and efficacy of azithromycin in the treatment of community-acquired pneumonia in children. Pediatr Infect Dis J 1998;17(10): Kogan R, Martinez MA, Rubilar L, et al. Comparative randomized trial of azithromycin versus erythromycin and amoxicillin for treatment of community-acquired pneumonia in children. Pediatr Pulmonol 2003;35(2): Roord JJ, Wolf BH, Gossens MM, et al. Prospective open randomized study comparing efficacies and safeties of a 3-day course of azithromycin and a 10-day course of erythromycin in children with community-acquired acute lower respiratory tract infections. Antimicrob Agents Chemother 1996;40(12): Block S, Hedrick J, Hammerschlag MR, et al. Mycoplasma pneumoniae and Chlamydia pneumoniae in pediatric community-acquired pneumonia: comparative efficacy and safety of clarithromycin vs. erythromycin ethylsuccinate. Pediatr Infect Dis J 1995;14(6): Garcia-Rey C, Aguilar L, Baquero F, et al. Importance of local variations in antibiotic consumption and geographical differences of erythromycin and penicillin resistance in Streptococcus pneumoniae. J Clin Microbiol 2002;40(1): Dagan R, Barkai G, Leibovitz E, et al. Will reduction of antibiotic use reduce antibiotic resistance? The pneumococcus paradigm. Pediatr Infect Dis J 2006;25(10): Andre M, Eriksson M, Molstad S, et al. The management of infections in children in general practice in Sweden: a repeated 1-week diagnosis-prescribing study in 5 counties in 2000 and Scand J Infect Dis 2005;37(11-12): Klein M. Multicenter trial of cefpodoxime proxetil vs. amoxicillin-clavulanate in acute lower respiratory tract infections in childhood. International Study Group. Pediatr Infect Dis J 1995;14(Suppl 4): Bradley JS, Arguedas A, Blumer JL, et al. Comparative study of levofloxacin in the treatment of children with communityacquired pneumonia. Pediatr Infect Dis J 2007;26(10): Gavranich JB, Chang AB. Antibiotics for community acquired lower respiratory tract infections (LRTI) secondary to Mycoplasma pneumoniae in children. Cochrane Database Syst Rev 2005(3):CD Läkemedelsverket. Läkemedelsbehandling vid rinosinuit Behandlingsrekommendation. Information från läkemedelsverket 2005(3): Medicinska forskningsrådet. Behandling av öroninflammation. Konsensusuttalande. Stockholm: Medicinska forskningsrådet; Odenholt I, Cars O, Ostlund A, et al. Penicillin V bör doseras tre gånger dagligen. Läkartidningen 2004;101(41): Craig WA, Andes D. Pharmacokinetics and pharmacodynamics of antibiotics in otitis media. Pediatr Infect Dis J 1996;15(3): Odenholt I, Cars O. RAF s synpunkter på doseringsrekommendationer för antibakteriella medel. [cited 2007 November 1st]; Available from: Melander E, Ekdahl K, Jonsson G, et al. Frequency of penicillin-resistant pneumococci in children is correlated to community utilization of antibiotics. Pediatr Infect Dis J 2000;19(12): Rojas MX, Granados C. Oral antibiotics versus parenteral antibiotics for severe pneumonia in children. Cochrane Database Syst Rev 2006(2):CD Eriksson M. Influensa hos barn. Information från Läkemedelsverket 2002(6): Bass JL, Corwin M, Gozal D, et al. The effect of chronic or intermittent hypoxia on cognition in childhood: a review of the evidence. Pediatrics 2004;114(3): Bass JL, Gozal D. Oxygen therapy for bronchiolitis. Pediatrics 2007;119(3):611. Information från Läkemedelsverket 3:
36 Akut bronkit/luftrörskatarr Malin André, Christer Norman Sammanfattning Akut bronkit (luftrörskatarr) är en akut luftvägsinfektion med hosta som huvudsymtom. Andra symtom kan också finnas som upphostningar, bröstsmärtor, dyspné eller väsande andning. Det är viktigt att utesluta pneumoni, KOL och astma. Akut bronkit orsakas oftast av virus som influensa och rhinovirus. Bakteriella infektioner förekommer men är sällsynta och kräver i regel ingen annan behandling. Hosta vid akut bronkit pågår i 3 4 veckor. Antibiotika har ingen eller marginell effekt. Det finns ingen evidens för att mykoplasmaorsakad akut bronkit behöver behandlas annorlunda. Patienter med obstruktivitet kan ha nytta av inhalerade betastimulerare. Det saknas evidens för hostdämpande medel. Definition Definitioner av akut bronkit/luftrörskatarr har varierat. I de flesta studier och översikter definieras akut bronkit som en akut luftvägsinfektion som varar högst tre veckor med hosta som huvudsymtom. Lunginflammation ska ha uteslutits (1 4). Andra symtom kan också finnas såsom upphostningar, bröstsmärtor, dyspné eller väsande andning. I några engelska studier har man krävt att patienterna förutom hosta har haft minst ett av ovanstående symtom. Man har också krävt att andra luftvägssjukdomar uteslutits såsom pneumoni, astma och sinuit (5,6). I de evidensbaserad skotska riktlinjerna har begreppet akut bronkit ersatts med non-pneumonic nedre luftvägsinfektion, det vill säga nedre luftvägsinfektion som inte är lunginflammation (7). I detta dokument har vi valt att använda de vedertagna begreppen akut bronkit eller luftrörskatarr. Diagnosen akut bronkit/luftrörskatarr används för en nytillkommen inflammation i nedre luftvägarna med övergående hosta som inte är orsakad av en annan bakomliggande sjukdom. Differentialdiagnoser Pneumoni Det är viktigt att utesluta pneumoni. Enstaka symtom eller fynd kan vare sig säkert bekräfta eller utesluta pneumoni. Om följande tre fynd saknas är sannolikheten för pneumoni i det närmaste försumbar: hjärtfrekvens över 100 slag/minut, andningsfrekvens över 20/min, feber mer än 37,8 (8,9). Ytterligare undersökningar behövs då i regel inte för att utesluta pneumoni Förkylning Vid förkylning har patienterna förutom hosta ofta symtom på övre luftvägsinfektion som nästäppa, snuva, halsont. Förekomst av förkylningssymtom talar emot pneumonidiagnos (8). Rinosinuit Patienter med bakteriell rinosinuit har oftast haft förkylningssymtom > 10 dagar förutom en kombination av ensidig, purulent snuva, ensidig uttalad smärta i ansikte eller tänder tillsammans med en försämring av förkylningen, så kallat dubbelinsjuknande (10). Kronisk bronkit Kronisk bronkit definieras som daglig hosta och sputa i minst tre månader under två år i rad och frånvaro av annan sjukdom som förklarar symtomen. Rökning är den dominerade riskfaktorn (11). KOL Kroniskt obstruktiv lungsjukdom är en progredierande inflammatorisk sjukdom med kronisk luftvägsobstruktion vilket manifesteras i undersökning med spirometri som sänkt FEV 1 /VC-kvot eller FEV 1 /FVC (< 70 %) och som ej normaliseras efter bronkdilaterande behandling eller steroidbehandling. Rökning är den klart dominerande riskfaktorn (11). Astma Astma karaktäriseras av återkommande episoder med andnöd, pipande andning och hosta. Diagnosen astma kräver en samlad bedömning med anamnes tillsammans med påvisande av variabel luftvägsobstruktion med reversibilitetstest och/eller Peak Expiratory Flow (PEF)-variablitet (12). Hjärtsvikt Patienter med hjärtsvikt kan söka med framförallt nattlig hosta och andnöd. Ofta är patienterna äldre, med anamnes på tidigare hjärt-kärlsjukdom. Vid misstanke om hjärtsvikt bör diagnosen verifieras. Normala natriuretiska peptider (BNP eller NT-proBNP) talar starkt emot hjärtsvikt (13). Ett flertal andra sjukdomstillstånd kan också presenteras med hosta, till exempel tuberkulos, lungtumör och gastroesofagal reflux. Förekomst I de svenska primärvårdsundersökningarna vecka 47 från 2000, 2002 och 2005 utgjorde luftvägsinfektionerna cirka 70 % av infektionsdiagnoserna. Bland luftvägsinfektionerna dominerade förkylning och halsinfektion och stod för cirka hälften av besöken medan akut bronkit svarade för 9 % (André M, in press). Amerikanska data anger att 4 5 % av alla vuxna får en eller flera episoder av akut bronkit per år (14). Engelska data uppger att akut bronkit drabbar 36 Information från Läkemedelsverket 3:2008
37 4,4 % av vuxna över 16 år och att 82 % av episoderna förekommer under hösten och vintern (15). I USA uppges 90 % av patienterna med akut bronkit söka sjukvård. I Sverige är siffran sannolikt lägre. Etiologi En trolig patogen har identifierats i mellan % (16,17). De stora variationerna sammanhänger troligen med vilka patienter som studeras, vilken metodik som används för att identifiera virus och atypiska bakterier och den aktuella epidemiska situationen. I en brittisk primärvårdsstudie på 316 patienter med nedre luftvägsinfektion identifierades en trolig patogen i 55 % av fallen. Bakterier fanns hos 82 (pneumokocker, Hemofilus), atypiska bakterier hos 75 (klamydia, mykoplasma) och virus hos 61 (influensa A). Infektion med flera patogener var vanligt (15). I en annan brittisk primärvårdsstudie av 80 patienter med nedre luftvägsinfektion hittade man en trolig patogen i 69 % av fallen (17). Hos en frisk kontrollgrupp återfanns en patogen hos 14 %. Virus identifierades hos 63 % av de med nedre luftvägsinfektion. De vanligaste var rhinovirus och influensa. Bakterier identifierades hos 26 %. Pneumokocker var vanligast. Atypiska patogener var ovanligt. I en holländsk interventionsstudie kunde etiologiskt agens påvisas hos 46 %. Virus var vanligast. Atypisk patogen återfanns bara i 1,5 % av fallen (18). Influensa är en av de vanligaste orsakerna till akut bronkit. Typiska symtom är ett plötsligt insjuknande med allmän sjukdomskänsla, frysningar och snabbt stigande feber (39 40 ºC), varefter kraftig huvudvärk och svår mus kelvärk tillkommer. Hård torrhosta är särskilt framträdande, ofta i kombination med retrosternal smärta. I nor malfallet varar febern tre till fem dagar och som regel är den akuta sjukdomen över efter fem till sju dagar. Hosta och trötthet kan kvarstå i ytterligare ett par veckor (19). B. Pertussis är en inte helt ovanlig orsak till långvarig hosta. Den har påvisats hos % bland patienter som söker för långvarig hosta. I en dansk undersökning fann man pertussis hos 16 % av fallen (20). Naturalförlopp Definitionen av akut bronkit förutsätter att hostan inte varar mer än tre veckor, men de studier som undersökt naturalförlopp har visat att hostan hos en stor del av patienterna varar längre, % hostade fortfarande efter tre veckor (21,22). En majoritet av de drabbade upplevde att deras dagliga aktiviteter inskränktes under symtomtiden (22,23). Det är relativt vanligt att okomplicerad akut bronkit medför en övergående och tillfällig obstruktivitet. I en amerikansk undersökning av 27 patienter med akut bronkit hade 40 % ett FEV 1 på mindre än 80 % av förväntat (24). De lätt sänkta värdena normaliserades inom 4 5 veckor. En äldre studie pekade på att återkommande episoder med akut bronkit var asso- cierat med astma (25). I en nyare isländsk studie undersöktes 138 patienter med diagnosen akut bronkit. Tre år senare uppfyllde 19 % av patienterna kriterier för astma (26). Diagnostik Akut bronkit är i många avseenden en uteslutningsdiagnos. Det betyder att när en patient söker med hosta som huvudsymtom måste allvarlig sjukdom uteslutas. Det gäller i första hand pneumoni och bakomliggande kronisk lungsjukdom som astma eller KOL. Anamnes och klinisk undersökning räcker i de flesta fall. Fråga om: Tidigare sjukdom. Rökning Kontrollera: Opåverkad patient? Kliniska symtom för lunginflammation (feber, takypné, takykardi)? Frikostig med spirometri vid rökning och misstanke på obstruktivitet Specifika diagnoskriterier Det diagnostiska och prognostiska värdet av olika symtom och tester har utvärderats i flera studier. Det finns några förhållanden, som är viktigt att ta hänsyn till när resultaten av dessa studier granskas. För många kliniska kriterier (till exempel auskultation av lungor, bedömning av röntgenbild) varierar bedömningen betydligt mellan olika bedömare (8). Möjligheten att med resultatet av ett test förutsäga om en patient har en sjukdom eller ej är avhängigt av hur vanligt det aktuella tillståndet är i den undersökta gruppen. Testets andel sant positiva och sant negativa svar (det vill säga sensitivitet och specificitet) är konstant. När prevalensen minskar ökar andelen falskt positiva testsvar och därmed minskar det positiva prediktiva värdet, vilket ofta är ett bekymmer i primärvården där det är en låg förekomst av akuta allvarliga sjukdomar. I en studie från Norge visades att det prediktiva värdet av CRP > 60 mg/l för att identifiera pnuemoni minskade från 0,43 bland patienter med misstänkt pneumoni till 0,12 om det utfördes på alla patienter med luftvägsinfektion i en primärvårdsmottagning (27). Det betyder bland annat att nyttan av tester är olika på en sjukhusmottagning med stor andel patienter med den eftersökta sjukdomen jämfört med i primärvård. Val av golden standard för den aktuella diagnosen påverkar värderingen av det diagnostiska kriteriet. De flesta studierna har utgått ifrån att det är röntgenförändringar som är golden standard för diagnosen pneumoni, underförstått att alla röntgenologiskt verifierade pneumonier ska antibiotikabehandlas. Flera brittiska primärvårdsforskare ifrågasätter detta och menar att den avgörande frågan är vilka patienter Information från Läkemedelsverket 3:
38 som har nytta av antibiotika. Därför använder de som resultatmått att patienten återkommit till sjukvården med fortsatta besvär (6,15,28). Vilket diagnostiskt värde har: Färgade upphostningar? Flera studier har visat att färgade upphostningar inte differentierar mellan akut bronkit och pneumoni. Patienter med akut bronkit och färgade upphostningar blir inte fortare besvärsfria med antibiotikabehandling (15,29,30). Auskultatoriska biljud på lungorna? Flera studier har visat att spridda lungauskultationsfynd som krepitationer och bronkiella andningsljud inte kan skilja pneumoni från akut bronkit. Patienter med akut bronkit och auskultatoriska biljud vid lungauskultation blir inte fortare besvärsfria med antibiotikabehandling (8,29,30). Däremot är fokala auskultationsfynd vanligare vid pneumoni än vid akut bronkit. (31). Förhöjt CRP? Både från Norge och från Holland har man visat att förhöjt CRP är känsligare an andra förekommande laboratorieanalyser och kliniska tecken för att skilja ut lunginflammation (29,32). Nyttan av patientnära CRP i klinisk praxis har dock ifrågasatts, eftersom man inte visat att användning leder till att antibiotikaförskrivning i högre grad riktas till de patienter som har nytta av den (15,33). I en systematisk översikt konkluderas att värdet av diagnostisk CRP-testning vid nedre luftvägsinfektioner inte är tillräckligt studerat och att de få studier som finns har en låg metodologisk kvalitet. CRP är inte tillräckligt sensitivt eller specifikt för att identifiera en lunginflammation (definierat som röntgeninfiltrat och bakteriell etiologi) (34). Från Sverige har vi rapporterat om en sannolik överanvändning av patientnära CRP vid luftvägsinfektion. När patienter med ospecifika luftvägsdiagnoser (bronkit, hosta) som testats med CRP jämfördes med de som inte testats, förskrevs antibiotika till en större andel om CRP tagits < 3 dagar från debut men till en lägre andel när CRP tagits > 7 dagar efter debut av symtomen. Orsaken tycktes vara att en alltför låg beslutsgräns användes. Vid CRP > 25 mg/l fick 50 % av patienterna antibiotika. Det är möjligt att användning av CRP senare i förloppet hos patienter med långdragen hosta hjälper allmänläkaren att avstå från antibiotika (35). Diagnostiska kriterier Varken färgade upphostningar eller krepitationer och bronkiella andningsljud kan skilja mellan akut bronkit och lunginflammation. Antibiotikabehandling av patienter med akut bronkit och dessa symtom leder ej till förkortad symtomtid. CRP är inte rutinprov för patienter med akut bronkit. Behandling/omhändertagande Antibiotika I en Cochrane-review uppdaterad 2004 är slutsatsen att antibiotika har blygsamma effekter. Storleken på denna effekt måste ses i relation till potentiella biverkningar, medikalisering av ett självläkande tillstånd, ökad resistens hos luftvägspatogener och kostnader för antibiotikabehandling (3). Nio randomiserade studier från 1970 till 2002 med sammanlagt 750 patienter ingick. Studierna inkluderade patienter i åldrarna 8 år till över 65 år. Ingen studie inkluderade patienter med hosta längre än 30 dagar. Fem studier inkluderade hosta i mindre än 14 dagar. I de flesta studierna exkluderades kliniskt misstänkt pneumoni. I två studier gjordes lungröntgen på alla. Rökare och icke-rökare ingick. I fyra studier jämfördes doxycyklin mot placebo och i fyra studier erytromycin mot placebo. Antibiotika medförde att tiden med hosta förkortades med 0,58 dagar, tiden med produktiv hosta med 0,52 dagar och tiden med sjukdomskänsla med 0,58 dagar. Ingen skillnad sågs vad gällde natthosta eller begränsningar av aktiviteter. Biverkningar var vanligare i antibiotikagruppen (illamående, kräkningar, utslag, huvudvärk, vaginit). Två andra metaanalyser/systematiska översikter kommer till likartade resultat. I metaanalysen av Bent (36) ingick åtta studier och slutsatsen var att antibiotika till i övrigt friska patienter med akut bronkit inte kunde rekommenderas på grund av liten klinisk effekt jämfört med risk för biverkningar och kostnader för ökad antibiotikaresistens. I en systematisk översikt (37) blir slutsatsen att antibiotika inte förkortar tiden med hosta och att fördelarna är marginella och inte uppvägs av risken för biverkningar. I en stor och välgjord studie som publicerats efter ovanstående metaanalyser jämfördes amoxicillin (omedelbart eller som recept i reserv ) mot ingen behandling på 807 patienter i brittisk primärvård med okomplicerad nedre luftvägsinfektion (6). Amoxicillin hade ingen effekt på hostan. Vissa sekundära effektmått förkortades med mindre än en dag. Subgruppsanalyser på barn, äldre (133 patienter > 60 år) och på de med färgade sputa visade inga skillnader. Hostan kvarstod i genomsnitt i 21 dagar. En patient utan behandling utvecklade pneumoni och 33 patienter fick diagnos astma inom ett år. Det finns inga hållpunkter för att akut bronkit orsakad av Mycoplasma pneumoniae skulle ha särskild nytta av antibiotikabehandling. I en randomiserad placebokontrollerad primärvårdsstudie med erytromycin vid akut bronkit sågs ingen effekt på hosta hos de 25 patienter som fått positiv snabbtest för Mycoplasma pneumoniae (38). I en brittisk kohortstudie angavs 75 patienter ha atypisk patogen (15). 57 % av dessa antibiotikabehandlades. De flesta fick amoxicillin men även erytromycin och kinolon gavs. Det var ingen skillnad i benägenhet att söka på nytt för samma infektion under en månads uppföljning hos 38 Information från Läkemedelsverket 3:2008
39 de som behandlats med amoxicillin jämfört med erytromycin/kinolon-behandlade. En randomiserad primärvårdsstudie jämförde amoxicillin mot roxitromycin på 196 vuxna patienter med nedre luftvägsinfektion (18). Ingen skillnad i utläkning sågs. En metaanalys av studier som jämför betalaktamantibiotika mot antibiotika aktiva mot atypiska patogener hos patienter med mild till måttlig pneumoni fann ingen skillnad i effekt vid pneumoni orsakad av Mycoplasma pneumoniae eller Chlamydia pneumoniae. Däremot var effekten bättre vid pneumoni orsakad av Legionella-species (39). I de svenska studierna från vecka 47 från 2000, 2002 och 2005 behandlades cirka 50 % av patienterna med diagnos akut bronkit med antibiotika och i hälften av fallen förskrevs tetracyklin (Andre M, in press). Beta-2-stimulerande medel I en Cochraneöversikt från 2006 konstateras att det finns blygsam evidens för rutinmässig användning av beta-2-stimulerare vid akut bronkit hos vuxna (4). De kan möjligen minska symtom inkluderande hosta hos patienter med akut bronkit och samtidiga tecken på obstruktivitet. I metaanalysen inkluderades fem studier på vuxna, tre med orala beta-2-stimulerare och två med inhalerade. Salbutamol undersöktes i tre studier, fenoterol i en studie. Sammanlagt 418 patienter ingick. Patienter med underliggande lungsjukdom som astma eller KOL var exkluderade liksom patienter med pertussis eller pneumoni. Däremot exkluderades inte patienter med tillfälligt pipande/väsande andning. I fyra av de fem studierna anges hur många som inkluderats med väsande andning och det varierar mellan %. Behandlingstiden var mindre än sju dagar i alla studier. Man såg ingen säkerställd effekt på andelen som hostade efter sju dagar eller i graden av hosta även om det fanns en trend till betastimulerarnas fördel. Det var ingen skillnad mellan peroral eller inhalerad betastimulering. I subgruppsanalyser kunde man se att de patienter som hade mest inslag av obstruktivitet var de som hade nytta av behandlingen. Oro, skakighet och tremor var säkerställt vanligare i betastimulerargruppen. I en av metaanalysens studier inkluderades 80 i övrigt friska patienter som hade fortsatt hosta en vecka efter besök hos norska allmänläkare (40). Drygt hälften var rökare och hostan hade varat i dagar vid inklusion. Metakolintest visade tecken på bronkiell måttlig hyperreaktivitet hos 14 av 59 (24 %) undersökta patienter. Hostan minskade något snabbare i fenoterolgruppen men det var inte statistiskt säkerställt. FEV 1 ökade med 5 % i fenoterolgruppen och 0,5 % i placebogruppen. I subgrupper med bronkiell hyperreaktivitet, väsande andning eller FEV 1 < 80 % minskade hosta och andra symtom som sputum, dyspné och bröstsmärta påtagligt. Hostmedicin Det finns få kliniskt relevanta studier på hostmediciner. Ett flertal är gjorda på farmakologiskt inducerad hosta. En Cochraneöversikt fann 17 studier med sammanlagt vuxna patienter med hosta (41). Sex studier jämförde hosthämmande mot placebo. Kodein saknade effekt. Dextrometorfan (Tussidyl) var bättre än placebo i två studier men saknade effekt i en tredje. Två studier jämförde expektorantiat guajfenesin (Resyl) mot placebo. Den ena visade en svag effekt, den andra visade ingen effekt. En studie utvärderade mucolytikat bromhexin. Man såg en blygsam effekt på hosta som minskade mellan dag 4 10 jämfört med placebo. Två studier jämförde kombinationer av antihistamin och avsvällande (loratadin/pseudoefedrin respektive dexbromfeniramin/ pseudoefedrin) mot placebo. I den ena studien var kombinationen bättre än placebo i den andra sågs ingen skillnad. Sammanfattningsvis konstaterar Cochrane-översikten att det inte finns någon god evidens för eller emot hostmediciner. Studierna har ofta olika design, med olika populationer och effektmått. Studierna är små och visar ofta motstridiga resultat. Man kan också ifrågasätta de positiva effekternas kliniska relevans. Behandling av akut bronkit Den stora majoriteten av patienter har ingen nytta av någon behandling. En lite grupp med pneumoniliknande akut bronkit har sannolikt nytta av antibiotika. En liten grupp med astmaliknande akut bronkit har nytta av inhalerade beta-stimulerare. Fördröjd förskrivning Två randomiserade kontrollerade studier från primärvård har undersökt effekten av fördröjd förskrivning av antibiotika bland patienter med hosta som huvudsymtom. Fördröjd förskrivning innebar att patienten fick möjlighet att återkomma till mottagningen för att hämta antibiotikareceptet efter sju (42) respektive 14 dagar (6). I ena studien undersöktes effekten jämfört med omedelbar förskrivning (42), i den andra ingick dessutom en jämförelse mot att inte förskriva antibiotika (6). Inga skillnader sågs i kliniska utfallsmått som feber eller hosta förutom en patient som insjuknade i pneumoni i den grupp av 273 patienter som inte fick antibiotika (6). Patienterna var mer nöjda med omedelbar förskrivning än fördröjd. Behandlingen tycktes påverka patienternas förväntningar inför kommande sjukdomsepisod på så sätt att de som omedelbart fick antibiotika i högre grad trodde att antibiotika var effektivt mot hostan och i högre grad tänkte söka sjukvård nästa gång de blev sjuka. Antibiotikakonsumtion minskade signifikant i gruppen som fick fördröjd förskrivning jämfört med de som fick omedelbar Information från Läkemedelsverket 3:
40 förskrivning (6,42). När antibiotikakonsumtionen följdes under tre veckor efter besöket var det ingen skillnad i antibiotikakonsumtion i den grupp som fått fördröjd förskrivning konsumtionen jämfört med de som inte förskrivits antibiotika vid första besöket (6). Patientinformation Patientens kunskap och förväntningar påverkar i hög grad läkarens beslut om förskrivning av antibiotika vid akut bronkit (43). Avgörande är inte bara patientens förväntningar utan vad läkaren tror att patienten önskar. I en primärvårdsstudie fick 77 % av patienterna antibiotika när allmänläkaren trodde de förväntade sig det jämfört med 29 % när läkaren inte trodde de förväntade sig antibiotika, men bara i 47 % av fallen var läkarens bedömning av patienternas förväntan korrekt (44). Det som visats vara viktigast för patienten är att få svar på sina frågor, att få information om sjukdomen och den behandling som föreslås. En förbättrad kommunikation mellan läkare och patient har i sig visats leda till en minskad antibiotikaförskrivning (45, Cals in press). Informationen kan förlänga det aktuella besöket något men flera studier har visat att en minskad förskrivning av antibiotika minskar patientens benägenhet att söka igen vid en ny episod (46). Benämningen på symtomen har betydelse för patientens förståelse och läkarens val av behandling. Engelskans uttryck bronchitis samvarierar med högre antibiotikaanvändning jämfört med benämning- en chest cold (47). Det är möjligt att det svenska begreppet luftrörskatarr på motsvarande sätt mer förknippas med en virusinfektion och att användning av det begreppet skulle underlätta för läkare att avstå från antibiotika. Rökning ökar risken för besvär med hosta. Enkla råd om rökslut och information om nikotinersättning är en av de mest kostnadseffektiva förebyggande åtgärder som sjukvården förfogar över (48). Därför bör varje patient som söker för hosta tillfrågas om rökning och de som röker bör få råd om att sluta, information om nikotinersättning och vid behov utökat rökslutarstöd. I några studier har effekten av skriftlig information i samband med besöket utvärderats (innehållande beskrivning av naturalförlopp, för- och nackdelar med antbiotikaanvändning, råd om vilka symtom som bör leda till ny kontakt med sjukvården). Muntlig information gavs i alla studierna. Skriftlig information resulterade i färre återbesök för samma sjukdomsepisod (28). I en studie, där patienterna samtidigt fick med sig ett antibiotikarecept hem var det färre i gruppen som fått skriftlig information som hämtade ut förskrivet antibiotika (49). I en tredje studie gav den skriftliga informationen ingen effekt i antibiotikakonsumtion under de närmsta tre veckorna, vilket förklaras av den lägre nivån av antibiotikaförskrivningen i den studien (6). I konsultation för akut bronkit/luftrörskatarr bör läkaren förhöra sig om patientens egna föreställningar och farhågor, fråga om rökning, ge råd om rökslut och nikotinersättning till rökare, informera om naturalförlopp (i genomsnitt tre veckor, men för 30 % längre, upp till 4 5 veckor), informera om att antibiotika inte förkortar symtomtiden, informera om antibiotikas biverkningar och resistensproblem. Skriftlig information Patienter med akut bronkit bör erhålla skriftligt informationsmaterial som beskriver sjukdomsförloppet och varför antibiotika inte förskrivs. Referenser 1. Gonzales R, Sande MA. Uncomplicated acute bronchitis. Ann Intern Med 2000;133: Braman SS. Chronic cough due to acute bronchitis: ACCP evidence-based clinical practice guidelines. Chest 2006;129: Smucny J, Fahey T, Becker L, et al. Antibiotics for acute bronchitis.[update of Cochrane Database Syst Rev. 2000;(4):CD000245; PMID: ]. Cochrane Database of Systematic Reviews 2004(4):CD Smucny J, Becker L, Glazier R. Beta2-agonists for acute bronchitis.[update of Cochrane Database Syst Rev. 2004;(1):CD001726; PMID: ]. Cochrane Database of Systematic Reviews 2006(4):CD Macfarlane JT, Colville A, Guion A, et al. Prospective study of aetiology and outcome of adult lower-respiratory-tract infections in the community. Lancet 1993;341: Little P, Rumsby K, Kelly J, et al. Information leaflet and antibiotic prescribing strategies for acute lower respiratory tract infection: a randomized controlled trial. JAMA 2005;293: [Anonymous]. Community management of olwer respiratory tract infection in adults. A national clinical guideline. Sign publication No 59. Scottish Intercollegiate Guidelines network; Metlay JP, Kapoor WN, Fine MJ. Does this patient have community-acquired pneumonia? Diagnosing pneumonia by history and physical examination. JAMA 1997;278: Nolt BR, Gonzales R, Maselli J, et al. Vital-sign abnormalities as predictors of pneumonia in adults with acute cough illness. Am J Emerg Med 2007;25: [Anonymous]. Pharmacological treatment of rhinosinusitis. Information from Medical Products Agency; 2005;3: Information från Läkemedelsverket 3:2008
41 11. [Anonymous]. Treatment of chronic pulmonary obstructive disease COPD. Information from Medical Products Agency 2002;4: [Anonymous]. Pharmacological treatment in asthma. Information from Medical Products Agency 2007;1: [Anonymous]. Diagnosis and treatment of chronic heart failure. Information from Medical Products Agency 2006;1: Benson V, Marano MA. Current estimates from the National Health Interview Survey, Vital & Health Statistics Series 10: Data From the National Health Survey 1998: Macfarlane J, Holmes W, Gard P, et al. Prospective study of the incidence, aetiology and outcome of adult lower respiratory tract illness in the community. Thorax 2001;56: Jonsson JS, Sigurdsson JA, Kristinsson KG, et al. Acute bronchitis in adults. How close do we come to its aetiology in general practice? Scand J Prim Health Care 1997;15: Creer DD, Dilworth JP, Gillespie SH, et al. Aetiological role of viral and bacterial infections in acute adult lower respiratory tract infection (LRTI) in primary care. Thorax 2006;61: Hopstaken RM, Nelemans P, Stobberingh EE, et al. Is roxithromycin better than amoxicillin in the treatment of acute lower respiratory tract infections in primary care? A doubleblind randomized controlled trial. J Fam Pract 2002;51: [Anonymous]. Treatment and prophylaxis of influenza with antiviral drugs. Information from Medical Products Agency 2007;5: Birkebaek NH. Bordetella pertussis in the aetiology of chronic cough in adults. Diagnostic methods and clinic. Dan Med Bull 2001;48: Williamson HA, Jr. A randomized, controlled trial of doxycycline in the treatment of acute bronchitis. J Fam Pract 1984;19: Verheij T, Kaptein AA, Mulder J. Acute bonchitis: course of symptoms and restrictions in patients daily activitities. Scand J Prim Health Care 1995;13: Hopstaken RM, Coenen S, Butler CC, et al. Prognostic factors and clinical outcome in acute lower respiratory tract infections: a prospective study in general practice. Fam Pract 2006;23: Williamson HA, Jr. Pulmonary function tests in acute bronchitis: evidence for reversible airway obstruction. J Fam Pract 1987;25: Hallett JS, Jacobs RL. Recurrent acute bronchitis: the association with undiagnosed bronchial asthma. Ann Allergy 1985;55: Jonsson JS, Gislason T, Gislason D, et al. Acute bronchitis and clinical outcome three years later: prospective cohort study. BMJ 1998;317: Melbye H, Straume B. The spectrum of patients strongly influences the usefulness of diagnostic tests for pneumonia. Scand J Prim Health Care 1993;11: Macfarlane J, Prewett J, Rose D, et al. Prospective case-control study of role of infection in patients who reconsult after initial antibiotic treatment for lower respiratory tract infection in primary care. BMJ 1997;315: Hopstaken RM, Muris JWM, Knottnerus JA, et al. Contributions of symtptoms, signs, erthrocyte sedimentation rate, and C-reactive protein to a diagnosis of pneumonia in acute lower respiratory tract infection. B J Gen Pract 2003;53: Melbye H, Straume B, Aasebo U, et al. Diagnosis of pneumonia in adults in general practice. Relative importance of typical symptoms and abnormal chest signs evaluated against a radiographic reference standard. Scand J Prim Health Care 1992;10: Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections. Eur Resp J 2005;26: Melbye H, Straume B, Aasebo U, et al. The diagnosis of adult pneumonia in general practice. The diagnostic value of history, physical examination and some blood tests. Scand J Prim Health Care 1988;6: Kolmos HJ, Little P. Controversies in management: should general practitioners perform diagnostic tests on patients before prescribing antibiotics? BMJ 1999;318: van der Meer V, Neven AK, van den Broek PJ, et al. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ 2005;331: Andre M, Schwan A, Odenholt I. Swedish Study Group on Antibiotic U. The use of CRP tests in patients with respiratory tract infections in primary care in Sweden can be questioned. Scand J Infect Dis 2004;36: Bent S, Saint S, Vittinghoff E, et al. Antibiotics in acute bronchitis: a meta-analysis. Am J Med 1999;107: Fahey T. Antibiotics for respiratory tract symptoms in general practice. Br J Gen Pract 1998;48: King DE, Williams WC, Bishop L, et al. Effectiveness of erythromycin in the treatment of acute bronchitis. J Fam Pract 1996;42: Mills GD, Oehley MR, Arrol B. Effectiveness of beta lactam antibiotics compared with antibiotics active against atypical pathogens in non-severe community acquired pneumonia: meta-analysis. BMJ 2005;330: Melbye H, Aasebo U, Straume B. Symptomatic effect of inhaled fenoterol in acute bronchitis: a placebo-controlled doubleblind study. Fam Pract 1991;8: Schroeder K, Fahey T. Over-the-counter medications for acute cough in children and adults in ambulatory settings. [update of Cochrane Database Syst Rev 2001;(3):CD001831; PMID: ]. Cochrane Database of Systematic Reviews. 2004(4):CD Dowell J, Pitkethly M, Bain J, et al. A randomised controlled trial of delayed antibiotic prescribing as a strategy for managing uncomplicated respiratory tract infection in primary care. Br J Gen Pract 2001;51: Macfarlane J, Holmes W, Macfarlane R, et al. Influence of patients expectations on antibiotic management of acute lower respiratory tract illness in general practice: questionnaire study. BMJ 1997;315: Cockburn J, Pit S. Prescribing behaviour in clinical practice: patients expectations and doctors perceptions of patients expectations a questionnaire study. BMJ 1997;315: Grol R, Mokkink H, Helsper-Lucas A, et al. Effects of the vocational training of general practice consultation skills and medical performance. Med Educ 1989;23: Dosh SA, Hickner JM, Mainous AG, et al. Predictors of antibiotic prescribing for nonspecific upper respiratory infections, acute bronchitis, and acute sinusitis. An UPRNet study. Upper Peninsula Research Network. J Fam Pract 2000;49: Gonzales R, Wilson A, Crane LA, et al. What s in a name? Public knowledge, attitudes, and experiences with antibiotic use for acute bronchitis. Am J Med 2000;108: Cohen D, Eliasson M, Eriksson C, et al. Smoking cessation methods. Stockholm. SBU rapport Macfarlane J. Reducing antibiotic use for acute bronchitis in primary care: blinded, randomised controlled trial of patient information leaflet. BMJ 2002;324:91 4. Information från Läkemedelsverket 3:
42 Akut bronkit hos barn etiologi och epidemiologi Margareta Eriksson Akuta luftvägsinfektioner med hosta är vanliga hos barn. Nyligen utförda longitudinella kohortstudier av friska barn i USA och Australien har bekräftat tidigare kunskaper att förskolebarn har genomsnittligt sex luftvägsinfektioner per år med en duration på en vecka (1,2). Om man regelbundet dessutom undersöker barn med otoskop finner man i samband med 30 % av episoderna ett otitstatus. I Tabell I sammanfattas normalförekomst av luftvägsinfektioner och dess komplikationer hos för övrigt friska barn i västvärlden (Tabell I). Obstruktiva andningsbesvär i anslutning till en nedre luftvägsinfektion är mycket vanligt hos barn. Under diagnosen akut bronkit döljer sig flera olika tillstånd. Ett problem är att diagnoser används olika i USA och andra delar av västvärlden. Bronkiolit används i Europa huvudsakligen för andningsbesvär hos mycket unga barn, medan bronkiolit i amerikansk litteratur betyder andningsbesvär hos barn ibland ända upp till två års ålder. Obstruktiv bronkit (wheezy bronchitis) används hos oss som diagnos för barn med pipande andning som led i en förkylning. På röntgen kan man se perihilära infiltrat och hyperinflation. En tredje grupp är småbarnsastma som ofta försämras i anslutning till luftvägsinfektioner. Diagnosen astma används ofta efter tre episoder av pipande andning hos samma individ. När det gäller total frekvens i en population anges mycket olika siffror. I en studie från Göteborg angavs detta förekomma hos 15 % av alla barn medan man i en studie i Stockholm har angett siffror på 25 % av alla barn. Man får dock inse att bortfallet i båda studierna var relativt stort och det är mycket möjligt att bortfallet innehåller fler barn som ej hade besvär. Om man räknar antalet obstruktiva episoder som en funktion av antalet utskrivna nebunetter i åldersgruppen noll till fyra år skulle det i Stockholmsområdet utgöra ungefär 20 %. Enligt den diagnos/receptundersökning som utförts under vecka 47 år utgör akut bronkit enbart 3 % av luftvägsdiagnoser hos barn på en allmänläkarmottagning. I vårt land sjukhusvårdas varje år 0,4 0,2 % av alla barn. Etiologin vid obstruktiva andningsbesvär anses nu kunna påvisas hos ända upp till 80 % av alla barn med hjälp av PCR-metodik. I denna typ av studie dominerar rinovirus följt av RS-virus och influensa. Mer än ett virus förekommer hos cirka 10 % av alla barn (1). Ett fåtal studier har också diskuterat betydelsen av samtidig förekomst av bakterier, huvudsakligen pneumokocker, påvisade med serologi (3). Den kliniska betydelsen av denna samtidigt förekommande bakterieinfektion är dock svårt att värdera då man inte kunde påvisa att dessa barn var svårare sjuka än övriga barn. Enligt Cochrane finns enbart en studie över värdet av antibiotika från 1966 omfattande 52 barn som ej visade någon skillnad vad gäller symtomduration (4). Flera studier sammanfattade i en metaanalys har också visat att tidig antibiotikabehandling inte kan förebygga komplikationer i form av pneumoni (5). När det gäller olika virus har man dock visat att rinovirus ger betydligt lindrigare infektioner än RSV, influensa och adenovirus hos friska personer. Hos barn (och vuxna) med astma eller annan kronisk lungsjukdom ger rinovirus ej fler men svårare och mer långdragna infektioner (6). Nyligen har man hos åtminstone vissa individer med astma funnit en defekt i immunförsvaret som skulle kunna förklara att just rinovirusinfektionen ger svårare symtom. Betydelsen av mykoplasma och klamydia har diskuterats intensivt under senare år. Från vissa centra, bland annat i Italien, har dessas ökande roll vid olika typer vid luftvägsinfektioner framhållits (7). Bärarskap förekommer hos cirka 5 % medan frekvensen vid såväl faryngit som upprepade luftvägsinfektioner har angivits så högt som 30 %. Detta har beskrivits också hos barn yngre än fem år. Hos barn med upprepade luftvägsinfektioner påvisades ofta mykoplasma. Detta har i sin tur lett till behandlingsstudier där man använt en makrolid, företrädesvis azitromycin. Ännu så länge finns få rapporter från andra grupper. Epidemiologi påverkas liksom den vid pneumoni i stor utsträckning av barnets ålder, säsong och förekomst av epidemier. Vintertid drabbas företrädesvis de yngsta barnen av RS-virus och influensa. Rinovirus förekommer året runt men med en topp under hösten. Övriga virus inklusive de som nyligen beskrivits förefaller förekomma året runt i en lägre frekvens. Tabell I. Naturalförlopp vid luftvägsinfektion. 100 friska barn 1 4 år/år 600 luftvägsinfektioner 200 otitfynd 15 3 obstruktiva episoder 4 pneumonier Frekvenser avser friska barn i åldern 1 4 år och bygger på data från flera studier i västvärlden. 42 Information från Läkemedelsverket 3:2008
43 Referenser 1. Lambert Stephen B, Allen Kelly M, Druce Julian D, et al. Community Epidemiology of human metapneumovirus, human coronavirus NL63, and other respiratory viruses in healthy preschool-aged children using parent-collected specimens. Pediatrics 2007;120: Clark Julia E, Hammal Donna, Spencer David, et al. Children with pneumonia how do they present and how are they managed? Arch Dis Child 2007;92: Lehtinen P, Jartti T, Virkki R, et al. Bacterial coinfections in children with viral wheezing. Eur J Clin Microbial Infect Dis 2006:25; Spurling GK, Fonseka K, Doust J, et al. Antibiotics for bronchiolitis in children. Cochrane Database Syst Rev 2007: Gadomski A. Potential interventions for preventing pneumonia among young children: lack of effect of antibiotic treatment for upper respiratory infections. Pediatr Infect Dis J 1993;12: Corne Jonathan M, Marshall Clare, et al. Frequency, severity, and duration of rinovirus infections in asthmatic and nonasthmatic individuals: a longitudinal cohort study. Lancet 2002;359: Principi N, Esposito S. Emerging role of Mycoplasma pneumoniae and Chlamydia pneumoniae in paediatric respiratorytract infections. Lancet Infectious Diseases 2001;1: Akuta exacerbationer av KOL och kronisk bronkit skall de antibiotikabehandlas? Ingemar Qvarfordt, Mats Kalin Definition och svårighetsgradering Diagnosen akut exacerbation av kronisk bronkit och kroniskt obstruktiv lungsjukdom förutsätter korrekt diagnos av dessa båda bakomliggande sjukdomar. Kroniskt obstruktiv lungsjukdom (KOL) är en långsamt progredierande inflammatorisk luftrörs/lungsjukdom som karakteriseras av kronisk luftvägsobstruktion. Lungfunktionsmässigt manifesteras detta som sänkt FEV 1 /FVC-kvot vid spirometri. Lungfunktionsnedsättningen är irreversibel i den bemärkelsen att patienten aldrig uppnår normalvärden, varken spontant eller efter behandling. Luftvägsobstruktionen vid KOL orsakas i varierande proportioner av inflammatoriska förändringar i små perifera luftrör (bronkiolit) samt av emfysem i lungvävnaden. En indelning av KOL i olika svårighetsgrader återfinns i Tabell I. Kronisk bronkit (KB) definieras i symtomtermer som hosta med upphostning de flesta dagar under minst tre månader per år under åtminstone två på varandra följande år, utan annan påvisbar orsak. Kronisk bronkit kan förekomma utan samtidig luftvägsobstruktion och KOL kan utvecklas utan att patienten haft symtom på kronisk bronkit. Förekomst av kronisk bronkit reflekterar inflammatoriska förändringar och slemkörtelhypertrofi/plasi i centrala bronker och korrelerar till ökad risk för nedre luftvägsinfektioner (1,2). Tabell I. Stadieindelning av KOL enligt det svenska nationella vårdprogrammet, baserad på spirometridata (79). Diagnos/Klassifikation Definition förutom FEV 1 /FVC < 70 % Preklinisk KOL FEV 1 80 % av förväntat värde Lindrig KOL FEV % av förväntat värde Medelsvår KOL FEV % av förväntat värde Svår KOL FEV 1 < 30 % av förväntat värde eller FEV 1 < 50 % av förväntat värde och förekomst av negativa prognosfaktorer Svår kronisk hypoxi (po 2 7,3 kpa) Kronisk hyperkapni (pco 2 6,5 kpa) Cirkulationspåverkan Låg kroppsvikt FEV 1 : forcerad exspiratorisk volym på en sekund; FVC: forcerad vitalkapacitet. Information från Läkemedelsverket 3:
44 Akuta exacerbationer är episodiskt förekommande försämringar i habitualtillståndet hos patienter med KB/KOL. En av alla forskare och kliniker accepterad och enhetlig definition av en akut exacerbation saknas ännu. I vetenskaplig litteratur har akuta exacerbationer definierats utifrån två skilda principer, antingen med utgångspunkt från den kliniska bilden (antal av vissa definierade symtom) (3), eller utifrån utnyttjande av sjukvårdsresurser (läkarbesök, antibiotikakurer) (4), med många variationer inom dessa huvudtemata. Det har nyligen visats hur denna brist på enhetlighet i definition och registrering av exacerbationer har försvårat en korrekt tolkning av behandlings- och epidemiologiska studier (5). Det av den medicinska professionen och WHO bildade Global initiative for chronic obstructive lung disease (GOLD) har formulerat en definition som pragmatiskt söker förena båda principerna. En akut exacerbation definieras här som an event in the natural course of the disease characterized by a change in the patient s baseline dyspnea, cough, and/or sputum that is beyond normal day-to-day variations, is acute in onset, and may warrant a change in regular medication in a patient with underlying COPD (6). Denna definition tar dock ej hänsyn till att en rad olika tillstånd kan förvärra dyspné och andra symtom och därmed likna eller förvärra en exacerbation utan att därför orsaka den, till exempel pneumoni, lungemboli och hjärtsvikt. Mest citerad och använd, särskilt i behandlingsstudier, är den av Anthonisen, et al. (3) uppställda symtombaserade definitionen, som delar in exacerbationer i tre typer beroende på förekomsten av tre kardinalsymtom: ökad dyspné, ökad sputumvolym, ökad sputumpurulens (se Tabell II). Snarlika symtomkombinationer har fått definiera en akut exacerbation i andra studier (7). I den akuta handläggningen av en enskild patient är naturligtvis symtombilden avgörande för bedömning av den mest sannolika etiologin och som kommer att framgå nedan är förekomst av purulent sputum viktigast för bedömning av indikationen för antibiotikabehandling. Symtomens svårighetsgrad vid en akut exacerbation är mindre beroende av exacerbationen i sig än av hur svår grundsjukdomen är och är därför oftast inte avgörande för om exacerbationen skall antibiotikabehandlas eller ej. Svårighetsgradering är däremot central för att avgöra behov av vårdnivå. Till hjälp för bedömningen av rätt vårdnivå finns i det svenska nationella vårdprogrammet för KOL en vägledning för värdering av svårighetsgraden vid akut exacerbation (8). Denna återges i Tabell III. Epidemiologi och betydelse Akuta exacerbationer är vanliga vid KB/KOL och är den kanske viktigaste orsaken till mortalitet och vårdbehov. En mortalitet på 11 % i samband med sjukhusvård för akut exacerbation med hyperkapni Tabell II. Symtombaserad indelning av akuta exacerbationer enligt Anthonisen, et al. (3). Typ I Typ II Typ III Ökad dyspné, ökad sputumvolym, ökad sputumpurulens. Två av symtomen ovan. Ett av symtomen i kombination med minst ett av följande: snuva, pip i bröstet, halsont, ökad hosta, oförklarad feber, 20 % ökad hjärtfrekvens eller andningsfrekvens. Tabell III. Vägledning för klinisk värdering av svårighetsgraden vid akut försämring av KOL. Lindrig medelsvår exacerbation Svår exacerbation Livshotande exacerbation Allmänpåverkan Obetydlig lindrig Påverkad, cyanos, Konfusion koma ödem Dyspné Obetydlig besvärande ansträngningsdyspné Vilodyspné Uttalad vilodyspné Andningsfrekvens < 25/min > 25/min Hjärtfrekvens < 110/min > 110/min Saturation 90 % < 90 % < 90 % (luftandning) Blodgas Behöver vanligen ej mätas po 2 < 8,0 kpa pco 2 6,5 kpa po 2 < 6,5 kpa pco 2 9,0 kpa ph < 7,3 Från Nationellt vårdprogram för KOL, med tillåtelse (8). 44 Information från Läkemedelsverket 3:2008
45 ningar (22,23), medan man i ungefär en tredjedel av fallen inte kan finna en specifik utlösande orsak (9). Det förtjänar här att upprepas vad heterogena patientmaterial och varierande definitioner i olika studier har inneburit för svårigheten att bringa klarhet i denna fråga. En sammanställning av de vanligaste kända orsakerna eller triggerfaktorerna för akuta exacerbationer ses i Tabell IV. I det följande kommer det viktigaste av vår nuvarande kunskap om bakterier och virus som orsak eller utlösande faktor till akuta exacerbationer vid KOL att belysas. Bakterier som orsak till akuta exacerbationer I studier där man använt bronkoskopisk provtagning från nedre luftvägar har akuta exacerbationer kunnat associeras till odlingsfynd av potentiellt patogena bakterier i bronksekret i ungefär 50 % av fallen (24,25). Vid svåra exacerbationer som krävt respiratorvård är denna siffra ännu högre (26,27). Signifikansen av bakteriefynd vid exacerbationer är dock svårvärderad % av patienterna är nämligen i stabil fas koloniserade i de nedre luftvägarna med samma bakteriespecies som påträffas vid exacerbation (24,26,28 31). Vanligast isolerade bakterier är i fallande ordning: Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis (24 27,32), medan Gramnegativa tarmbakterier, Pseudomonas aeruginosa och andra mindre vanliga Gramnegativa bakterier förekommer främst vid svår KOL. Speciellt gäller detta P. aeruginosa, som också är vanlioch en total tvåårsmortalitet på 49 % därefter har rapporterats i en amerikansk studie (9). I en holländsk studie var mortaliteten 8 % under vårdtiden och 23 % under året efter (10). Hur svår grundsjukdomen är betyder mest för utfall och prognos vid en akut exacerbation, men även exacerbationen i sig har betydelse. I en studie av 304 män med KOL och en uppföljningstid på fem år befanns mortaliteten vara signifikant korrelerad till frekvensen akuta exacerbationer som krävde sjukhusvård. Däremot hade ålder, samtidig annan sjukdom, lungfunktion och behov av långtids oxygenbehandling ingen betydelse (11). Patienter med täta akuta exacerbationer uppvisar sämre hälsorelaterad livskvalitet och snabbare försämring i sitt allmänna hälsotillstånd (12,13). Dessutom finns allt mer evidens för att exacerbationer påverkar det progressiva lungfunktionsbortfallet vid KOL (14 16) och att exacerbationsfrekvensen ökar med graden av luftvägsobstruktion (17,18). Akuta exacerbationer svarar också för en stor andel av de kostnader och resurser som tas i anspråk i vården av patienter med KOL. En svensk beräkning från början av 2000-talet skattar siffran till % av alla hälso- och sjukvårdskostnader hänförbara till KOL (19). Etiologi Publicerade data talar för att % av akuta exacerbationer orsakas av luftvägsinfektioner (20,21). En mindre andel (10 %) kan hänföras till luftförore- Tabell IV. Orsaker till exacerbationer av kronisk bronkit och KOL. Infektioner Bakterier Hemophilus influenzae Streptococcus penumoniae Moraxella catarrhalis Pseudomonas aeruginosa Staphylococcus aureus Enterobacteriacae Virus Rhinovirus Influensa Parainfluensa Adenovirus Respiratoriskt syncytievirus Luftföroreningar NO 2 SO 2 Ozon Partiklar Sammanställt från Sapey E, Stockley RA (80). Information från Läkemedelsverket 3:
46 gare efter antibiotikabehandling och sjukhusvistelse (27,32 34). Bakterier måste ändå anses ha betydelse för symtomutveckling eftersom positiva odlingar är vanligare och bakteriekoncentrationen högre vid exacerbationer; fynd av bakterier är dessutom korrelerat till förhöjda nivåer av inflammationsmarkörer och ökad mängd neutrofila blodkroppar i luftvägssekret (24,26,35,36). Kolonisation i sig förefaller också ha betydelse för tendensen att få exacerbationer och för prognosen av grundsjukdomen. Man har funnit att koloniserade patienter har tecken på högre grad av neutrofil inflammation i luftrören (31), att inflammationsgraden korrelerar till både mängden och arten (P. aeruginosa > H. influenzae > M. catarrhalis) av koloniserande bakterier (37 39), och att kolonisation åtminstone med pneumokocker ökar risken för att drabbas av en exacerbation (33). Slutligen verkar koloniserade patienter drabbas oftare och av svårare exacerbationer (30). Även studier av det immunologiska svaret mot enskilda bakteriestammar talar för att bakterier spelar en viktig roll vid akuta exacerbationer. Fynd av en ny bakteriestam i luftrören kunde i 30 % av fallen kopplas till symtom på en exacerbation i en långtidsuppföljning av en kohort patienter med KB där majoriteten också hade KOL (40). Samma forskargrupp kunde också påvisa utveckling av nya stamspecifika antikroppar mot Haemophilus influenzae efter exacerbationer (41). Liknande observationer har också gjorts för Moraxella catarrhalis (42). Kanske är akvisition av en ny stam och det inflammatoriska/ immunologiska svar den ger upphov till viktigare än ökad mängd av en bakteriestam som redan fanns på plats som utlösande faktor för en exacerbation (43). I samband med antibiotikabehandling av exacerbationer har man också kunnat visa att eradikering av den framodlade bakterien är associerad med minskad inflammation i luftvägarna (44). Vilken roll intracellulära bakterier som Chlamydia pneumoniae och Mycoplasma pneumoniae spelar som orsak till akuta exacerbationer är mer oklart. I en alldeles nypublicerad studie av 246 sputa från 104 patienter med KOL fann man inga DNA-spår av någondera bakterien vare sig vid exacerbation eller i stabil fas (45). Det är rimligt att anta att dessa agens inte har någon stor betydelse som orsak till akuta exacerbationer. Betydelsen av virus vid akuta exacerbationer I äldre, välgjorda studier med användning av virusisolering och serologi har akut virusinfektion kunnat påvisas i % av fall av akut exacerbation av KOL, med influensa A, parainfluensa 1 3, adenovirus, rinovirus och koronavirus som vanligaste fynd (46,47). I en nyare prospektiv studie av 504 exacerbationer hos 101 patienter med måttligt svår/svår KOL kunde över 60 % associeras till förkylningssymtom och vid dessa tillfällen var tiden till utläkning förlängd (48). Vid infektion med vanligt rinovirus hos KOL-patienter förefaller de nedre luftvägarna ofta bli direkt angripna (49,50). PCR-teknik har idag ökat möjligheterna till specifik och känslig diagnostik. Minst ett virus kunde påvisas med PCR i 39 % av 168 exacerbationer av KOL i en studie (51) och virusfynd var i denna förenat med högre frekvens exacerbationer (51). I en annan nyligen publicerad studie kunde cirka 50 % av akuta exacerbationer associeras till virusinfektioner, med rinovirus, respiratoriskt syncytievirus (RSV) och influensa A som vanligaste fynd (52). Dubbelinfektion förefaller också vara associerat med starkare inflammatoriskt svar och svårare symtom (52,53). Återkommande fynd av RSV i sputum från KOLpatienter i stabil fas är associerat med hög inflammatorisk aktivitet och snabbare förlust av lungfunktion (54), vilket antyder en roll för kronisk eller persisterande RSV-infektion för sjukdomens prognos. De senaste årens forskning pekar alltså på virus som en vanligare orsak till akuta exacerbationer än vad man tidigare ansett och att virus ofta förekommer samtidigt med bakterier i luftvägarna. Ställningstagande till antibiotikabehandling Det är angeläget att kunna identifiera bakteriella infektioner där det finns möjligheter att påverka förloppet med antibiotika. Det har visat sig att upphostningarnas utseende kan prediktera fynd av bakterier. I en undersökning omfattande 89 patienter var purulenta (gröna eller gröngula) sputa i jämförelse med mukösa (vita eller vitgrå) signifikant associerade till fynd av patogena bakterier (84 vs. 38 %) och till högre (> 107 CFU/mL) bakteriekoncentration (55). Liknande fynd gjordes av samma forskargrupp i en annan undersökning vars huvudresultat redovisas i Tabell V (56). I denna senare undersökning kunde också olika inflammationsmarkörer påvisas i högre frekvens och i högre koncentration hos dem med purulent sputum. Tabell V. Relation mellan utseende och bakteriefynd i sputum vid akut exacerbation av KOL. Purulent sputum Muköst sputum N = 42 N = 27 Sputumfärg Grönt/gult Vitt Andel med fynd av patogen bakterie % Andel med bakterietal > 107 CFU/mL % Data hämtade från Gompertz, et al. (56). 46 Information från Läkemedelsverket 3:2008
47 Värdet av sputumpurulens som markör för bakterieförekomst vid akuta exacerbationer har nyligen bekräftats med hjälp av jämförelse med bronkoskopiskt erhållna skyddade borstprover (protected specimen brush, PSB) (57). Faktorer signifikant associerade med fynd av patogena bakterier i PSB-odling var patientrapporterad sputumpurulens (OR 27,2 [CI 4,6 60,7]), svår KOL (FEV 1 < 50 %), mer än fyra exacerbationer senaste året samt sjukhusvård på grund av akut exacerbation senaste året. Med exacerbationerna stratifierade enligt Anthonisen (3) (Tabell I) fann man patogena bakterier i skyddat borstprov i 80 % av typ I-exacerbationer, men bara i 35 % vid typ II (2/12 purulenta) och 6 % vid typ III. Fastän associationer mellan CRP-nivå och sannolikt bakterieorsakad exacerbation finns på gruppnivå (58,59) är det uppenbart att CRP inte kan användas för att indikera etiologi och indikation för antibiotika i det enskilda fallet (60). Effekt av antibiotikabehandling Effekten av och indikationerna för antibiotikabehandling vid akut exacerbation av KB/KOL är fortfarande kontroversiella frågor. Endast ett mindre antal randomiserade, placebokontrollerade studier av antibiotikabehandling av akuta exacerbationer finns publicerade (3,61 68). I fyra av dessa nio studier kunde en signifikant effekt till fördel för antibiotikagrupperna konstateras (3;64;65;68). Vid värdering av resultaten av alla studierna är det vikigt att notera att patienter med KOL utgjorde en minoritet; de flesta inkluderade hade kronisk bronkit. En blandning av sjukhusvårdade och polikliniska patienter ingick, men framför allt saknas ett gemensamt mått på behandlingseffekt i de olika studierna. I en metaanalys av de nio studierna kunde en signifikant effekt till fördel för antibiotikabehandling konstateras (69). Studierna och metaanalysen utvärderades i en SBU-rapport publicerad år 2000 och rapportens slutsats blev att antibiotikabehandling av patienter med exacerbation av kronisk bronkit med eller utan KOL förkortar exacerbationen och minskar symtomen (70). Den gynnsamma effekten är dock tydligare i bättre definierade subgrupper. Cochranesamarbetet publicerade 2006 en rapport som behandlar antibiotikabehandling av akuta exacerbationer av KOL (71). I denna inkluderades förutom de ovan citerade studierna även en icke engelskspråkig och ett par konferensabstract. Man fann att antibiotikabehandling av akuta exacerbationer med ökad hosta och purulenta sputa som symtom reducerar akut mortalitet, risk för behandlingssvikt och sputumpurulens med respektive 77, 53 och 44 %. Rapporten stödjer bruk av antibiotika vid akut exacerbation av KOL. Vilka patienter skall behandlas med antibiotika? Den tidigare omnämnda studien av Anthonisen, et al. (3) har den mest väldefinerade patientgruppen (bara patienter med KOL) och är den som fått störst betydelse för de rekommendationer och den praxis som under senare år blivit förhärskande när det gäller indikation för antibiotika. Den ger också viss vägledning när det gäller urval av patienter som bör behandlas. Studien visade att antibiotika (amoxicillin, trimetoprim/sulfametoxazol eller doxycyklin) givet till KOL-patienter med typ I-exacerbationer (Tabell I) gav signifikant bättre utläkning än placebo (63 % jämfört med 43 %). Även vid exacerbationer typ II kunde en tendens till gynnsam effekt noteras. Som tidigare nämnts finns en tydlig koppling mellan purulens och förekomst av höga bakterietal i sputum (55), vilket antyder att en subgrupp av patienter med typ II-exacerbationer där sputumpurulens är ett av kardinalsymtomen sannolikt skulle kunna ha nytta av antibiotikabehandling. Detta har dock inte specifikt studerats. Även stadium i grundsjukdomen har betydelse för effekten av antibiotikabehandling. En randomiserad placebokontrollerad studie av patienter med exacerbation av KOL som behövde mekanisk ventilation visade att antibiotikabehandling (ofloxacin) medförde minskad sjukhusmortalitet (absolut riskreduktion 17,5 %, 95 % CI 4,3 30,7) och minskad frekvens sekundär vårdrelaterad infektion jämfört med placebo (72). Dessutom har patienter med svår lungfunktionsnedsättning och hög exacerbationsfrekvens senaste året oftare nytta av antibiotikabehandling än de med mildare sjukdom (73). I vilken utsträckning patienter med kronisk bronkit, utan eller med lindrig KOL, vilka oftast inte behöver sjukhusvård, behöver behandlas med antibiotika är oklart och otillräckligt studerat. Purulens tydande på bakterieförekomst i sputum är ett vanligt symtom vid exacerbation även av kronisk bronkit och lindrig KOL (58,74), men då svår dyspné är mer sällsynt i denna patientgrupp leder en exacerbation mer sällan till läkarkontakt (12). I de nypublicerade europeiska riktlinjerna rekommenderas trots allt antibiotikabehandling vid mild sjukdom om en exacerbation av typ I föreligger (75). Antibiotikaval Den vägledande principen för val av antibiotikum måste vara lokal kunskap om vilka bakterier som är vanligast förekommande i den patientgrupp man avser behandla och resistensläget för de preparat som kan komma ifråga. Dessutom bör övergripande nationella eller regionala riktlinjer beaktas. Idag föreligger risk för överförskrivning av kinoloner med stark risk för ökad resistensutveckling mot preparat i denna grupp. Eftersom publicerade studier om etiologi vid exacerbationer av KB/KOL i Sverige saknas får rekommendationer baseras på internationella studier, men med hänsyn tagen till det svenska (eller lokala) resistensläget. Det betyder att vid kronisk bronkit, lindrig och medelsvår KOL bör i första hand am- Information från Läkemedelsverket 3:
48 oxicillin, doxycyklin eller trimetoprimsulfa användas. H. influenzae dominerar, men endast cirka 10 % är betalaktamasproducerande; S. pneumoniae är i allmänhet känslig för ovanstående tre preparat, medan M. catarrhalis nästan alltid bildar betalaktamas, men är känslig för doxycyklin och trimsulfa. Dessutom är M. catarrhalis en mindre aggressiv bakterie även om dess betydelse som signifikant patogen i en del fall av akut exacerbation är dokumenterad. För att täcka in M. catarrhalis och betalaktamasproducerande H. influenzae utgör amoxicillin/klavulansyra eller cefalosporin alternativ. Vid svåra exacerbationer och/eller svår grundsjukdom med behov av sjukhusvård kan oftast cefotaxim användas med mycket god effekt mot ovanstående tre species. Man måste emellertid inse att det i detta läge finns risk för att P. aeruginosa och eventuellt än mer problematiska species kan vara involverade. Ett flertal behandlingsalternativ kan övervägas som ceftazidim, piperacillin-tazobactam, karbapenem eller kinolon. Behandlingstid I de fyra refererade studier där gynnsam effekt av antibiotika kunde statistiskt säkerställas varierade behandlingstiderna mellan sju och 21 dagar (3,64,65,68). Baserat på nyare studier där olika behandlingstider prövats kan antibiotika ges i tre till sju dagar med gott resultat (76 78). I dessa studier användes dock endast nyare kinoloner eller telitromycin för de kortaste behandlingstiderna. Sammanfattning Akuta exacerbationer är vanliga vid kronisk bronkit och KOL. De är orsaken till en stor andel av de kostnader och det resursutnyttjande av sjukvården som kan hänföras till folksjukdomen KOL. Akuta exacerbationer är för patienterna förenade med ökad mortalitet, sämre livskvalitet och förvärrad långtidsprognos för grundsjukdomen. Uppskattningsvis två tredjedelar av alla exacerbationer orsakas av luftvägsinfektioner med bakterier och/eller virus. Patogena bakterier i stor mängd kan påvisas i nedre luftvägar i cirka hälften av alla exacerbationer men också ofta mellan exacerbationerna. De vanligast förekommande bakterierna är okapslade Hemophilus influenzae, Streptococcus penumoniae och Moraxella catarrhalis. Vid medelsvår/svår KOL (FEV < 50 % förväntat) påträffas även Pseudomonas aeruginosa, Stap- 1 hylococcus aureus och olika arter av Enterobacteriacae. Förekomst av gulgrönt missfärgade upphostningar purulent sputum är korrelerat till bakterieförekomst, höga bakterietal och ökad inflammation i nedre luftvägar. Antibiotikabehandling av patienter med exacerbation av kronisk bronkit med eller utan KOL kan förkorta exacerbationen och minska symtomen (2b). Den positiva effekten av antibiotika är tydligast om purulens är ett av symtomen (2c). Störst effekt av antibiotikabehandling kan förväntas vid samtidig förekomst av symtomen ökad dyspné, ökad sputumvolym, ökad sputumpurulens (2b). Antibiotika som en del av behandlingen till patienter med svår exacerbation av KOL som kräver invasiv eller noninvasiv mekanisk ventilation minskar mortaliteten och risken för sekundär vårdrelaterad infektion (2b). Referenser 1. Fletcher C, Peto R. The natural history of chronic airflow obstruction. BMJ 1977;1: Prescott E, Lange P, Vestbo J. Chronic mucus hypersecretion in COPD and death from pulmonary infection. Eur Respir J 1995;8: Anthonisen NR, Manfreda J, Warren CP, et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106: Rodriguez-Roisin R. Toward a consensus definition for COPD exacerbations. Chest 2000;117(5 Suppl 2): Aaron SD, Fergusson D, Marks GB, et al. Counting, analyzing and reporting exacerbations of COPD in randomized, controlled trials. Thorax 2007 Aug 16 [e-published ahead of print]. 6. Global strategy for diagnosis, management, and prevention of COPD, 2006 [Tillgängligt från 7. Boman G, Bäcker U, Larsson S, et al. Oral acetylcysteine reduces exacerbation rate in chronic bronchitis: report of a trial organized by the Swedish Society for Pulmonary Diseases. Eur J Respir Dis 1983;64: Nationellt vårdprogram för KOL, version 1.5, Nivå 2, avsnitt 6.1, [Tillgängligt från: 9. Connors AF Jr, Dawson NV, Thomas C, et al. Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med 1996;154(4 Pt 1): Groenewegen KH, Schols AM, Wouters EF. Mortality and mortality-related factors after hospitalization for acute exacerbation of COPD. Chest 2003;124: Soler-Cataluna JJ, Martinez-Garcia MA, Roman Sanchez P, et al. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax 2005;60: Seemungal TAR, Donaldson GC, Paul EA, et al. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Resp Crit Care Med 1998;157: Spencer S, Calverley PM, Sherwood Burge P, et al. Health status deterioration in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;163: Kanner RE, Anthonisen NR, Connett JE. Lower respiratory illnesses promote FEV(1) decline in current smokers but not ex-smokers with mild chronic obstructive pulmonary disease: results from the lung health study. Am J Respir Crit Care Med 2001;164: Donaldson GC, Seemungal TA, Bhowmik A, et al. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax 2002;57: Dowson LJ, Guest PJ, Stockley RA. Longitudinal changes in physiological, radiological, and health status measurements in alpha(1)-antitrypsin deficiency and factors associated with decline. Am J Respir Crit Care Med 2001;164(10 Pt 1): Information från Läkemedelsverket 3:2008
49 17. Burge S, Wedzicha JA. COPD exacerbations: definitions and classifications. Eur Respir J Suppl 2003;41: Donaldson GC, Seemungal TA, Patel IS, et al. Longitudinal changes in the nature, severity and frequency of COPD exacerbations. Eur Respir J 2003;22: Andersson F, Borg S, Jansson SA, et al. The costs of exacerbations in chronic obstructive pulmonary disease (COPD). Respir Med 2002;96: Ball P. Epidemiology and treatment of chronic bronchitis and its exacerbations. Chest 1995;108(suppl 2): Murphy TF, Sethi S, Niederman MS. The role of bacteria in exacerbations of COPD. A constructive view. Chest 2000;118: Sunyer J, Saez M, Murillo C, et al. Air pollution and emergency room admissions for chronic obstructive pulmonary disease: a 5-year study. Am J Epidemiol 1993;137: White AJ, Gompertz S, Stockley RA. Chronic obstructive pulmonary disease. 6: The aetiology of exacerbations of chronic obstructive pulmonary disease. Thorax. 2003;58: Monso E, Ruiz J, Rosell A, et al. Bacterial infection in chronic obstructive pulmonary disease. Am J Crit Care Med 1995;152: Fagon JY, Chastre J, Trouillet JL, et al. Characterization of distal bronchial microflora during acute exacerbation of chronic bronchitis. Am Rev Respir Dis 1990;142: Pela R, Marchesani F, Agostinelli C, et al. Airways microbial flora in COPD patients in stable clinical conditions and during exacerbations: a bronchoscopic investigation. Monaldi Arch Chest Dis 1998;53: Soler N, Torres A, Ewig S, et al. Bronchial microbial patterns in severe exacerbations of chronic obstructive pulmonary disease (COPD) requiring mechanical ventilation. Am J Respir Crit Care Med 1998;157(5 Pt 1): Zalacain R, Sobradillo V, Amilibia J, et al. Predisposing factors to bacterial colonization in chronic obstructive pulmonary disease [see comments]. Eur Respir J 1999;13: Riise GC, Larsson S, Larsson P, et al. The intrabronchial microbial flora in chronic bronchitis patients: a target for N-acetylcysteine therapy? Eur Respir J 1994;7: Patel IS, Seemungal TA, Wilks M, et al. Relationship between bacterial colonisation and the frequency, character, and severity of COPD exacerbations. Thorax 2002;57: Sethi S, Maloney J, Grove L, et al. Airway inflammation and bronchial bacterial colonization in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;173: Miravitlles M, Espinosa C, Fernandez-Laso E, et al. Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD. Study Group of Bacterial Infection in COPD. Chest 1999;116: Bogaert D, van der Valk P, Ramdin R, et al. Host-pathogen interaction during pneumococcal infection in patients with chronic obstructive pulmonary disease. Infect Immun 2004;72: Eller J, Ede A, Schaberg T, et al. Infective exacerbations of chronic bronchitis: relation between bacteriologic etiology and lung function. Chest 1998;113: Sethi S, Muscarella K, Evans N, et al. Airway inflammation and etiology of acute exacerbations of chronic bronchitis. Chest 2000;118: Soler N, Ewig S, Torres A, et al. Airway inflammation and bronchial microbial patterns in patients with stable chronic obstructive pulmonary disease. Eur Respir J 1999;14: Hill AT, Campbell EJ, Hill SL, et al. Association between airway bacterial load and markers of airway inflammation in patients with stable chronic bronchitis. Am J Med 2000;109: Bresser P, Out TA, van Alphen L, et al. Airway inflammation in nonobstructive and obstructive chronic bronchitis with chronic haemophilus influenzae airway infection. Comparison with noninfected patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000;162(3 Pt 1): Angrill J, Agusti C, De Celis R, et al. Bronchial inflammation and colonization in patients with clinically stable bronchiectasis. Am J Respir Crit Care Med 2001;164: Sethi S, Evans N, Grant BJ, et al. New strains of bacteria and exacerbations of chronic obstructive pulmonary disease. N Engl J Med 2002;347: Sethi S, Wrona C, Grant BJ, et al. Strain-specific immune response to Haemophilus influenzae in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004;169: Murphy TF, Brauer AL, Grant BJ, et al. Moraxella catarrhalis in chronic obstructive pulmonary disease: burden of disease and immune response. Am J Respir Crit Care Med 2005;172: Sethi S, Sethi R, Eschberger K, et al. Airway bacterial concentrations and exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007;176: White AJ, Gompertz S, Bayley DL, et al. Resolution of bronchial inflammation is related to bacterial eradication following treatment of exacerbations of chronic bronchitis. Thorax 2003;58: Diederen BM, van der Valk PD, Kluytmans JA, et al. The role of atypical respiratory pathogens in exacerbations of chronic obstructive pulmonary disease. Eur Respir J 2007;30: Gump DW, Phillips CA, Forsyth BR, et al. Role of infection in chronic bronchitis. Am Rev Respir Dis 1976;113: Buscho RO, Saxtan D, Shultz PS, et al. Infections with viruses and Mycoplasma pneumoniae during exacerbations of chronic bronchitis. J Infect Dis 1978;137: Seemungal TA, Donaldson GC, Bhowmik A, et al. Time course and recovery of exacerbations in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000;161: Seemungal TA, Harper-Owen R, Bhowmik A, et al. Detection of rhinovirus in induced sputum at exacerbation of chronic obstructive pulmonary disease. Eur Respir J 2000;16: Rohde G, Wiethege A, Borg I, et al. Respiratory viruses in exacerbations of chronic obstructive pulmonary disease requiring hospitalisation: a case-control study. Thorax 2003;58: Seemungal T, Harper-Owen R, Bhowmik A, et al. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164: Papi A, Bellettato CM, Braccioni F, et al. Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med 2006;173: Wilkinson TM, Hurst JR, Perera WR, et al. Effect of interactions between lower airway bacterial and rhinoviral infection in exacerbations of COPD. Chest 2006;129: Wilkinson TM, Donaldson GC, Johnston SL, et al. Respiratory syncytial virus, airway inflammation, and FEV1 decline in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;173: Stockley RA, O Brien C, Pye A, et al. Relationship of sputum color to nature and outpatient management of acute exacerbations of COPD. Chest 2000;117: Gompertz S, O Brien C, Bayley DL, et al. Changes in bronchial inflammation during acute exacerbations of chronic bronchitis. Eur Respir J 2001;17: Soler N, Agusti C, Angrill J, et al. Bronchoscopic validation of the significance of sputum purulence in severe exacerbations of chronic obstructive pulmonary disease. Thorax 2007;62: Stolz D, Christ-Crain M, Morgenthaler NG, et al. Copeptin, C-reactive protein, and procalcitonin as prognostic biomarkers in acute exacerbation of COPD. Chest 2007;131: Hurst JR, Perera WR, Wilkinson TM, et al. Systemic and upper and lower airway inflammation at exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;173:71 8. Information från Läkemedelsverket 3:
50 60. Hurst JR, Donaldson GC, Perera WR, et al. Use of plasma biomarkers at exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;174: Berry DG, Fry J, Hindley CP, et al. Exacerbations of chronic bronchitis treatment with oxytetracycline. Lancet 1960;1: Elmes PC, Fletcher CM, Dutton AA. Prophylactic use of oxytetracycline for exacerbations of chronic bronchitis. Br Med J 1957;2: Elmes PC, King TK, Langlands JH, et al. Value of ampicillin in the hospital treatment of exacerbations of chronic bronchitis. Br Med J 1965;2: Fear EC, Edwards G. Antibiotic regimes in chronic bronchitis. Br J Dis Chest 1962;56: Jorgensen AF, Coolidge J, Pedersen PA, et al. Amoxicillin in treatment of acute uncomplicated exacerbations of chronic bronchitis. A double-blind, placebo-controlled multicentre study in general practice. Scand J Prim Health Care 1992;10: Nicotra MB, Rivera M, Awe RJ. Antibiotic therapy of acute exacerbations of chronic bronchitis. A controlled study using tetracycline. Ann Intern Med 1982;97: Petersen ES, Esmann V, Honcke P, et al. A controlled study of the effect of treatment on chronic bronchitis. An evaluation using pulmonary function tests. Acta Med Scand 1967;182: Pines A, Raafat H, Greenfield JS, et al. Antibiotic regimens in moderately ill patients with purulent exacerbations of chronic bronchitis. Br J Dis Chest 1972;66: Saint S, Bent S, Vittinghoff E, et al. Antibiotics in chronic obstructive pulmonary disease exacerbations. A meta-analysis. Jama 1995;273: Behandling av astma och KOL. En systematisk kunskapssammanställning. Stockholm: Statens beredning för medicinsk utvärdering. 2000;151: Ram FS, Rodriguez-Roisin R, Granados-Navarrete A, et al. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2006;(2):CD Nouira S, Marghli S, Belghith M, et al. Once daily oral ofloxacin in chronic obstructive pulmonary disease exacerbation requiring mechanical ventilation: a randomised placebo-controlled trial. Lancet 2001;358: Allegra L, Blasi F, de Bernardi B, et al. Antibiotic treatment and baseline severity of disease in acute exacerbations of chronic bronchitis: a re-evaluation of previously published data of a placebo-controlled randomized study. Pulm Pharmacol Ther 2001;14: Gompertz S, Bayley DL, Hill SL, et al. Relationship between airway inflammation and the frequency of exacerbations in patients with smoking related COPD. Thorax 2001;56: Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005;26: Fogarty C, de Wet R, Mandell L, et al. Five-day telithromycin once daily is as effective as 10-day clarithromycin twice daily for the treatment of acute exacerbations of chronic bronchitis and is associated with reduced health-care resource utilization. Chest 2005;128: Wilson R, Schentag JJ, Ball P, et al. A comparison of gemifloxacin and clarithromycin in acute exacerbations of chronic bronchitis and long-term clinical outcomes. Clin Ther 2002;24: Wilson R, Allegra L, Huchon G, et al. Short-term and longterm outcomes of moxifloxacin compared to standard antibiotic treatment in acute exacerbations of chronic bronchitis. Chest 2004;125: Nationellt vårdprogram för KOL, version 1.5, Nivå 2, avsnitt [Tillgängligt från: Sapey E, Stockley RA. COPD exacerbations. 2: aetiology. Thorax 2006;61: Information från Läkemedelsverket 3:2008
51 Symtomatisk behandling av hosta i samband med infektioner i luftvägarna Lennart Hansson Sammanfattning Det finns ingen/ringa modern dokumentation av hostläkemedel som fyller kriterier för GCP, varför en del värderingar är baserade på klinisk erfarenhet eller på äldre studier av främst opiatderivat. Eftersom många läkemedel saknar subvention så finns det inte någon anledning för läkemedelsföretagen att göra några studier och många preparat säljs som så kallade OTC (over the counter)-läkemedel eller som naturläkemedel där det inte finns krav på visad effekt. För slemlösande medel saknas evidensbaserade studier vad gäller klinisk effekt. Vid torrhosta har man även börjat ifrågasätta de kliniska studierna för centralt verkande hostdämpande läkemedel. Att det föreligger klinisk (subjektiv) effekt är otvetydigt, men det är fullt möjligt att det bara är placeboeffekt. Det är ändå rimligt att man använder sin läkekonst och förskriver hostläkemedel med omdöme. Behandlingsförslag vid hosta i samband med luftvägsinfektioner Torrhosta i samband med luftvägsinfektion ingen hostdämpande behandling. Slemhosta vid luftvägsinfektion ingen behandling med slemlösande farmaka. Besvärlig långvarig postinfektiös torrhosta etylmorfin alt. inhalationssteroider kan prövas. Inledning Hosta är sannolikt det vanligaste symtomet vid luftvägssjukdomar och är mycket vanligt i samband med akuta infektioner i övre och nedre luftvägar. Hosta har många andra underliggande orsaker och förekommer vid många sjukdomstillstånd i luftvägarna. Hosta utlöses via mekanisk och/eller kemisk stimulering i luftvägarna och är en viktig reflex som skyddar lungor och luftvägar. Hosta kan dessutom medverka till att sprida luftvägsinfektioner. Det finns ingen definition på patologisk hosta, eftersom det är ett helt och hållet subjektivt symtom och därmed svårvärderat. Relationen mellan subjektiva symtom och objektiva fynd är dessutom oklar. Individer kan ha en besvärande hosta, vilket omgivningen uppfattar, utan att man själv anger symtom och vise versa: få hoststötar men uttalade besvär. Enligt diagnosreceptundersökningen 2000 förekom hosta som symtom eller diagnos i öppen vård hos 2,0 %, astma hos 2,5 % samt bronkit hos 1,1 % av alla patienter, men man kunde då inte särskilja akuta och kroniska symtom (1). I epidemiologiska studier anges prevalensen för (kronisk) hosta till 3 30 % hos vuxna icke-rökare (2), men siffrorna är säkert i underkant eftersom välkontrollerade epidemiologiska studier pekar mot en prevalens på cirka 10 % i Sverige (3). Denna översikt kommer att fokusera på behandling av hosta vid luftvägsinfektioner. Fysiologi och patofysiologi De underliggande patofysiologiska mekanismerna bakom hosta är inte kända. Den vanligaste teorin (främst vid torrhosta) är uppreglering av hostreflexen via påverkan på postulerade hostreceptorer, afferenta nervbanor eller via centrala mekanismer (4). I en pro- spektiv studie hos friska individer som följdes över tid uppkom en ökad känslighet för inhalerat kapsaicin i samband med luftvägsinfektion vilket tolkats som en ökad känslighet i sensoriska nerver (5). Hostreceptorer har histologiskt inte kunnat påvisas, men det antas att de sensoriska nervändslut, som ofta återfinns ytligt i slemhinnan, fyller denna funktion. Studier under senare år har påvisat en kapsaicin-receptor (typ 1 vanilloid-receptor) som möjligen kan vara den länge sökta host-receptorn (6). Motsvarande receptor har visat sig vara mediatorer av smärta i huden. Mekanismen vid slemhosta sker sannolikt även via påverkan på receptorer, men även volym, slemproduktion, konsistens och cilieaktivitet påverkar. Den efferenta delen av hostreflexen medieras via n. vagus, n. laryngeus superior (stänger glottis), n. phrenicus och spinala motornerver och är betydligt mer välundersökt än den afferenta (7), men är inte tillgänglig för farmakologisk terapi åtminstone vid akuta tillstånd. Akut hosta vid luftvägsinfektioner De flesta övre och nedre luftvägsinfektioner (virala övre luftvägsinfektioner, akuta bronkiter och pneumonier) kan ge upphov till besvärande hosta. Hosta relaterat till luftvägsinfektioner är sällan något diagnostiskt problem då den åtföljs av andra symtom (snuva, feber, allmän sjukdomskänsla, sjukdom i omgivningen). Om bakteriell infektion föreligger får antibiotika övervägas. Det är dock ytterst vanligt att patienter söker läkare på grund av hostan i sig då den upplevs som besvärande. Hostan kan vara torr eller medföra en ökad slemproduktion orsakad av den inflammation som uppkommer i samband med infektionen. Luftvägsinfektioner medför även en ospecifik ökad bronkiell reaktivitet som normaliseras efter cirka Information från Läkemedelsverket 3:
52 sex veckor (8). Ofta önskar/insisterar patienten på behandling och det förskrivs stora mängder slemlösande och hostdämpande medel på vida indikationer. Kvarstående hosta efter luftvägsinfektion postinfektiös hosta Kvarstående, så kallad postinfektiös (ofta postviral) hosta, förekommer vid % av alla luftvägsinfektioner. Den brukar definieras som hosta som kvarstår mer än tre veckor efter en luftvägsinfektion (9). Postinfektiös hosta pågår definitionsmässigt i högst åtta veckor, visar normal lungröntgen och går spontant i regress. Tillståndet orsakas sannolikt av inflammation, slemhinneskada och uppreglering av själva hostreflexen. En del patienter har återkommande långdragen hosta efter luftvägsinfektioner och benägenheten för detta tilltar med ökande ålder. Hos vissa patienter glider symtomen över i kronisk hosta, som definieras som hosta som varar mer än åtta veckor. Symtomatisk behandling värdering av effekt Torrhostan är teoretiskt enkel att behandla då principen är att minska antalet hostor, men för slemhosta ska man lösa upp slemmet, göra det lättare att hosta upp och samtidigt minska den besvärande hostan. De flesta hostdämpande läkemedel är ursprungligen studerade i olika djurmodeller. Humana studier av hostdämpande läkemedel har använt några olika metoder. Objektiva om än omständliga sätt att värdera hosta är att räkna antalet, registrera dem via bandspelare eller andra indirekta hjälpmedel som EMG. Subjektiva mått via VAS-skalor eller via enkäter, till exempel Leicester Cough Questionnaire, är vanligt i många studier (10). Sedan 1950-talet har man använt experimentellt inducerad hosta, via till exempel ammoniak (11), citronsyra (12) och kapsaicin (13), för att studera hostreflexen och värdera nya läkemedel. Det finns ingen etablerad metod för att bedöma mukolytisk effekt i kliniska studier och därför blir det oftast subjektiva mått eller ersättningsmått som till exempel lungfunktion som används för att beskriva effekt. Behandling av torrhosta Sammanfattning hostdämpande läkemedel Indikationen för användning hostdämpande läkemedel baserade på morfin och med centralverkande effekt är tveksam från ett evidensbaserat perspektiv och en tämligen stor del av effekten är sannolikt placeborelaterad i kombination med en påtaglig sedation främst hos barn (se nedan under placebo). Dock tyder en stor klinisk erfarenhet på effekt vid torrhosta (Evidensgrad 5). I. Läkemedel med effekt på receptorer/slemhinna Bronkvidgare/slemhinneavsvällande läkemedel beta- 2-agonist/efedrin Beta-2-stimulerare (inandat eller som oral lösning) har ofta använts som ospecifikt hostläkemedel både hos vuxna och barn. Bakgrunden är en hypotes från 1960-talet där man ansåg att hostreflexen primärt utlöstes av glatt bronkmuskelkontraktion (14) och hostreceptorer skulle enligt denna teori exciteras av mekanisk deformering av bronkväggen och bronkdilaterande läkemedel skulle därmed ha hostdämpande effekt. Det är klart visat att hostreflexen är oberoende av bronkmuskeltonus och att hosta och reflexogen bronkmuskelkontraktion är två skilda reflexer hos friska personer. Förhållandet är något mer oklart vid astma men effekten är sannolikt inte enbart medierad via bronkmuskelrelaxation (15,16). Det finns flera studier på både barn och vuxna med akut bronkit/ akut hosta samt en Cochraneanalys som visar att det saknas hostdämpande effekt av beta-2-agonister (Evidensgrad 1a) (17). Beta-2-stimulerare har effekt vid hosta endast då det föreligger en underliggande astma (18). I Sverige finns flera hostläkemedel som innehåller efedrin (Mollipect, 1 mg/ml och Lepheton 2,05 mg/ml), som utöver bronkvidgande effekt har en ospecifik adrenerg effekt och därmed ska verka slemhinneavsvällande. Detta har man på teoretiska grunder hävdat skall ha effekt på ödem i luftvägarna på små barn i samband med luftvägsinfektioner. Någon modern dokumentation för efedrins effekt på hosta finns inte och Mollipect förlorade dessutom sin tidigare subvention vid genomgången av Läkemedelsförmånsnämnden (LFN) Det finns ingen indikation för att använda bronkvidgande farmaka som symtomatisk behandling av hosta vid akuta luftvägsinfektioner annat än för behandling av underliggande astma. Antikolinergikum Inhalerat oxitropiumbromid visade ingen effekt vid hosta i samband med akut övre luftvägsinfektion (19) och några ytterligare studier vid akut hosta föreligger inte. I en mindre kontrollerad studie (14 patienter) med postinfektiös hosta kunde man påvisa hostdämpande effekt av inhalerat ipratropiumbromid, men detta gavs i hög dos (80 µg 4) (20). Ipratropiumbromid har även visat hostreducerande effekt på patienter med kronisk bronkit (21), men detta kunde inte verifieras i en stor studie av inhalerat tiotropium på 470 patienter med kroniskt obstruktiv lungsjukdom (22), vilket talar emot att effekten är medierad via en antikolinerg mekanism. I avsaknad av ytterligare studier rekommenderas inte behandling med antikolinergika vid akuta luftvägsinfektioner (Evidensgrad 1b). 52 Information från Läkemedelsverket 3:2008
53 Inhalationssteroider Det finns inga publicerade studier på inhalationssteroider i samband med akuta luftvägsinfektioner hos i övrigt friska individer. Det finns en mindre studie som visade hostdämpande effekt av inhalerat budesonid hos patienter med postinfektiös hosta (23) och ytterligare en studie på patienter med hosta mer än två veckor, där inhalerat flutikason gav en mindre, men statistiskt signifikant, hostdämpande effekt, men endast hos icke-rökare (24). Inhalationssteroider har ingen indikation vid akut hosta, men kan övervägas vid långdragen kvarstående hosta efter luftvägsinfektioner (Evidensgrad 1b vid postinfektiös hosta). Inhalerad lokalanestesi Den kliniskt mest effektiva behandlingen av torrhosta är lokalanestesi som verkar via påverkan på hostreceptorer alternativt afferenta nerver, vilket utnyttjas i samband med bronkoskopier. Inhalerad lokalanestesi i nebuliseringsform kan användas vid långdragen handikappande hosta, till exempel Xylocain mg 3 4, men inhalation måste ske efter måltid och patienten får sedan inte äta på två timmar och behandling bör ske via specialist med vana. Den begränsande faktorn är smaken och den uttalade bedövningen av hela munnen. Det finns en del studier och patientfall i litteraturen med mycket god effekt av nebuliserat lokalbedövningsmedel (25 27), men behandlingen kan endast användas vid selekterade fall (Evidensgrad 4) och är inte applicerbar vid akut hosta. II. Läkemedel med effekt på centrala nervsystemet Morfinpreparat Läkemedel baserat på morfin har under många decennier varit grunden för behandling med hostdämpande läkemedel och kodein (introducerat 1832) har varit gold standard (28). Det finns ganska många dubbelblinda och placebokontrollerade studier från främst 50- och 60-talet där man anger god klinisk effekt (29). I en översikt från 2007 gjordes en genomgång av studier på kodein där man, främst baserat på nyare studier, ifrågasätter kodeinets effekt både vid akut och vid kronisk hosta av olika genes (30 34) (Evidensgrad 1 b för avsaknad av effekt). Detta medför ett mycket stort problem med tolkningen av många äldre studier, då kodein ofta använts som referenssubstans. I Sverige används kodein i mycket begränsad omfattning som hostdämpande läkemedel på grund av biverkningar och risk för missbruk och förskrivning kräver dessutom särskild receptblankett. Noskapin har i äldre studier ansetts ha likvärdig hostdämpande effekt som kodein (35) men någon modern invändningsfri dokumentation finns inte (Evidensgrad 5). Det finns ytterst få vetenskapliga studier på rent morfin som hostdämpande läkemedel men en dubbelblind och placebokontrollerad studie från 2007 visade hostdämpande effekt av morfin vid kronisk hosta (36). Studier av morfin vid akut hosta finns inte publicerade. De kanske mest använda/förskrivna hostdämpande läkemedlen är Cocillana-etyfin som innehåller etylmorfinhydroklorid och dessutom senega- och cocillanaextrakt samt Lepheton som även innehåller efedrin (se ovan). Cocillana-etyfin innehåller betydligt mer etylmorfin än Lepheton (2,5 mg/ml jämfört med 0,82 mg/ml). Många patienter anger en mycket god klinisk effekt av etylmorfin, men det finns ingen vetenskaplig dokumentation på etylmorfin, inte ens i äldre litteratur (Evidensgrad 5). Det är svårt att hitta uppgifter om ekvipotens för morfin kontra etylmorfin, men det anses att etylmorfin är mer potent än kodein men mindre potent än morfin. I läroböcker anges att etylmorfin har samma hostdämpande effekt som kodein respektive morfin, men det saknas hänvisning till studier (29,35). Ett observandum är att inget av preparaten ska ges till barn under två år. Inget av preparaten kräver förskrivning via särskild receptblankett trots doserna av etylmorfin. Desentol (difenhydramin) Desentol förskrivs ofta vid hosta, inte minst i kombination med Lepheton (kombinationsmöjligheterna uttrycks mycket tydligt i FASS för båda preparaten). Desentol är en histaminantagonist med uttalad sedativ effekt och som även uppges ha antikolinerg effekt. Det har indikationen allergiska tillstånd, men hamnar av oklar anledning under hostläkemedel i FASS. Äldre studier har visat viss hostdämpande effekt vid kronisk hosta (37), men det har inte kunnat upprepas i nyare studier på barn vid övre luftvägsinfektioner (38) och en Cochraneanalys av difenhydramin vid kikhosta visar avsaknad av effekt (Evidensgrad 1b) (39). Sannolikt bidrar den sederande effekten till dess popularitet, det vill säga barnet somnar och vaknar mindre ofta på grund av hostan. Man har ansett att första generationens antihistaminer med större antikolinerg effekt skulle ha en bättre hostdämpande effekt, vilket skulle vara relaterat till effekt på slemhinnan i näsan, det vill säga mindre postnasalt dropp (28). Det finns ingen dokumentation på kombinationen Desentol och Lepheton och effekten är rimligen addering av två uttalat sederande läkemedel (Evidensgrad 5). Kombinationen förlorade subventionen vid genomgång av LFN och dess popularitet kommer sannolikt att minska som konsekvens av detta. Andra centralt verkande läkemedel Pentoxyverin (ingår i Toclase) anges vara ett icke-narkotiskt och icke-sederande hostdämpande läkemedel med central effekt. I äldre djurstudier anges likvärdig effekt med kodein och dextrometorfan. Ingen hostdämpande effekt visades i en provokationsstudie med kapsaicin på patienter med långdragen hosta och några övriga kliniska studier är inte genomförda (2) och det finns inget stöd för användning vid akut hosta (Evidensgrad 5). Information från Läkemedelsverket 3:
54 Behandling av slemhosta Vid tillstånd med mukös hypersekretion är syftet med hostan att föra bort slemmet. Detta kan underlättas genom att påverka mukociliära faktorer, till exempel i form expektorantia genom att öka volymen alternativt att minska produktionen, ändra konsistensen eller påverkan på ciliefunktionen. Acetylcystein brustablett De hypotetiska effekterna för acetylcystein är: 1) att fungera som slemlösare 2) förhindra exacerbationer vid KOL och 3) påverka lungfunktionen vid KOL. Indikationen enligt FASS är kronisk bronkit, men hänför sig sannolikt mer till begreppet kronisk bronkit med emfysem, det som vi numera benämner KOL (kroniskt obstruktiv lungsjukdom). In vitro är acetylcystein en utmärkt slemlösare, men någon slemlösande effekt har aldrig visats i några invändningsfria kliniska studier. I FASS-texten till Mucomyst (finns inte längre på marknaden) anges dessutom Koncentrationen av acetylcystein i luftvägarna efter oral tillförsel av acetylcystein är troligen för låg för att utöva någon mukolytisk effekt. De studier som finns är av äldre datum och patientgrupper och diagnoser är svåra att värdera. En del studier är öppna och innehåller ingen placeboarm och andra är alltför små. Det finns inga studier på acetylcystein gjorda på i övrigt friska personer med slemhosta i samband med luftvägsinfektioner. Den kvarstående indikationen för acetylcystein skulle vara att förhindra exacerbationer vid KOL, men det kräver att man tar preparatet kontinuerligt under minst tre månader och inte vid behov som annars är ytterst vanligt. Det finns några placebokontrollerade studier på upp till 200 patienter från 1980-talet som visade färre exacerbationer, färre dagar med antibiotika eller färre sjukdagar (40 42). En metaanalys från 2000 (43) och en Cochraneanalys från 2006 (44) menar att det finns förebyggande effekt vid kontinuerlig behandling (Evidensgrad 1b). Detta motsägs av en stor och väl genomförd studie (BRONCUS), som inte kunde verifiera fynden annat än vid subgruppsanalys, där en mindre grupp som inte erhöll inhalationssteroider förbättrades (45). Allt fler patienter med svår KOL och exacerbationer behandlas numera med inhalationssteroider och därmed uteblir eventuellt den tidigare effekten. Man har även haft stora förhoppningar om att en förmodad antioxidativ effekt av acetylcystein skulle kunna förhindra lungfunktionsförsämring vid KOL, men detta kunde inte visas i BRONCUS-studien (45). Acetylcystein har ingen indikation vid slemhosta vid akuta luftvägsinfektioner. Bromhexin Bromhexin ingår i Bisolvon och Mollipect. Det finns viss dokumentation av effekt både på hosta och minskad sputumvolym vid astma och KOL, men dessa studier är av äldre datum och i vissa studier har man använt betydligt högre doser än de rekommenderade doserna enligt FASS eller kombinerat preparatet med antibiotika (46 48). Det finns samtidigt ett flertal studier utan effekt (28,49 51). Det föreligger enstaka studier vid akut luftvägsinfektion, men med tveksam uppläggning och svårtolkade resultat. Sammantaget finns ingen modern dokumentation som stödjer användandet av bromhexin vid akuta luftvägsinfektioner. Ambroxol Detta är en metabolit till bromhexin och ingår i Mucoangin. Äldre studier på mucociliärt clearance har inte visat någon effekt (52). Guafenisin Guafenisin finns i Resyl och Exolyt (innehåller även ammoniumklorid och klorcyklizin) som båda saknar läkemedelssubvention. Det finns två publicerade kontrollerade studier med motsägande resultat (53,54) och samtliga studier är av äldre datum och någon modern invändningsfri dokumentation föreligger inte. Ammoniumklorid Ingår i Quilla som inte har någon subvention och det finns ingen vetenskaplig dokumentation på ammoniumklorid. Övriga läkemedel/behandlingar Klorcyklizin Klorcyklizin är ett antihistamin som ingår i Exolyt. Det finns inga vetenskapliga studier genomförda med denna substans vid hosta. I litteraturen förekommer några rapporter om klorcyklazin men då endast i samband med biverkningar. I andra länder förekommer preparatet i kombination med morfin. Placebo Det finns flera väl genomförda studier som visar god hostdämpande effekt (> 50 % reduktion) av det undersökta läkemedlet (31,55), men som inte skiljer sig statistiskt från placebo. Vid genomgång av åtta placebokontrollerade studier på hosta vid akuta övre luftvägsinfektioner beräknades att 85 % av den hostdämpande effekten kunde tillskrivas placebo medan endast 15 % var relaterat till det aktiva läkemedlet (56) (Evidensgrad 2 b för placeboeffekt). En genomgång av endast placeboeffekten undersöktes i en grupp patienter med övre luftvägsinfektion, där hälften erhöll vitamin E (som beskrevs som aktivt hostdämpande läkemedel) och övriga patienter ingen behandling. I vitamingruppen reducerades hostan med 50 % men den obehandlade gruppen hade väsentligen oförändrad hosta. Detta togs som belägg för den stora placeboeffekten, som anses förklara en stor del av den hostdämpande effekten hos många läkemedel. En hypotes är att man frisätter endogena opioider med verkan på ett central hostcentrum, men eftersom man har svårt att påvisa någon hostdämpande effekt 54 Information från Läkemedelsverket 3:2008
55 av centralt verkande läkemedel, är det möjligt att placeboeffekten medieras på annat sätt (56). Sockerlösliga/etanol Många hostläkemedel innehåller socker och etanol och det finns studier som anger att just sockerinnehållet skulle kunna medföra en hostdämpande effekt (16). Apoteket tillhandahåller flera mixturer (till exempel Timjanssirap, Bröstdroppar), men det finns ingen vetenskaplig dokumentation varken vid akut eller kronisk hosta. Referenser 1. Svensk läkemedelsstatistik Apoteket AB Hansson L. The human cough reflex in health and disease. A role for sensory hyperresponsiveness in patients with chronic cough. (avhandling). Lund: Lunds Universitet; Lundbäck B. Asthma, chronic bronchitis and respiratory symptoms: prevalence and important determinants. The obstructive lung disease in northern Sweden study I. (avhandling). Umeå; Umeå Universitet; Canning BJ. Anatomy and neurophysiology of the cough reflex: ACCP evidence-based clinical practice guidelines. Chest 2006;129: O Connell F, Thomas VE, Studham JM, et al. Capsaicin cough sensitivity increases during upper respiratory infection. Respir Med 1996;90: Morice AH, Geppetti P. Cough 5: The type 1 vanilloid receptor: a sensory receptor for cough. Thorax 2004;59: Leith DE, Butler JP, Sneddon SL, et al. Cough. In: Handbook of physiology. The Respiratory System. The respiratory system: mechanics of breathing. Section 3. Vol III, pt 1. Bethesda, MD: Am Physiol Soc 1986: Empey DW, Laitinen LA, Jacobs L, et al. Mechanisms of bronchial hyperreactivity in normal subjects after upper respiratory tract infection. Am Rev Respir Dis 1976;113: Braman SS. Postinfectious cough: ACCP evidence-based clinical practice guidelines. Chest 2006;129: Birring SS, Prudon B, Carr AJ, et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester Cough Questionnaire (LCQ). Thorax 2003;58: Höglund NJ, Michaëlsson M. A method for determining the cough threshold with some preliminary experiments on the effect of codeine. Acta Physiol Scand 1950;21: Bickerman BH, Cohen BM, German E. The cough response of normal human subjects stimulated experimentally by citric acid aerosol: alterations produced by antitussive agents. Am J Med Sci 1956;232: Collier JG, Fuller RW. Capsaicin inhalation in man and the effects of sodium cromoglycate. Br J Pharmacol 1984;81: Salem H, Aviado DM. Antitussive drugs with special reference to a new theory for the initiation of the cough reflex and the influence of bronchodilators. Am J Med Sci 1964;247: Karlsson J-A, Sant Ambrogio G, Widdicombe J. Afferent neural pathways in cough and reflex bronchoconstriction. J Appl Physiol 1988;65: Fuller RW, Jackson DM. Physiology and treatment of cough (editorial). Thorax 1990;45: Smucny J, Flynn C, Becker L, et al. Beta2-agonists for acute bronchitis. Cochrane Database Syst Rev 2004;(1):CD Fujimura M, Kamio Y, Hashimot T et al. Cough receptor sensitivity and bronchial responsiveness in patients with only chronic nonproductive cough: in view of effect of bronchodilator terapy. J Asthma 1994;31: Lowry R, Wood A, Higenbottam T. The effect of anticholin- ergic bronchodilator therapy on cough during upper respiratory tract infections. Br J Clin Pharmacol 1994;37: Holmes PW, Barter CE, Pierce RJ. Chronic persistent cough: use of ipratropium bromide in undiagnosed cases following upper respiratory tract infection. Respir Med 1992;86: Ghafouri MA, Patil KD, Kass I. Sputum changes associated with the use of ipratropium bromide. Chest 1984; 86: Casaburi R, Briggs DD, Donohue JF, et al. The spirometric efficacy of once-daily dosing with tiotropium in stable COPD. Chest 2000;118: Pornsuriyasak P, Charoenpan P, Vongvivat K, et al. Inhaled corticosteroid for persistent cough following upper respiratory tract infection. Respirology 2005;10: Ponsioen BP, Hop WC, Vermue NA, et al. Effiacy of fluticasone on cough: a randomised controlled trial. Eur Respir J 2005;25: Hansson L, Midgren B. Karlsson JA. Effects of inhaled lignocaine and adrenaline on capsaicin-induced cough in humans. Thorax 1994;49: Udezue E. Lidocaine inhalation for cough suppression. Am J Emerg Med 2001;19: Trochtenberg S. Nebulized lidocaine in the treatment of refactory cough. Chest 1994;105: Bolser, DC. Cough suppressant and pharmacologic protussive therapy: ACCP evidence-based clinical practice guidelines. CHEST 2006;129: Cough. Raven Press New York eds Braga PC, Allergra L. Bolser DC, Davenport PW. Codeine and cough: an ineffective gold standard. Curr Opin Allergy Clin Immunol 2007;7:32 6. Eccles R, Morris S, Jawad M. Lack of effect of codeine in the treatment of cough associated with acute upper respiratory tract infection. J Clin Pharm Ther 1992;17: Freestone C, Eccles R. Assessment of the antitussive efficacy of codeine in cough associated with common cold. J Pharm Pharmacol 1997;49: Hutchings HA, Eccles R. The opioid agonist codeine and antagonist naltrexone do not affect voluntary suppression of capsaicin induced cough in healthy subjects. Eur Respir J 1994;7: Smith J, Owen E, Earis J, et al. Effect of codeine on objective measurement of cough in chronic obstructive pulmonary disease. J Allergy Clin Immunol 2006;117: Ziment I. Respiratory Pharmacology and Therapeutics, Saunders Morice AH, Menon MS, Mulrennan SA, et al. Opiate therapy in chronic cough. Am J Respir Crit Care Med 2007;175: Lilienfield LS, Rose JC, Princiotto JV. Antitussive activity of diphenhydramine in chronic cough. Clin Pharmacol Ther 1976;19(4): Paul IM, Yoder KE, Crowell KR, et al. Effect of dextromethorphan, diphenhydramine, and placebo on nocturnal cough and sleep quality for coughing children and their parents. Pediatrics 2004;114: Pillay V, Swingler G. Symptomatic treatment of the cough in whooping cough. Cochrane Database Syst Rev 2003;(4):CD Boman G, Backer U, Larsson S, et al. Oral acetylcysteine reduces exacerbation rate in chronic bronchitis: report of a trial organized by the Swedish Society for Pulmonary Diseases. Eur J Respir Dis 1983;64: Oral N-acetylcysteine and exacerbation rates in patients with chronic bronchitis and severe airways obstruction. British Thoracic Society Research Committee. (No authors listed) Thorax 1985;40: Rasmussen JB, Glennow C. Reduction in days of illness after long-term treatment with N-acetylcysteine controlled-release tablets in patients with chronic bronchitis. Eur Respir J 1988;1: Information från Läkemedelsverket 3:
56 Grandjean EM, Berthet P, Ruffmann R, et al. Efficacy of oral long-term N-acetylcysteine in chronic bronchopulmonary disease: a meta-analysis of published double-blind, placebocontrolled clinical trials. Clin Ther 2000;22: Poole PJ, Black PN. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev ;3:CD Decramer M, Rutten-van Molken M, Dekhuijzen PN, et al. Effects of N-acetylcysteine on outcomes in chronic obstructive pulmonary disease (Bronchitis Randomized on NAC Cost-Utility Study, BRONCUS): a randomised placebo-controlled trial. Lancet 2005;365(9470): Lal S, Bhalla KK. A controlled trial of bromhexine ( Bisolvon ) in out-patients with chronic bronchitis. Curr Med Res Opin 1975;3(2):63 7. Heilborn H, Pegelow K-O, Odeblad E. Effect of bromhexine and guaiphenesine on clinical state, ventilatory capacity and sputum viscosity in chronic asthma. Scand J Resp Dis 1976;57: Valenti S, Marenco G. Italian multicenter study on the treatment of chronic obstructive lung disease with bromhexine. A double-blind placebo-controlled trial. Respiration 1989;56: Mossberg B, Philipson K, Strandberg K, et al. Clearance by voluntary coughing and its relationship to subjective assessment and effect of intravenous bromhexine. Eur J Respir Dis 1981; 62: Olivieri D, Ciaccia A, Marangio E, et al. Role of bromhexine in exacerbations of bronchiectasis. Double-blind randomized multicenter study versus placebo. Respiration 1991;58: Thompson KJ, Reeve J. A clinical trial of bromhexine. N Z Med J 1972;76: Houtmeyers E, Gosselink R, Gayan-Ramirez G, et al. Effects of drugs on mucus clearance. Eur Respir J 1999;14: Robinson R, Cummings WB, Deffenbaugh ER. Effectiveness of guaifenesin as an expectorant: a cooperative double-blind study. Curr Ther Res 1977;22: Kuhn JJ, Hendley JO, Adams KF, et al. Antitussive effect of guaifenesin in young adults with natural colds: objective and subjective assessment. Chest 1982;82: Lee PC, Jawad MS, Hull JD, et al. The antitussive effect of placebo treatment on cough associated with acute upper respiratory infection. Psychosom Med 2005;67: Eccles R. The powerful placebo in cough studies? Pulm Pharmacol Ther 2002;15: Kvalitetsgradering av evidens (efter NHS Research and Developement, 1999; 1 a Systematisk analys av randomiserade kontrollerade studier med homogenicitet 1 b Minst en stor randomiserad kontrollerad studie 1 c Allt eller intet uppfylls när alla patienter dog innan behandlingen blev tillgänglig men några överlever med behandlingen, eller några överlevde utan behandling men med behandling överlever alla 2 a Systematisk analys av kohortstudier med homogenicitet 2 b Individuella kohortstudier inklusive randomiserade kontrollerade studier med lågt bevisvärde (låg kvalitet, vida konfidensintervall, låg inklusion av vissa subgrupper i en studie etc.) 2 c Utfallsstudier ( Outcomes Research ) 3 a Systematisk analys av fall-kontrollstudier med homogenicitet 3 b Individuella fall-kontrollstudier 4 Fallserier med fall-kontrollstudier och kohortstudier med låg kvalitet 5 Expertsynpunkter utan kritiska analyser eller baserade på fysiologi etc. Gradering av rekommendationer A Baseras på evidensgrad 1a, b eller c B Baseras på evidensgrad 2a, b och c samt 3a och b C Baseras på evidensgrad 4 D Baseras på evidensgrad 5 56 Information från Läkemedelsverket 3:2008
57 Vaccination mot influensa och pneumokocker som prevention mot luftvägsinfektioner Åke Örtqvist Vaccination mot influensa Den enskilt viktigaste åtgärden för att begränsa morbiditet och mortalitet i influensa utgörs av en årlig vaccination av de medicinska riskgrupperna (se Faktaruta 1). Influensavacciner Under influensavaccinationens mer än 50-åriga historia har olika typer av vaccin använts. De som finns på marknaden i Sverige idag är inaktiverade trivalenta split- eller subunitvacciner. Trivalent innebär att vaccinet innehåller två influensa A-stammar (i regel H1N1 och H3N2) samt en influensa B-stam. Vaccinerna framställs genom odling av influensavirus på hönsägg och innehåller 15 µg antigen av vardera influensastam. Vaccinerna ges i en dos till alla över tre års ålder. Till barn mellan sex månader och tre års ålder ges två doser, vardera innehållande halva vuxenvolymen, med minst fyra veckor emellan. Det finns också ett subunitvaccin med tillsatt adjuvans (Fluad) som är godkänt för riskgruppsvaccination av personer över 65 år. Under 2007 godkändes i EU ett inaktiverat trivalent influensavaccin odlat på cellkultur (Optaflu), vilket således kan användas till äggallergiker. Detta vaccin, som är godkänt från 18 års ålder beräknas bli tillgängligt i Sverige under Ett levande försvagat influensavaccin (Flumist) som ges intranasalt finns godkänt i USA för personer mellan 2 49 års ålder. Vaccinet har i studier på barn visats vara mer effektivt än inaktiverade vacciner (1,2) (Evidensgrad 1a), men astmaliknande biverkningar hos de minsta barnen gjorde att det inte godkändes under två års ålder. Immunogenicitet och säkerhet En hemagglutinin-inhiberande (HI) titer på 1:40 efter vaccination är den allmänt använda och accepterade surrogatmarkören för ett adekvat immunsvar på influensavaccin (2). De inaktiverade vaccinerna är väsentligen likvärdiga när det gäller immunogeniciteten och vaccinering med dessa leder till att en titer på 1:40 uppnås hos % av unga friska personer, men oftast inte hos mer än % av äldre personer (3,4,5) (Evidensgrad 1b). Med tillsättning av ett adjuvans, som till exempel i Fluad, kan dock immunogeniciteten förbättras hos äldre personer (6) (Evidensgrad 1b). Ett spännande arbete pågår hos flera fabrikanter med att ta fram nya adjuvans, vilka dels kan förbättra immunogeniciteten och dels verka antigensparande, det vill säga att varje hönsägg räcker till fler vaccindoser än idag. De levande försvagade vaccinerna tycks inte ge lika höga HI-titrar, som de inaktiverade, men ger istället signifikant högre titrar av sekretoriskt IgA i nässlemhinnan (2) (Evidensgrad 1a). Inaktiverade influensavacciner är mycket säkra (7) (Evidensgrad 1a). Systemreaktioner ses inte oftare efter vaccination med aktivt vaccin (< 10 %) än efter injektion av placebo (2) (Evidensgrad 1a), medan lokalreaktioner som ömhet, svullnad och rodnad är vanligare, i cirka % av fallen jämfört med cirka 5 10 % efter placebo (8,9) (Evidensgrad 1b). Årlig revaccinering innebär ingen ökad risk för biverkningar och leder inte heller till sämre immunsvar på sikt, eller sämre skyddseffekt av vaccinet (10,11) (Evidensgrad 1b). Skyddseffekt Unga friska personer I en Cochrane-analys, som utvärderade 25 randomiserade studier med totalt nästan personer i åldrarna14 70 år, fann man att skyddseffekten av inaktiverat influensavaccin mot serologiskt verifierad influensa var 70 % (95 % KI 56 80) (7) (Evidensgrad 1a). För klinisk influensa var effekten mycket sämre, bara 15 % (95 % KI 8 21), vilket dock inte är förvånande med tanke på att många olika virus kan Faktaruta 1. Socialstyrelsens föreskrift avseende influensavaccination (SOSFS 1997:21). Det är Socialstyrelsens mening att vaccination mot influensa är av värde för följande grupper: 1. Patienter med kronisk hjärt- och/eller lungsjukdom; i synnerhet de med hjärtsvikt och nedsatt lungfunktion. 2. Personer över 65 års ålder. Indikationen ökar med stigande ålder och vid underliggande kronisk sjukdom. Även patienter med andra kroniska sjukdomar, som instabil diabetes mellitus eller gravt nedsatt infektionsförsvar (av sjukdom eller medicinering), kan rekommenderas vaccination mot influensa, men värdet av vaccinationen är ej lika väl dokumenterat som för de ovan nämnda grupperna. Personer med risk för allvarligt influensaförlopp bör vaccineras årligen. Vaccinet ges i god tid inför kommande influensasäsong vanligen under oktober månad. Information från Läkemedelsverket 3:
58 87 % (95 % KI 39 97) och den totala dödligheten med 78 % (95 % KI 39 92) (17) (Evidensgrad 2b). Äldre personer, 65 år Det finns bara en randomiserad dubbelblind studie av hög kvalitet utförd på denna patientgrupp (18) (Evidensgrad 1b). Denna holländska studie på cirka äldre personer visade att influensavaccin skyddar mot såväl serologisk som klinisk influensa till cirka 50 %, men var inte dimensionerad för att bedöma skyddet mot influensakomplikationer eller död. Ett stort antal observationella studier har dock adresserat just dessa frågor och dessa finns sammanfattade i tre olika metaanalyser (19,20,21) (Evidensgrad 2a). Den senaste av dessa (20) inkluderar 64 olika studier med totalt flera miljoner patienter. Trots relativt stora skillnader mellan när och hur de tre metaanalyserna genomfördes, uppvisar de förvånansvärt enhetliga resultat när det gäller skyddet mot komplikationer till influensasjukdomen hos äldre personer, med ett skydd på % mot pneumoni och sjukhusvård för influensa och pneumoni och ett procentigt skydd mot död oavsett orsak (Tabell I). Liknande resultat, med cirka 30 % reduktion av behoven av sjukhusvård för influensa och pneumoni, samt cirka 40 % reduktion av den totala dödligheten, har visats från Stockholms län där alla personer 65 års ålder erbjöds influensa och pneumokockvaccination i en prospektiv kohortstudie under (22,23) (Evidensgrad 2b). Problemet med obsevationella studier är dock, att oavsett hur väl man korrigerar för kända biases, som till exempel ålder och underliggande sjukdomar, så kan risken för komplikation och död skilja sig åt mellan de som väljer att vaccinera respektive inte vacge influensalik sjukdom. Den begränsade skyddseffekten mot klinisk influensa ledde till att frånvaron från arbete/skola endast reducerades med 0,16 dagar (95 % KI 0,04 0,29) hos vaccinerade personer. Vårdpersonal Två kluster-randomiserade studier ger stöd för att influensavaccinering av vårdpersonal reducerar den totala dödligheten hos äldre vårdtagare som långtidsvårdas på sjukhus eller motsvarande (12,13) (Evidensgrad 2b). Två systematiska översikter har bekräftat dessa resultat, även om de ursprungliga studierna har vissa metodologiska problem (14,15). En nyligen presenterad kluster-randomiserad studie innefattande sjukhemspatienter samt patienter som vårdades i hemmet ger stöd för att det är viktigt att vaccinera vårdpersonal mot influensa (16) (Evidensgrad 2b). Denna studie visade en signifikant minskning av influensalik sjukdom, minskat behov av läkarkonsultationer och en minskning av den totala dödligheten i de patientgrupper där vårdpersonalen var influensavaccinerad i högre utsträckning (cirka 50 %) jämfört med de där personalen endast i låg frekvens (cirka 5 %) var vaccinerad. Personer yngre än 65 år men med ökad risk för komplikationer till influensa Det finns inga randomiserade kontrollerade studier som omfattar högriskpatienter yngre än 65 år, men väl några observationella studier. I en stor fall-kontrollstudie från Holland av personer år kunde man visa att influensavaccination, efter justering för olika bakgrundsfaktorer och personernas uppskattade benägenhet att låta vaccinera sig, minskade behovet av att söka husläkare med 26 % (95 % KI 7 47), behovet av sjukhusvård för hjärt-lungsjukdom med Tabell I. Skyddseffekten i procent (95 % KI) av inaktivaterat influensavaccin hos äldre personer. Gross, et al. (1995) (19) Vu, et al. (2002) (21) Jefferson, et al. (2005) (20) Hemmaboende äldre EA * - skydd mot pneumoni EA ES ** - skydd mot behov av sjukhusvård för influensa 33 % (27 38) 27 % (21 33) eller pneumoni - skydd mot död orsakat av influensa eller 47 % (25 62) NS pneumoni - skydd mot död oavsett orsak 50 % (45 56) 47 % (39 54) Institutionsboende äldre EA - skydd mot pneumoni 53 % (35 66) 46 % (30 58) - skydd mot behov av sjukhusvård 50 % (28 65) 45 % (16 64) - skydd mot död orsakat av influensa eller EA 42 % (17 59) pneumoni - skydd mot död oavsett orsak 68 % (56 76) 60 % (23 79) * Ej analyserat i denna studie. ** Ej signifikant skyddseffekt. 58 Information från Läkemedelsverket 3:2008
59 cinera sig mot influensa. För att korrigera för olika benägenhet att låta vaccinera sig kan man jämföra risken för till exempel död under influensasäsong med den under icke influensasäsong. I en analys av hela treårsmaterialet från den ovan nämnda studien från Stockholm visade det sig att skyddet mot död oavsett orsak, som i primäranalysen var % alla tre åren, efter sådan korrektion minskade till 14 % under 1998/1999 (måttlig influensaaktivitet), 19 % under 1999/2000 (måttlig hög influensaaktivitet) och inget alls under den tredje säsongen, 2000/2001, när det nästan inte var någon influensaaktivitet (24). Numbers needed to treat, det vill säga hur många personer som behövde vaccineras för att rädda ett liv under dessa tre influensasäsonger var 297 (95 % KI ), 158 (95 % KI ), och 743 (95 % KI 314- ). Sammanfattningsvis så står det klart att influensavaccin under år när influensa cirkulerar i samhället och den cirkulerande influensastammen/stammarna och vaccinet matchar varandra väl ger äldre personer ett gott skydd mot influensa, komplikationer till influensa som till exempel pneumoni och mot död, även om skyddet är lägre än vad som tidigare varit den gängse uppfattningen. Hälsoekonomi Resultaten från hälsoekonomiska analyser av vaccination av friska unga personer (framför allt från USA) har varierat från en kostnad på upp till 68 dollar per vaccinerad till att vara kostnadsbesparande, vilket åtminstone delvis beror på hur väl vaccinet varit matchat den cirkulerande influensastammen och intensiteten av den aktuella epidemin (25,26,27). Det finns dock inga hälsoekonomiska skäl att rekommendera generell influensavaccination av unga friska vuxna. Hos äldre personer har influensavaccination visats vara kostnadsbesparande (28,29,30) Vaccination mot pneumokocker Pneumokockvacciner Det finns för närvarande två tillgängliga pneumokockvacciner. Ett 23-valent kapselpolysackaridvaccin (23-PV) samt ett 7-valent proteinkonjugerat polysackaridvaccin (7-KPV). 23-PV innehåller 25 µg kapselpolysackaridantigen från vardera av 23 olika pneumokockserotyper (serotyp 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, och 33F), vilka tillsammans orsakar cirka 90 % av all invasiv pneumokocksjukdom (32). Det proteinkonjugerade vaccinet (7-KPV) utvecklades under 1990-talet eftersom rent polysackaridantigen är dåligt immunogent hos små barn (33). Vaccinet innehåller 2 eller 4 µg av de sju ingående serotyperna (serotyp 4, 6B, 9V, 14, 18C, 19F, 23F ), vardera kopplat till ett difteriliknande protein (CRM197). Dessa sju serotyper var de som under tiden för vaccinutvecklingen var vanligast hos små barn i USA och som också oftast var de som associerades med nedsatt känslighet mot penicillin och andra antibiotika. Nya typer av konjugatvacciner, innehållande tio respektive tretton serotyper, är i slutstadiet av kliniska prövningar. Immunogenicitet och säkerhet 23-PV Vaccination av vuxna med 23-PV leder i regel till en bra immunstimulering, även hos äldre personer (34,35,36) (Evidensgrad 2b). En mindre del av äldre och/eller kroniskt sjuka personer svarar dock sämre mot någon eller några av de ingående serotyperna (37,38,39) (Evidensgrad 2b). Det 23-valenta vaccinet måste därför betraktas som 23 vacciner i ett där en person kan svara bra på de flesta serotyperna, men ändå riskera att drabbas av en klinisk infektion med någon av de andra ingående serotyperna (40) (Evidensgrad 2b). Ett serotyp-specifikt IgG-svar korrelerar i regel med ett bra svar i opsono-fagocytostester, det vill säga med ett bra kvalitativt svar, men även här kan äldre personer ibland svara mindre väl (41,42) (Evidensgrad 2b). Efter en primär pneumokockvaccination med 23-PV sjunker antikroppshalten gradvis och når ursprungsnivån någon gång mellan tre till tio år, beroende bland annat på patientens ålder (43,44) (Evidensgrad 2b). Vid en första revaccination svarar äldre patienter något sämre än vid primovaccinationen, men majoriteten får ändå en signifikant antikroppsstegring mot flertalet serotyper (45,46) (Evidensgrad 2b). Vid upprepade revaccinationer har risk för toleransutveckling diskuterats, men den kliniska betydelsen av en eventuell sådan är inte klarlagd (47). Skydds effekten av revaccination finns inte studerad, men en revaccination när det gått fem år rekommenderas för splenektomerade patienter (48) och bör övervägas för övriga grupper som primovaccinerats. Lättare lokalreaktioner är vanligt (hos upp till 50 % av patienterna) efter vaccination med 23-PV, men dessa försvinner i regel inom ett till ett par dygn (45,49) (Evidensgrad 1b). Kraftigare lokalreaktioner, med svullnader > 10 cm i diameter, uppträder i cirka 2 3 % medan systemreaktioner är mycket ovanliga. Efter revaccination är risken för kraftiga lokalreaktioner något ökad och tycks vara relaterad till den kvarstående typspecifika IgG-nivån vid vaccinationstillfället (45,46,50) (Evidensgrad 2b). 7-KPV Hos barn ger det konjugerade vaccinet en mycket god antikroppstegring. Efter tre priming-doser under första levnadsåret (t.ex. vid två, fyra och sex månaders ålder) når närmare 100 % av barnen ett typspecifikt IgG på > 0,35 µg/ml, en nivå som associerats med klinisk skyddseffekt, och en tydlig boostereffekt ses efter en uppföljningsdos vid till exempel månaders ålder (33) (Evidensgrad 1b). Även med två priming-doser (t.ex. vid tre och fem månaders ålder) under första levnadsåret når flertalet barn över den Information från Läkemedelsverket 3:
60 antikroppsnivå som satts i samband med en skyddande effekt (> 0,35 µg/ml) och får samma goda boostersvar vid månaders ålder. Ett mindre antal studier har undersökt immunogeniteten hos vuxna efter vaccination med 7-KPV, såväl hos olika grupper av immunsupprimerade som hos äldre personer. I vissa studier och för vissa serotyper har ett bättre svar setts för 7-KPV än för 23-PV, men det finns inte stöd för att säga att 7-KPV generellt sett leder till en bättre immunstimulering än det rena polysackaridvaccinet hos vuxna (51) (Evidensgrad 2a). Eftersom det hittills inte heller gått att uppmäta någon boostereffekt hos vuxna och 7-KPV endast innehåller just sju serotyper finns i dagsläget ingen anledning att överväga att rekommendera detta vaccin till vuxna. 7-KPV är ett säkert vaccin som ger företrädesvis lokala biverkningar, framför allt sveda vid injektion och ömhet vid vaccinationsstället, i ungefär samma frekvens som andra barnvaccinationer (33) (Evidensgrad 1a). Systemsymtom som trötthet och feber förekommer, liksom sällsynta fall av (feber)kramper, anafylaktisk reaktion och trombocytopeni. Efter mer än 20 miljoner vaccinerade barn i USA finns inga riktigt allvarliga biverkningar rapporterade. Skyddseffekt av 23-PV Skyddseffekten av 23-PV hos vuxna finns utvärderad i åtta systematiska översikter, varav de tre senaste är de mest välgjorda och inkluderar både randomiserade och observationella studier (52,53,54) (Evidensgrad 1a 2a). Unga, friska vuxna Hos unga och friska vuxna skyddar 23-PV till % mot invasiv pneumokockinfektion (IPS) med pneumoni och tycks också ge ett moderat skydd mot non-bakteriemisk pneumokockpneumoni och död i pneumoni (55,56) (Evidensgrad 1b). Dessa data är dock huvudsakligen baserade på studier från Sydafrika och Papua Nya Guinea, gjorda på populationer med mycket hög incidens av pneumokocksjukdom, vilket gör att relevansen för svenska förhållanden är svår att värdera. Äldre och kroniskt sjuka personer Hos äldre personer har två nordiska randomiserade studier indikerat en skyddseffekt på % mot IPS 57,58 (Evidensgrad 1b). Varken dessa, andra randomiserade studier, eller metaanalyser av randomiserade studier har tyvärr haft tillräcklig power för att statistiskt säkerställa en sådan skyddseffekt. Ett flertal observationella studier har dock visat en skyddseffekt mot IPS av samma storleksordning och genom att inkludera dessa i de systematiska översikterna har man övertygande visat att 23-PV har en cirka 50 procentig skyddseffekt mot IPS hos äldre personer (Tabell II) (Evidensgrad 2a). Även de observationella studier som genomförts efter publiceringen av metaanalyserna stöder detta fynd (23,59,60) (Evidensgrad 2b). Metaanalyserna av randomiserade studier har inte visat någon skyddseffekt mot pneumoni NUD eller pneumokockpneumoni. Några nya observationella studier (23,61,62), men inte alla (63), har dock indikerat att vaccinet kan ha en skyddseffekt på % mot pneumoni NUD hos äldre personer (Evidensgrad 2b). De få studier som finns indikerar att 23-PPV har begränsad skyddseffekt hos immunsupprimerade, med undantag av splenektomerade patienter (64,65) (Evidensgrad 2b). Hos patienter med hiv har varierande, men i huvudsak negativa, resultat erhållits (66,67) (Evidensgrad 1b). Skyddseffekt av 7-KPV Stora randomiserade studier har visat att vaccination av barn med 7-KPV ger ett procentigt skydd mot IPS orsakad av någon av de sju ingående serotyperna, samt ett cirka procentigt skydd mot röntgenverifierad pneumoni NUD (68 70) (Evidensgrad 1a). Sedan vaccinationerna infördes i barnvaccinationsprogrammet i USA år 2000 har incidensen av IPS minskat mycket kraftigt, inkluderande också för pneumokocker med nedsatt känslighet för penicillin (71,72,73) (Evidensgrad 2c). Dessa effekter har setts både hos de vaccinerade barnkohorterna och hos äldre barn samt hos vuxna, indikerande en påtaglig flockimmunitet. Dessutom har behovet sjukhusvård Tabell II. Skyddseffekt i procent (95 % KI) av det 23-valenta pneumokockvaccinet mot invasiv pneumokocksjukdom hos äldre personer och/eller hos personer med kroniska underliggande sjukdomar, baserat på två metaanalyser av randomiserade kontrollerade studier och observationella studier. Randomiserade kontrollerade studier (RCT s) RCT s + fallkontrollstudier Fallkontrollstudier Kohortstudier Melegaro and Edmunds, 2004 (54). 44 % ( 45 79) 47 % (30 60) Conaty, et al (52). 49 % ( 23 79) 55 % (44 64) 47 % (19 65) 60 Information från Läkemedelsverket 3:2008
61 för pneumoni NUD i USA minskat signifikant hos både barn under två års ålder samt hos åldersgrupperna år och 65 år, mellan innan vaccinationerna påbörjades 2004 (74). Hälsoekonomi 23-PV Det 23-valenta vaccinet som skydd för IPS har befunnits vara kostnadsbesparande i USA (75) (Evidensgrad 2b). I Europa, där både sjukvårdskostnaderna och den uppmätta incidensen av IPS är betydligt lägre än i USA, har en studie från fem länder visat att vaccinet ger skydd mot IPS hos äldre personer med en medelgod kostnadseffektivitet (76) (Evidensgrad 2b). 7-KPV För det konjugerade pneumokockvaccinet finns två aktuella svenska hälsoekonomiska analyser. Den ena är utförd av IHE på beställning av socialstyrelsen och indikerar att ett allmänt pneumokockvaccinationsprogram i Sverige skulle kunna förhindra ett avsevärt antal infektioner, huvudsakligen akut otitis media, och minska pneumokockrelaterad sjuklighet och dödlighet. Dessa positiva hälsoeffekter kan uppnås inom begreppen måttliga eller låga kostnader per QALY. De känslighetsanalyser som gjordes tydde på att resultatet var stabilt för rimliga förändringar av de ingående förutsättningar som analysen baseras på. En likartad ekonomisk analys för svenska förhållanden, men där man delvis gjort andra uppskattningar av olika ingångsvärden, har nyligen utförts av det brittiska konsultbolaget Forth Hurdle Consulting Limited (4H) i samverkan med vaccintillverkaren Wyeth, som marknadsför det aktuella vaccinet Prevenar (PCV7 model for Sweden. Report number 21_32, submitted 29 July 2007). Denna studie fann att en allmän barnvaccination skulle innebära en mindre nettobesparing. Referenser 1. Belshe RB, Edwards KM, Vesikari T, et al. Live attenuated versus inactivated influenza vaccine in infants and young children. N Engl J Med 2007;356: Beyer WE, Palache AM, de Jong JC, et al. Cold-adapted live influenza vaccine versus inactivated vaccine: systemic vaccine reactions, local and systemic antibody response, and vaccine efficacy. A meta-analysis. Vaccine 2002;20: Bernstein E, Kaye D, Abrutyn E, et al. Immune response to influenza vaccination in a large healthy elderly population. Vaccine 1999;17: Govaert TM, Sprenger MJ, Dinant GJ, et al. Immune response to influenza vaccination of elderly people. A randomized double-blind placebo-controlled trial. Vaccine 1994;12: Iorio AM, Zei T, Neri M, et al. Immunization of elderly volunteers with the inactivated whole influenza vaccine: assessment of antibody responses by haemagglutination inhibition and single radial haemolysis tests. Eur J Epidemiol 1992;8: Squarcione S, Sgricia S, Biasio LR, et al. Comparison of the reactogenicity and immunogenicity of a split and a subunitadjuvanted influenza vaccine in elderly subjects. Vaccine 2003;21: Demicheli V, Rivetti D, Deeks JJ, et al. Vaccines for preventing influenza in healthy adults. Cochrane Database Syst Rev 2004;CD Allsup SJ, Gosney M, Regan M, et al. Side effects of influenza vaccination in healthy older people: a randomised single-blind placebo-controlled trial. Gerontology 2001;47: Govaert TM, Dinant GJ, Aretz K, et al. Adverse reactions to influenza vaccine in elderly people: randomised double blind placebo controlled trial. BMJ 1993;307: Beyer WE, de Bruijn IA, Palache AM, et al. Protection against influenza after annually repeated vaccination: a meta-analysis of serologic and field studies. Arch Intern Med 1999;159: Buxton JA, Skowronski DM, Ng H, et al. Influenza revaccination of elderly travelers: antibody response to single influenza vaccination and revaccination at 12 weeks. J Infect Dis 2001;184: Carman WF, Elder AG, Wallace LA, et al. Effects of influenza vaccination of health-care workers on mortality of elderly people in long-term care: a randomised controlled trial. Lancet 2000;355: Potter J, Stott DJ, Roberts MA, et al. Influenza vaccination of health care workers in long-term-care hospitals reduces the mortality of elderly patients. J Infect Dis 1997;175: Burls A, Jordan R, Barton P, et al. Vaccinating healthcare workers against influenza to protect the vulnerable--is it a good use of healthcare resources? A systematic review of the evidence and an economic evaluation. Vaccine 2006;24: Thomas RE, Jefferson T, Demicheli V, et al. Influenza vaccination for healthcare workers who work with the elderly. Cochrane Database Syst Rev 2006;3:CD Hayward AC, Harling R, Wetten S, et al. Effectiveness of an influenza vaccine programme for care home staff to prevent death, morbidity, and health service use among residents: cluster randomised controlled trial. BMJ 2006;333: Hak E, Buskens E, van Essen GA, et al. Clinical effectiveness of influenza vaccination in persons younger than 65 years with high-risk medical conditions: the PRISMA study. Arch Intern Med 2005;165: Govaert TM, Thijs CT, Masurel N, et al. The efficacy of influenza vaccination in elderly individuals. A randomized doubleblind placebo-controlled trial. JAMA 1994;272: Gross PA, Hermogenes AW, Sacks HS, et al. The efficacy of influenza vaccine in elderly persons. A meta-analysis and review of the literature. Ann Intern Med 1995;123: Jefferson T, Rivetti D, Rivetti A, et al. Efficacy and effectiveness of influenza vaccines in elderly people: a systematic review. Lancet 2005;366: Vu T, Farish S, Jenkins M, et al. A meta-analysis of effectiveness of influenza vaccine in persons aged 65 years and over living in the community. Vaccine 2002;20: Hedlund J, Christenson B, Lundbergh P, et al. Effects of a large-scale intervention with influenza and 23-valent pneumococcal vaccines in elderly people: a 1-year follow-up. Vaccine 2003;21: Christenson B, Hedlund J, Lundbergh P, et al. Additive preventive effect of influenza and pneumococcal vaccines in elderly persons. Eur Respir J 2004;23: Ortqvist A, Granath F, Askling J, et al. Influenza vaccination and mortality: prospective cohort study of the elderly in a large geographical area. Eur Respir J 2007;Accepted for publication. 25. Bridges CB, Thompson WW, Meltzer MI, et al. Effectiveness and cost-benefit of influenza vaccination of healthy working adults: A randomized controlled trial. JAMA 2000;284: Nichol KL, Lind A, Margolis KL, et al. The effectiveness of vaccination against influenza in healthy, working adults. N Engl J Med 1995;333: Nichol KL. Cost-benefit analysis of a strategy to vaccinate healthy working adults against influenza. Arch Intern Med 2001;161: Information från Läkemedelsverket 3:
62 28. Hak E, van Essen GA, Buskens E, et al. Is immunising all patients with chronic lung disease in the community against influenza cost effective? Evidence from a general practice based clinical prospective cohort study in Utrecht, The Netherlands. J Epidemiol Community Health 1998;52: Mullooly JP, Bennett MD, Hornbrook MC, et al. Influenza vaccination programs for elderly persons: cost-effectiveness in a health maintenance organization. Ann Intern Med 1994;121: Scott WG, Scott HM. Economic evaluation of vaccination against influenza in New Zealand. Pharmacoeconomics 1996;9: Smith NM, Bresee JS, Shay DK, et al. Prevention and Control of Influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2006;55: Ortqvist A. Pneumococcal vaccination: current and future issues. Eur Respir J 2001;18: Oosterhuis-Kafeja F, Beutels P, Van Damme P. Immunogenicity, efficacy, safety and effectiveness of pneumococcal conjugate vaccines ( ). Vaccine 2007;25: Hedlund JU, Kalin ME, Ortqvist AB, et al. Antibody response to pneumococcal vaccine in middle-aged and elderly patients recently treated for pneumonia. Arch Intern Med 1994;154: Musher DM, Luchi MJ, Watson DA, et al. Pneumococcal polysaccharide vaccine in young adults and older bronchitics: determination of IgG responses by ELISA and the effect of adsorption of serum with non-type-specific cell wall polysaccharide. J Infect Dis 1990;161: Sankilampi U, Honkanen PO, Bloigu A, et al. Antibody response to pneumococcal capsular polysaccharide vaccine in the elderly. J Infect Dis 1996;173: Rubins JB, Puri AK, Loch J, et al. Magnitude, duration, quality, and function of pneumococcal vaccine responses in elderly adults. J Infect Dis 1998;178: Rubins JB, Alter M, Loch J, et al. Determination of antibody responses of elderly adults to all 23 capsular polysaccharides after pneumococcal vaccination. Infect Immun 1999;67: van Kessel DA, van Velzen-Blad H, van den Bosch JM, et al. Impaired pneumococcal antibody response in bronchiectasis of unknown aetiology. Eur Respir J 2005;25: Ortqvist A, Henckaerts I, Hedlund J, et al. Non-response to specific serotypes likely cause for failure to 23-valent pneumococcal polysaccharide vaccine in the elderly. Vaccine 2007;25: Goldblatt D, Hussain M, Andrews N, et al. Antibody responses to nasopharyngeal carriage of Streptococcus pneumoniae in adults: a longitudinal household study. J Infect Dis 2005;192: Romero-Steiner S, Musher DM, Cetron MS, et al. Reduction in functional antibody activity against Streptococcus pneumoniae in vaccinated elderly individuals highly correlates with decreased IgG antibody avidity. Clin Infect Dis 1999;29: Konradsen HB. Quantity and avidity of pneumococcal antibodies before and up to five years after pneumococcal vaccination of elderly persons. Clin Infect Dis 1995;21: Sankilampi U, Honkanen PO, Bloigu A, et al. Persistence of antibodies to pneumococcal capsular polysaccharide vaccine in the elderly. J Infect Dis 1997;176: Jackson LA, Benson P, Sneller VP, et al. Safety of revaccination with pneumococcal polysaccharide vaccine. JAMA 1999;281: Torling J, Hedlund J, Konradsen HB, et al. Revaccination with the 23-valent pneumococcal polysaccharide vaccine in middle-aged and elderly persons previously treated for pneumonia. Vaccine 2003;22: O Brien KL, Hochman M, Goldblatt D. Combined schedules of pneumococcal conjugate and polysaccharide vaccines: is hyporesponsiveness an issue? Lancet Infect Dis 2007;7: Centers for Disease Control and Prevention. Recommended Adult Immunization Schedule United States, October 2007 September JAMA 2007;298: Honkanen PO, Keistinen T, Kivela SL. Reactions following administration of influenza vaccine alone or with pneumococcal vaccine to the elderly. Arch Intern Med 1996;156: Jackson LA, Neuzil KM, Whitney CG, et al. Safety of varying dosages of 7-valent pneumococcal protein conjugate vaccine in seniors previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine 2005;23: Abraham-Van Parijs B. Review of pneumococcal conjugate vaccine in adults: implications on clinical development. Vaccine 2004;22: Conaty S, Watson L, Dinnes J, et al. The effectiveness of pneumococcal polysaccharide vaccines in adults: a systematic review of observational studies and comparison with results from randomised controlled trials. Vaccine 2004;22: Dear K, Holden J, Andrews R, et al. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev 2003;CD Melegaro A, Edmunds WJ. The 23-valent pneumococcal polysaccharide vaccine. Part I. Efficacy of PPV in the elderly: a comparison of meta-analyses. Eur J Epidemiol 2004;19: Austrian R, Douglas RM, Schiffman G, et al. Prevention of pneumococcal pneumonia by vaccination. Trans Assoc Am Physicians 1976;89: Smit P, Oberholzer D, Hayden-Smith S, et al. Protective efficacy of pneumococcal polysaccharide vaccines. JAMA 1977;238: Honkanen PO, Keistinen T, Miettinen L, et al. Incremental effectiveness of pneumococcal vaccine on simultaneously administered influenza vaccine in preventing pneumonia and pneumococcal pneumonia among persons aged 65 years or older. Vaccine 1999;17: Ortqvist A, Hedlund J, Burman LA, et al. Randomised trial of 23-valent pneumococcal capsular polysaccharide vaccine in prevention of pneumonia in middle-aged and elderly people. Swedish Pneumococcal Vaccination Study Group. Lancet 1998;351: Dominguez A, Salleras L, Fedson DS, et al. Effectiveness of pneumococcal vaccination for elderly people in Catalonia, Spain: a case-control study. Clin Infect Dis 2005;40: Musher DM, Rueda-Jaimes AM, Graviss EA, et al. Effect of pneumococcal vaccination: a comparison of vaccination rates in patients with bacteremic and nonbacteremic pneumococcal pneumonia. Clin Infect Dis 2006;43: Nichol KL, Baken L, Wuorenma J, et al. The health and economic benefits associated with pneumococcal vaccination of elderly persons with chronic lung disease. Arch Intern Med 1999;159: Vila-Corcoles A, Ochoa-Gondar O, Hospital I, et al. Protective effects of the 23-valent pneumococcal polysaccharide vaccine in the elderly population: the EVAN-65 study. Clin Infect Dis 2006;43: Jackson LA, Neuzil KM, Yu O, et al. Effectiveness of pneumococcal polysaccharide vaccine in older adults. N Engl J Med 2003;348: Butler JC, Breiman RF, Campbell JF, et al. Pneumococcal polysaccharide vaccine efficacy. An evaluation of current recommendations. JAMA 1993;270: Shapiro ED, Berg AT, Austrian R, et al. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine. N Engl J Med 1991;325: Breiman RF, Keller DW, Phelan MA, et al. Evaluation of effectiveness of the 23-valent pneumococcal capsular polysaccharide vaccine for HIV-infected patients. Arch Intern Med 2000;160: French N, Nakiyingi J, Carpenter LM, et al. 23-valent pneumococcal polysaccharide vaccine in HIV-1-infected Ugandan adults: double-blind, randomised and placebo controlled trial. Lancet 2000;355: Information från Läkemedelsverket 3:2008
63 68. Black S, Shinefield H, Fireman B, et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Northern California Kaiser Permanente Vaccine Study Center Group. Pediatr Infect Dis J 2000;19: Hansen J, Black S, Shinefield H, et al. Effectiveness of heptavalent pneumococcal conjugate vaccine in children younger than 5 years of age for prevention of pneumonia: updated analysis using World Health Organization standardized interpretation of chest radiographs. Pediatr Infect Dis J 2006;25: Lucero MG, Dulalia VE, Parreno RN, et al. Pneumococcal conjugate vaccines for preventing vaccine-type invasive pneumococcal disease and pneumonia with consolidation on x-ray in children under two years of age. Cochrane Database Syst Rev 2004;CD Kyaw MH, Lynfield R, Schaffner W, et al. Effect of introduction of the pneumococcal conjugate vaccine on drug-resistant Streptococcus pneumoniae. N Engl J Med 2006;354: Lexau CA, Lynfield R, Danila R, et al. Changing epidemiology of invasive pneumococcal disease among older adults in the era of pediatric pneumococcal conjugate vaccine. JAMA 2005;294: Whitney CG, Farley MM, Hadler J, et al. Decline in invasive pneumococcal disease after the introduction of protein-polysaccharide conjugate vaccine. N Engl J Med 2003;348: Grijalva CG, Nuorti JP, Arbogast PG, et al. Decline in pneumonia admissions after routine childhood immunisation with pneumococcal conjugate vaccine in the USA: a time-series analysis. Lancet 2007;369: Sisk JE, Moskowitz AJ, Whang W, et al. Cost-effectiveness of vaccination against pneumococcal bacteremia among elderly people. JAMA 1997;278: Ament A, Baltussen R, Duru G, et al. Cost-effectiveness of pneumococcal vaccination of older people: a study in 5 western European countries. Clin Infect Dis 2000;31: Kvalitetsgradering av evidens (efter NHS Research and Developement, 1999; 1 a Systematisk analys av randomiserade kontrollerade studier med homogenicitet 1 b Minst en stor randomiserad kontrollerad studie 1 c Allt eller intet uppfylls när alla patienter dog innan behandlingen blev tillgänglig men några överlever med behandlingen, eller några överlevde utan behandling men med behandling överlever alla 2 a Systematisk analys av kohortstudier med homogenicitet 2 b Individuella kohortstudier inklusive randomiserade kontrollerade studier med lågt bevisvärde (låg kvalitet, vida konfidensintervall, låg inklusion av vissa subgrupper i en studie etc.) 2 c Utfallsstudier ( Outcomes Research ) 3 a Systematisk analys av fall-kontrollstudier med homogenicitet 3 b Individuella fall-kontrollstudier 4 Fallserier med fall-kontrollstudier och kohortstudier med låg kvalitet 5 Expertsynpunkter utan kritiska analyser eller baserade på fysiologi etc. Gradering av rekommendationer A Baseras på evidensgrad 1a, b eller c B Baseras på evidensgrad 2a, b och c samt 3a och b C Baseras på evidensgrad 4 D Baseras på evidensgrad 5 Information från Läkemedelsverket 3:
64 Mikrobiologisk diagnostik av nedre luftvägsinfektioner, särskilt öppenvården Maria Rotzén Östlund Virologi Luftvägsvirus Virus kan orsaka såväl övre- som nedre luftvägsinfektion. Samtliga nu kända virus orsakande övre luftvägsinfektion kan även ge nedre luftvägsinfektion. Metoder för att påvisa virus, virusantigen eller virus arvsmassa samt metoder att påvisa antikroppar mot virus har funnits tillgängliga för bruk i sjukvården under många år. De virus som framförallt varit tillgängliga för diagnostik är influensavirus A och B, respiratory syncytial virus (RSV), adenovirus och parainfluensavirus 1 3. Sedan början av 2000-talet har flera nya virus påvisats. Dessa har, undantaget det coronavirus som orsakar SARS (HCoV-SARS) (1), inte varit upphov till nya sjukdomar utan har snarare varit förklaring till tidigare odiagnostiserade fall av luftvägsinfektion. Nya virus är humant metapneumovirus (2), två nya coronavirus, HCoV-NL63 (3) och HCoV-HKU1 (4) samt humant bocavirus (5). Även tidigare kända coronavirus, HCoV-229E och HCoV-OC43 (6) samt rhinovirus (7) har visat sig kunna ha en större betydelse för nedre luftvägsinfektion än man tidigare trott. I denna presentation kommer inte virus som kan förekomma i luftvägarna och orsaka sjukdom hos till exempel immunsupprimerade patienter att tas med, detta gäller framför allt herpesgruppens virus. Provtagningsmaterial Möjliga provtagningsmaterial är nasofarynxaspirat, nasofarynxsekret taget med pinne och transporterat i transportmedium för virologisk diagnostik samt bronkoalveolärt lavage (BAL). För i övrigt friska patienter återfinns virus i tillräckligt stora mängder i näsan för att ett prov från den bakre delen av näsan ska vara fullt dugligt för diagnostik även av infektioner i de nedre luftvägarna. För andra patientgrupper, till exempel immunsupprimerade, kan BAL vara rekommendabelt i vissa situationer, men kommer inte att diskuteras mer i denna presentation. Nasofarynxaspirat har en lång diagnostisk tradition i Sverige. Provmaterialet fungerar väl för både virusodling, antigentester och nukleinsyreamplifierande tekniker (i fortsättningen benämnt NAT), till exempel polymerase chain reaction (PCR). Då den virologiska diagnostiken mer övergår till NAT kan nasofarynxsekret taget med pinne komma att bli ett Tabell I. Virusodling Fördelar Bred diagnostik. Hög känslighet. Nackdelar Långsamt, negativt svar erhålls efter dagar. Vissa virus svårodlade/ej odlingsbara. Finns endast på en del universitetssjukhus. Antigendetektion/påvisning av virus arvsmassa 1. IF Fördelar Snabbt (svar inom två till tre timmar efter ankomst till laboratoriet). Mycket hög känslighet för vissa virus, till exempel influensa och RSV. Kräver tränad personal för avläsning. Nackdelar Ger endast svar på efterfrågat virus. 2. Snabbtester (EIA, immunkromatografi) Fördelar Snabbt (svar inom en timme efter ankomst till laboratoriet). Lätt att avläsa. Nackdelar Lägre känslighet än IF och NAT (varierar mellan olika kommersiella kit). Ger endast svar på efterfrågat virus. Finns endast tillgängligt för RSV och influensa. 3. NAT Fördelar Relativt snabbt (svar inom ett dygn efter ankomst till laboratoriet). Enda metoden för diagnostik av vissa virus. Nackdelar Ger endast svar på efterfrågat virus. 64 Information från Läkemedelsverket 3:2008
65 mer använt och rekommenderat provmaterial, bland annat då dessa metoder till skillnad från till exempel immunofluorescens inte kräver en större mängd intakta celler. Metoder Diagnostik av virala luftvägsinfektioner baseras på virusodling, antigendetektion och NAT (Tabell I). Virusodling utförs idag rutinmässigt endast på några universitetssjukhus och utförs genom att patientprov ympas på flera olika cellinjer, och sedan avläses i mikroskop en till två gånger per vecka under tio till 14 dagar. Antigentester omfattar dels immunofluorescens (IF), där epitelceller från patientprov färgas med fluorescensmärkta monoklonala antikroppar, dels olika snabbtester (immunkromatografi eller membran-eia). NAT används på ett flertal mikrobiologiska laboratorier för influensa och RSV-diagnostik. Omfattande diagnostik med NAT för alla eller nästan alla kända luftvägsvirus finns också att tillgå på ett par ställen i landet. Under många år har diagnostik av luftvägsvirus skett med antigendetektion med IF ofta kompletterat med virusodling. Fler och fler laboratorier övergår nu till NAT av flera skäl. Dels har flera nya virus påvisats, som inte låter sig diagnostiseras på annat sätt än med NAT, dels har de molekylärbiologiska metoderna förbättrats så att tidsåtgången börjar närma sig den tid som åtgår för till exempel IF. Även kostnaden har blivit mer överkomlig. Bruket av patientnära analyser (PNA) för RSV och influensa har också diskuterats. Metodernas användbarhet i öppenvården Virologisk diagnostik av luftvägsinfektioner är inom slutenvården bland annat viktigt för att möjliggöra kohortvård vid influensa- och RSV-epidemier, för differentialdiagnostik vid infektioner hos immunsupprimerade och andra sedan tidigare sjuka patienter, för differentialdiagnostik för att undvika antibiotikabehandling samt för att följa epidemiologin av luftvägsvirus. I öppenvården är användbarheten av virologisk diagnostik inte lika självklar. Differentialdiagnostik gentemot bakteriella infektioner är nödvändig inom såväl slutenvården som öppenvården, men sker i öppenvården oftast genom bedömning av andra parametrar, såväl kliniska som laborativa, varför virologisk diagnostik inte är lika nödvändig ur detta perspektiv. I början av RSV- och influensaepidemierna varje år är det dock av stort värde att kunna fastställa de första fallen lokalt. Detta bör göras med nasofarynxaspirat/ sekret enligt det lokala laboratoriets instruktioner. Epidemiologin följs också nationellt via den frivilliga laboratorierapporteringen till Smittskyddsinstitutet samt genom den provtagning som hör till den svenska influensaövervakningen, se I vissa fall kan virologisk diagnostik vara nödvändig i öppenvård. Till exempel kan det vid en anhopning av nedre luftvägsinfektioner inom ett begränsat område eller inom en begränsad grupp vara viktigt att påvisa etiologiskt agens. Ett nasofarynxprov inskickat till det lokala laboratoriet som komplement till den bakteriologiska diagnostiken är då att rekommendera. Sammanfattningsvis har en betydande teknisk utveckling skett inom diagnostiken av luftvägsvirus, samtidigt som flera nya virus påvisats. Trots detta är användbarheten av virologisk diagnostik i öppenvården begränsad. Referenser 1. Rota PA, Oberste MS, Monroe SS, et al. Characterization of a novel coronavirus associated with severe acute respiratory syndrome. Science 2003;300(5624): van den Hoogen BG, de Jong JC, Groen J, et al. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med 2001;7(6): van der Hoek L, Pyrc K, Jebbink MF, et al. Identification of a new human coronavirus. Nat Med 2004;10(4): Woo PC, Lau SK, Chu CM, et al. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J Virol 2005;79(2): Allander T, Tammi MT, Eriksson M, et al. Cloning of a human parvovirus by molecular screening of respiratory tract samples. Proc Natl Acad Sci USA 2005;102(36): van der Hoek L. Human coronaviruses: what do they cause? Antivir Ther 2007;12(4 Pt B): Greenberg SB. Rhinovirus and coronavirus infections. Semin Respir Crit Care Med 2007;28(2): Information från Läkemedelsverket 3:
66 Bakteriologisk diagnostik av nedre luftvägsinfektioner inom öppenvården Åsa Melhus Sammanfattning Mikrobiologisk diagnostik av nedre luftvägsinfektioner inom öppenvården är oftast av begränsat värde. Om man ändå väljer att gå vidare med diagnostiken, bör man betänka att den kan vara bristfällig och behäftad med en del metodologiska problem. Dessa är associerande med bland annat bristande gyllene standard/ referensmetod, bristande sensitivitet/specificitet, bristande representativitet och bärarskap. För att förbättra diagnostiken bör enstaka sera undvikas och kliniska data alltid anges. Trots att samhällsförvärvade, nedre luftvägsinfektioner är relativt vanliga och tekniken har gått framåt, så föreligger det fortfarande svårigheter att fastställa etiologin till dessa infektioner. Även i studier med optimerad provtagning och relativt extensiv metodarsenal, lyckas man sällan etablera det orsakandet agenset i mer än hälften av fallen (1 3). Med de nyare molekylärbiologiska teknikerna ökar chanserna att man ska kunna identifiera den infektionsorsakande mikroorganismen, men detta gäller framför allt virus och inte i lika hög grad bakterier (4). I den kliniska situationen är fastställandet av den orsakande mikroorganismen ofta betydligt mindre frekvent än i studier. Den empiriska behandlingen fungerar oftast väl, varför behovet av mikrobiologisk diagnostik inom öppenvården är ringa. Med ökande svårighetsgrad på infektionen, så ökar emellertid även kraven på diagnostiken. Vid de svåraste infektionerna är chansen att man ska lyckas identifiera patogenen också oftast högst, och detta beror inte endast på att man använder sig av mer invasiva provtagningstekniker. Diagnostiken försvåras dock av tidigare insatt antibiotikabehandling och av sen kontakt med den slutna vården. Oberoende av vilket val man gör avseende metod för identifiering av en luftvägspatogen, kommer man att stöta på olika typer av problem. Vilka valmöjligheter man har står väl beskrivit i Smittskyddsinstitutets Referensmetodik för laboratoriediagnostik, Infektionsdiagnostik 2: 2 Nedre luftvägsinfektioner ( Lite av problematiken samt för- och nackdelar med de olika metoderna beskrivs nedan. Diagnostiska metoder Direktmikroskopi Den äldsta, enklaste och snabbaste metoden att påvisa förekomst av bakterier i luftvägarna är att utföra direktmikroskopi på sputa. Specificiteten för detta test är vanligtvis låg, förutom då pneumokocker är involverade (5,6). Utfallet vilar i hög grad på avläsaren och uppvisar en stor variabilitet. Andra problem är att många patienter ej har några upphostningar. Vid legionellainfektioner kan % av patienterna ha svårt för att lämna ett prov (7). Dessutom är kvali- teten på provmaterialet inte sällan för låg för att tillåta en bedömning. I Sverige saknas rutinen att utföra akut direktmikroskopi, och gramfärgning återfinns vanligtvis endast på laboratorier med klinisk mikrobiologisk diagnostik. Metoden utförs då endast som en verifikation av provmaterialets representativitet avseende nedre luftvägar, på uttrycklig begäran eller på frågeställningen tuberkulos. I det senare fallet används dock en annan färgningsteknik. För vissa agens finns det möjlighet att öka specificiteten genom immunofluorescensteknik. Detta har gällt bland annat legionella och bordetella. Då detta rör sig om så kallad fåtalsdiagnostik, är det svårt att uppehålla den kompetens som krävs för att hålla en acceptabel nivå på avläsningen. Flertalet laboratorier har därför övergivit immunofluorescenstekniken för PCR. Odling Odlingen kan vara allmän eller riktad. Vid allmän odling avgör i stor utsträckning provmaterialet vad man söker efter och vilka bakteriemängder som krävs för att man ska betrakta fynden som signifikanta. Anamnesen kan dock styra sökandet i en bredare riktning. Även om odling ofta är den gyllene standarden, har den sina nackdelar. Till dessa hör låg sensitivitet och odlingstiden. I vissa fall saknas det dessutom en välfungerande odlingsmetod, och det gäller väsentligen bakterier som är vanligare inom den öppna än den slutna vården (Mycoplasma pneumoniae, Chlamydophila pneumoniae). Sensitiviteten varierar i hög grad beroende på provtagningsteknik, provtagningsmaterial, när provet är taget i förhållande till insjuknandet, transportsystem/-tider och antibiotikabehandling. Till de stora fördelarna hör att odlingen tillåter resistensbestämning och möjliggör epidemiologiska uppföljningar. Vid svårare infektioner, efter besök i områden med hög frekvens antibiotikaresistenta bakterier och vid terapisvikt, bör odling alltid övervägas. Specificiteten vid odling är vanligtvis hög men avhängig provmaterialet. Säkrast betraktas odling av blod och pleuravätska, följt av sekret eller lavage erhållet via bronkoskop, sputum och slutligen nasofa- 66 Information från Läkemedelsverket 3:2008
67 rynxsekret (8). Inom öppenvård brukar de två senare provmaterialen vara de vanligaste, även om provtagningen minskat alltmer under senare år. I populationer där bärarskap av luftvägspatogener är hög, kan den kliniska relevansen av de bakteriella fynden från dessa provmaterial vara svårbedömd. För legionella finns inget bärarskap, men tyvärr är sensitiviteten för sputumodlingar ofta < 10 % (7). Odling är den vanligaste metoden att fastställa förekomst av Streptococcus pneumoniae, Haemophilus influenzae och Moraxella catarrhalis i luftvägarna. Serologi Serologin är ofta för långsam för att kunna användas i det akuta skedet. Den är dock användbar vid utbrott eller när man till exempel har behov av att följa epidemiologiska skeenden retrospektivt. Med serologiska metoder finns det alltid en risk för korsreaktioner eller ospecifika utfall. Tidigare infektioner eller vaccination kan försvåra tolkningen. För att det serologiska svaret överhuvudtaget ska kunna bedömas vid luftvägsinfektioner, bör sera alltid paras. Det innebär att man redan tidigt i förloppet måste besluta sig för vilken diagnostisk nivå man vill lägga sig på. Man måste också vara beredd på att man ibland måste vänta i upp till två månader på en serokonversion. För flertalet extracellulära bakterier finns det ingen serologi att tillgå annat än i forskningssammanhang. För de atypiska luftvägspatogenerna utgör serologin däremot något av den diagnostiska basen, även om den många gånger är suboptimal eller direkt undermålig. För M. pneumoniae finns det ett flertal kommersiella test att tillgå, men överensstämmelsen dem emellan kan vara oacceptabelt låg (9 11). En del patienter svarar inte med IgM-antikroppar vid mycoplasmainfektion, medan såväl IgM- som IgGantikroppar kan påvisas hos fullt friska individer (11,12). I det senare fallet har antikroppsnivåerna varit associerade med blodgruppstillhörighet eller ett positivt Coombs test (12). Att sera sällan är parade gör bedömningen i stort sett omöjlig, och risken för överdiagnostik är uppenbar. För C. pneumoniae och legionella är problemet ibland omvänt; alla patienter svarar inte med en antikroppsproduktion. Till detta kommer att om det finns ett svar på C. pneumoniae, så kan det se olika ut beroende på om det rör sig om en primär infektion eller en reinfektion (13). Detta öppnar upp för misstolkningar. Generellt sett bör bakteriologisk serologi tolkas med försiktighet och alltid tillsammans med kliniska data. Molekylärbiologiska metoder För bakterier där odlingssensitiviteten är låg och/eller serologin brottas med metodproblem, kan molekylärbiologiska metoder vara ett alternativ. Dessa metoder är relativt snabba och påverkas i mindre grad av antibiotikabehandling och tiden mellan infektionsdebut och provtagning. Vanligtvis används PCR-teknik, men mer multiplexa tekniker som tillåter undersökning av mer än ett tiotal agens i ett och samma prov är under utveckling. Även om sensitiviteten vanligtvis är högre med PCR än vid odling, så kan inhiberande faktorer i provmaterialet försämra utfallet. Sputum är det provmaterial som är mest problematiskt i detta hänseende, och för att undvika inhibition föredras ofta en kombination av svalg- och nasofarynxsekret för öppenvården. Valet av målsekvenser för PCR kan också påverka och ge såväl falskt positiva som falskt negativa svar. För den mycket promiskuösa pneumokocken behövs det sannolikt minst två målgener (14). Bärarskap och långdragen PCR-positivitet, vilket är inte helt ovanligt vid S. pneumoniae- respektive C. pneumoniaeinfektioner, kan också grumla bilden. Specificiteten är dock hög hos de molekylärbiologiska metoderna, och den ligger vanligen över 98 % (15). Många laboratorier väljer nu PCR före odling vid diagnostik av Bordetella pertussis och legionella. Troligtvis är PCR vid frågeställningen mycoplasma att föredra framför andra diagnostiska metoder (16), men de enda molekylärbiologiska metoder som är fullt ut validerade är PCR för mykobakterier och legionella. Snabbtest Det finns för närvarande två kommersiella snabbtest att tillgå som inte bygger på antikroppspåvisning, och de är framför allt avsedda för att fastställa legionella- och pneumokockantigen i urin. Legionellatestet är inriktat på att identifiera infektioner orsakade av Legio nella pneumophila serogrupp 1, den bakterie som än så länge orsakat de flesta legionellainfektioner inom öppenvården. Sensitiviteten ligger runt % beroende på referensmetod och infektionens svårighetsgrad (7,17), medan specificiteten brukar ligga över 95 % (1). Idag är denna metod tillsammans med serologin det vanligaste sättet att identifiera legionellainfektioner. Pneumokocktestet är ett relativt nytt test, och det har förutom urin även applicerats på bland annat sputa, nasofarynxsekret och pleuravätska. Sensitiviteten för pneumokocktestet utfört på urin varierar, men brukar ligga mellan % (1). Antalet falskt positiva test stiger i populationer där bärarskap är vanligt eller där streptokocker kan kontaminera provmaterialet. I en studie genomförd av van der Eerden (18), ökade antalet konstaterade pneumokockpneumonier med 5 % med urinantigentestet. I en annan studie där de två snabbtesten inkluderades, kunde det orsakande agenset identifieras i ytterligare 18 % (19). Att notera är att ett negativt urinantigentest inte utesluter en legionellos eller pneumokockinfektion, och antigenen kan kvarstå en längre tid i urinen. Antibiotikabehandling brukar inte påverka utsöndringen. Övriga test Testning av köldagglutininer förekommer fortfarande vid mycoplasmadiagnostik. Köldagglutininer förekommer endast hos cirka 50 % av alla patienter med mykoplasmainfektion, och specificitet är så låg som cirka 40 % (20). Då dessa agglutininer dessutom Information från Läkemedelsverket 3:
68 är relativt vanliga vid virala infektioner med liknande symtom, bör detta test utgå ur den diagnostiska arsenalen. Referenser 1. Schouten JA, Prins JM, Bonten MJ, et al. Revised SWAB guidelines for antimicrobial therapy of community-acquired pneumonia. J Med 2005;63: Strålin K, Törnqvist E, Staum Kaltoft M, et al. Etiologic diagnosis of adult bacterial pneumonia by culture and PCR applied to respiratory tract samples. J Clin Microbiol 2006;44: Hohenthal U, Vainionpää R, Meurman O, et al. Aetiological diagnosis of community acquired pneumonia: utility of rapid microbiological methods with respect to disease severity. Scan J Infect Dis 2007: Templeton KE, Scheltinga SA, van den Eeden WC, et al. Improved diagnosis of the aetiology of community acquired pneumonia with real time polymerase chain reaction. Clin Infect Dis 2005;41: Raghavendran K, Wang J, Belber C, et al. Predictive value of sputum gram stain for the determination of appropriate antibiotic therapy in ventilator-associated pneumonia. J Trauma 2007;62: Garcia-Vazquez E, Marcos MA, Mensa J, et al. Assessment of the usefulness of sputum culture for diagnosis of communityacquired pneumonia using the PORT predictive scoring system. Arch Inter Med 2004;164: Waterer GW, Baselski VS, Wunderink RG. Legionella and community-acquired pneumonia: a review of current diagnostic tests from a clinician s viewpoint. Am J Med 2001;110: Marston BJ, Plouffe JF, File Jr TM, et al. The Community-Based Pneumonia Incidence Study Group. Incidence of community-acquired pneumonia requiring hospitalisation. Results of a population-based active surveillance study in Ohio. Arch Intern Med 1997;157: Beersma MFC, Dirven K, van Dam SP, et al. Evaluation of 12 commercial tests and the complement fixation test for Mycoplasma pneumoniae-specific immunoglobulin G (IgG) and IgM antibodies, with PCR used as the gold standard. J Clin Microbiol 2005;43: Talkington DF, Shott S, Fallon MT, et al. Analysis of eight commercial enzyme immunoassay tests for detection of antibodies to Mycoplasma pneumoniae in human serum. Clin Diagn Lab Immunol 2004;11: Petitjean J, Vabret A, Gouarin S, et al. Evaluation of four commercial immunoglobulin G (IgG)- and IgM-specific enzyme immunoassays for diagnosis of Mycoplasma pneumoniae infections. J Clin Microbiol 2002;40: Nir-Paz R, Michael-Gayego A, Ron M, et al. Evaluation of eight commercial tests for Mycoplasma pneumoniae antibodies in the absence of acute infection. Clin Microbiol Infect 2006;12: Kumar S, Hammerschlag MR. Acute respiratory infection due to Chlamydia pneumoniae: current status of diagnostic methods. Clin Infect Dis 2007;44: Whatmore AM, Efstratiou A, Pickerill AP, et al. Genetic relationships between clinical isolates of Streptococcus pneumoniae, Streptococcus oralis, and Streptococcus mitis: characterization of atypical pneumococci and organisms allied to S.mitis harboring S.pneumoniae virulence factor-encoding genes. Infect Immun 2000;68: Murdoch DR. Molecular genetic methods in the diagnosis of lower respiratory tract infections. APMIS 2004;112: Templeton KE, Scheltinga SA, Graffelman AW, et al. Comparison and evaluation of real-time PCR, real-time nucleic acid sequence-based amplification, conventional PCR, and serology for diagnosis of Mycoplasma pneumoniae. J Clin Microbiol 2003;41: Yzerman EPF, den Boer JW, Lettinga KD, et al. Sensitivity of three urinary antigen tests associated with clinical severity in a large outbreak of legionnaires disease in the Netherlands. J Clin Microbiol 2002;40: Van der Eerden MM, Vlaspolder F, de Graaff CS, et al. Value of intensive diagnostic microbiological investigation in lowand high-risk patients with community-acquired pneumonia. Eur J Clin Microbiol Infect Dis 2005;24: Andreo F, Dominguez J, Ruiz J, et al. Impact of rapid urine antigen tests to determine the etiologi of community-acquired pneumonia in adults. Respir Med 2006;100: Chang YT, Yang YH, Chiang BL. The significance of a rapid cold hemagglutination test for detecting mycoplasma infections in children with asthma exacerbation. J Microbiol Immunol Infect 2006;39: Information från Läkemedelsverket 3:2008
69 Point of care testing in lower respiratory tract infections the role of the CRP test Hasse Melbye Does this patient have pneumonia? Diagnosing pneumonia may be rather easy in typical cases, when the patient presents with dyspnoea, high fever, and obvious signs of pulmonary consolidation. In most cases, however, the diagnosis is not clear cut. More than 40 % of patients who actually have got pneumonia, as shown by an acute radiographic infiltrate, leaves the GP office with a different diagnosis, according to three studies from general practice (1 3). Over-diagnosis of pneumonia occurs even more frequently according to these three studies. The positive predictive value of a doctor s diagnosis of pneumonia, based on history and physical examination, was between 19 and 24 % (1 3). We have limited knowledge about the consequences of these diagnostic errors. The greater part of under-diagnosed pneumonia cases in primary care are probably self-limiting illnesses, but patients with chest infection not treated with antibiotics had an increased risk of later to have a pneumonia diagnosed, compared to those treated with antibiotics, in a recent British study (4). The effect of delayed diagnosis and treatment may be fatal in some cases (5). Over-diagnosis certainly leads to unnecessary use of antibiotics. Most misdiagnosed patients probably have acute bronchitis or an obstructive lung disease (6), and antibiotics could probably be safely withheld in the majority of cases (7). When should exacerbations of asthma and COPD be treated with antibiotics? Infectious exacerbations of asthma and COPD, also represent diagnostic challenges for the general practitioner. These are frequently caused by viral infection (8,9), but bacteria play an important role in exacerbations of severe COPD (10). Anthonisen s criteria (11) are used as a guideline for antibiotic treatment in COPD, but the subjectivity of these criteria can lead to uncertainty. Should this patient be admitted to hospital? To assess the severity of a lower respiratory tract infection (LRTI) is as important as making the right diagnosis. The degree of dyspnoea and fatigue are certainly taken into account by GPs, and the respiratory rate and heart rate may give valuable clues. A need for careful monitoring of the patient may give the answer. The question is: Could any additional examination or point of care tests be helpful in this respect? Additional tests in suspected LRTI Point of care testing and additional examinations extend the basis of diagnostic decisions. The C-reactive protein (CRP) test has become commonplace in primary care in Scandinavia. The test was carried out in 42 % of Swedish patients with respiratory tract infection, and in % when LRTI was diagnosed, according to a study from (12). However, there are different views regarding the usefulness of this test. Before discussing the utility of the CRP test in more detail, a short overview of additional examinations and point of care tests, relevant for LRTI patients in primary care will be presented. The CRP response in respiratory tract infections CRP in uncomplicated viral infections In viral respiratory tract infections the serum concentration of CRP usually increases and reach a peak after 2 4 days (14,28). Maximum values do not always exceed 5 or 8 mg/l, which are the limits for detection by the currently used CRP-tests, but peaks between 10 and 50 mg/l are frequently seen. Higher values are often found in influenza and adenoviral infections, but they seldom exceed 100 mg/l (29). After the fourth day of illness the serum concentration usually drops rapidly, and will, after 10 days, be lower than 10 mg/l, if not complicated by a bacterial superinfection (14). Normal CRP responses in uncomplicated viral infections are shown in Figure 1. Figure 1. Typical CRP response in uncomplicated viral infections, based on a clinical study (14). Information från Läkemedelsverket 3:
70 Tabell I. Point of care tests and additional examinations in suspected LRTI in general practice. Blood test C-reactive protein Procalcitonin WBC ESR D-dimer Diagnostic value High values (> 100 mg/l) indicate pneumonia (13), but can also be found in pulmonary embolism and myocardial infarction and in uncomplicated influenza with an illness duration of 3 5 days (14). Pneumonia can usually be ruled out when CRP < 10mg/L (15), as can bacterial infection in COPD exacerbations (16). The PCT value is particularly increased in severe bacterial infections (17), and treatment algorithm based on the test has been shown to be effective in reducing antibiotic use (18). Elevated values (> /L) may indicate bacterial infection (i.e. pneumococci), whereas infection with viruses and atypicals (M. pneumoniae and C. pneumoniae) usually are associated with normal values (19). High values (> 40 mm/h) may indicate pneumonia, while a normal value reduces the probability of pneumonia (15). Elevated values is typical of thromboembolism, but is also seen in pneumonia (20). Other examinations/tests Spirometry The best method (with the option of reversibility testing) for diagnosing obstructive pulmonary diseases (21). ECG Blood pressure Temperature Pulse oximetry Chest X-ray Useful in the diagnosis of acute myocardial infarction and heart failure (22). Low blood pressure (diastolic 60 mm or systolic < 90 mm) indicates bad prognosis and a need of hospitalisation in pneumonia (23). High temperature is frequently found in pneumonia, but also in acute influenza. Low values (< 92 %) may indicate severe pneumonia or other severe cardiopulmonary diseases (24), and that oxygen should be given during transport to hospital (25). Infiltrate may be diagnosed in most cases of pneumonia (27). Heart failure, cancer and other pulmonary diseases may be diagnosed. Utility When pneumonia can be suspected and in exacerbations of asthma and COPD. Practical tests are available. No point of care test is yet available. The analysis may become a valuable alternative to the CRP test. Can be given some weight in the differentiation between pneumococcal and atypical/viral pneumonia. Can be used as an alternative to CRP test. Can be used in ruling out thromboembolism, but is not useful in the differentiation between pneumonia and pulmonary embolism. A practical test is available. Useful in acute bronchitis with signs of obstruction and when pneumonia is suspected and CRP is normal, in order to disclose COPD and asthma When acute heart failure can be suspected due to age and cardiovascular risk factors. Relevant when assessing pneumonia severity, particularly when hospitalisation is considered. An alternative to CRP test, but of less value in children and elderly. Useful in dyspnoeic or exhausted patients. Pneumonia cannot be excluded because of normal values (26). Useful in diagnosing severe cases and in ruling out pulmonary cancer in followup assessments. 70 Information från Läkemedelsverket 3:2008
71 CRP in pneumonia CRP values above 100 mg/l, are not uncommon in pneumonia. In 96 adult patients hospitalized with community acquired pneumonia, mean CRP values on admittance was 174, with a range from 26 to 367 (17). Higher values have been found in pneumococcal than in mycoplasmal and viral pneumonias (19). In pneumonias treated in primary care, median values between 50 and 60 mg/l, have been found (2,15,30). CRP values above 50 mg/l were found four times more frequently in patients with pneumonia than in patients without pneumonia, who had been ill for less than a week, and ten times more frequently in patients who had been ill for more than a week (15). The low frequency of elevated CRP values after one week in uncomplicated viral infections may explain the increased specificity of the test after one week of illness (Figure 1). In primary care studies a CRP value below 10 mg/l have been found in approximately one out of 10 patients with a radiographic infiltrate indicating pneumonia (3,15,30). We know that it may take more than 12 hours from the start of a severe infection till a CRP value above 10 mg/l can be measured. Other reasons why CRP values below 10 mg/l values can occur together with an infiltrate on chest x-ray are not clarified, but we know that radiographic infiltrates may persist for several weeks after clinical recovery (31). Patients with an infiltrate in spite of normal CRP value may have pneumonia in regress, but still persistent symptoms due to COPD, bronchial hyper-responsiveness, heart failure or simply a post-infectious cough, conditions that do not need antibacterial treatment. Based on the incomplete sensitivity of the CRP test (with a threshold of 20 mg/l) for a radiographic infiltrate, Scandinavian researchers have recently discouraged the use of the test (3,30). However, fewer radiographic infiltrates are overlooked by a CRP based prediction rule than by diagnosis based on history and physical examination alone (2). CRP in exacerbations of COPD CRP values > 10 mg/l are usually found in exacerbations of COPD when a bacterial agent is detected (16). Values below 10 mg/l are found in the majority of exacerbations when not associated with increased sputum purulence (32). A decision not to treat with antibiotics based on Anthonisen s criteria can be supported by a normal CRP value, but should probably be revised when the CRP value exceeds 50 mg/l. Utility studies Scientific evidence for the usefulness of the CRP test in lower respiratory tract infections, was examined by van der Meer and co-authors in 2005 (33). Although the test was found to be of significant diagnostic value in identifying patients with pneumonia, the authors did not find sufficient support for a wide introduction of the CRP test as a guide in the prescription of antibiotics. Controlled trials have so far not been able to prove benefits from applying the test in terms of improved clinical outcome or less use of antibiotics (34 36). These trials have, however, been carried out among GPs with limited knowledge and experience with the test. The interpretation of the CRP test is not clear cut, different thresholds should be applied depending on the duration of illness, and it cannot be expected that GPs, who are inexperienced with the use of the test, put great emphasis on a test result not in concordance with their clinical assessment. In a more recent Norwegian study, GPs who had used the CRP test for some years thought it contributed substantially to the diagnosis in 30 % of patients with an infectious illness (37). While still waiting for a randomised controlled trial supporting the use of the CRP test in LRTI, treatment algorithms based on procalcitonin measurements have shown to lower the use of antibiotics without compromising the safety of the patients (18). Concerns about excessive use of the CRP test The widespread use of the test in general practice in Scandinavia has been questioned (12,38). It has been stated that the CRP test is often used routinely, with little impact on diagnosis and treatment (38). Findings of moderately elevated CRP values in patients with respiratory tract infections, may too frequently lead to prescriptions of antibiotics, prescriptions that possibly would have been avoided if the test had not been carried out (12). The widespread use of the test can probably be ascribed a desire among GPs for support in the difficult decisions on antibiotic prescribing, and with its diagnostic properties, particularly in predicting pneumonia, such support can certainly be given. The interpretation of the test is, however, probably more difficult than anticipated. To defend the widespread use, the GPs should enhance their knowledge about the nature of the CRP response and about how to interpret the test in a clinical context. Assessing severity The CRP value does not predict outcome, once a diagnosis of pneumonia has been made (39). Quality assured scoring systems are of greater value, like the CRB65 which is based on four findings: confusion, respiratory rate (> 30/min), low blood pressure (diastolic 60 mm or systolic < 90 mm, and age above 65 (23,39). Procalcitonin is probably a better predictor of prognosis than CRP (39), due to a greater specificity for septic bacterial infections (17). However both CRP and procalcitonin can be used in evaluating response to therapy in pneumonia patients after three days of antibacterial treatment (17). Reduced values confirm the effectiveness of given treatment. Conclusion Additional tests may be helpful in the evaluation of patients with LRTI. The frequently used CRP test is useful in diagnosing and ruling out pneumonia, when interpreted in a clinical context. The test re- Information från Läkemedelsverket 3:
72 sult is usually of limited value when the illness has lasted less than a week. When admitting the patient to hospital is considered, pulse oximetry and blood pressure measurement can be helpful. Referenser 1. Melbye H, Straume B, Aasebo U, et al. Diagnosis of pneumonia in adults in general practice. Relative importance of typical symptoms and abnormal chest signs evaluated against a radiographic reference standard. Scand J Prim Health Care 1992;10(3): Hopstaken RM, Muris JW, Knottnerus JA, et al. Contributions of symptoms, signs, erythrocyte sedimentation rate, and C-reactive protein to a diagnosis of pneumonia in acute lower respiratory tract infection. Br J Gen Pract 2003;53(490): Holm A, Nexoe J, Bistrup LA, et al. Aetiology and prediction of pneumonia in lower respiratory tract infection in primary care. Br J Gen Pract 2007;57(540): Petersen I, Johnson AM, Islam A, et al. Protective effect of antibiotics against serious complications of common respiratory tract infections: retrospective cohort study with the UK General Practice Research Database. BMJ 2007 October Community-acquired pneumonia in adults in British hospitals in : a survey of aetiology, mortality, prognostic factors and outcome. The British Thoracic Society and the Public Health Laboratory Service. Q J Med 1987;62(239): Melbye H, Berdal BP, Straume B, et al. Pneumonia--a clinical or radiographic diagnosis? Etiology and clinical features of lower respiratory tract infection in adults in general practice. Scand J Infect Dis 1992;24(5): Smucny J, Fahey T, Becker L, et al. Antibiotics for acute bronchitis. Cochrane Database Syst Rev 2004;(4):CD Wedzicha JA. Role of viruses in exacerbations of chronic obstructive pulmonary disease. Proc Am Thorac Soc 2004;1(2): Beasley R, Coleman ED, Hermon Y, et al. Viral respiratory tract infection and exacerbations of asthma in adult patients. Thorax 1988;43(9): Cameron RJ, de WD, Welsh TN, et al. Virus infection in exacerbations of chronic obstructive pulmonary disease requiring ventilation. Intensive Care Med 2006;32(7): Anthonisen NR, Manfreda J, Warren CP, et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106(2): Andre M, Schwan A, Odenholt I. The use of CRP tests in patients with respiratory tract infections in primary care in Sweden can be questioned. Scand J Infect Dis 2004;36(3): Flanders SA, Stein J, Shochat G, et al. Performance of a bedside C-reactive protein test in the diagnosis of communityacquired pneumonia in adults with acute cough. Am J Med 2004;116(8): Melbye H, Hvidsten D, Holm A, et al. The course of C- reactive protein response in untreated upper respiratory tract infection. Br J Gen Pract 2004;54(506): Melbye H, Straume B, Brox J. Laboratory tests for pneumonia in general practice: the diagnostic values depend on the duration of illness. Scand J Prim Health Care 1992;10(3): Dev D, Wallace E, Sankaran R, et al. Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease. Respir Med 1998;92(4): Hedlund J, Hansson LO. Procalcitonin and C-reactive protein levels in community-acquired pneumonia: correlation with etiology and prognosis. Infection 2000;28(2): Christ-Crain M, Jaccard-Stolz D, Bingisser R, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial. Lancet 2004;363(9409): Lehtomaki K. Clinical diagnosis of pneumococcal, adenoviral, mycoplasmal and mixed pneumonias in young men. Eur Respir J 1988;1(4): Guneysel O, Pirmit S, Karakurt S. Plasma d-dimer levels increase with the severity of community acquired pneumonia. Tuberk Toraks 2004;52(4): Fabbri L, Pauwels RA, Hurd SS. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: GOLD Executive Summary updated COPD 2004;1(1): Hedberg P, Lonnberg I, Jonason T, et al. Electrocardiogram and B-type natriuretic peptide as screening tools for left ventricular systolic dysfunction in a population-based sample of 75- year-old men and women. Am Heart J 2004;148(3): Bauer TT, Ewig S, Marre R, et al. CRB-65 predicts death from community-acquired pneumonia. J Intern Med 2006;260(1): Kelly AM, McAlpine R, Kyle E. How accurate are pulse oximeters in patients with acute exacerbations of chronic obstructive airways disease? Respir Med 2001;95(5): BTS Guidelines for the Management of Community Acquired Pneumonia in Adults. Thorax 2001;56(Suppl 4): Tanen DA, Trocinski DR. The use of pulse oximetry to exclude pneumonia in children. Am J Emerg Med 2002;20(6): Syrjala H, Broas M, Suramo I, et al. High-resolution computed tomography for the diagnosis of community-acquired pneumonia. Clin Infect Dis 1998;27(2): Whicher JT, Chambers RE, Higginson J, et al. Acute phase response of serum amyloid A protein and C reactive protein to the common cold and influenza. J Clin Pathol 1985;38(3): Ruuskanen O, Putto A, Sarkkinen H, et al. C-reactive protein in respiratory virus infections. J Pediatr 1985;107(1): Lagerstrom F, Engfeldt P, Holmberg H. C-reactive protein in diagnosis of community-acquired pneumonia in adult patients in primary care. Scand J Infect Dis 2006;38(11 12): Jay SJ, Johanson WG, Jr., Pierce AK. The radiographic resolution of Streptococcus pneumoniae pneumonia. N Engl J Med 1975;293(16): Weis N, Almdal T. C-reactive protein--can it be used as a marker of infection in patients with exacerbation of chronic obstructive pulmonary disease? Eur J Intern Med 2006;17(2): van dm, V, Neven AK, van den Broek PJ, et al. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ 2005;331(7507): Melbye H, Aaraas I, Fleten N, et al. [The value of C-reactive protein testing in suspected lower respiratory tract infections. A study from general practice on the effect of a rapid test on antibiotic research and course of the disease in adults]. Tidsskr Nor Laegeforen 1995;115(13): Diederichsen HZ, Skamling M, Diederichsen A, et al. Randomised controlled trial of CRP rapid test as a guide to treatment of respiratory infections in general practice. Scand J Prim Health Care 2000;18(1): Dahler-Eriksen BS, Lauritzen T, Lassen JF, et al. Near-patient test for C-reactive protein in general practice: assessment of clinical, organizational, and economic outcomes. Clin Chem 1999;45(4): Lindbaek M, Hjortdahl P. [C-reactive protein in general practice. An important diagnostic tool in infections]. Tidsskr Nor Laegeforen 1998;118(8): Engstrom S, Molstad S, Lindstrom K, et al. Excessive use of rapid tests in respiratory tract infections in Swedish primary health care. Scand J Infect Dis 2004;36(3): Kruger S, Papassotiriou J, Marre R, et al. Pro-atrial natriuretic peptide and pro-vasopressin to predict severity and prognosis in community-acquired pneumonia : Results from the German competence network CAPNETZ. Intensive Care Med 2007 October Information från Läkemedelsverket 3:2008
73 Biverkningsnytt Rapporterade psykiatriska biverkningar av Acomplia en genomgång Läkemedelsverket vill uppmärksamma förskrivare och sjukvårdspersonal på förekomsten av rapporterade allvarliga psykiatriska biverkningar hos patienter behandlade med Acomplia (rimonabant). Av produktinformationen framgår att läkemedlet är kontraindicerat vid pågående egentlig depression och/ eller behandling med antidepressiva läkemedel. Acomplia blev godkänt i juni 2006 som tilläggsbehandling till diet och motion for behandling av fetma (BMI 30 kg/m 2 ) och övervikt (BMI 27 kg/m 2 ) vid samtidig förekomst av riskfaktorer såsom typ 2- diabetes mellitus eller blodfettsrubbning. Psykiatriska biverkningar I de studier som låg till grund för godkännandet av Acomplia sågs framför allt psykiatriska biverkningar. Av produktinformationen framgår att Acomplia är kontraindicerat vid pågående egentlig depression och/eller behandling med antidepressiva läkemedel. Under Varningar och försiktighet finns ytterligare varningar angående självmordstankar samt att patienter med okontrollerad psykiatrisk sjukdom ej rekommenderas behandling med Acomplia. De biverkningsrapporter som inkommit för Acomplia till det svenska biverkningsregistret har jämförts med de biverkningsrapporter som kommit in för Reductil, ett annat centralt verkande läkemedel för behandling av övervikt och fetma samt för Xenical, ett medel för viktminskning med en perifer verkningsmekanism (hämmare av gastrointestinala lipaser), se Tabell I. För Xenical finns det fyra rapporter om ångest, i övrigt är det enstaka rapporter angående oro, depression, nedstämdhet samt sömnrubbning. De flesta rapporter som kommit in till Läkemedelsverket gäller biverkningar som rör huden och mag-tarmkanalen. För Reductil rör sig de flesta rapporter om psykiatriska biverkningar och cirkulationsbiverkningar. Figur 1. Försäljningssiffror för Xenical, Reductil och Acomplia. DDD = definierad dygnsdos. Antal DDD per tusen invånare och dag under tolv månader. Information från Läkemedelsverket 3:
74 Biverkningsnytt Tabell I. Rapporterade biverkningar för Acomplia, Reductil och Xenical. Läkemedel (godkänt sedan) Totalt antal rapporter Rapporter med troligt samband Rapporter med psykiatriska biverkningar Acomplia (2006 ) Reductil (2001 ) Xenical (1998 ) Nedan följer exempel på rapporter som kommit in till Läkemedelsverket. Reductil Fall 1 26-årig kvinna som förskrivs Reductil mot sin övervikt, behandlas under två månader och går ner 8 kg i vikt. Under den andra behandlingsmånaden märks en tilltagande nedstämdhet och detta resulterar i utsättning av medicinen. Patienten har ingen depressiv episod tidigare, inga andra sjukdomar eller mediciner. Efter en månad beskrivs patienten som tillfrisknad. Fall 2 En 52 år gammal kvinna startade behandling med Reductil. Efter en veckas behandling avbröt hon behandlingen eftersom omgivningen märkte att hon blev aggressiv. Aggressiviteten försvann när hon upphörde med behandlingen. Hon började åter medicinera med Reductil, men avslutade efter två veckor eftersom aggressiviteten återkom efter varje tablettintag. Fall 3 37-årig överviktig, sjukpensionerad kvinna som behandlas med Tryptizol sedan lång tid tillbaka. Startade med Reductil, efter cirka åtta veckors behandling sökte patienten vårdcentral på grund av depressivitet och suicidtankar. Hon hade haft en episod av tablettbehandlad depression i livet, annars psykiskt frisk. Reductil sattes ut och vid kontakt tio dagar senare är de psykiska besvären borta. Av produktinformationen för Reductil framgår att preparatet är kontraindicerat vid psykisk sjukdom och vid användning av centralt verkande läkemedel mot psykiatrisk sjukdom. I avsnittet Varningar och försiktighet sägs att sällsynta fall av depression, självmordstankar samt självmord har rapporterats i samband med Reductilbehandling. Acomplia Fall 1 62-årig man med diabetes, hypertoni och övervikt startade behandling med Acomplia. Efter fyra veckors behandling var patienten lätt depressiv och hade en ökad benägenhet att drömma. Behandlingen fortsattes då patienten hade god effekt. Under de följande veckorna fick patienten tilltagande besvär med mardrömmar och behandlingen avbröts. Två veckor efter seponerad behandling var problemen med mardrömmar så stora att han erbjöds vård på psykiatrisk klinik samt insättande av Seroquel. Patienten avböjde intagning. Patienten hade inte haft några psykiska problem tidigare. Fall 2 62-årig kvinna med kraftig övervikt som startade behandling med Acomplia. Efter ungefär tre månaders behandling sökte hon för ökad tendens till ångest. Kvinnan själv kopplade ihop den plötsliga panikångesten med Acomplia. Hon hade svårt att vara ensam, panikångestattacker, klaustrofobi och aggressivitet. Hon hade även självmordstankar. Fall 3 71-årig man med tilltagande depressivitet och personlighetsförändring, dominerad av ökad aggressivitet mot andra människor. Patienten återkom till sitt habitualtillstånd sju till tio dagar efter utsättning av Acomplia. Fall 4 66-årig kvinna med adipositas och gonarthros. Hon hade inte haft några depressiva episoder eller symtom innan insättandet av Acomplia. Hon hade en kortare håglöshetsperiod när hon började med Acomplia i januari 2007 men det gick över efter fyra till fem dagar. Vid kontroll fyra veckor efter insättandet hade hon bra effekt och inga biverkningar. I juni fick patienten tilltagande förstämning, självmordstankar, svettning, ångest, panik, sömnsvårigheter mm. och fick hjälp på psykiatriska kliniken med antidepressiv behandling. Antidepressiva behandlingsdosen blev ökad tre gånger. Sambandet mellan depression och Acomplia insåg inte patienten själv förrän i mitten av september 2007 och mådde sedan bättre efter utsättandet av Acomplia. 74 Information från Läkemedelsverket 3:2008
75 Biverkningsnytt Fall 5 19-årig man med tablettmissbruk sedan en längre tid, depressiva besvär. Obesitas. Inkom till sjukhus djupt medvetslös efter intag av Imovane och troligen opiater. Under vårdtiden uttalade suicidtankar och försökte även hänga sig i en duschslang. Tidigare inga noteringar om suicidtankar. Rapportörens bedömning ät att mannens psykiska hälsa i form av tablettöverkonsumtion och depression förvärrats av Acomplia. Behov av kontroll och uppföljning Läkemedelsverket önskar uppmärksamma förskrivare på ovan beskrivna psykiatriska biverkningar av Acomplia, som kan medföra allvarliga besvär för patienten, sjukskrivning med mera. Av fallbeskrivningarna framgår att också patienter helt utan tidigare psykiatriska besvär kan råka ut för depression, för- stämningstillstånd samt aggressivitet. Man kan också råka ut för psykiatriska biverkningar efter relativt lång behandlingstid, i vissa fall efter fem till sex månaders behandling även om insjuknande inom de tre första månaderna är vanligast. Noggrann kontroll och uppföljning efter insatt behandling är befogad. Läs de senaste biverkningsnyheterna på Information från Läkemedelsverket 3:
76 Läkemedelsmonografier Isentress (raltegravir) ATC-kod: J05AX08 Filmdragerad tablett innehåller 400 mg raltegravir (som kalium). Varje tablett innehåller 26,06 mg laktosmonohydrat som hjälpämne. MSD Sammanfattning Isentress (raltegravir) är det första godkända läkemedlet ur klassen integrashämmare. Effekten av raltegravir som tillägg till optimerad bakgrundsterapi har studerats i stora placebokontrollerade pivotala studier av behandlingserfarna hiv-1-infekterade patienter. Patienterna hade avancerad hiv-infektion (90 % CDC-klass C) och uttalad resistens mot godkända hiv-läkemedel. Drygt 60 % av patienterna som erhöll raltegravir uppvisade icke detekterbara virusnivåer efter 24 veckors behandling, vilket var signifikant bättre än resultatet med placebo (cirka 30 %). Den antivirala potensen är hög raltegravir givet med 2 nukleosidanaloger till behandlingsnaiva patienter medförde icke detekterbara virusnivåer efter signifikant kortare tids behandling än vad man sett under behandling med annat hiv-läkemedel (efavirenz). Emellertid har man hos patienter som sviktat under behandling med raltegravir i hiv-isolat ofta sett nyckelmutationer som bekräftar raltegravirresistens (Q148H/K/R och N155H). Preliminära data talar för en korsresistens inom klassen integrashämmare. Det är således av stor vikt att raltegravir ges i kombination med andra aktiva läkemedel för att undvika klassomfattande resistensutveckling. Raltegravir var väl tolererat och gav samma typ och grad av biverkningar som placebo i de pivotala studierna. Behandling med raltegravir påverkar ej blodlipider (t-kolesterol, LDL, triglycerider). I prekliniska studier har man inte sett några signaler avseende toxicitet. Säkerhetsdata är fortfarande av begränsad omfattning. Till skillnad från många andra hiv-läkemedel har raltegravir en låg interaktionspotential. Datum för godkännande: (central procedur). Läkemedelsverkets värdering Raltegravir är ett mycket värdefullt tillskott till behandlingserfarna hiv-1-infekterade patienter. Den antiretrovirala potensen är uttalat god liksom den säkerhetsprofil som hittills presenterats. För patienter med ett stort antal andra läkemedel är raltegravirs relativt låga interaktionspotential också värdefull. Verksam beståndsdel Den verksamma beståndsdelen i Isentress är raltegravir. Indikationer Raltegravir i kombination med andra antiretrovirala läkemedel är indicerat för behandlingserfarna, vuxna hiv-1-infekterade patienter. Dosering Rekommenderad dos Isentress är 400 mg två gånger dagligen, med eller utan föda. Farmakokinetik Absorption Raltegravir (400 mg b.i.d.) administrerades utan hänsyn till föda i de pivotala studierna, vilket också blev rekommendationen för dosering vid godkännandet. Raltegravirs koncentrationsprofil påverkas dock uttalat av fettrik föda. Vid samtidigt intag av måltid med måttlig respektive hög fetthalt ses en cirka 65-procentig respektive fyrfaldig ökning av C min -koncentration (12-timmarsvärdet), jämfört med intag i fastande. C max påverkas i mindre utsträckning och förskjuts så att koncentrationsprofilen mera liknar den som ses med en slow release-formulering. Vid samtidigt intag av måltid med låg fetthalt sågs däremot ingen ökning av raltegravirkoncentrationer. Om, utifrån ovanstående, samtidigt intag av mera fetthaltig föda kan ha en positiv effekt på behandlingsutfall hos vissa patientgrupper, till exempel vid uttalad resistens mot andra ingående läkemedel, eller då det föreligger interaktion med inducerande läkemedel är oklart, och kan ej utvärderas från studierna. 76 Information från Läkemedelsverket 3:2008
77 Monografier Hos friska försökspersoner ökar C max - AUC och C min proportionellt inom dosintervallet mg. Den absoluta biotillgängligheten för raltegravir har inte fastställts. Distribution Raltegravir är bundet till humant plasmaprotein till cirka 83 % inom koncentrationsintervallet 2 10 µm. Penetration till centrala nervsystemet i människa, avläst som koncentration i cerebrospinalvätska, är ännu ej studerat. Raltegravir passerade med lätthet moderkakan hos råtta, men penetrerade inte till CNS i någon märkbar utsträckning. Metabolism och utsöndring Den huvudsakliga mekanismen för clearance av raltegravir är UGT1A1-medierad glukuronidering, vilket sker i levern. Raltegravir påverkar i sig inte enzymet. Efter intag i fastande är halveringstiden för raltegravir ungefär nio timmar, med en snabb första fas (~ 1 timme), vilken står för stora delar av AUC. Som framgått ovan är förhållandet annorlunda vid samtidigt intag av fettrik föda. Efter peroral administrering av raltegravir utsöndrades cirka 51 % och 32 % av dosen i feces respektive urin. I feces förekom enbart raltegravir, varav merparten troligen härrör från hydrolys av raltegravirglukuronid som utsöndrats i gallan och av icke absorberat läkemedel. I urinen sågs raltegravir (9 % av dosen) och raltegravir-glukuronid (23 % av dosen). UGT1A1-polymorfism Genetisk polymorfism i UGT1A-genen är vanligt förekommande och kan medföra nedsatt aktivitet av detta enzym. I en jämförelse av 30 försökspersoner med en vanligt förekommande polymorfism (*28/*28-genotyp) och 27 försökspersoner med vildtypsgenotyp uppgick det geometriska medelvärdet av kvoten för AUC till 1,41 (CI90 %: 96; 2,09) och för C 12h till 1,91 (CI90%: 1,43; 2,55), det vill säga det sågs en signifikant ökning av raltegravirexponering hos individer med sådan polymorfism, ungefär samma ökning som ses då raltegravir ges samtidigt som atazanavir (se senare avsnitt). Dosjustering anses inte nödvändigt hos personer med reducerad UG- T1A1-aktivitet på grund av genetisk polymorfism. Farmakokinetik i speciella patientgrupper a) Patienter med nedsatt njurfunktion Farmakokinetik är jämförd mellan patienter med normal (n = 10) och uttalat nedsatt (n = 10) njurfunktion. Ingen uppenbar association sågs mellan raltegravirs AUC 0-, C max eller C 12 h och njurfunktion. Ingen dosjustering krävs vid nedsatt njurfunktion. b) Patienter med nedsatt leverfunktion Farmakokinetik är jämförd mellan patienter med normal (n = 8) och måttligt nedsatt (Child-Pugh scores 7 8, n = 8) leverfunktion. Variabiliteten var högre för patienter med nedsatt funktion (AUC 3,05 µm h till 50,08 µm h) än för patienter med normal funktion (AUC 13,24 36,42 µm h). Vid jämförelse av medelvärden förelåg dock ingen kliniskt relevant skillnad; glukuronidering är inte till så stor utsträckning påverkad vid nedsatt leverfunktion. Man har ej utfört studier på patienter med uttalat nedsatt leverfunktion och ingen dosjustering anses befogad. c) Andra grupper I de pivotala studierna sågs ingen farmakokinetisk påverkan beroende av kön, ålder eller ras. Denna populationskinetik bör tolkas försiktigt med tanke på att patienterna i fas II- och III-studierna doserade Isentress utan hänsyn till födointag, och andelen kvinnor respektive åldersvariation var låg. Interaktioner med andra läkemedel Som framgått påverkas raltegravir av läkemedel som hämmar eller inducerar UGT1A1, medan raltegravir inte signifikant påverkar enzymet vid terapeutiska koncentrationer. Absorptionen påverkas av ph i magsäcken. Raltegravir har ingen signifikant metabolisering via CYP-systemet. Huvudsakliga interaktioner summeras nedan; för detaljer hänvisas till produktresumé (respektive FASS): Ökade koncentrationer av raltegravir Atazanavir (med eller utan ritonavir) hämmar UGT1A1 och medför en signifikant ökad exponering av raltegravir: Dosjustering av raltegravir krävs emellertid inte. Tenofovir ökar signifikant exponeringen av raltegravir, av oklar anledning. Dosjustering krävs ej. Omeprazol (som representant för syrahämmare) medför en kraftigt ökad exponering av raltegravir med en 4-faldig ökning av C max och 3-faldig ökning av AUC. Det är oklart om detta medför en säkerhetsrisk. Syrahämmande läkemedel bör i möjligaste mån undvikas. Minskade koncentrationer av raltegravir Efavirenz inducerar UGT1A1 och sänker raltegravirexponeringen signifikant (AUC cirka 35 %, C 12 h cirka 20 %). Dosjustering av raltegravir krävs inte. Rifampicin inducerar UGT1A1 och sänker exponeringen av raltegravir (AUC cirka 40 %, C 12 h cirka 60 %). Det är oklart om denna relativt uttalade sänkning av raltegravir kan medföra nedsatt effekt och kombinationen bör om möjligt undvikas. Effekten av ökad (till exempel dubblerad) dos av raltegravir för att kompensera detta har ej studerats. Rifabutin skall studeras. Den inducerande effekten är mindre uttalad än den som ses med rifampicin, varför kombinationen sannolikt kommer att kunna ges utan dosjustering av raltegravir. Farmakodynamik Verkningsmekanism: När hiv-virus har penetrerat cellen, omvandlas hiv-rna till hiv-dna via hiv-virusets reverserade transkriptas. Integras, även detta ett Information från Läkemedelsverket 3:
78 Monografier hiv-kodat enzym, infogar därefter detta hiv-dna i värdcellens genom. Raltegravir hämmar hiv-integras selektivt och förhindrar härmed infogningen av hiv- DNA i värdcellens genom. Hiv-genom som inte integrerats kan inte styra produktionen av nya infektiösa viruspartiklar. Man har inte funnit att raltegravir signifikant inhiberar något humant enzym, inklusive DNA-polymeras α, β och γ. Antiviral aktivitet in vitro Vid koncentrationerna 31 ± 20 nm resulterade raltegravir i 95 % hämning (IC95) av hiv-1-stam H9IIIB (T-lymfoidcellkulturer med 10 % fetalt kalvserum). För 15 kliniska isolat (6 subtyper representerade) var IC nm (perifiera mononukleära celler). Enstaka tester har gjorts på hiv-2-isolat (i CEM 174 celler) med lågt IC95 (6 nm). Resistens in vitro Vid successivt ökande koncentrationer av raltegravir i cellkultur utvecklade hiv-1 (laboratorieisolat) mutation Q148K, senare följt av mutationer E138A och G140A. Introduktion av mutationer Q148K, E138A/Q148 och E138A/G140A/Q148K i vildtypsvirus medförde genomsnittligt en 46-faldig, 90- faldig och 508-faldig ökning av IC50-värden. Resistens in vivo I analys av virus från 60 patienter med virologisk svikt under behandling med raltegravir (pivotala studierna) uppvisade 42 patienter (70 %) virus med nytillkomna mutationer i integrasgenen (Tabell I). Två huvudsakliga nyckelmutationer har identifierats: N155H (med sekundära mutationer E92Q, V151I, T97A, G163Roch L74M). Q148K/R/H (med sekundära mutationer G140S/A och E138K). En tredje nyckelmutation är sannolikt Y143HR/C (med föreslagna sekundära mutationer L74A/I, E92Q, T97A, I203M och S230R). Primärmutationerna ger ensamma en signifikant nedsatt känslighet för raltegravir in vitro, vilket inte är fallet med de sekundära mutationerna. Tillsammans med primärmutation medför de däremot ytterligare nedsatt känslighet och ibland ökad viral fitness in vitro. Ett fåtal av nämnda patienter (3/60) uppvisade endast nytillkomna sekundära integrasmutationer, utan att man hittade någon av de nämnda primära mutationerna. Korsresistens In vitro rapporteras korsresistens även med andra integrashämmare under utveckling. I en fas II-studie av elvitegravir, integrashämmare, sågs mutationer E92Q, E138K, Q148R/K/H eller N155H i virus från patienter med virologisk svikt (1). Således antar man att det kan föreligga hög grad av korsresistens även in vivo, inom klassen integrashämmare. Graden av korsresistens behöver dock bestämmas empiriskt för nya integrashämmare. Klinisk effekt Dosstudier Raltegravir i monoterapi Raltegravir har testats i tio dagars monoterapi (Tabell II). Ingen signifikant skillnad av korttidseffekt sågs i dosintervallet mg b.i.d. Dosstudie, kombinationsbehandling, behandlings- Tabell I. Genotypisk resistens från patienter (n = 60) med behandlingssvikt under raltegravir i pivotala studierna, data till och med vecka 24. Resistensmönster n (%) N (35) Q148 9 (15) Y143 5 (8,3) Multipla (av ovanstående) 4 (6,7) Endast sekundära 3 (5) Inga nytillkomna 1 18 (30) 1 Av mutationer som hittills anses vara kopplade till raltegravir Tabell II. Sänkning av hiv-1 RNA dag 10 efter tio dagars monoterapi (2). Dos Antal patienter medel (CI 95 %) log 10 kopior/ml 100 mg b.i.d. 7 1,93 ( 2,44; 1,42) 200 mg b.i.d. 7 1,98 ( 2,49; 1,47) 400 mg b.i.d. 6 1,66 ( 1,99; 1,34) 600 mg b.i.d. 8 2,16 ( 2,55; 1,77) Placebo 7 0,17 0,42; 0,07) 78 Information från Läkemedelsverket 3:2008
79 Monografier naiva patienter (studie 004) Samma doser som ovan har under 48 veckor jämförts med efavirenz, allt tillsammans med tenofovir/ lamivudin. Utfallet med raltegravir, oberoende av dos, var jämförbart med det för efavirenz (Tabell III). I studie 004 noterades att den initiala sänkningen av hiv-rna var signifikant snabbare med raltegravir än med efavirenz (Figur 1). Efter fyra veckors behandling uppvisade cirka 70 % av patienterna som fick raltegravir + tenofovir/lamivudin icke detekterbar virusnivå jämfört med cirka 20 % av dem som fick efavirenz + tenofovir/lamivudin, trots liknande hiv-rna vid baseline (3). Den kliniska signifikansen av detta är oklar. Dosstudie, kombinationsbehandling, behandlingserfarna patienter (studie 005). Raltegravir i dos 200, 400 eller 600 mg b.i.d. jämfördes med placebo, allt tillsammans med optimerad bakgrundsterapi, i behandlingserfarna patienter. Behandlingsutfall vecka 24 var liknande för de olika doserna raltegravir (Tabell IV). Denna studie skulle också utvärdera säkerhet (res- pektive effekt) för raltegravir givet med (n = 127) eller utan atazanavir (n = 52) som en del av optimerad bakgrundsbehandling; som tidigare nämnts ökar atazanavir exponeringen av raltegravir. Biverkningsfrekvensen hos patienter med raltegravir var generellt jämförbar med den hos patienter med eller utan atazanavir. Pivotala studier Godkännandet av raltegravir för aktuell patientgrupp (behandlingserfarna patienter) baseras på 48 veckors data från två identiska randomiserade, kontrollerade, blindade multicenterstudier: BENCHMRK 1 (n = 352, Europa, Asien, Sydamerika) och BENCHMRK 2 (n = 351, Nord- och Sydamerika) Huvudsakliga inklusionskriterier: Resistens mot minst ett läkemedel inom vardera klasser NRTI, NNRTI och PI. Hiv-RNA >1 000 kopior under aktuell behandling (minst två månaders duration). 16 år. Tabell III. Resultat vecka 48 med raltegravir respektive efavirenz i kombination med tenofovir/lamivudinbehandlingsnaiva patienter. Hiv-1 RNA, < 50 kopior/ml Alla n/n (%) Raltegravir, 100 mg b.i.d. 33/39 (85) Raltegravir, 200 mg b.i.d. 33/40 (83) Raltegravir, 400 mg b.i.d. 36/41 (88) Raltegravir, 600 mg b.i.d. 35/40 (88) Efavirenz, 600 mg q.d. 33/38 (87) Ökning Cd4+ T-celler jämfört baseline 1 medel, celler/µl (CI 95 %) Raltegravir, 100 mg b.i.d. 221 ( ) Raltegravir, 200 mg b.i.d. 146 (96 197) Raltegravir, 400 mg b.i.d ) Raltegravir, 600 mg b.i.d. 187 ( ) Efavirenz, 600 mg q.d. 170 ( ) 1 Medelvärde för Cd4+ T-celler vid baseline: 260 celler/µl, välbalanserat mellan grupperna. Figur 1. Andel (%) med hiv-rna < 50 Behandlingsvecka Information från Läkemedelsverket 3:
80 Monografier Design: Patienterna randomiserades (2:1) till (blindad) behandling med raltegravir 400 mg oralt två gånger dagligen eller placebo i kombination med optimerad bakgrund (OBT). OBT kunde inkludera enfuvirtid, tipranavir, och efterhand även darunavir. BENCHMRK-studierna pågår, med en total duration på 156 veckor. Resultat De inkluderade patienterna hade traditionella baseline-karakteristika för aktuell typ av studie, det vill säga huvudsakligen vita medelålders män, med framskriden hiv-infektion med resistens mot ett flertal läkemedel och omfattande tidigare antiretroviral terapi (Tabell V). Flertalet patienter inkluderades vid amerikanska respektive europeiska kliniker. Drygt 60 % av patienterna behandlade med raltegravir uppvisade icke detekterbar virusnivå vecka 24, vilket var cirka 30 % bättre jämfört med placebo (Tabell VI). Behandlingsutfallet med raltegravir var starkt associerat till antal aktiva läkemedel i OBT. Tabell IV. Resultat v 24 i dos-kombinationsstudie, behandlingserfarna patienter. Raltegravir (b.i.d) Placebo 200 mg (n = 43) 400 mg (n = 45) 600 mg (n = 45) (n = 45) Andel med hiv-rna < 50 kopior/ml, n (%) 28 (65,1) 25 (55,6) 30 (66,7) 6 (13,3) Hiv-RNA-sänkning (log 10 kopior/ml) 1,80 1,87 1,84 0,35 Ökning Cd4+ T-celler, medel (celler/µl) 62,9 112,8 94,1 5,4 Tabell V. Patientkarakteristika i BENCHMRK (n = 699). Manligt kön 88 % Ras (vit, svart, latinamerikan, asiat), % 68; 13; 10; 3 Inkluderad från Nordamerika: Europa: 42 % 37 % Ålder, medel 45 år CD4-tal (celler/µl blod) ~150 Hiv-RNA (log 10 kopior/ml) 4,6 Antal år med ART ~10 1 aktiva läkemedel i OBT (GSS) 65 % Co-infektion Hepatit C (ej B) Hepatit B (ej C) 9 % 6 % Tabell VI. Resultat vecka 24, BENCHMRK 1 + 2, ITT. Ökning av CD4-T-celler, medel/µl blod Andel (%) hiv-rna < 50 kopior/ml Alla Vid baseline hiv-rna: kopior/ml < kopior/ml Med antal aktiva ARV i OBT 1 = Enfuvirtid med i OBT Ja (för första gången) Nej Darunavir med i OBT Ja (för första gången) Nej 1 Baserat på GSS, Genotypic Sensitivity Score. Raltegravir 400 mg b.i.d. (n = 462) (49/111) 71 (122/173) 75 (81/108) 81 (73/90) 62 (173/278) 72 (114/159) 62 (169/271) Placebo (n = 237) (4/64) 37 (35/94) 60 (29/48) 62 (29/47) 30 (43/145) 55 (48/88) 24 (32/135) Skillnad mot placebo, % (CI 95 %) 30,0 (22,3; 37,4) 37,9 (26,0; 48,4) 33,3 (21,0; 44.6) 14,6 ( 0,9; 30,7) 19,4 (3,8; 35,6) 32,6 (22,8; 41,5) 17,2 (47; 29,6) 38,7 (29,0; 47,3) 80 Information från Läkemedelsverket 3:2008
81 Monografier Andra patientgrupper Tidigare obehandlade vuxna 48-veckorsdata från dosstudier av tidigare obehandlade patienter finns presenterade tidigare i monografin. Konfirmerande studier pågår; för godkännande krävs tvåårsdata om man visar non-inferiority och ettårsdata om man visar superiority för denna patientgrupp. Barn Det pågår studier av behandlingserfarna barn och unga vuxna. Resultat skall enligt aktuell planering presenteras under Säkerhetsvärdering Sammanfattningsvis var raltegravir väl tolererat i de pivotala studierna. I dessa avbröts behandling på grund av biverkningar hos cirka 2 % av patienter behandlade med raltegravir, liknande som med placebo. Prekliniska data Gängse studier avseende allmäntoxicitet, upprepad dosering avseende toxicitet, genotoxicitet och utvecklingstoxicitet har utförts med raltegravir på möss, råttor, hundar och kaniner. Vid exponeringsnivåer betydligt högre än terapeutiska koncentrationer sågs ingen specifik toxicitet; det vill säga inget målorgan för toxicitet sågs i djurstudierna. Långtidsstudier (två år) av karcinogenicitet för raltegravir hos gnagare pågår men är ännu inte slutförda. Ingen mutagenicitet sågs in vitro. Raltegravir var inte teratogent i studier avseende utvecklingstoxicitet på råttor och kaniner. Kliniska säkerhetsdata Exponering Vid godkännandet hade 758 patienter randomiserats till raltegravir. Inkluderande patienter som erhållit raltegravir open-label inom studierna var siffran 900. Medianexponeringen av dos 400 mg b.i.d. var 35 veckor; de flesta hade exponerats minst 24 veckor (upp till 90 veckor). Biverkningar I poolad analys av pivotala studierna och föregående dosstudie (studie 005, behandlingserfarna patienter) sågs biverkningar i liknande frekvens bland patienter randomiserade till raltegravir, jämfört med de randomiserade till placebo (Tabell VII). Utslag tenderade att ses i högre frekvens med raltegravir (23/507, 4,5 % jämfört med 8/282, 2,8 %). Inga av dessa utslag var allvarliga, eller medförde utsättning av raltegravir. Av utslag som prövarna ansåg vara relaterade till studiedrog, var frekvensen helt liknande (ralegravir 2 %, placebo 2,5 %). Patienter som behandlades med atazanavir och/ eller tenofovir får en högre exponering av raltegravir (se tidigare, Interaktioner med andra läkemedel ). Sådan behandling som del i OBT påverkade ej biverkningsfrekvens/mönster. Maligniteter Vid senaste rapporteringen inför godkännandet hade 19 maligniteter rapporterats hos patienter behandlade med raltegravir inom nämnda studier av behandlingserfarna och behandlingsnaiva patienter en liknande frekvens som hos placebogruppen, relativ risk 1,2 (0,4 4,1). Av dessa 19 var åtta rekurrenta, det vill säga hade diagnostiserats innan inklusion i studien. Typen av maligniteter var de typiska för aktuell patientgrupp. Maligniteter följs inom risk management-programmet. Påverkan på laboratorievärden En något högre frekvens av transaminasstegringar sågs med raltegravir (cirka 4,5 %) än med placebo (cirka 2,5 %) hos behandlingserfarna patienter. Likaså var CK-stegring något vanligare inom samma patientgrupp (3,2 % jämfört med 0,9 %). Övriga, sedvanliga, parametrar förekom i samma frekvens. Emellertid var både transaminasstegringar och CK-stegring mindre vanliga med raltegravir än med efavirenz i studie 004, behandlingsnaiva patienter. Sammanfattningsvis har man inte sett någon signifikant påverkan av raltegravir på sedvanlig blodkemi. Med tanke på avancerad OBT i de pivotala stu- Tabell VII. Biverkningar (%) inom pivotala studier och fas IIb dosstudie (005). Typ av biverkan 400 mg b.i.d. (N = 507) Placebo (N = 282) Skillnad raltegravir vs. placebo, % CI95 Patienter med 1 biverkan 84,0 86,2 7,1; 3,2 Gastrointestinala Diarré 16,6 19,5 8,8; 2,5 Illamående 9,9 14,2 9,5; 0,3 Metabola 10,3 8,5 2,7; 5,8 Muskuloskeletala 15,2 13,5 3,6; 6,6 CNS 22,1 22,7 6,9; 5,3 Huvudvärk 9,7 11,7 6,9; 2,3 Psykiatriska 10,8 12,1 6,2; 3,3 Hud utslag 4,5 2,8 1,0; 4,5 Information från Läkemedelsverket 3:
82 Monografier dierna är data avseende blodlipider mest intressanta att studera i behandlingsnaiva patienter. I tidigare nämnda studie 004 (behandlingsnaiva) sågs ingen påverkan på blodlipider (t-kolesterol, LDL, HDL eller triglycerider) av raltegravir givet tillsammans med tenofovir/lamivudin. QT-tid Vid dosering av mg raltegravir till friska försökspersoner (n = 12, moxifloxacin som positiv kontroll) sågs ingen association mellan koncentrationer av raltegravir och QT-tid. Man anser ej att det finns risk för QT-påverkan med raltegravir givet i godkänd dosering. Diskussion Raltegravir, den första godkända integrashämmaren, har visat sig vara en potent antiretroviral. Flera positiva aspekter noteras: Behandlingsutfallet i de pivotala studierna var lovande, då andelen patienter som uppnådde icke detekterbar virusnivå med raltegravir (drygt 60 %) var cirka 30 % högre än vad som sågs med placebo. De säkerhetsdata som hittills presenterats är begränsade, men har inte visat några signaler avseende toxicitet, vare sig i prekliniska eller kliniska studier. Raltegravir har en relativt låg interaktionspotential och är således lätt att dosera tillsammans med andra läkemedel. Den hiv-rna-sänkning som ses vid kort tids monoterapi är jämförbar med den som ses med boostrad proteashämmare, det vill säga cirka 2log 10 efter tio dagars behandling. I explorativ dosstudie av behandlingsnaiva patienter uppnådde patienter behandlade med raltegravir plus tenofovir/lamivudin icke detekterbar virusnivå signifikant snabbare än vad som setts med tidigare godkända trippelbehandlingar; cirka 70 % av patienterna hade icke detekterbart hiv-rna redan efter fyra veckors behandling. Den modell som hittills angivits som förklaring av den bifasiska sänkning av hiv-rna som ses vid antiretroviral behandling ifrågasätts härmed till del (4). Man har tidigare sagt att virus i den långsammare andra fasen av virussänkning under hiv-behandling kommer från vilande långlivade celler och/eller från utsläpp från dentritiska celler. En efterhand sjunkande cytotoxisk T-cellsrespons har även föreslagits som orsak. Ingen av dessa teorier kan förklara varför raltegravir, som ren integrashämmare, skulle påverka den andra virusfasen annorlunda, eftersom modellerna föreslår att detta virus härstammar från källor som en integrashämmare inte skulle påverka (redan integrerat virus). Det faktum att raltegravir givet i kombination medför en påtagligt snabb sänkning av virusnivåer har redan hunnit få stor uppmärksamhet inom professionen. I detta sammanhang bör dock noteras att raltegravir, och andra integrashämmare under utveckling, inte har en hög barriär mot resistens. För att signifikant nedsatt känslighet ska utvecklas mot boostrad proteashämmare krävs generellt flera mutationer i hiv-proteasgenen, det vill säga det råder en hög barriär mot resistens. För andra nu godkända direkta antiretroviraler, inklusive integrashämmare, kan enstaka mutationer i hiv-genomet medföra uttalat nedsatt känslighet hos det muterade viruset, så kallade nyckelmutationer. Åtminstone tre sådana nyckelmutationer är identifierade för raltegravir, vilka ensamma kraftigt reducerar känsligheten för preparatet. Vidare finns redan övertygande data som talar för att det råder en hög grad av korsresistens inom klassen integrashämmare. Detta innebär, den höga antivirala potensen till trots, att det är av stor vikt att raltegravir ges i kombination med andra aktiva läkemedel, för att undvika klassomfattande resistensutveckling. Referenser Där referens ej ges är data hämtade från godkännandeprocessens utredningsrapporter. Dessa finns till del summerade i Isentress European Public Assessment Report (Scientific Discussion): McColl DJ, et al. Resistance and cross-resistance to first-generation integrase inhibitors: insights from a Phase II study of elvitegravir (GS-9137). 16th International HIV Drug ResistanceWorkshop; 2007, Abstract Markowitz M, Morales-Ramirez JO, Nguyen BY, et al. Antiretroviral activity, pharmacokinetics, and tolerability of MK- 0518, a novel inhibitor of HIV-1 integrase, dosed as monotherapy for 10 days in treatment-naive HIV-1-infected individuals. J Acquir Immune Defic Syndr 2006;43: Markowitz M, Nguyen BY, Gotuzzo E, et al. Rapid and durable antiretroviral effect of the HIV-1 Integrase inhibitor raltegravir as part of combination therapy in treatment-naive patients with HIV-1 infection: results of a 48-week controlled study. J Acquir Immune Defic Syndr 2007:1;46: Murray JM, Emery S, Kelleher AD, et al. Antiretroviral therapy with the integrase inhibitor raltegravir alters decay kinetics of HIV, significantly reducing the second phase. AIDS 2007;21: Information från Läkemedelsverket 3:2008
83 Monografier Veterinärmedicinska läkemedel ProMeris/ProMeris Duo (metaflumizon respektive metaflumizon/amitraz) ATC-kod: QP53AX25/QP53AD51 Spot-on-lösning till katt respektive hund Fort Dodge Animal Health Holland Sammanfattning ProMeris och ProMeris Duo är två nya antiparasitära läkemedel. Båda innehåller metaflumizon, som är en insekticid med effekt mot loppor. Metaflumizon har ingen repellerande effekt utan verkar efter oralt upptag i lopporna. Effekten mätt som andel djur som blir helt fria från loppor var cirka 50 % i sex veckor, vilket i studierna visade sig vara likvärdigt med eller något sämre än effekten av kontrollsubstansen fipronil. Mätt som reduktion av antalet loppor var effekten %. Säkerheten vid behandling med metaflumizon bedöms som mycket god. Då någon larvicid/ovicid effekt inte finns dokumenterad krävs behandling med en insekticid produkt även av omgivningen för tillfredsställande behandlingsresultat. ProMeris Duo har indikation för hund och innehåller förutom metaflumizon även amitraz som har effekt mot fästingar. Amitraz är en välkänd antiparasitär substans, som dock inte funnits i något godkänt läkemedel på den svenska marknaden tidigare. Amitraz och dess aktiva metabolit är hämmare av monoaminoxidas och blockerar oktopaminreceptorer hos fästingarna. Metaboliten är även en alfa-2-receptoragonist med effekt på däggdjursceller. Det systemiska upptaget av amitraz från ProMeris Duo är dock begränsat och neurologiska biverkningar är därför sällsynta. Försiktighet bör dock iakttas särskilt i hushåll med små barn. Effekten mätt som andel djur som blir helt fria från fästingar var %, vilket i studierna var jämförbart med effekten av kontrollsubstansen fipronil. Reduktionen av antalet fästingar var > 90 % under studieperioden (56 dagar) i den pivotala fältstudien, vilket var något längre är de cirka fem veckor som dokumenterades i vissa av de experimentella studierna. Eftersom enstaka fästingar finns kvar trots behandling är effekten inte tillräcklig för att helt eliminera risken för fästingburna sjukdomar. Observera Amitraz som finns i Promeris Duo är toxiskt för katt och det är därför mycket viktigt att de båda ProMeris-produkterna inte blandas samman. ProMeris Duo är kontraindicerat till katt. Godkännandedatum: (central procedur). Läkemedelsverkets värdering ProMeris innehåller metaflumizon som har effekt mot loppor hos katt. Metaflumizon är en ny substans vars effekt förefaller vara jämförbar med den hos tidigare godkända alternativ. Metaflumizon finns även i ProMeris Duo i kombination med amitraz. Promeris Duo har effekt mot loppor och fästingar hos hund. Effekten och säkerheten bedöms vara jämförbar med den hos tidigare godkända alternativ. Verksam beståndsdel Den verksamma beståndsdelen i ProMeris är metaflumizon. Metaflumizon föreligger som en blandning av två stereoisomerer, en E- och en Z-isomer. Metaflumizon är lättlöslig i aceton och etylacetat, löslig i diklormetan, måttligt löslig i metanol och nästan olöslig i hexan. ProMeris finns tillgänglig i form av en spot-onlösning i endospipetter. Metaflumizon Information från Läkemedelsverket 3:
84 Monografier Indikationer ProMeris: För behandling av och prevention mot infektioner av loppor (Ctenocephalides canis och C. felis) hos katt. ProMeris Duo: För behandling av och prevention mot infektioner av loppor (Ctenocephalides canis och C. felis) och fästingar (Ixodes ricinus, Ixodes hexagonus, Rhipicephalus sanguineus, Dermacentor reticulatus och Dermacentor variabilis) hos hund. ProMeris och ProMeris Duo kan användas som ett led i behandling av loppallergidermatit (FAD). Dosering ProMeris: Rekommenderad minimidos är 40 mg metaflumizon/kg kroppsvikt, motsvarande 0,20 L/ kg kroppsvikt. ProMeris Duo: Rekommenderad minimidos är 20 g/kg kroppsvikt för vardera metaflumizon och amitraz, motsvarande 0,133 L/kg kroppsvikt. För optimal loppkontroll administreras produkten med fyra till sex veckors mellanrum under hela loppsäsongen. Loppangrepp förhindras i upp till sex veckor och fästingangrepp i upp till fyra veckor efter en enstaka behandling, beroende på det omgivande nyinfektionstrycket. Klinik Klinisk effekt Effekt av metaflumizon mot loppor (Ctenocephalides felis) hos hund och katt (ProMeris och Pro- Meris Duo) Engångsbehandling med 20 mg/kg kroppsvikt metaflumizon till hund eliminerade > 90 % av lopporna i experimentella studier. Effekten kvarstod upp till 35 dagar. Högre doser ledde inte till någon ytterligare bättre effekt hos hund, medan man hos katt såg den bästa effekten vid dosen 40 mg/kg. Vid denna dos till katt eliminerades > 90 % av lopporna och reinfektion förhindrades under sex veckor. Effekten var i båda djurslagen måttlig vid det första mättillfället (8 timmar) och fullgod efter timmar. Resultaten konfirmerandes i fältstudier där katter och hundar med loppor (> 5 dag 0) randomiserades till behandling med ProMeris/ProMeris Duo eller till en positiv komparator. Många olika raser/storlekar och varierande åldrar ingick i studien. Hos katt var effekten måttlig med cirka 50 % av katterna helt fria från loppor under studieperioden (56 dagar), vilket är jämförbart med effekten av den positiva kontrollen fipronil (Tabell I). Effekten mätt som reduktion av antalet loppor var cirka 90 % hos båda grupperna (Tabell II). Hos hund var effekten mätt som reduktion av antalet loppor cirka 85 % upp till dag 56, vilket var något lägre än väntat. Jämförelsesubstansen fipronil var effektivare (cirka 95 %). Att effekten inte nådde 90 %-nivån antogs bero på sämre effekt i två franska kliniker som låg i ett område med mycket stora loppproblem den säsongen. Den mer långsamt insättande effekten av metaflumizon (som verkar först när loppan bitit) jämfört med fipronil (som är ett kontaktgift) antas vara orsaken till att antalet loppor i pälsen vid varje enskild tidpunkt är högre i metaflumizongruppen. Andelen djur som blev helt fria från loppor framgår av Tabell III. I studierna behandlades även kontaktdjur i hushållet, vilket är viktigt för att undvika återinfektion. Som en del av behandlingen bör även omgivningen behandlas med en lämplig insekticid och textilier som djuren kommer i kontakt med bör tvättas. Tabell I. Effekt av metaflumizon mot loppor hos katt. Andel djur fria från loppor. Studiedag Metaflumizon 40 mg/kg Kontroll (fipronil) Antal katter Andel fria från loppor (%) Antal katter Andel fria från loppor (%) , , , , , , , ,86 Tabell II. Effekt av metaflumizon mot loppor hos katt. Procent reduktion av antalet loppor. Studiedag Metaflumizon 40 mg/kg Kontroll (fipronil) Antal katter % effekt Antal katter % effekt , , , , , , , ,7 84 Information från Läkemedelsverket 3:2008
85 Monografier Effekt av amitraz mot fästingar (Ixodes ricinus, Ixodes scapularis, Rhipicephalus sanguineus, Haemaphysalis leachi och Amblyomma americanum) hos hund (ProMeris Duo) Dosbestämningsstudier visar att 20 mg/kg amitraz är tillräckligt för att ge fullgod effekt. Antalet fästingar på djuret minskade med över 95 % med en effektduration på upp till fem veckor oberoende av species. Resultaten bekräftades i en fältstudie där hundar av blandade raser och åldrar ingick. Effekten mätt som reduktion av antalet fästingar var > 90 % under studietiden (56 dagar). Andelen hundar som blev helt fria från fästingar framgår av Tabell IV. Effekten mot såväl loppor som fästingar kvarstår även om djuren blir våta. Långvarig och intensiv vattenkontakt bör dock undvikas. Vid ofta återkommande vattenkontakt, särskilt i kombination med upprepad schamponering, kan effektdurationen förkortas. Studier har dock visat att schamponering två veckor efter behandling inte påverkade effektdurationen. Farmakodynamik och Farmakokinetik Metaflumizon är det gemensamma aktiva innehållsämnet i ProMeris och ProMeris Duo och det svarar för effekten mot loppor. Metaflumizon är en insekticid tillhörande semikarbazongruppen. Substansen blockerar natriumkanaler och därmed störs nervfunktioner, vilket resulterar i paralys och insektens död. Effekten medieras således på samma sätt som effekten av lokalanestetika, men substansen är mycket selektiv och toxiciteten för däggdjursceller är därför låg. Metaflumizon verkar efter oralt upptag hos parasiten. Detta innebär att effekten insätter långsammare än efter behandling med repellenter eller kontaktgifter. Amitraz svarar för effekten mot fästingar i ProMeris Duo till hund. Det är en formamidinakaricid med delvis okänd verkningsmekanism. Troligen medieras effekten genom hämning av monoaminoxidas (MAO) och genom att oktopaminreceptorer blockeras. Följden blir ökad nervaktivitet, vilket leder till fästingens död. Amitraz verkar som MAO-hämmare även på däggdjursceller och därutöver har en metabolit till amitraz (BTS27271) effekter på däggdjursceller genom att stimulera adrenerga alfa-2-receptorer. Katter är mycket känsliga för effekter av amitraz, vilket är orsaken till att ProMeris Duo är kontraindicerat till katt. Även människa och hund tillhör de djurslag där neurologiska effekter efter amitraz-exponering förekommer. ProMeris och ProMeris Duo är formulerade för att ge effekt mot loppor respektive loppor och fästingar genom icke-systemisk exponering för parasiterna på hud och hår. Maximal effekt erhålls inom 48 timmar. Efter lokal applicering på ett enda ställe mellan skulderbladen distribueras både metaflumizon och amitraz snabbt över hudytan. Maximala koncentrationer i hår nåddes i de flesta fall 1 7 dagar (kortare tid på katt än på hund) efter behandling och avtog inom 56 dagar efter behandling. Båda substanserna var mätbara i pälsen 56 dagar efter behandling. Det systemiska upptaget efter lokal applicering är i normalfallet försumbart. Tillräckligt upptag för att ge systemiska effekter av amitraz i hund kan dock förekomma hos enstaka individer, till exempel om djuren slickar sig eller vid skadad hud. Någon känd resistens mot metaflumizon finns inte i dagsläget. Det finns dock en viss risk för korsresistens med pyretroider (sådan korsresistens är påvisad för en kemiskt relaterad substans, indoxakarb). Eftersom substansen är ny har inducerad resistens inte hunnit uppstå. Fall av resistens mot amitraz hos fästing på nötkreatur har rapporterats och resistens hos Rhipicephalus sanguineus har kunnat påvisas in vitro. I dagsläget är resistens inte något problem under svenska förhållanden. Tabell III. Andel hundar som blev helt fria från loppor efter metaflumizonbehandling. Studiedag Metaflumizon 20 mg/kg Kontroll (fipronil) Antal hundar Andel fria från loppor (%) Antal hundar Andel fria från loppor (%) , , , , , , , ,5 Tabell IV. Effekt av amitraz mot fästingar hos hund. Studiedag Amitraz 20 mg/kg Kontroll (fipronil) Antal hundar Andel fria från fästingar (%) Antal hundar Andel fria från fästingar (%) , , , , , , , ,0 Information från Läkemedelsverket 3:
86 Monografier Säkerhetsvärdering Biverkningarna hos katt begränsar sig till lokala effekter såsom lindriga hud- och pälsförändringar dagarna efter applicering, samt hypersalivering om katten slickar applikationsstället medan det ännu är vått. Även hos hund är dessa lokala biverkningar de vanligaste. Därutöver ses, i mer sällsynta fall, tecken på amitrazförgiftning såsom sedering, slöhet, CNSdepression, hyperglykemi, bradykardi och långsam, ytlig andning, vilka kan förekomma hos en liten andel djur. Symtomen är vanligtvis övergående och upphör utan behandling inom 24 timmar. Vid allvarliga eller kvarstående symtom kan intramuskulär injektion med alfa-2-adrenoreceptorantagonisten atipamezolhydroklorid (Antisedan vet.) ges i dosen 0,2 mg/kg kroppsvikt. Toleransstudier är utförda på katter respektive hundar (beagle och chihuahua) ner till åtta veckors ålder i upp till fem gånger dosen upprepat upp till sju gånger var fjortonde dag. Användning rekommenderas därför inte till djur som är yngre än åtta veckor. Försvagade djur ska inte behandlas. Några kliniska tecken på förgiftning sågs inte i toleransstudierna. Hundar behandlade med ProMeris Duo visade dock tecken på förändringar i vissa klinisk-kemiska parametrar som till exempel förhöjning av glukos vid fem gånger dosen efter 24 timmar och i vissa fall åtta dagar efter behandling. Detta ses som en behandlingsrelaterad effekt kopplad till amitraz. För att minska risken för systemexponering bör man applicera spot-on-lösningen i nacken så att djuret inte kommer åt att slicka sig. Det är även viktigt att tillse att djur inte slickar varandra innan applikationsstället torkat. Detta gäller särskilt valpar i de fall en digivande tik behandlas. ProMeris Duo har visat sig vara säkert att använda till dräktiga tikar, medan motsvarande studier för ProMeris till katt saknas. Det finns dock ingenting som tyder på teratogena eller andra embryotoxiska effekter av metaflumizon. För att undvika onödig exponering av insekter och kvalster i omgivningsmiljön rekommenderas att man undviker att låta behandlade djur bada i floder, dammar eller strömmande vattendrag inom 24 timmar efter behandlingen. Riskerna för användaren är framför allt kopplade till risken för exponering av amitraz i ProMeris Duo. Liknande försiktighetsåtgärder rekommenderas dock för båda produkterna. ProMeris och ProMeris Duo får inte hanteras av barn. Detta gäller även använda pipetter och djuret självt under tiden fram till att appliceringsstället är torrt. Man rekommenderar därför att man applicerar lösningen på kvällen och därefter inte klappar djuret eller låter djuret sova i sängen den natten. För ProMeris Duo rekommenderas även användning av skyddshandskar eftersom amitraz kan orsaka hudsensibilisering och allergiska reaktioner. En speciell riskgrupp utgör personer som står på medicinsk behandling med monoaminoxidashämmare. Dessa bör hantera ProMeris Duo med extra stor försiktighet. Referens EPAR ( Du vet väl att samtliga läkemedelsmonografier finns på 86 Information från Läkemedelsverket 3:2008
87 Läkemedelsförmånsnämnden Läkemedelsförmånsnämnden, LFN, är den myndighet som beslutar vilka läkemedel och förbrukningsartiklar som ska subventioneras av samhället. Besluten fattas av en nämnd som finns inom myndigheten. Nämnden består av en ordförande och tio ledamöter. Ledamöterna har tillsammans en bred medicinsk, såväl praktisk som vetenskaplig, och hälsoekonomisk kompetens. Två av ledamöterna har erfarenhet från brukargrupper. Cancerläkemedlet Tasigna beviljas subvention Läkemedelsförmånsnämnden, LFN, har beslutat att cancerläkemedlet Tasigna ska ingå i läkemedelsförmånen och räknas in i högkostnadsskyddet. Tasigna används för att behandla blodcancersjukdomen kronisk myeloisk leukemi. Tasigna är ett särläkemedel för behandling av vuxna med kronisk myeloisk leukemi, KML. KML är en cancersjukdom som drabbar de vita blodkropparna. LFN bedömer att sjukdomens svårighetsgrad är hög. De personer som är aktuella för behandling med Tasigna är mycket svårt sjuka och behöver bra, effektiva läkemedel. Det är viktigt för oss att samhällets pengar satsas på de patientgrupper som har de största behandlingsbehoven. Varje år insjuknar cirka 100 personer i kronisk myeloisk leukemi, KML. De flesta som drabbas är om- kring 60 år då diagnosen ställs. Män drabbas oftare än kvinnor. Om inte sjukdomen behandlas är överlevnaden knappt fyra år. Det enda alternativet till Tasigna är läkemedlet Sprycel som är likvärdigt, både avseende medicinsk effekt och kostnader. De två läkemedlen har dock något olika biverkningsprofil vilket ger patienterna ytterligare ett behandlingsalternativ. Läkemedlet riktar sig till en svårt sjuk patientgrupp och ger likvärdig medicinsk effekt och kostnad som det mest relevanta behandlingsalternativet. Sänkta priser för läkemedelskopior sparade fem miljarder Priserna på läkemedelskopior fortsatte att falla under Sedan systemet med utbyte av likvärdiga läkemedel infördes på landets apotek har prisnivån för kopiorna halverats. Prisnedgången på dessa läkemedel motsvarade bara under 2007 en besparing på fem miljarder kronor. Läkemedelsförmånsnämnden, LFN, hanterar över prisansökningar varje år. De flesta handlar om prissänkningar på så kallade generika, kopior av läkemedel vars patent gått ut. Det nya systemet för utbyte av läkemedel infördes Det innebär att Apoteket alltid lämnar ut det billigaste likvärdiga läkemedlet till kunden (om inte kunden väljer att själv betala mellanskillnaden till det dyrare preparatet, alternativt om förskrivaren motsatt sig utbyte genom att signera får ej bytas ut -rutan på receptblanketten). Att apoteken erbjuder den läkemedelskopia som har lägst pris skapar utrymme för samhället att ha råd med fler och dyrare läkemedel. Det leder till att vi får ut mer hälsa för de skattepengar som går till subvention av läkemedel. Läkemedelsföretagen konkurrerar om att alltid ha lägsta pris så att Apoteket lämnar ut deras läkemedel till kunden. Konkurrensen har resulterat i att prisnivån på läkemedelskopior har halverats sedan Ett exempel är den tidigare storsäljaren Zocord mot höga blodfetter. Sedan patentet gick ut har priset på detta läkemedel sjunkit cirka 95 procent. Siffrorna är hämtade ur LFN:s årsredovisning för år 2007 som finns att ladda ned från LFN:s webbplats För dessa sidor ansvarar LFN: Läkemedelsförmånsnämnden, kontakt: Cecilia Hultin, Box 55, Solna, Telefon: , e-post: Cecilia.Hultin@lfn.se, Information från Läkemedelsverket 3:
Nedre luftvägsinfektioner hos vuxna Nya riktlinjer och kvalitetsindikatorer
 Nedre luftvägsinfektioner hos vuxna Nya riktlinjer och kvalitetsindikatorer Sven Engström Distriktsläkare Gränna Vårdcentral Ordf. SFAMQ Omfattning Patienter med luftvägsinfektioner är vanliga i primärvården
Nedre luftvägsinfektioner hos vuxna Nya riktlinjer och kvalitetsindikatorer Sven Engström Distriktsläkare Gränna Vårdcentral Ordf. SFAMQ Omfattning Patienter med luftvägsinfektioner är vanliga i primärvården
Nedre luftvägsinfektioner hos barn och vuxna. Carl Spindler Karolinska Universitetssjukhuset 2013
 Nedre luftvägsinfektioner hos barn och vuxna Carl Spindler Karolinska Universitetssjukhuset 2013 Problemets omfattning Luftvägsinfektioner utgör 10-30% av alla konsultationer i öppen vård Bland patienter
Nedre luftvägsinfektioner hos barn och vuxna Carl Spindler Karolinska Universitetssjukhuset 2013 Problemets omfattning Luftvägsinfektioner utgör 10-30% av alla konsultationer i öppen vård Bland patienter
Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni
 Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni Sigvard Mölstad Primärvårdens FoU-enhet Jönköping Sidan 1 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Rekommendationer från
Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni Sigvard Mölstad Primärvårdens FoU-enhet Jönköping Sidan 1 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Rekommendationer från
Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård
 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Den 21 22 november 2007 anordnades en workshop om farmakologisk behandling av nedre luftvägsinfektioner i samarbete mellan Läkemedelsverket
Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Den 21 22 november 2007 anordnades en workshop om farmakologisk behandling av nedre luftvägsinfektioner i samarbete mellan Läkemedelsverket
Pneumoni på vårdcentral
 Pneumoni på vårdcentral Vad är rekommenderad behandlingstid vid 1. 7 dagar Rätt pneumoni: 1. 10 dagar 2. 14 dagar När rekommenderas lungrtg som uppföljning vid pneumoni? 1. Alltid (för att kontrollera
Pneumoni på vårdcentral Vad är rekommenderad behandlingstid vid 1. 7 dagar Rätt pneumoni: 1. 10 dagar 2. 14 dagar När rekommenderas lungrtg som uppföljning vid pneumoni? 1. Alltid (för att kontrollera
Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni. Sigvard Mölstad Lunds Universitet, CRC, Malmö
 Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni Sigvard Mölstad Lunds Universitet, CRC, Malmö PRIS: 60 vårdcentraler. 10 diagnoser stod för 89 % av antibiotikaförskrivningen 2010 Diagnos % av total
Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni Sigvard Mölstad Lunds Universitet, CRC, Malmö PRIS: 60 vårdcentraler. 10 diagnoser stod för 89 % av antibiotikaförskrivningen 2010 Diagnos % av total
Information. Årgång 19 NummeR 3 maj 2008. Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård ny rekommendation 7
 Information från Läkemedelsverket Årgång 19 NummeR 3 maj 2008 ny rekommendation 7 Patienter med luftvägsinfektioner är vanliga inom primärvården i de nordiska länderna, där de utgör 10 30 % av alla konsultationer.
Information från Läkemedelsverket Årgång 19 NummeR 3 maj 2008 ny rekommendation 7 Patienter med luftvägsinfektioner är vanliga inom primärvården i de nordiska länderna, där de utgör 10 30 % av alla konsultationer.
Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni. Sigvard Mölstad Lunds Universitet, CRC, Malmö
 Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni Sigvard Mölstad Lunds Universitet, CRC, Malmö PRIS: 60 vårdcentraler. 10 diagnoser stod för 89 % av antibiotikaförskrivningen 2010 Diagnos % av total
Nedre luftvägsinfektioner hosta, akut bronkit, pneumoni Sigvard Mölstad Lunds Universitet, CRC, Malmö PRIS: 60 vårdcentraler. 10 diagnoser stod för 89 % av antibiotikaförskrivningen 2010 Diagnos % av total
Nedre luftvägsinfektioner. Katarina Hedin specialist i allmänmedicin, docent Växjö
 Nedre luftvägsinfektioner Katarina Hedin specialist i allmänmedicin, docent Växjö Nedre luftvägsinfektion Pneumoni Bronkit Figur 2. (illustration av M Bergman/K Strålin). Information från Läkemedelsverket
Nedre luftvägsinfektioner Katarina Hedin specialist i allmänmedicin, docent Växjö Nedre luftvägsinfektion Pneumoni Bronkit Figur 2. (illustration av M Bergman/K Strålin). Information från Läkemedelsverket
Powerpointpresentation som kan användas vid fortbildning av vårdcentralens personal. Anteckningarna under bilderna är ett stöd för den som håller i
 Powerpointpresentation som kan användas vid fortbildning av vårdcentralens personal. Anteckningarna under bilderna är ett stöd för den som håller i presentationen, exempelvis Stramas kontaktläkare. Denna
Powerpointpresentation som kan användas vid fortbildning av vårdcentralens personal. Anteckningarna under bilderna är ett stöd för den som håller i presentationen, exempelvis Stramas kontaktläkare. Denna
Powerpointpresentation som kan användas vid fortbildning av vårdcentralens personal. Anteckningarna under bilderna är ett stöd för den som håller i
 Powerpointpresentation som kan användas vid fortbildning av vårdcentralens personal. Anteckningarna under bilderna är ett stöd för den som håller i presentationen, exempelvis Stramas kontaktläkare. Denna
Powerpointpresentation som kan användas vid fortbildning av vårdcentralens personal. Anteckningarna under bilderna är ett stöd för den som håller i presentationen, exempelvis Stramas kontaktläkare. Denna
STRAMA 2004 Luftvägsinfektioner hos vuxna
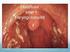 STRAMA 2004 Luftvägsinfektioner hos vuxna Jonas Hedlund Infektionskliniken, Karolinska Universitetssjukhuset Solna Ämnesområden Pneumoni hos vuxna revision jämfört vårdprogram 1997 Influensa hos vuxna,
STRAMA 2004 Luftvägsinfektioner hos vuxna Jonas Hedlund Infektionskliniken, Karolinska Universitetssjukhuset Solna Ämnesområden Pneumoni hos vuxna revision jämfört vårdprogram 1997 Influensa hos vuxna,
Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni
 Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni Mårten Prag, Kristoffer Strålin, Hans Holmberg Infektionskliniken, Universitetssjukhuset, Örebro Antibiotikabehandling på sjukhus vid samhällsförvärvad
Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni Mårten Prag, Kristoffer Strålin, Hans Holmberg Infektionskliniken, Universitetssjukhuset, Örebro Antibiotikabehandling på sjukhus vid samhällsförvärvad
Luftvägsinfektioner Folke Lagerström Vivalla VC
 Luftvägsinfektioner Folke Lagerström Vivalla VC Pneumoni - Tonsillit - Sinuit - Otit Vilka bör antibiotikabehandlas? Vilka kan avstå från behandling? Vilka antibiotika bör användas? Tecken allvarlig infektion:
Luftvägsinfektioner Folke Lagerström Vivalla VC Pneumoni - Tonsillit - Sinuit - Otit Vilka bör antibiotikabehandlas? Vilka kan avstå från behandling? Vilka antibiotika bör användas? Tecken allvarlig infektion:
Pneumonier i öppen och slutenvård Strama
 MEDICINSK INSTRUKTION 1 (8) Pneumoni är en av de vanligaste infektionsdiagnoserna inom slutenvården. Endast en liten andel vårdas på infektionsklink, och många patienter med pneumonier handläggs polikliniskt
MEDICINSK INSTRUKTION 1 (8) Pneumoni är en av de vanligaste infektionsdiagnoserna inom slutenvården. Endast en liten andel vårdas på infektionsklink, och många patienter med pneumonier handläggs polikliniskt
fråga pat HUR hen reagerade! DOKUMENTERA
 Luftvägsinfektioner Varning Om allergi finns angiven: fråga pat HUR hen reagerade! Om pat får misstänkt allergisk reaktion DOKUMENTERA substans, symtom och förlopp i journalen! Tips: kolla gamla recept!
Luftvägsinfektioner Varning Om allergi finns angiven: fråga pat HUR hen reagerade! Om pat får misstänkt allergisk reaktion DOKUMENTERA substans, symtom och förlopp i journalen! Tips: kolla gamla recept!
PRIS Primärvårdens Infektionsdatabas
 PRIS Primärvårdens Infektionsdatabas 07-11 Primärvårdens FoU-enhet Jönköping Sven Engström Alla vårdcentraler som har RAVE inbjuds att delta. På mindre 4. Fyll än i datumintervallet 5 minuter skapas ovan
PRIS Primärvårdens Infektionsdatabas 07-11 Primärvårdens FoU-enhet Jönköping Sven Engström Alla vårdcentraler som har RAVE inbjuds att delta. På mindre 4. Fyll än i datumintervallet 5 minuter skapas ovan
Optimalt omhändertagande av pneumonipatienter. Jessica Kaminska 2012-10-24
 Optimalt omhändertagande av pneumonipatienter Jessica Kaminska 2012-10-24 Pneumoni Hos icke immunsupprimerade patienter med samhällsförvärvad pneumoni som behandlas på sjukhus Innehåll Pre- och post-antibiotika
Optimalt omhändertagande av pneumonipatienter Jessica Kaminska 2012-10-24 Pneumoni Hos icke immunsupprimerade patienter med samhällsförvärvad pneumoni som behandlas på sjukhus Innehåll Pre- och post-antibiotika
Rekommendationer för antibiotikabehandling SJUKHUSVÅRD 2013-12-03
 PNEUMONI CRB-65 är ett klinisk index som består av 4 enkla parametrar (konfusion, respiration, blodtryck och ålder) som var och en kan generera en poäng. CRB-65 används som gradering av allvarlighetsgrad
PNEUMONI CRB-65 är ett klinisk index som består av 4 enkla parametrar (konfusion, respiration, blodtryck och ålder) som var och en kan generera en poäng. CRB-65 används som gradering av allvarlighetsgrad
Primärvårdens Infektionsdatabas, PRIS, 2010
 Primärvårdens Infektionsdatabas, PRIS, 2010 Antal enheter, antal listade, 2010 56 vårdcentraler - 32 från Stockholmsområdet - 24 från övriga landet 528 932 listade - 348 982 från Stockholmsområdet - 179
Primärvårdens Infektionsdatabas, PRIS, 2010 Antal enheter, antal listade, 2010 56 vårdcentraler - 32 från Stockholmsområdet - 24 från övriga landet 528 932 listade - 348 982 från Stockholmsområdet - 179
Delexamen 4 Infektion FACIT
 MEQ-fråga 1 Sida 1 (7) (Totalt 19 poäng) Natten är på väg att övergå idag i mitten av februari och du är medicinjour på Norrtälje sjukhus när en 66-årig man dyker upp. Han berättar att han för 3 dagar
MEQ-fråga 1 Sida 1 (7) (Totalt 19 poäng) Natten är på väg att övergå idag i mitten av februari och du är medicinjour på Norrtälje sjukhus när en 66-årig man dyker upp. Han berättar att han för 3 dagar
Behandlingsrekommendationer. Luftvägsinfektioner
 Behandlingsrekommendationer Luftvägsinfektioner Våren 2013 U T G I V E N A V L Ä K E M E D E L S K O M M I T T É N I L A N D S T I N G E T S Ö R M L A N D SIDAN 2 LUFTVÄGSINFEKTIONER LUFTVÄGSINFEKTION
Behandlingsrekommendationer Luftvägsinfektioner Våren 2013 U T G I V E N A V L Ä K E M E D E L S K O M M I T T É N I L A N D S T I N G E T S Ö R M L A N D SIDAN 2 LUFTVÄGSINFEKTIONER LUFTVÄGSINFEKTION
Pneumoni - diagnostik och behandling hos immunkompetenta
 Godkänt den: 2016-07-18 Ansvarig: Fredrik Sund Gäller för: Infektionssjukdomar Pneumoni - diagnostik och behandling hos immunkompetenta Innehåll Bedömning av svårighetsgrad enligt CRB-65...2 Etiologisk
Godkänt den: 2016-07-18 Ansvarig: Fredrik Sund Gäller för: Infektionssjukdomar Pneumoni - diagnostik och behandling hos immunkompetenta Innehåll Bedömning av svårighetsgrad enligt CRB-65...2 Etiologisk
Minifall Tecken på allvarlig infektion 2019
 Minifall Tecken på allvarlig infektion 2019 2019-05-22 Om ni har valt Minifall Tecken på allvarlig infektion som del av ert självdeklarationsarbete, ska ni diskutera alla de tre korta journalanteckningarna
Minifall Tecken på allvarlig infektion 2019 2019-05-22 Om ni har valt Minifall Tecken på allvarlig infektion som del av ert självdeklarationsarbete, ska ni diskutera alla de tre korta journalanteckningarna
Antibiotikabehandling i öppenvård (Reviderad 2012-04-10)
 1 Strama NLL Antibiotikabehandling i öppenvård (Reviderad 2012-04-10) I arbetet med att uppdatera STRAMAs antibiotikarekommendationer har vi tittat mycket på möjligheten att optimera doseringen av antibiotika.
1 Strama NLL Antibiotikabehandling i öppenvård (Reviderad 2012-04-10) I arbetet med att uppdatera STRAMAs antibiotikarekommendationer har vi tittat mycket på möjligheten att optimera doseringen av antibiotika.
PM Medicinskt. Pneumokocker- Akut sjukdomsdebut, hållsmärta och LPK>15x10 9. Ses i alla åldrar. Haemophilus influenzae- Vanlig hos patienter med KOL
 Specialitet: Infektionsmedicin PM Medicinskt Text författare: Jon Olinder/Anna-Karin Larsson Faktaansvarig: Jon Olinder/Anna-Karin Larsson Godkänt av: Johan Sundler Skapat: 2008-01-22 Reviderat: 2013-04-04
Specialitet: Infektionsmedicin PM Medicinskt Text författare: Jon Olinder/Anna-Karin Larsson Faktaansvarig: Jon Olinder/Anna-Karin Larsson Godkänt av: Johan Sundler Skapat: 2008-01-22 Reviderat: 2013-04-04
Chlamydia pneumoniae (TWAR) kan orsaka såväl akuta som kroniska luftvägsinfektioner.
 There are no translations available. BAKGRUND/ORSAKER Chlamydia pneumoniae (TWAR) kan orsaka såväl akuta som kroniska luftvägsinfektioner. Klamydier är små gramnegativa strikt intracellulära bakterier,
There are no translations available. BAKGRUND/ORSAKER Chlamydia pneumoniae (TWAR) kan orsaka såväl akuta som kroniska luftvägsinfektioner. Klamydier är små gramnegativa strikt intracellulära bakterier,
Rekommendationer för antibiotikabehandling ÖPPENVÅRD 2014-05-14. Innehåll ALLMÄN INFORMATION... 2 LUFTVÄGSINFEKTIONER... 3
 Strama NLL Rekommendationer för antibiotikabehandling ÖPPENVÅRD 2014-05-14 Innehåll ALLMÄN INFORMATION... 2 LUFTVÄGSINFEKTIONER... 3 Streptokocktonsillit... 3 Akut mediaotit... 3 Akut rhinosinuit... 3
Strama NLL Rekommendationer för antibiotikabehandling ÖPPENVÅRD 2014-05-14 Innehåll ALLMÄN INFORMATION... 2 LUFTVÄGSINFEKTIONER... 3 Streptokocktonsillit... 3 Akut mediaotit... 3 Akut rhinosinuit... 3
Sjukhusförvärvad pneumoni - behandlingsrekommendation
 Sjukhusförvärvad pneumoni - behandlingsrekommendation Ett konsensusdokument från expertmöte anordnat av Läkemedelsverket 5 6 maj 2015 Definitioner HAP (hospital-acquired pneumonia) - sjukhusförvärvad pneumoni,
Sjukhusförvärvad pneumoni - behandlingsrekommendation Ett konsensusdokument från expertmöte anordnat av Läkemedelsverket 5 6 maj 2015 Definitioner HAP (hospital-acquired pneumonia) - sjukhusförvärvad pneumoni,
Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni
 Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni 1. Hur ska samhällsförvärvad pneumoni behandlas? - Infektionsläkarföreningens
Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni Antibiotikabehandling på sjukhus vid samhällsförvärvad pneumoni 1. Hur ska samhällsförvärvad pneumoni behandlas? - Infektionsläkarföreningens
VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER RIKTLINJE FÖR VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER
 VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER RIKTLINJE FÖR VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER KARLSTADS KOMMUN Beslutad i: Vård- och omsorgsförvaltningen Ansvarig: Medicinskt ansvarig sjuksköterska
VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER RIKTLINJE FÖR VACCINATION MOT INFLUENSA OCH PNEUMOKOCKER KARLSTADS KOMMUN Beslutad i: Vård- och omsorgsförvaltningen Ansvarig: Medicinskt ansvarig sjuksköterska
SKÅNELISTAN 2006 rekommenderade läkemedel. Antibiotikaval. vid vanliga infektioner i öppen vård
 SKÅNELISTAN 2006 rekommenderade läkemedel Antibiotikaval vid vanliga infektioner i öppen vård Terapigrupp Antibiotika/infektioner i öppen vård Övertyga Dig om diagnosen! Behandla inte akut bronkit eller
SKÅNELISTAN 2006 rekommenderade läkemedel Antibiotikaval vid vanliga infektioner i öppen vård Terapigrupp Antibiotika/infektioner i öppen vård Övertyga Dig om diagnosen! Behandla inte akut bronkit eller
Antibiotikaförskrivning vid akut bronkit på Tallhöjdens vårdcentral
 VESTA Antibiotikaförskrivning vid akut bronkit på Tallhöjdens vårdcentral ST-läk : Fahad Youssef Klinisk handledare: Rodulf Najjar Vetenskaplig handledare: Holger Theobald Sammanfattning Bakgrund Nedre
VESTA Antibiotikaförskrivning vid akut bronkit på Tallhöjdens vårdcentral ST-läk : Fahad Youssef Klinisk handledare: Rodulf Najjar Vetenskaplig handledare: Holger Theobald Sammanfattning Bakgrund Nedre
Rekommendationer för antibiotikabehandling ÖPPENVÅRD
 Strama NLL Rekommendationer för antibiotikabehandling ÖPPENVÅRD 2013-06-11 I arbetet med att uppdatera STRAMAs antibiotikarekommendationer har vi tittat mycket på möjligheten att optimera doseringen av
Strama NLL Rekommendationer för antibiotikabehandling ÖPPENVÅRD 2013-06-11 I arbetet med att uppdatera STRAMAs antibiotikarekommendationer har vi tittat mycket på möjligheten att optimera doseringen av
Influensa- och pneumokockvaccination
 Influensa- och pneumokockvaccination Åke Örtqvist Smittskyddsläkare 1 december, 2016 Influensa- och pneumokockvaccinationskampanjen nästan. Kampanjperiod 9 nov - 28 feb http://www.vardgivarguiden.se/behandlingsstod/smitt
Influensa- och pneumokockvaccination Åke Örtqvist Smittskyddsläkare 1 december, 2016 Influensa- och pneumokockvaccinationskampanjen nästan. Kampanjperiod 9 nov - 28 feb http://www.vardgivarguiden.se/behandlingsstod/smitt
Handläggning av lindrigt sjuka patienter med misstänkt influensasjukdom
 2013-01-11 Information till 1177/Vårdguiden Handläggning av lindrigt sjuka patienter med misstänkt influensasjukdom Influensaaktiviteten kommer att öka de närmaste veckorna. Svininfluensa (influensa A(H1N1)pdn09
2013-01-11 Information till 1177/Vårdguiden Handläggning av lindrigt sjuka patienter med misstänkt influensasjukdom Influensaaktiviteten kommer att öka de närmaste veckorna. Svininfluensa (influensa A(H1N1)pdn09
Resistensläge i öppenvård:
 Resistensläge i öppenvård: S. aureus i sårodlingar Haemophilus influenzae i nasofarynxodlingar Streptococcus pneumoniae i nasofarynxodlingar E. coli i urinodlingar Johanna Haiko och Inga Fröding Klinisk
Resistensläge i öppenvård: S. aureus i sårodlingar Haemophilus influenzae i nasofarynxodlingar Streptococcus pneumoniae i nasofarynxodlingar E. coli i urinodlingar Johanna Haiko och Inga Fröding Klinisk
Luftvägsinfektioner. Kristoffer Strålin, Docent, Överläkare Infektionskliniken Karolinska Universitetssjukhuset
 Luftvägsinfektioner Kristoffer Strålin, Docent, Överläkare Infektionskliniken Karolinska Universitetssjukhuset April 2014 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Rekommendationer
Luftvägsinfektioner Kristoffer Strålin, Docent, Överläkare Infektionskliniken Karolinska Universitetssjukhuset April 2014 Farmakologisk behandling av nedre luftvägsinfektioner i öppen vård Rekommendationer
Rapport från Pneumoniregistret 2012
 Rapport från Pneumoniregistret 212 Sammanfattning Det nationella kvalitetsregistret för patienter som vårdas för pneumoni på infektionsklinik skapades av Infektionsläkarföreningen för att öka kunskapen
Rapport från Pneumoniregistret 212 Sammanfattning Det nationella kvalitetsregistret för patienter som vårdas för pneumoni på infektionsklinik skapades av Infektionsläkarföreningen för att öka kunskapen
Influensa- och pneumokockvaccination säsongen 2018/2019 i Västmanland - Kampanjstart tisdag den 6 november 2018
 INFORMATION 1 (5) Aktuellt inför höstens vaccinationskampanj Årets influensakampanj startar i början av november precis som ifjol. Inför den här säsongen har vi i regionen upphandlat ett nytt vaccin, Vaxigrip
INFORMATION 1 (5) Aktuellt inför höstens vaccinationskampanj Årets influensakampanj startar i början av november precis som ifjol. Inför den här säsongen har vi i regionen upphandlat ett nytt vaccin, Vaxigrip
SKÅNELISTAN 2007 rekommenderade läkemedel. Antibiotikaval. vid vanliga infektioner i öppen vård. Terapigrupp Antibiotika/infektioner i öppen vård
 SKÅNELISTAN 2007 rekommenderade läkemedel Antibiotikaval vid vanliga infektioner i öppen vård Terapigrupp Antibiotika/infektioner i öppen vård Övertyga Dig om diagnosen! Behandla inte akut bronkit eller
SKÅNELISTAN 2007 rekommenderade läkemedel Antibiotikaval vid vanliga infektioner i öppen vård Terapigrupp Antibiotika/infektioner i öppen vård Övertyga Dig om diagnosen! Behandla inte akut bronkit eller
Luftvägssmitta, Smittspårningsutbildning Bodil Ardung Tf. enhetschef / smittskyddssjuksköterska
 Luftvägssmitta, Smittspårningsutbildning 2018 Bodil Ardung Tf. enhetschef / smittskyddssjuksköterska Allmänfarliga Difteri Fågelinfluensa Smittspårningspliktiga luftvägsinfektioner Pneumokocker med nedsatt
Luftvägssmitta, Smittspårningsutbildning 2018 Bodil Ardung Tf. enhetschef / smittskyddssjuksköterska Allmänfarliga Difteri Fågelinfluensa Smittspårningspliktiga luftvägsinfektioner Pneumokocker med nedsatt
Klinisk basgrupp/typfall Infektionsmedicin, Termin 7
 Fall 4: Emma, 30 år Emma, 30 år, söker på vårdcentralen med urinträngningar sedan 3 dagar tillbaks. Hon är frisk sedan tidigare, är gravid i vecka 21. Ingen känd antibiotikaöverkänslighet. Hon har inte
Fall 4: Emma, 30 år Emma, 30 år, söker på vårdcentralen med urinträngningar sedan 3 dagar tillbaks. Hon är frisk sedan tidigare, är gravid i vecka 21. Ingen känd antibiotikaöverkänslighet. Hon har inte
Vaccination mot influensa
 Vaccination mot influensa 2017-2018 Information till Mödrahälsovården från Smittskydd Västra Götaland Alla gravida rekommenderas vaccination Gravida har en förhöjd risk att drabbas av svår influensasjukdom
Vaccination mot influensa 2017-2018 Information till Mödrahälsovården från Smittskydd Västra Götaland Alla gravida rekommenderas vaccination Gravida har en förhöjd risk att drabbas av svår influensasjukdom
Rapport från Pneumoniregistret 2011
 Rapport från Pneumoniregistret 2011 Sammanfattning Det nationella kvalitetsregistret för patienter som vårdas för pneumoni på infektionsklinik skapades av Infektionsläkarföreningen för att öka kunskapen
Rapport från Pneumoniregistret 2011 Sammanfattning Det nationella kvalitetsregistret för patienter som vårdas för pneumoni på infektionsklinik skapades av Infektionsläkarföreningen för att öka kunskapen
Behandling av infektioner i öppenvård - barn
 Behandling av infektioner i öppenvård - barn Ingrid Ziegler ST-läkare Infektionskliniken USÖ Luftvägsinfektioner hos barn Normalt i småbarnsgrupp: Rejäl feber var 3:e vecka under säsong Ofta hög feber-omogen
Behandling av infektioner i öppenvård - barn Ingrid Ziegler ST-läkare Infektionskliniken USÖ Luftvägsinfektioner hos barn Normalt i småbarnsgrupp: Rejäl feber var 3:e vecka under säsong Ofta hög feber-omogen
Patient information. Några råd när någon i Din familj får. varskrivelse 131 praktiserende læg. Ett europeiskt projekt med familjeläkare i sex länder
 Patient information Några råd när någon i Din familj får en infektion varskrivelse 131 praktiserende læg Ett europeiskt projekt med familjeläkare i sex länder LUFTVEJSINFEKTIONER I ALMEN PRAKS Virus eller
Patient information Några råd när någon i Din familj får en infektion varskrivelse 131 praktiserende læg Ett europeiskt projekt med familjeläkare i sex länder LUFTVEJSINFEKTIONER I ALMEN PRAKS Virus eller
1. Bakgrund. Beskrivning Diarienr: Ej tillämpligt 1(8)
 Beskrivning Diarienr: Ej tillämpligt 1(8) Dokument ID: 09-128818 Fastställandedatum: 2017-06-14 Giltigt t.o.m.: 2018-06-14 Upprättare: Signar K Mäkitalo Fastställare: Signar Mäkitalo Pneumokocker - Vaccination
Beskrivning Diarienr: Ej tillämpligt 1(8) Dokument ID: 09-128818 Fastställandedatum: 2017-06-14 Giltigt t.o.m.: 2018-06-14 Upprättare: Signar K Mäkitalo Fastställare: Signar Mäkitalo Pneumokocker - Vaccination
Urinvägsinfektioner. Malin André, allmänläkare Uppsala. nedre och övre
 Urinvägsinfektioner Malin André, allmänläkare Uppsala nedre och övre UVI-antibiotika i olika åldrar Recept/1000 invånare/år 700 600 500 Urinvägsantibiotika Annan antibiotika 400 300 200 100 0 0-6 år 7-19
Urinvägsinfektioner Malin André, allmänläkare Uppsala nedre och övre UVI-antibiotika i olika åldrar Recept/1000 invånare/år 700 600 500 Urinvägsantibiotika Annan antibiotika 400 300 200 100 0 0-6 år 7-19
Rapport från Pneumoniregistret för år 2008
 Rapport från Pneumoniregistret för år 2008 Inledning Det nationella kvalitetsregistret för pneumonier vårdade på infektionsklinik skapades av infektionsläkarföreningen för att öka kunskapen om vilka patienter
Rapport från Pneumoniregistret för år 2008 Inledning Det nationella kvalitetsregistret för pneumonier vårdade på infektionsklinik skapades av infektionsläkarföreningen för att öka kunskapen om vilka patienter
Antibiotikaresistens 2018 Blekinge och Kronoberg. Klinisk mikrobiologi för Blekinge och Kronoberg
 Antibiotikaresistens 18 Blekinge och Kronoberg Klinisk mikrobiologi för Blekinge och Kronoberg Allmän information Metod En angiven resistens kan påverkas både av en faktiskt ökad resistens i bakteriepopulationen,
Antibiotikaresistens 18 Blekinge och Kronoberg Klinisk mikrobiologi för Blekinge och Kronoberg Allmän information Metod En angiven resistens kan påverkas både av en faktiskt ökad resistens i bakteriepopulationen,
Rapport från Pneumoniregistret 2015
 1 Rapport från Pneumoniregistret 15 Det nationella kvalitetsregistret för patienter som vårdas för pneumoni på infektionsklinik skapades av Infektionsläkarföreningen för att öka kunskapen om vilka patienter
1 Rapport från Pneumoniregistret 15 Det nationella kvalitetsregistret för patienter som vårdas för pneumoni på infektionsklinik skapades av Infektionsläkarföreningen för att öka kunskapen om vilka patienter
Pneumokockvaccination. Christer Mehle Infektionskliniken, NUS
 Pneumokockvaccination Christer Mehle Infektionskliniken, NUS Pneumkockbakterien och sjukdomassociation Pasteur och Sternberg, bakteriens upptäckt och association till pneumoni slutet av 1800-talet Neufeld
Pneumokockvaccination Christer Mehle Infektionskliniken, NUS Pneumkockbakterien och sjukdomassociation Pasteur och Sternberg, bakteriens upptäckt och association till pneumoni slutet av 1800-talet Neufeld
Infektioner hos äldre
 Infektioner hos äldre KOL och antibiotika Michael Runold Överläkare, Lung- och allergikliniken Karolinska Ordförande i Expertrådet för luftvägs- och allergisjukdomar, Stockholm KOL Definitioner, etiologi,
Infektioner hos äldre KOL och antibiotika Michael Runold Överläkare, Lung- och allergikliniken Karolinska Ordförande i Expertrådet för luftvägs- och allergisjukdomar, Stockholm KOL Definitioner, etiologi,
Influensa och pneumokockvaccination säsongen
 Tjänsteställe, handläggare Smittskyddsenheten 2017 10 19 17 333 1(6) Hans Boman Distribution Verksamhets och enhetschefer inom primärvården i Västernorrland Verksamhetschefer inom Specialistvården Mödrahälsovårdsöverläkare
Tjänsteställe, handläggare Smittskyddsenheten 2017 10 19 17 333 1(6) Hans Boman Distribution Verksamhets och enhetschefer inom primärvården i Västernorrland Verksamhetschefer inom Specialistvården Mödrahälsovårdsöverläkare
Äldre och infektioner. -enbart ett institutionsproblem? Johan Struwe Smittskyddsintitutet
 Äldre och infektioner -enbart ett institutionsproblem? Johan Struwe Smittskyddsintitutet Utveckling i slutenvård 1996-2006 Index 1996=100 Källa: SKL 2007 Källa: SKL 2007 4000 3500 3000 2500 2000 1500 1000
Äldre och infektioner -enbart ett institutionsproblem? Johan Struwe Smittskyddsintitutet Utveckling i slutenvård 1996-2006 Index 1996=100 Källa: SKL 2007 Källa: SKL 2007 4000 3500 3000 2500 2000 1500 1000
Anne Tideholm Nylén Luftvägsinfektioner. Influensa Pneumokocker Kikhosta Tuberkulos Legionella
 Luftvägsinfektioner Influensa Pneumokocker Kikhosta Tuberkulos Legionella Influensa Smittväg: Droppsmitta och kontaktsmitta Inkubationstid: 1-3 dygn Smittfri: Ett dygn efter feberfrihet eller 6-7 dygn
Luftvägsinfektioner Influensa Pneumokocker Kikhosta Tuberkulos Legionella Influensa Smittväg: Droppsmitta och kontaktsmitta Inkubationstid: 1-3 dygn Smittfri: Ett dygn efter feberfrihet eller 6-7 dygn
Till dig som har fått vaccin mot lunginflammation
 Till dig som har fått vaccin mot lunginflammation polysackaridvaccin mot pneumokockinfektioner, konjugerat, adsorberat, 13-valent Kort om lunginflammation Du har fått den här broschyren av din läkare eller
Till dig som har fått vaccin mot lunginflammation polysackaridvaccin mot pneumokockinfektioner, konjugerat, adsorberat, 13-valent Kort om lunginflammation Du har fått den här broschyren av din läkare eller
Antibiotikaresistens 2017 Blekinge och Kronoberg. Klinisk mikrobiologi för Blekinge och Kronoberg
 Antibiotikaresistens 217 Blekinge och Kronoberg Klinisk mikrobiologi för Blekinge och Kronoberg Allmän information Metod En angiven resistens kan påverkas både av en faktiskt ökad resistens i bakteriepopulationen,
Antibiotikaresistens 217 Blekinge och Kronoberg Klinisk mikrobiologi för Blekinge och Kronoberg Allmän information Metod En angiven resistens kan påverkas både av en faktiskt ökad resistens i bakteriepopulationen,
Vaccination mot influensa
 Vaccination mot influensa 2018-2019 Information till Mödrahälsovården från Smittskydd Västra Götaland Vaccination är bästa skyddet mot influensa Personer med dåligt immunförsvar har sämre effekt av vaccinet.
Vaccination mot influensa 2018-2019 Information till Mödrahälsovården från Smittskydd Västra Götaland Vaccination är bästa skyddet mot influensa Personer med dåligt immunförsvar har sämre effekt av vaccinet.
维 市 华 人 协 会 健 康 讲 座 2009-11-14 19:00-20:00 甲 流 概 况 及 疫 苗 注 射 主 讲 : 方 静 中 文 注 释 ; 曾 义 根,( 如 有 错 误, 请 以 瑞 典 文 为 准 )
 维 市 华 人 协 会 健 康 讲 座 2009-11-14 19:00-20:00 甲 流 概 况 及 疫 苗 注 射 主 讲 : 方 静 中 文 注 释 ; 曾 义 根,( 如 有 错 误, 请 以 瑞 典 文 为 准 ) 甲 流 病 毒 图 片 Vad är speciellt med den nya influensan? 甲 流 的 特 点 Den nya influensan A (H1N1)
维 市 华 人 协 会 健 康 讲 座 2009-11-14 19:00-20:00 甲 流 概 况 及 疫 苗 注 射 主 讲 : 方 静 中 文 注 释 ; 曾 义 根,( 如 有 错 误, 请 以 瑞 典 文 为 准 ) 甲 流 病 毒 图 片 Vad är speciellt med den nya influensan? 甲 流 的 特 点 Den nya influensan A (H1N1)
Urinvägsinfektioner hos äldre
 Urinvägsinfektioner hos äldre Patientrelaterade riskfaktorer för UVI hos äldre Försämrat urinavflöde - residualurin Prostataförstoring Blåsprolaps Försvagning av blåsmuskulatur Blåssten Kort urinrör Atrofiska
Urinvägsinfektioner hos äldre Patientrelaterade riskfaktorer för UVI hos äldre Försämrat urinavflöde - residualurin Prostataförstoring Blåsprolaps Försvagning av blåsmuskulatur Blåssten Kort urinrör Atrofiska
Urinvägsinfektioner i öppenvård gradera mera!
 Urinvägsinfektioner i öppenvård gradera mera! Pär-Daniel Sundvall Strama Västra Götaland Närhälsan FoU-centrum Södra Älvsborg och Sandared vårdcentral Akut cystit hos kvinnor utan behandling 30% självläker
Urinvägsinfektioner i öppenvård gradera mera! Pär-Daniel Sundvall Strama Västra Götaland Närhälsan FoU-centrum Södra Älvsborg och Sandared vårdcentral Akut cystit hos kvinnor utan behandling 30% självläker
Kvartalsrapport Kvartal SÄS
 Klokt Antibiotikaval Kvartalsrapport Kvartal 3 2011 SÄS Södra Älvsborgs Sjukhus Klokt Antibiotikaval Klokt Antibiotikaval på SÄS Sammanfattning av kvartal 3 2011 Bra!!! Mindre bra Södra Älvsborgs Sjukhus
Klokt Antibiotikaval Kvartalsrapport Kvartal 3 2011 SÄS Södra Älvsborgs Sjukhus Klokt Antibiotikaval Klokt Antibiotikaval på SÄS Sammanfattning av kvartal 3 2011 Bra!!! Mindre bra Södra Älvsborgs Sjukhus
Randare/vikarie vid infektionsklinik Akutmedicin Kirurgi/ortopedi Medicin Annan Okänt. (åååå-mm-dd) (åååå-mm-dd)
 I registrets formulär för Svår Sepsis/Septisk Chock registreras: Alla patienter med samhällsförvärvad svår sepsis/septisk chock som diagnostiserats inom 24 timmar efter ankomst till sjukhus (diagnoskoder
I registrets formulär för Svår Sepsis/Septisk Chock registreras: Alla patienter med samhällsförvärvad svår sepsis/septisk chock som diagnostiserats inom 24 timmar efter ankomst till sjukhus (diagnoskoder
LUFTVÄGSINFEKTIONER. Helena Alpkvist Specialistläkare Infektionskliniken, Karolinska Universitetssjukhuset
 LUFTVÄGSINFEKTIONER Helena Alpkvist Specialistläkare Infektionskliniken, Karolinska Universitetssjukhuset September 2018 Dagens föreläsning Fokus på pneumoni - Etiologi (samhällsförvärvad vs sjukhusförvärvad)
LUFTVÄGSINFEKTIONER Helena Alpkvist Specialistläkare Infektionskliniken, Karolinska Universitetssjukhuset September 2018 Dagens föreläsning Fokus på pneumoni - Etiologi (samhällsförvärvad vs sjukhusförvärvad)
Goda råd vid infektion. En liten guide om hur du som är 65 år och äldre tar hand om din hälsa och dina infektioner
 Goda råd vid infektion En liten guide om hur du som är 65 år och äldre tar hand om din hälsa och dina infektioner Bästa tiden att plantera ett träd var för tjugo år sedan, den näst bästa tiden är nu Information
Goda råd vid infektion En liten guide om hur du som är 65 år och äldre tar hand om din hälsa och dina infektioner Bästa tiden att plantera ett träd var för tjugo år sedan, den näst bästa tiden är nu Information
Kvartalsrapport Kvartal SÄS
 Klokt Antibiotikaval Kvartalsrapport Kvartal 4 2013 SÄS Södra Älvsborgs Sjukhus Klokt Antibiotikaval Antibiotikaförskrivning i VGR Recept/ 1000 invånare under senaste 12-månadersperioden Det går åt rätt
Klokt Antibiotikaval Kvartalsrapport Kvartal 4 2013 SÄS Södra Älvsborgs Sjukhus Klokt Antibiotikaval Antibiotikaförskrivning i VGR Recept/ 1000 invånare under senaste 12-månadersperioden Det går åt rätt
Överdiagnostik av penicillinallergi
 Överdiagnostik av penicillinallergi Gunnar Jacobsson Infektionsläkare TG Infektion 20190131 10 % av USAs befolkning, 32 milj, har en uppgiven penicillinvarning 1 Vanligt men ofta fel! Vanligt att patienter
Överdiagnostik av penicillinallergi Gunnar Jacobsson Infektionsläkare TG Infektion 20190131 10 % av USAs befolkning, 32 milj, har en uppgiven penicillinvarning 1 Vanligt men ofta fel! Vanligt att patienter
Resistensläge i öppenvård:
 Resistensläge i öppenvård: S. aureus i sårodlingar Haemophilus influenzae i nasofarynxodlingar Streptococcus pneumoniae i nasofarynxodlingar E. coli i urinodlingar Inga Fröding och Christian Giske Klinisk
Resistensläge i öppenvård: S. aureus i sårodlingar Haemophilus influenzae i nasofarynxodlingar Streptococcus pneumoniae i nasofarynxodlingar E. coli i urinodlingar Inga Fröding och Christian Giske Klinisk
När behöver vi antibiotika?
 När behöver vi antibiotika? och när är det onödigt Christer Norman, familjeläkare Strama, Stockholm Effekt av antibiotika utvärderas i randomiserade kontrollerade studier Randomise ring =Slumpmässig fördelning
När behöver vi antibiotika? och när är det onödigt Christer Norman, familjeläkare Strama, Stockholm Effekt av antibiotika utvärderas i randomiserade kontrollerade studier Randomise ring =Slumpmässig fördelning
Antibiotikaförskrivning vid akut bronkit och pneumoni
 VESTA Södra programmet 2010 Antibiotikaförskrivning vid akut bronkit och pneumoni Följsamhet till riktlinjer vid Johannes Husläkarmottagning Nanna Schumacher Qwerin ST-läkare, Johannes Husläkarmottagning
VESTA Södra programmet 2010 Antibiotikaförskrivning vid akut bronkit och pneumoni Följsamhet till riktlinjer vid Johannes Husläkarmottagning Nanna Schumacher Qwerin ST-läkare, Johannes Husläkarmottagning
Att förebygga kikhosta hos spädbarn. Augusti 2016
 Att förebygga kikhosta hos spädbarn Augusti 2016 Innehåll 1. Om kikhosta idag 2. Rekommendationer för att förebygga kikhosta hos spädbarn: Vaccination Behandling och diagnostik Uppmärksamhet 3. Veta mer
Att förebygga kikhosta hos spädbarn Augusti 2016 Innehåll 1. Om kikhosta idag 2. Rekommendationer för att förebygga kikhosta hos spädbarn: Vaccination Behandling och diagnostik Uppmärksamhet 3. Veta mer
Ordinera influensa- och Pneumokockvaccin
 Ordinera influensa- och Pneumokockvaccin Vilka får ordinera influensa- och PnC-vaccin? Läkare Distriktssjuksköterskor som har genomgått dssk-vub Andra sjuksköterskor som efter genomgången utbildning godkäns
Ordinera influensa- och Pneumokockvaccin Vilka får ordinera influensa- och PnC-vaccin? Läkare Distriktssjuksköterskor som har genomgått dssk-vub Andra sjuksköterskor som efter genomgången utbildning godkäns
Influensa- och pneumokockvaccination 2015/2016
 INSTRUKTION 1 (15) INFLUENSAVACCINATION ORDINATION RISKGRUPPER Inför säsongen 2015/2016 har sammansättningen av säsongsvaccinet ändrats jämfört med föregående år så att en influensa A-stam och influensa
INSTRUKTION 1 (15) INFLUENSAVACCINATION ORDINATION RISKGRUPPER Inför säsongen 2015/2016 har sammansättningen av säsongsvaccinet ändrats jämfört med föregående år så att en influensa A-stam och influensa
INFEKTION FALL 1:INF. Lab: CRP 350, vita 22, trombocyter 380, kreatinin 200, Hb 150, ASAT 0,98, ALAT 0,90.
 66-årig man (Erik) söker på akuten med följande symtom; 3 dagars hög feber, pendlat mellan 39-40 grader successivt tilltagande produktiv hosta (rödbrunaktiga upphostningar) och andfåddhet vid djupa andetag
66-årig man (Erik) söker på akuten med följande symtom; 3 dagars hög feber, pendlat mellan 39-40 grader successivt tilltagande produktiv hosta (rödbrunaktiga upphostningar) och andfåddhet vid djupa andetag
Överdiagnostik av penicillinallergi. Gunnar Jacobsson Infektionsläkare
 Överdiagnostik av penicillinallergi Gunnar Jacobsson Infektionsläkare 20181113 Penicillinallergi - hur många av uppgivna reaktioner kan inte verifieras med testning? 1. 30 % 2. 50 % 3. 75 % 4. 90 % Vanligt
Överdiagnostik av penicillinallergi Gunnar Jacobsson Infektionsläkare 20181113 Penicillinallergi - hur många av uppgivna reaktioner kan inte verifieras med testning? 1. 30 % 2. 50 % 3. 75 % 4. 90 % Vanligt
Multiple choice frågor
 Ett eller flera rätta alternativ Multiple choice frågor16-04-28 1 (5) 1 Vilket/vilka av följande antibiotika är olämpligt att använda vid infektion efter kattbett? a. PcV b. Amoxicillin c. Heracillin R
Ett eller flera rätta alternativ Multiple choice frågor16-04-28 1 (5) 1 Vilket/vilka av följande antibiotika är olämpligt att använda vid infektion efter kattbett? a. PcV b. Amoxicillin c. Heracillin R
Influensa. Fredrik Idving
 Influensa Fredrik Idving I diagrammet visas det uppskattade antalet personer med influensaliknande sjukdom som sökt vård per 100.000 listade patienter. Nuvarande säsong visas med röd linje. Två tidigare
Influensa Fredrik Idving I diagrammet visas det uppskattade antalet personer med influensaliknande sjukdom som sökt vård per 100.000 listade patienter. Nuvarande säsong visas med röd linje. Två tidigare
Lunch med smittskyddsläkaren
 Lunch med smittskyddsläkaren Pneumokockvaccination uppdaterade rekommendationer 2018-03-02 Lisa Labbé Sandelin Pneumokockinfektion Stor risk för allvarlig sjukdom. Stor börda för sjukvård, individer och
Lunch med smittskyddsläkaren Pneumokockvaccination uppdaterade rekommendationer 2018-03-02 Lisa Labbé Sandelin Pneumokockinfektion Stor risk för allvarlig sjukdom. Stor börda för sjukvård, individer och
Influensasäsongen i Östergötland
 Influensasäsongen i Östergötland 2018-2019 Statistik Vaccinationskampanjen Vaccinationskampanjen startade den 6 november 2018. Innan och under vaccinationskampanjen samlades en strategigrupp med deltagare
Influensasäsongen i Östergötland 2018-2019 Statistik Vaccinationskampanjen Vaccinationskampanjen startade den 6 november 2018. Innan och under vaccinationskampanjen samlades en strategigrupp med deltagare
Modern UVI-behandling går den ihop med antibiotikamålen?
 Modern UVI-behandling går den ihop med antibiotikamålen? Nils Rodhe Distriktsläkare Falu Vårdcentral, Falun Centrum för Klinisk Forskning, Dalarna Kvinnor Män Äldre Cystit hos kvinnor Obehagligt Men
Modern UVI-behandling går den ihop med antibiotikamålen? Nils Rodhe Distriktsläkare Falu Vårdcentral, Falun Centrum för Klinisk Forskning, Dalarna Kvinnor Män Äldre Cystit hos kvinnor Obehagligt Men
Upptaktsmöte inför influensasäsongen 2014-15. Per Hagstam Smittskydd Skåne
 Upptaktsmöte inför influensasäsongen 2014-15 Per Hagstam Smittskydd Skåne 1 Varför influensavaccinera? För de flesta är influensa en ofarlig sjukdom Riskgruppsbaserad strategi Vaccination avser att förebygga
Upptaktsmöte inför influensasäsongen 2014-15 Per Hagstam Smittskydd Skåne 1 Varför influensavaccinera? För de flesta är influensa en ofarlig sjukdom Riskgruppsbaserad strategi Vaccination avser att förebygga
Delexamen 4 Infektion FACIT s
 MEQ-fråga 2 Sida 1 (7) En 71-årig man inkommer med ambulans. Han har haft snuva, slemhosta och huvudvärk i två dagar. Känt sig varm. I morse påtagligt sämre med frysningar, trötthet, mycket hosta och en
MEQ-fråga 2 Sida 1 (7) En 71-årig man inkommer med ambulans. Han har haft snuva, slemhosta och huvudvärk i två dagar. Känt sig varm. I morse påtagligt sämre med frysningar, trötthet, mycket hosta och en
Innehåll. Antibiotika. Nr 4 2008
 SMITTSKYDD, NORRBOTTENS LÄNS LANDSTING, 971 80 LULEÅ, TELEFON 0920-28 36 16 Nr 4 2008 Innehåll Antibiotika... 1 Antibiotikaförskrivning i Norrbotten första halvåret 2008... 1 Uppdaterade antibiotikarekommendationer
SMITTSKYDD, NORRBOTTENS LÄNS LANDSTING, 971 80 LULEÅ, TELEFON 0920-28 36 16 Nr 4 2008 Innehåll Antibiotika... 1 Antibiotikaförskrivning i Norrbotten första halvåret 2008... 1 Uppdaterade antibiotikarekommendationer
Hälso- och sjukvårdsnämnden
 Hälso- och sjukvårdsnämnden Håkan Miörner Smittskyddsläkare 040-33 71 81 Hakan.Miorner@skane.se YTTRANDE Datum 2016-09-06 Dnr 1602288 1 (5) Remiss. Riskgruppsvaccinationer som särskilda vaccinationsprogram
Hälso- och sjukvårdsnämnden Håkan Miörner Smittskyddsläkare 040-33 71 81 Hakan.Miorner@skane.se YTTRANDE Datum 2016-09-06 Dnr 1602288 1 (5) Remiss. Riskgruppsvaccinationer som särskilda vaccinationsprogram
10 INFEKTION REKOMMENDERADE LÄKEMEDEL TERAPIRÅD. Tetracykliner doxycyklin Doxyferm
 10 INFEKTION REKOMMENDERADE LÄKEMEDEL BAKTERIELLA INFEKTIONER Penicilliner amoxicillin flukloxacillin pivmecillinam efalosporiner ceftibuten edax Kinoloner ciprofloxacin Makrolider erytromycin TERAPIRÅD
10 INFEKTION REKOMMENDERADE LÄKEMEDEL BAKTERIELLA INFEKTIONER Penicilliner amoxicillin flukloxacillin pivmecillinam efalosporiner ceftibuten edax Kinoloner ciprofloxacin Makrolider erytromycin TERAPIRÅD
Kvartalsrapport Kvartal SÄS
 Klokt Antibiotikaval Kvartalsrapport Kvartal 3 2013 SÄS Södra Älvsborgs Sjukhus Klokt Antibiotikaval Antibiotikaförskrivning i VGR Recept/ 1000 invånare under senaste 12-månadersperioden Det går åt rätt
Klokt Antibiotikaval Kvartalsrapport Kvartal 3 2013 SÄS Södra Älvsborgs Sjukhus Klokt Antibiotikaval Antibiotikaförskrivning i VGR Recept/ 1000 invånare under senaste 12-månadersperioden Det går åt rätt
Faktaägare: Håkan Ivarsson, distriktsläkare, vårdcentralen Teleborg. Fastställd av: Stephan Quittenbaum, tf ordförande medicinska kommittén
 Riktlinje Process: Hälso- och sjukvård Område: Urinvägsinfektioner Giltig fr.o.m: 2014-05-07 Faktaägare: Håkan Ivarsson, Distriktsläkare vårdcentralen Teleborg Fastställd av: Stephan Quittenbaum, tf ordförande
Riktlinje Process: Hälso- och sjukvård Område: Urinvägsinfektioner Giltig fr.o.m: 2014-05-07 Faktaägare: Håkan Ivarsson, Distriktsläkare vårdcentralen Teleborg Fastställd av: Stephan Quittenbaum, tf ordförande
Vad är förkylning? Förkylning orsakas av virus. Det finns cirka 400 olika förkylningsvirus som alla ger olika besvär.
 Vad är förkylning? Förkylning orsakas av virus. Det finns cirka 400 olika förkylningsvirus som alla ger olika besvär. Anita Groth, privat ÖNH-specialist Strama Vilka är symtomen vid förkylning? Snuva Ont
Vad är förkylning? Förkylning orsakas av virus. Det finns cirka 400 olika förkylningsvirus som alla ger olika besvär. Anita Groth, privat ÖNH-specialist Strama Vilka är symtomen vid förkylning? Snuva Ont
av MDR gramnegativa bakterier
 Handläggning av infektioner orsakade av MDR gramnegativa bakterier Stramadagen 10 maj 2017, Arlanda Thomas Tängdén, Programråd Strama, Infektion Uppsala Uppdraget från Programråd Strama Att ta fram riktlinjer
Handläggning av infektioner orsakade av MDR gramnegativa bakterier Stramadagen 10 maj 2017, Arlanda Thomas Tängdén, Programråd Strama, Infektion Uppsala Uppdraget från Programråd Strama Att ta fram riktlinjer
Hur kan mått och mätmetoder användas i förändringsarbete? Sigvard Mölstad Primärvårdens FoU-enhet Jönköping
 Hur kan mått och mätmetoder användas i förändringsarbete? Sigvard Mölstad Primärvårdens FoU-enhet Jönköping Mål och mått? Mål för antibiotikarecept och vald klass Mål per diagnos/infektion/symtom Diagnos/behandling
Hur kan mått och mätmetoder användas i förändringsarbete? Sigvard Mölstad Primärvårdens FoU-enhet Jönköping Mål och mått? Mål för antibiotikarecept och vald klass Mål per diagnos/infektion/symtom Diagnos/behandling
Öroninflammation Svante Hugosson
 Öroninflammation Svante Hugosson Man kan ej sätta likhetstecken mellan öronsmärta och akut öroninflammation. Troligen har cirka hälften av barnen med öronsmärta denna åkomma. Överdiagnostik av akut öroninflammation
Öroninflammation Svante Hugosson Man kan ej sätta likhetstecken mellan öronsmärta och akut öroninflammation. Troligen har cirka hälften av barnen med öronsmärta denna åkomma. Överdiagnostik av akut öroninflammation
Ful urinsticka- vem har inte det? Läkarmöte Blå korset 5 juni 2013 Thomas Tängdén, Infektionskliniken och Strama
 Ful urinsticka- vem har inte det? Läkarmöte Blå korset 5 juni 2013 Thomas Tängdén, Infektionskliniken och Strama Asta 82 år Hjärtsvikt, FF, svikt. Tidigare CVL med viss kvarstående svaghet vä och afasi.
Ful urinsticka- vem har inte det? Läkarmöte Blå korset 5 juni 2013 Thomas Tängdén, Infektionskliniken och Strama Asta 82 år Hjärtsvikt, FF, svikt. Tidigare CVL med viss kvarstående svaghet vä och afasi.
Antibiotikaval. vid vanliga infektioner i öppen vård. Rekommenderade läkemedel. Läkemedelsrådet i Region Skåne
 2017 1 Antibiotikaval vid vanliga infektioner i öppen vård Rekommenderade läkemedel Läkemedelsrådet i Region Skåne Terapigrupp Antibiotika/Infektioner i öppen vård www.skane.se/skanelistan 2 INNEHÅLL Streptokocktonsillit...
2017 1 Antibiotikaval vid vanliga infektioner i öppen vård Rekommenderade läkemedel Läkemedelsrådet i Region Skåne Terapigrupp Antibiotika/Infektioner i öppen vård www.skane.se/skanelistan 2 INNEHÅLL Streptokocktonsillit...
Vaccination mot influensa
 Vaccination mot influensa 2017-2018 Information till sjukvårdspersonal från Smittskydd Västra Götaland Din roll som sköterska eller läkare Ditt råd är viktigt när patienten ska fatta beslut om vaccination
Vaccination mot influensa 2017-2018 Information till sjukvårdspersonal från Smittskydd Västra Götaland Din roll som sköterska eller läkare Ditt råd är viktigt när patienten ska fatta beslut om vaccination
Vaccinationer. DFP Dialogforum för pensionärer Torsdag 14 april Jan Smedjegård, smittskyddsläkare
 Vaccinationer DFP Dialogforum för pensionärer Torsdag 14 april 2016 Jan Smedjegård, smittskyddsläkare Influensavirus Kan ge Säsongsinfluensa Pandemisk influensa Mer begränsat antal fall av zoonotisk influensa
Vaccinationer DFP Dialogforum för pensionärer Torsdag 14 april 2016 Jan Smedjegård, smittskyddsläkare Influensavirus Kan ge Säsongsinfluensa Pandemisk influensa Mer begränsat antal fall av zoonotisk influensa
OM ANTIBIOTIKA Därför får du antibiotika Därför får du inte antibiotika
 OM ANTIBIOTIKA Därför får du antibiotika Därför får du inte antibiotika Vad är antibiotika? Antibiotika är läkemedel som används för att behandla och i sällsynta fall förebygga infektioner som orsakas
OM ANTIBIOTIKA Därför får du antibiotika Därför får du inte antibiotika Vad är antibiotika? Antibiotika är läkemedel som används för att behandla och i sällsynta fall förebygga infektioner som orsakas
