TKK, TTY, LTY, OY, TY, VY, ÅA / Ingenjörsavdelningarna Inträdesförhör i kemi
|
|
|
- Max Göransson
- för 7 år sedan
- Visningar:
Transkript
1 TKK, TTY, LTY, Y, TY, VY, ÅA / Ingenjörsavdelningarna Inträdesförhör i kemi Framställningen av uranmetall ur renad urandioxidmalm sker via följande reaktionssteg: (1) U (s) + 4 HF (g) UF 4 (s) + H (l) () UF 4 (s) + Mg (s) uppvärmning U (s) + MgF (s) a) Vilket är uranets oxidationstal i U, UF 4 och U. b) Vilket ämne är reduktionsmedel i reaktion ()? Motivera ditt svar. c) Hur många liter HF gas behövs för att producera 0,500 g uranmetall, U? Temperaturen är 00 o och trycket 101,5 kpa. d) Uranmetall kan också framställas genom elektrolys av smält UF 4 enligt följande totalreaktion: UF 4 (l) U(l) + F (g). Hur stor elektricitetsmängd behövs för att producera 0,500 g uranmetall, U?. Vid förbränning av svavelhaltiga bränslen, såsom olja och stenkol, frigörs svaveldioxid i luften. Svaveldioxiden oxideras i luften till svaveltrioxid, som därefter reagerar med vatten till svavelsyra. Svavelsyran faller till marken i samband med regn. Som en följd av att svavelsyra under många år samlats i en sjö har sjöns ph sjunkit till värdet 5,00. Sjöns vatten kan neutraliseras med kalciumhydroxid, a(h). a) Skriv neutralisationsreaktionen. b) Hur många kilogram kalciumhydroxid behövs för att neutralisera sjöns vatten, då sjöns yta är 1,5 km och medeldjupet 6,0 m? Temperaturen är 5 o.. I ett slutet reaktionskärl, vars volym var 1,00 dm, infördes H - ja I -gas och temperaturen höjdes till 9 o. Vätgas och jodgas reagerar till vätejodidgas enligt följande reaktionslikhet: H (g) + I (g)! HI (g) Då jämvikt uppnåtts var gasernas koncentrationer i kärlet följande: [HI] = 0,490 mol/dm, [H ] = 0,080 mol/dm och [I ] = 0,060 mol/dm a) Beräkna värdet för reaktionens jämviktskonstant, K c, vid 9 o. b) Åt vilket håll förskjuts jämviktsläget, om mer HI-gas förs in i reaktionskärlet? Temperaturen är 9 o. Motivera ditt svar. c) 0,00 mol HI-gas förs in i jämviktsblandningen. Beräkna gasernas koncentrationer i kärlet då den nya jämvikten uppnåtts. Temperaturen är 9 o. 4. a) Hur mycket (mg) kalciumkarbonat, a, löser sig i 1,00 dm rent vatten (5 o )? Löslighetsprodukten för kalciumkarbonat K s (a ) = 5, mol /dm 6 vid temperaturen 5 o. b) Hårt vatten innehåller a + -joner, som kan fällas ut som svårlösligt kalciumkarbonat, om man tillsätter -joner i vattnet. Bildas det en a -fällning, om man tillsätter 10 mg fast natriumkarbonat, Na, i 50 cm hårt vatten, vars [a + ] = 8, mol/dm? (Lösningens volym kan antas vara konstant).
2 5. a) Rita strukturformler för följande föreningar: 1) dietyleter ) en tertiär alkohol med fyra kolatomer ) -buten-1-ol 4) butanal b) Vilka av föreningarna i punkt a) är strukturisomerer till -butanon? Motivera ditt svar. 6. a) Skriv reaktionslikheter med strukturformler för de reaktioner där -metyl--penten, vars molekylformel är 6 H 1, reagerar med följande föreningar: 1) H, katalysator ) H, katalysator ) Hl b) Skriv strukturformel för utgångsämnet A i följande reaktion och namnge föreningen A. A reduktion H H H c) Skriv reaktionslikhet med strukturformler för hydrolys av bensoesyrans etylester dvs. av etylbensoat. Grundämnenas molmassor: Grundämne: H Na a U M / (g mol 1 ) 1,01 1,01 16,00,99 40,08 8,0 Konstanter: R = 8,15 J mol 1 K 1 F = A s mol 1
3 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Kemian valintakoetehtävien 006 malliratkaisut 1. a) uraanin hapetusasteet U : +IV, UF 4 : +IV ja U: 0 b) reaktion () pelkistin on Mg, sillä se hapettuu 0 +II c) m(u) = 0,500 g M(U) = 8,0 g/mol! n(u) =,10 10 mol () : n(uf 4 ) = n(u) (1): n(uf 4 ) = 4 1 n(hf)! n(hf) = 4 n(u) = 8,40 10 mol pv = nrt nrt 8,40 10 mol 8,15 J / Kmol 57,15 K! V(HF) = = =, m = 0,95 dm p 1015Pa d) UF 4 (l) U (l) + F (g) m(u) = 0,500 g M(U) = 8,0 g/mol! n(u) =,10 10 mol Q = It = znf = 4,10 10 mol A s mol 1 = 811 A s. Neutralointireaktio: H S 4 (aq) + a(h) (s) as 4 (aq) + H (l) Järviveden ph = 5,00! [H + ] = 10 5 mol/dm Järven tilavuus = m 6,0 m = m! n(h + ) = cv = 10 5 mol/dm dm = mol H S 4 + H H + + S 4! n(h S 4 ) = 1 n(h + ) = mol = n(a(h) ) M(a(H) ) = 74,10 g/mol! m(a(h) ) = n M = mol 74,10 g/mol = 4500 g = 00 kg
4 . a) H (g) + I (g)! HI(g) K c = [ HI] [ H ][ I ] ( / dm ) = 0,490mol 0,080mol / dm 0,060mol / dm = 50 b) Le hatelierin periaatteen mukaisesti reaktio pyrkii kumoamaan ulkoisen muutoksen ts. pyrkii kuluttamaan lisätyn HI-kaasun, jolloin tasapainoasema siirtyy lähtöaineiden suuntaan eli vasemmalle. c) H (g) + I (g)! HI(g) tasapaino (mol/dm ) 0,080 0,060 0,490 lisäys (mol/dm ) ,00 uudet alkukon- 0,080 0,060 0,790 sentraatiot (mol/dm ) muutos (mol/dm ) +x +x -x uusi tasapaino (mol/dm ) 0,080 + x 0,060 + x 0,790 x K c = [ HI] [ H ][ I ] = ( 0,790 x) (0,080 + x) (0,060 + x) = 50! 0,64,16x + 4x = 50x + 7,0x + 0,4! 46x + 10,16x 0,84 = 0! x = 0,0 mol/dm (x < 0)! [H ] = (0, ,0) mol/dm = 0,11 mol/dm [I ] = (0, ,0) mol/dm = 0,09 mol/dm [HI] = (0,790 0,0) mol/dm = 0,74 mol/dm 4. a) a (s)! a + (aq) + (aq) alussa (mol/dm ) a 0 0 tasapainossa (mol/dm ) a-x x x K s = [a + ] [ ] = 5, mol /dm 6! x = 5, mol /dm 6! x = 7, mol/dm M(a ) = 100,09 g/mol! m(a ) = c V M = 7, mol/dm 1 dm 100,09 g/mol = 7,08 10 g = 7,1 mg
5 b) m(na ) = 10 mg, M(Na ) = 105,99 g/mol! n(na ) = M m = 10mg 105,99 mg / mmol = 0,094 mmol V = 50 cm n 0,094mmol! c(na ) = = V 50 cm =, mol/dm c( ) = c(na ) =, mol/dm (Na Na + + ) c(a + ) = 8, mol/dm Ionitulo = [a + ] [ ] = 8, mol/dm, mol/dm =, mol /dm 6 > 5, mol /dm 9 (=K s (a ))! saostuma muodostuu 5. a) 1) dietyylieetteri H H ) neljähiilinen tertiäärinen alkoholi H ) -buten-1-oli H HH H H 4) butanaali H H H b) -butanonin: H = 4 H 8 rakenneisomeerejä ovat -buten-1-oli ja butanaali, sillä niillä on sama molekyylikaava ( 4 H 8 ) kuin -butanonilla
6 6. a) 1) katalyytti HH + H HH H ) HH + H katalyytti H H H ) HH + Hl H H l b) H -metyyli--butanoni c) H H + H + H H.
Jämviktsuppgifter. 2. Kolmonoxid och vattenånga bildar koldioxid och väte enligt följande reaktionsformel:
 Jämviktsuppgifter Litterarum radices amarae, fructus dulces 1. Vid upphettning sönderdelas etan till eten och väte. Vid en viss temperatur har följande jämvikt ställt in sig i ett slutet kärl. C 2 H 6
Jämviktsuppgifter Litterarum radices amarae, fructus dulces 1. Vid upphettning sönderdelas etan till eten och väte. Vid en viss temperatur har följande jämvikt ställt in sig i ett slutet kärl. C 2 H 6
4. Kemisk jämvikt när motsatta reaktioner balanserar varandra
 4. Kemisk jämvikt när motsatta reaktioner balanserar varandra 4.1. Skriv fullständiga formler för följande reaktioner som kan gå i båda riktningarna (alla ämnen är i gasform): a) Kolmonoxid + kvävedioxid
4. Kemisk jämvikt när motsatta reaktioner balanserar varandra 4.1. Skriv fullständiga formler för följande reaktioner som kan gå i båda riktningarna (alla ämnen är i gasform): a) Kolmonoxid + kvävedioxid
Övningar Homogena Jämvikter
 Övningar Homogena Jämvikter 1 Tiocyanatjoner, SCN -, och järn(iii)joner, Fe 3+, reagerar med varandra enligt formeln SCN - + Fe 3+ FeSCN + färglös svagt gul röd Vid ett försök sätter man en liten mängd
Övningar Homogena Jämvikter 1 Tiocyanatjoner, SCN -, och järn(iii)joner, Fe 3+, reagerar med varandra enligt formeln SCN - + Fe 3+ FeSCN + färglös svagt gul röd Vid ett försök sätter man en liten mängd
1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206.
 1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206. a) Antalet protoner är., antalet neutroner är. och antalet elektroner. hos atomer av isotopen. b) Vilken partikel bildas om en
1. Ett grundämne har atomnummer 82. En av dess isotoper har masstalet 206. a) Antalet protoner är., antalet neutroner är. och antalet elektroner. hos atomer av isotopen. b) Vilken partikel bildas om en
Alla papper, även kladdpapper lämnas tillbaka.
 Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Maxpoäng 66 g 13 vg 28 varav 4 p av uppg. 18,19,20,21 mvg 40 varav 9 p av uppg. 18,19,20,21 Alla papper, även kladdpapper lämnas tillbaka. 1 (2p) En oladdad atom innehåller 121 neutroner och 80 elektroner.
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
(tetrakloroauratjon) (2)
 UTTAGIG TILL KEMIOLYMPIADE 2015 TEORETISKT PROV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. jälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
UTTAGIG TILL KEMIOLYMPIADE 2015 TEORETISKT PROV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. jälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
Hjälpmedel: räknare, formelsamling, periodiska system. Spänningsserien: K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au. Kemi A
 Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
Uppsala Universitet Fysiska Institutionen Tekniskt- naturvetenskapligt basår Raúl Miranda 2007 Namn: Stark Karl Grupp: Den bästa.. Datum: Tid: 08.00 12.00 jälpmedel: räknare, formelsamling, periodiska
Då du skall lösa kemiska problem av den typ som kommer nedan är det praktiskt att ha en lösningsmetod som man kan använda till alla problem.
 Kapitel 2 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Kapitel 2 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5.
 Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5. Modellsvar Räknefel och slarvfel, - ½ p. Halvpoäng upphöjas inte. Till exempel om totalpoäng är 2½ p. slutpoäng
Diplomingenjörs - och arkitektutbildningens gemensamma antagning 2017 Urvalsprov i DI-kemi 31.5. Modellsvar Räknefel och slarvfel, - ½ p. Halvpoäng upphöjas inte. Till exempel om totalpoäng är 2½ p. slutpoäng
Allmän Kemi 2 (NKEA04 m.fl.)
 Allmän Kemi (NKEA4 m.fl.) --4 Uppgift a) K c [NO] 4 [H O] 6 /([NH ] 4 [O ] 5 ) eller K p P(NO) 4 P(H O) 6 /(P(NH ) 4 P(O ) 5 ) Om kärlets volym minskar ökar trycket och då förskjuts jämvikten åt den sida
Allmän Kemi (NKEA4 m.fl.) --4 Uppgift a) K c [NO] 4 [H O] 6 /([NH ] 4 [O ] 5 ) eller K p P(NO) 4 P(H O) 6 /(P(NH ) 4 P(O ) 5 ) Om kärlets volym minskar ökar trycket och då förskjuts jämvikten åt den sida
KEMIOLYMPIADEN 2007 Uttagning
 KEMILYMPIADEN 2007 Uttagning 1 2006-10-19 Provet omfattar 5 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Inga konstanter och atommassor ges i problemtexten. Dessa hämtas
KEMILYMPIADEN 2007 Uttagning 1 2006-10-19 Provet omfattar 5 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Inga konstanter och atommassor ges i problemtexten. Dessa hämtas
Kapitel Kapitel 12. Repetition inför delförhör 2. Kemisk kinetik. 2BrNO 2NO + Br 2
 Kapitel 1-18 Repetition inför delförhör Kapitel 1 Innehåll Kapitel 1 Kemisk kinetik Redoxjämvikter Kapitel 1 Definition Kapitel 1 Området inom kemi som berör reaktionshastigheter Kemisk kinetik Kapitel
Kapitel 1-18 Repetition inför delförhör Kapitel 1 Innehåll Kapitel 1 Kemisk kinetik Redoxjämvikter Kapitel 1 Definition Kapitel 1 Området inom kemi som berör reaktionshastigheter Kemisk kinetik Kapitel
Kapitel Repetition inför delförhör 2
 Kapitel 12-18 Repetition inför delförhör 2 Kapitel 1 Innehåll Kapitel 12 Kapitel 13 Kapitel 14 Kapitel 15 Kapitel 16 Kapitel 17 Kapitel 18 Kemisk kinetik Kemisk jämvikt Syror och baser Syra-basjämvikter
Kapitel 12-18 Repetition inför delförhör 2 Kapitel 1 Innehåll Kapitel 12 Kapitel 13 Kapitel 14 Kapitel 15 Kapitel 16 Kapitel 17 Kapitel 18 Kemisk kinetik Kemisk jämvikt Syror och baser Syra-basjämvikter
Kemiolympiaden 2014 En tävling i regi av Svenska Kemistsamfundet
 KEMILYMPIADE SVERIGE Kemiolympiaden 2014 En tävling i regi av Svenska Kemistsamfundet Till alla elever u är det dags för årets kemiolympiad. Kemiolympiaden är en tävling för gymnasieelever som inte fyllt
KEMILYMPIADE SVERIGE Kemiolympiaden 2014 En tävling i regi av Svenska Kemistsamfundet Till alla elever u är det dags för årets kemiolympiad. Kemiolympiaden är en tävling för gymnasieelever som inte fyllt
För godkänt resultat krävs 20 p och för väl godkänt krävs 30 p. Max poäng är 40 p
 Tentamen i kemi för Basåret, OKEOOl :2 den 20 april 2012 Skrivtid: 8.00-1300 Plats. 8132 Hjälpmedel: Räknare och tabell För godkänt resultat krävs 20 p och för väl godkänt krävs 30 p. Max poäng är 40 p
Tentamen i kemi för Basåret, OKEOOl :2 den 20 april 2012 Skrivtid: 8.00-1300 Plats. 8132 Hjälpmedel: Räknare och tabell För godkänt resultat krävs 20 p och för väl godkänt krävs 30 p. Max poäng är 40 p
REPETITIONSKURS I KEMI LÖSNINGAR TILL ÖVNINGSUPPGIFTER
 KEMI REPETITIONSKURS I LÖSNINGAR TILL ÖVNINGSUPPGIFTER Magnus Ehinger Fullständiga lösningar till beräkningsuppgifterna. Kemins grunder.10 Vi antar att vi har 10 000 Li-atomer. Av dessa är då 74 st 6 Li
KEMI REPETITIONSKURS I LÖSNINGAR TILL ÖVNINGSUPPGIFTER Magnus Ehinger Fullständiga lösningar till beräkningsuppgifterna. Kemins grunder.10 Vi antar att vi har 10 000 Li-atomer. Av dessa är då 74 st 6 Li
Prov i kemi kurs A. Atomens byggnad och periodiska systemet 2(7) Namn:... Hjälpmedel: räknedosa + tabellsamling
 Prov i kemi kurs A Namn:... Hjälpmedel: räknedosa + tabellsamling Lösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och
Prov i kemi kurs A Namn:... Hjälpmedel: räknedosa + tabellsamling Lösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och
Vilken av följande partiklar är det starkaste reduktionsmedlet? b) Båda syralösningarna har samma ph vid ekvivalenspunkten.
 1 (2/0/0) Beräkna trycket i en behållare med volymen 4,50 dm 3, temperaturen 34,5 ºC och som innehåller 5,83 g vätgas samt 11,66 g syrgas. (Gaserna betraktas som ideala gaser.) 2 (1/0/0) Två lika stora
1 (2/0/0) Beräkna trycket i en behållare med volymen 4,50 dm 3, temperaturen 34,5 ºC och som innehåller 5,83 g vätgas samt 11,66 g syrgas. (Gaserna betraktas som ideala gaser.) 2 (1/0/0) Två lika stora
Huvudansökan, kandidatprogrammet i kemi Urvalsprov kl
 Huvudansökan, kandidatprogrammet i kemi Urvalsprov 10.5.2019 kl. 10.00 13.00 Skriv ditt namn och dina personuppgifter med tryckbokstäver. Skriv ditt namn med latinska bokstäver (abcd...), inte till exempel
Huvudansökan, kandidatprogrammet i kemi Urvalsprov 10.5.2019 kl. 10.00 13.00 Skriv ditt namn och dina personuppgifter med tryckbokstäver. Skriv ditt namn med latinska bokstäver (abcd...), inte till exempel
Rättningstiden är i normalfall tre veckor, annars är det detta datum som gäller: Efter överenskommelse med studenterna är rättningstiden fem veckor.
 Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Kemi Bas A Provmoment: Tentamen Ladokkod: TX011X Tentamen ges för: Tbas, TNBas 7,5 högskolepoäng Namn: Personnummer: Tentamensdatum: 2012-10-22 Tid: 9:00-13:00 Hjälpmedel: papper, penna, radergummi kalkylator
Övningsuppgifter Syror och baser
 Övningsuppgifter Syror och baser Litterarum radices amarae, fructus dulces 1. Beräkna ph i en lösning med vätejonkoncentrationen: a) 0,036 mol/dm 3 b) 2 10-5 mol/dm 3 c) 2,0 mol/dm 3 d) 2,35 10-8 mol/dm
Övningsuppgifter Syror och baser Litterarum radices amarae, fructus dulces 1. Beräkna ph i en lösning med vätejonkoncentrationen: a) 0,036 mol/dm 3 b) 2 10-5 mol/dm 3 c) 2,0 mol/dm 3 d) 2,35 10-8 mol/dm
Aggregationstillstånd
 4. Gaser Aggregationstillstånd 4.1 Förbränning En kemisk reaktion mellan ett ämne och syre. Fullständig förbränning (om syre finns i överskott), t.ex. etanol + syre C2H6OH (l) +3O2 (g) 3H2O (g) + 2CO2
4. Gaser Aggregationstillstånd 4.1 Förbränning En kemisk reaktion mellan ett ämne och syre. Fullständig förbränning (om syre finns i överskott), t.ex. etanol + syre C2H6OH (l) +3O2 (g) 3H2O (g) + 2CO2
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Kemisk jämvikt Kap 3 En reaktionsformel säger vilka ämnen som reagerar vilka som bildas samt förhållandena mellan ämnena En reaktionsformel säger inte hur mycket som reagerar/bildas Ingen reaktion ger
Tentamen i KEMI del A för basåret GU (NBAK10) kl Institutionen för kemi, Göteborgs universitet
 Tentamen i KEMI del A för basåret GU (NBAK10) 2007-02-15 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: Väg och Vatten-huset Hjälpmedel: Räknare Ansvarig lärare: Leif Holmlid 772
Tentamen i KEMI del A för basåret GU (NBAK10) 2007-02-15 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: Väg och Vatten-huset Hjälpmedel: Räknare Ansvarig lärare: Leif Holmlid 772
KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16
 KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
KEMIOLYMPIADEN 2009 Uttagning 1 2008-10-16 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
Övningar Stökiometri och Gaslagen
 Övningar Stökiometri och Gaslagen 1 1 På baksidan av ett paket med Liljeholmens Stearinljus står berättat att Lars Johan Hierta, grundaren av Aftonbladet, i London år 1837 kom i kontakt med ett nytt ljus,
Övningar Stökiometri och Gaslagen 1 1 På baksidan av ett paket med Liljeholmens Stearinljus står berättat att Lars Johan Hierta, grundaren av Aftonbladet, i London år 1837 kom i kontakt med ett nytt ljus,
Tentamen i Allmän kemi 7,5 hp 5 november 2014 ( poäng)
 1 (6) Tentamen i Allmän kemi 7,5 hp 5 november 2014 (50 + 40 poäng) Tentamen består av två delar, räkne- respektive teoridel: Del 1: Teoridel. Max poäng: 50 p För godkänt: 28 p Del 2: Räknedel. Max poäng:
1 (6) Tentamen i Allmän kemi 7,5 hp 5 november 2014 (50 + 40 poäng) Tentamen består av två delar, räkne- respektive teoridel: Del 1: Teoridel. Max poäng: 50 p För godkänt: 28 p Del 2: Räknedel. Max poäng:
UTTAGNING TILL KEMIOLYMPIADEN 2006
 UTTAGNING TILL KEMIOLYMPIADEN 2006 TEORETISKT PROV 2006-03-15 Provet omfattar 6 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Konstanter som inte ges i problemtexten, hämtas
UTTAGNING TILL KEMIOLYMPIADEN 2006 TEORETISKT PROV 2006-03-15 Provet omfattar 6 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Konstanter som inte ges i problemtexten, hämtas
UTTAGNING TILL KEMIOLYMPIADEN 2011
 UTTAGNING TILL KEMIOLYMPIADEN 2011 TEORETISKT PROV 2011-03-15 Provet omfattar 11 uppgifter Provtid: 180 minuter. jälpmedel: Miniräknare, tabell- och formelsamling. Till uppgifterna 1-7 skall du endast
UTTAGNING TILL KEMIOLYMPIADEN 2011 TEORETISKT PROV 2011-03-15 Provet omfattar 11 uppgifter Provtid: 180 minuter. jälpmedel: Miniräknare, tabell- och formelsamling. Till uppgifterna 1-7 skall du endast
1 Tror du reaktionen nedan är momentan eller ej? Motivera. 1p S 2 O H + S(s) + SO 2 (g) + H 2 O(l)
 Tentamen 1 Baskemi 2 2011.05.02 1 Tror du reaktionen nedan är momentan eller ej? Motivera. S 2 O 2-3 + 2H + S(s) + SO 2 (g) + H 2 O(l) 2 Vad är a. ett intermediär? b. en radikal? c. en amfojon 3 Vi studerar
Tentamen 1 Baskemi 2 2011.05.02 1 Tror du reaktionen nedan är momentan eller ej? Motivera. S 2 O 2-3 + 2H + S(s) + SO 2 (g) + H 2 O(l) 2 Vad är a. ett intermediär? b. en radikal? c. en amfojon 3 Vi studerar
Kemisk jämvikt. Kap 3
 Kemisk jämvikt Kap 3 Vilken info ger en reaktionsformel? En reaktionsformel säger - vilka ämnen som reagerar, - vilka som bildas - samt förhållandena mellan ämnena som reagerar/bildas En reaktionsformel
Kemisk jämvikt Kap 3 Vilken info ger en reaktionsformel? En reaktionsformel säger - vilka ämnen som reagerar, - vilka som bildas - samt förhållandena mellan ämnena som reagerar/bildas En reaktionsformel
Viktigt! Glöm inte att skriva Tentamenskod på alla blad du lämnar in.
 Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2015-10-30 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2015-10-30 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Repetitionsuppgifter. gymnasiekemi
 Repetitionsuppgifter i gymnasiekemi Att börja med: A 2, 5, 7 B 2, 4, 5, 14, 15, 16, 19 C 2, 7, 8 D 1,2, 3 Om det är för lätt: B 9, 10, 12, 13, 21 C 3, 6 D 4, 5 Boel Lindegård 2006 Reviderad 2012 A. Atomernas
Repetitionsuppgifter i gymnasiekemi Att börja med: A 2, 5, 7 B 2, 4, 5, 14, 15, 16, 19 C 2, 7, 8 D 1,2, 3 Om det är för lätt: B 9, 10, 12, 13, 21 C 3, 6 D 4, 5 Boel Lindegård 2006 Reviderad 2012 A. Atomernas
4.1 Se lärobokens svar och anvisningar. 4.2 För reaktionen 2ICl(g) I 2 (g) + Cl 2 (g) gäller att. För reaktionen I 2 (g) + Cl 2 (g) 2ICl(g) gäller 2
 apitel 4 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
apitel 4 Här hittar du svar och lösningar till de övningsuppgifter som hänvisas till i inledningen. I vissa fall har lärobokens avsnitt Svar och anvisningar bedömts vara tillräckligt fylliga varför enbart
Stökiometri IV Blandade Övningar
 Stökiometri IV Blandade Övningar 1) 1 Man blandar 25,0 cm 3 silvernitratlösning, c = 0,100 M, med 50,0 cm 3 bariumkloridlösning c = 0,0240 M. Hur stor är: [Ag + ] i blandningen? [NO 3- ] i blandningen?
Stökiometri IV Blandade Övningar 1) 1 Man blandar 25,0 cm 3 silvernitratlösning, c = 0,100 M, med 50,0 cm 3 bariumkloridlösning c = 0,0240 M. Hur stor är: [Ag + ] i blandningen? [NO 3- ] i blandningen?
Tentamen i KEMI del B för Basåret GU (NBAK10) kl Institutionen för kemi, Göteborgs universitet
 Tentamen i KEMI del B för Basåret GU (NBAK10) 2007-03-23 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: örsalslängan A1, B1, B4 jälpmedel: Räknare valfri Ansvarig lärare: Leif olmlid
Tentamen i KEMI del B för Basåret GU (NBAK10) 2007-03-23 kl. 08.30-13.30 Institutionen för kemi, Göteborgs universitet Lokal: örsalslängan A1, B1, B4 jälpmedel: Räknare valfri Ansvarig lärare: Leif olmlid
Stökiometri I Massa-Molmassa Substansmängd
 Stökiometri I Massa-Molmassa Substansmängd 1 1 Bestäm atommassan för a) Syre b) Barium c) N 2 d) 8 S 2 2 Bestäm formelmassan för: a) Natriumklorid b) Aluminiumoxid c) Ag 2 SO 4 d) ZnHg(SCN) 4 e) UO 2 (NO
Stökiometri I Massa-Molmassa Substansmängd 1 1 Bestäm atommassan för a) Syre b) Barium c) N 2 d) 8 S 2 2 Bestäm formelmassan för: a) Natriumklorid b) Aluminiumoxid c) Ag 2 SO 4 d) ZnHg(SCN) 4 e) UO 2 (NO
Syror och baser. H 2 O + HCl H 3 O + + Cl H + Vatten är en amfolyt + OH NH 3 + H 2 O NH 4. Kemiföreläsning 3 2009-10-27
 Begrepp Syror och baser Kemiföreläsning 9--7 Några vanliga syror HCl (aq) saltsyra HNO salpetersyra H SO svavelsyra H CO kolsyra H PO fosforsyra HAc ättiksyra (egentligen CH COOH, Ac är en förkortning
Begrepp Syror och baser Kemiföreläsning 9--7 Några vanliga syror HCl (aq) saltsyra HNO salpetersyra H SO svavelsyra H CO kolsyra H PO fosforsyra HAc ättiksyra (egentligen CH COOH, Ac är en förkortning
Kapitel 16. Löslighet och komplex
 Kapitel 16 Löslighet och komplex Kapitel 16 Innehåll 16.1 Löslighetsjämvikter och löslighetsprodukt 16.2 Utfällning och kvalitativ analys 16.3 Jämvikter med lösningskomplex Copyright Cengage Learning.
Kapitel 16 Löslighet och komplex Kapitel 16 Innehåll 16.1 Löslighetsjämvikter och löslighetsprodukt 16.2 Utfällning och kvalitativ analys 16.3 Jämvikter med lösningskomplex Copyright Cengage Learning.
TESTA DINA KUNSKAPER I KEMI
 TESTA DINA KUNSKAPER I KEMI INFÖR STUDIERNA VID STOCKHOLMS UNIVERSITET TESTA DINA FÖRKUNSKAPER. 1 För att kunna koncentrera dig på det väsentliga i undervisningen måste du ha din gymnasiekemi aktuell.
TESTA DINA KUNSKAPER I KEMI INFÖR STUDIERNA VID STOCKHOLMS UNIVERSITET TESTA DINA FÖRKUNSKAPER. 1 För att kunna koncentrera dig på det väsentliga i undervisningen måste du ha din gymnasiekemi aktuell.
Energiuppgifter. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi vid en exoterm reaktion? O (s) H 2.
 Energiuppgifter Litterarum radices amarae, fructus dulces 1. Ange ett svenskt ord som är synonymt med termen entalpi. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi
Energiuppgifter Litterarum radices amarae, fructus dulces 1. Ange ett svenskt ord som är synonymt med termen entalpi. 2. Har reaktanterna (de reagerande ämnena) eller reaktionsprodukterna störst entalpi
Svar: Halten koksalt är 16,7% uttryckt i massprocent
 Kapitel 6 6.1 Se lärobokens svar och anvisningar. 6.3 Se lärobokens svar och anvisningar. 6. Se lärobokens svar och anvisningar. 6.5 Kalcium reagerar med vatten på samma sätt som natrium. Utgångsämnena
Kapitel 6 6.1 Se lärobokens svar och anvisningar. 6.3 Se lärobokens svar och anvisningar. 6. Se lärobokens svar och anvisningar. 6.5 Kalcium reagerar med vatten på samma sätt som natrium. Utgångsämnena
KEMIOLYMPIADEN 2017, OMGÅNG 2, ANVISNINGAR TILL LÄRAREN
 KEMIOLYMPIADEN 2017, OMGÅNG 2, ANVISNINGAR TILL LÄRAREN Denna fil innehåller rättningsmall och fullständiga lösningar till uppgifterna. Filen (och eventuell utskrift) ska förvaras under sekretess till
KEMIOLYMPIADEN 2017, OMGÅNG 2, ANVISNINGAR TILL LÄRAREN Denna fil innehåller rättningsmall och fullständiga lösningar till uppgifterna. Filen (och eventuell utskrift) ska förvaras under sekretess till
Kapitel 16. Lägre magtarmkanalen. Löslighet och komplex
 Kapitel 16 Löslighet och komplex Kapitel 16 Innehåll 16.1 16.2 Utfällning och kvalitativ analys 16.3 Jämvikter med lösningskomplex Copyright Cengage Learning. All rights reserved 2 Lägre magtarmkanalen
Kapitel 16 Löslighet och komplex Kapitel 16 Innehåll 16.1 16.2 Utfällning och kvalitativ analys 16.3 Jämvikter med lösningskomplex Copyright Cengage Learning. All rights reserved 2 Lägre magtarmkanalen
UTTAGNING TILL KEMIOLYMPIADEN 2018 TEORETISKT PROV nr 1
 UTTAGIG TILL KEMILYMPIADE 2018 TERETISKT PRV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Max: 40 poäng Redovisning och alla svar görs på svarsblanketten
UTTAGIG TILL KEMILYMPIADE 2018 TERETISKT PRV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Max: 40 poäng Redovisning och alla svar görs på svarsblanketten
a) 55,8 g/mol b) 183,8 g/mol c) 255,6 g/mol d) 303,7 g/mol 2. Galliumnitrid används i lysdioder. Vilken kemisk formel har galliumnitrid?
 UTTAGNING TILL KEMILYMPIADEN 2016 TERETISKT PRV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
UTTAGNING TILL KEMILYMPIADEN 2016 TERETISKT PRV nr 1 Provdatum: november vecka 45 Provtid: 120 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning och alla svar görs på svarsblanketten
Gaser: ett av tre aggregationstillstånd hos ämnen. Flytande fas Gasfas
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Hur förändras den ideala gasens inre energi? Beräkna också q. (3p)
 entamen i kemisk termodynamik den 4 juni 2013 kl. 14.00 till 19.00 Hjälpmedel: Räknedosa, BEA och Formelsamling för kurserna i kemi vid KH. Endast en uppgift per blad! Skriv namn och personnummer på varje
entamen i kemisk termodynamik den 4 juni 2013 kl. 14.00 till 19.00 Hjälpmedel: Räknedosa, BEA och Formelsamling för kurserna i kemi vid KH. Endast en uppgift per blad! Skriv namn och personnummer på varje
Kap 8 Redox-reaktioner. Reduktion/Oxidation (elektrokemi)
 Kap 8 Redox-reaktioner Reduktion/Oxidation (elektrokemi) Zinkbleck (zinkplåt) i en kopparsulfatlösning Zn (s) + CuSO 4 (aq) Zn (s) + Cu 2+ (aq) + SO 4 2+ (aq) Vad händer? Magnesium brinner i luft Vad
Kap 8 Redox-reaktioner Reduktion/Oxidation (elektrokemi) Zinkbleck (zinkplåt) i en kopparsulfatlösning Zn (s) + CuSO 4 (aq) Zn (s) + Cu 2+ (aq) + SO 4 2+ (aq) Vad händer? Magnesium brinner i luft Vad
Repetition F12. Lunds universitet / Naturvetenskapliga fakulteten / Kemiska institutionen / KEMA00
 Repetition F12 Kolligativa egenskaper lösning av icke-flyktiga ämnen beror främst på mängd upplöst ämne (ej ämnet självt) o Ångtryckssänkning o Kokpunktsförhöjning o Fryspunktssänkning o Osmotiskt tryck
Repetition F12 Kolligativa egenskaper lösning av icke-flyktiga ämnen beror främst på mängd upplöst ämne (ej ämnet självt) o Ångtryckssänkning o Kokpunktsförhöjning o Fryspunktssänkning o Osmotiskt tryck
Tentamen i Termodynamik för K och B kl 8-13
 Tentamen i Termodynamik för K och B 081025 kl 8-13 Tillåtna hjälpmedel: Miniräknare (med tillhörande handbok), utdelat formelblad med tabellsamling. Slutsatser skall motiveras och beräkningar redovisas.
Tentamen i Termodynamik för K och B 081025 kl 8-13 Tillåtna hjälpmedel: Miniräknare (med tillhörande handbok), utdelat formelblad med tabellsamling. Slutsatser skall motiveras och beräkningar redovisas.
Tentamen, Termodynamik och ytkemi, KFKA01,
 Tentamen, Termodynamik och ytkemi, KFKA01, 2016-10-26 Lösningar 1. a Mängden vatten är n m M 1000 55,5 mol 18,02 Förångningen utförs vid konstant tryck ex 2 bar och konstant temeratur T 394 K. Vi har alltså
Tentamen, Termodynamik och ytkemi, KFKA01, 2016-10-26 Lösningar 1. a Mängden vatten är n m M 1000 55,5 mol 18,02 Förångningen utförs vid konstant tryck ex 2 bar och konstant temeratur T 394 K. Vi har alltså
UTTAGNING TILL KEMIOLYMPIADEN 2008
 UTTAGIG TILL KEMIOLYMPIADE 008 TEORETISKT PROV 008-03-11 Provet omfattar 14 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. Till uppgifterna 1-10 skall du endast ge
UTTAGIG TILL KEMIOLYMPIADE 008 TEORETISKT PROV 008-03-11 Provet omfattar 14 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. Till uppgifterna 1-10 skall du endast ge
Titrering av en stark syra med en stark bas
 Titrering av en stark syra med en stark bas Titrering av en svag syra med en stark bas Titrering av en svag bas med en stark syra Bestämning av en svag syras pka-värde Titrering av oxalsyra (tvåprotonig
Titrering av en stark syra med en stark bas Titrering av en svag syra med en stark bas Titrering av en svag bas med en stark syra Bestämning av en svag syras pka-värde Titrering av oxalsyra (tvåprotonig
Blandade Övningar Stökiometri och Gaslagen 1
 Blandade Övningar Stökiometri och Gaslagen 1 1) 1 Då man upphettar 6,820 g zinkspat, som är ett mineral som innehåller zinkkarbonat, ZnCO 3, bildas 1,182 g CO 2. Hur många % rent ZnCO 3 innehåller mineralet?
Blandade Övningar Stökiometri och Gaslagen 1 1) 1 Då man upphettar 6,820 g zinkspat, som är ett mineral som innehåller zinkkarbonat, ZnCO 3, bildas 1,182 g CO 2. Hur många % rent ZnCO 3 innehåller mineralet?
Rättningstiden är i normalfall 15 arbetsdagar, annars är det detta datum som gäller:
 Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2016-10-27 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
Kemi Bas 1 Provmoment: Ladokkod: Tentamen ges för: TentamensKod: Tentamen 40S01A KBAST och KBASX 7,5 högskolepoäng Tentamensdatum: 2016-10-27 Tid: 09:00-13:00 Hjälpmedel: papper, penna, radergummi, kalkylator
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2
 UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
UTTAGNING TILL KEMIOLYMPIADEN 2012, OMGÅNG 2 Provet omfattar 19 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell- och formelsamling. 2012-03-14 Till uppgifterna 1-15 skall du endast ge svar.
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 3. Stökiometri
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 Molmassa 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter
Molekyler och molekylmodeller. En modell av strukturen hos is, fruset vatten
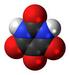 Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
Molekyler och molekylmodeller En modell av strukturen hos is, fruset vatten Sammanställt av Franciska Sundholm 2007 Molekyler och molekylmodeller En gren av kemin beskriver strukturen hos olika föreningar
4 Beräkna massprocenthalten koppar i kopparsulfat femhydrat Hur många gram natriumklorid måste man väga upp för att det ska bli 2 mol?
 Stökiometri VI 1 Hur många atomer finns det i en molekyl H 2SO 4? 1 2 Skriv kemiska formeln för jonföreningar: 2 a) Kalciumoxid b) Kaliumjodid c) Strontiumhydroxid d) Aluminiumsulfit 3 Ange eller beräkna:
Stökiometri VI 1 Hur många atomer finns det i en molekyl H 2SO 4? 1 2 Skriv kemiska formeln för jonföreningar: 2 a) Kalciumoxid b) Kaliumjodid c) Strontiumhydroxid d) Aluminiumsulfit 3 Ange eller beräkna:
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden PROVET I KEMI 22.3.2013 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Ylioppilastutkintolautakunta S tudentexamensnämnden PROVET I KEMI 22.3.2013 BESKRIVNING AV GODA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Godkänt-del A (uppgift 1 10) Endast svar krävs, svara direkt på provbladet.
 Tentamen för Termodynamik och ytkemi, KFKA10, 2018-01-08 Tillåtna hjälpmedel: Miniräknare, utdelat formelblad och tabellblad. Godkänt-del A (endast svar): Max 14 poäng Godkänt-del B (motiveringar krävs):
Tentamen för Termodynamik och ytkemi, KFKA10, 2018-01-08 Tillåtna hjälpmedel: Miniräknare, utdelat formelblad och tabellblad. Godkänt-del A (endast svar): Max 14 poäng Godkänt-del B (motiveringar krävs):
Kapitel 6. Termokemi. Kapaciteten att utföra arbete eller producera värme. Storhet: E = F s (kraft sträcka) = P t (effekt tid) Enhet: J = Nm = Ws
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
Bränsleanalys och rökgaskalkyl. Oorganisk Kemi I Föreläsning
 Bränsleanalys och rökgaskalkyl Oorganisk Kemi I Föreläsning 3 12.4.2011 Mål Att tillämpa det första trappsteget i processkemistens verktygslåda: Definiera stökiometriska samband mellan reaktant och produkt
Bränsleanalys och rökgaskalkyl Oorganisk Kemi I Föreläsning 3 12.4.2011 Mål Att tillämpa det första trappsteget i processkemistens verktygslåda: Definiera stökiometriska samband mellan reaktant och produkt
F1 F d un t amen l a s KEMA00
 F1 F d t l F1 Fundamentals KEMA00 A Materia och Energi SI-enheter Mätosäkerhet Potentiell energi Ep = mgh Coulombs lag q1 q2 4 r E p 0 B Grundämnen och atomer Atomnummer z (antal atomer i kärnan) Masstal
F1 F d t l F1 Fundamentals KEMA00 A Materia och Energi SI-enheter Mätosäkerhet Potentiell energi Ep = mgh Coulombs lag q1 q2 4 r E p 0 B Grundämnen och atomer Atomnummer z (antal atomer i kärnan) Masstal
Kursplan och betygskriterier i kemi. Utgångspunkten för kemi är de allmänna mål som finns redovisade i lpo94
 Kursplan och betygskriterier i kemi Utgångspunkten för kemi är de allmänna mål som finns redovisade i lpo94 Kemiundervisningen ska ge eleven kunskap om olika ämnen som man träffar på i vardagslivet. Den
Kursplan och betygskriterier i kemi Utgångspunkten för kemi är de allmänna mål som finns redovisade i lpo94 Kemiundervisningen ska ge eleven kunskap om olika ämnen som man träffar på i vardagslivet. Den
Huvudansökan, kandidatprogrammet i kemi Urvalsprov kl
 Tekniska anteckningar: KEMIA Sida: 1 (14) Huvudansökan, kandidatprogrammet i kemi Urvalsprov 9.5.2018 kl. 10.00 13.00 Skriv ditt namn och dina personuppgifter med tryckbokstäver. Skriv ditt namn med latinska
Tekniska anteckningar: KEMIA Sida: 1 (14) Huvudansökan, kandidatprogrammet i kemi Urvalsprov 9.5.2018 kl. 10.00 13.00 Skriv ditt namn och dina personuppgifter med tryckbokstäver. Skriv ditt namn med latinska
UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1. Läkemedel
 UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1 Provdatum: torsdagen den 15 november Provtid: 120 minuter Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning görs på svarsblanketten som
UTTAGNING TILL KEMIOLYMPIADEN 2013 TEORETISKT PROV nr 1 Provdatum: torsdagen den 15 november Provtid: 120 minuter Hjälpmedel: Räknare, tabell- och formelsamling. Redovisning görs på svarsblanketten som
Kapitel 6. Termokemi
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden PRVET I KEMI 7.9.013 BESKRIVNING AV GDA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
Ylioppilastutkintolautakunta S tudentexamensnämnden PRVET I KEMI 7.9.013 BESKRIVNING AV GDA SVAR De beskrivningar av svarens innehåll som ges här är inte bindande för studentexamensnämndens bedömning.
PTG 2015 övning 1. Problem 1
 PTG 2015 övning 1 1 Problem 1 Enligt mätningar i fortfarighetstillstånd producerar en destillationsanläggning 12,5 /s destillat innehållande 87 vikt % alkohol och 19,2 /s bottenprodukt innehållande 7 vikt
PTG 2015 övning 1 1 Problem 1 Enligt mätningar i fortfarighetstillstånd producerar en destillationsanläggning 12,5 /s destillat innehållande 87 vikt % alkohol och 19,2 /s bottenprodukt innehållande 7 vikt
Gaser: ett av tre aggregationstillstånd hos ämnen. Fast fas Flytande fas Gasfas
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 3. Stökiometri. Kan utföras om den genomsnittliga massan för partiklarna är känd. Man utgår sedan från att dessa är identiska.
 Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 3 Stökiometri Kapitel 3 Innehåll 3.1 Räkna genom att väga 3.2 Atommassor 3.3 Molbegreppet 3.4 3.5 Problemlösning 3.6 Kemiska föreningar 3.7 Kemiska formler 3.8 Kemiska reaktionslikheter 3.9 3.10
Kapitel 6. Termokemi. Kapaciteten att utföra arbete eller producera värme. Storhet: E = F s (kraft sträcka) = P t (effekt tid) Enhet: J = Nm = Ws
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 6.2 6.3 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage Learning. All rights reserved 2 Energi Kapaciteten att
KEMI 3. Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma.
 KEMI 3 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al. : Kemi 3 - Reaktioner och energi + MAOL!!! Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma. Kursinnehåll
KEMI 3 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al. : Kemi 3 - Reaktioner och energi + MAOL!!! Övningsprov finns på Matteus. Brådskande ärenden sköts via Wilma. Kursinnehåll
Kemiprov vecka 51 HT 2012
 Namn: Klass: Kemiprov vecka 51 HT 01 Provet består av tre delar, en grön, en lila och en blå del. Den gröna delen ger maximalt och testar endast för betyget E. Du som nöjer dig med betyget E, behöver bara
Namn: Klass: Kemiprov vecka 51 HT 01 Provet består av tre delar, en grön, en lila och en blå del. Den gröna delen ger maximalt och testar endast för betyget E. Du som nöjer dig med betyget E, behöver bara
Repetition F10. Lunds universitet / Naturvetenskapliga fakulteten / Kemiska institutionen / KEMA00
 Repetition F10 Gibbs fri energi o G = H TS (definition) o En naturlig funktion av P och T Konstant P och T (andra huvudsatsen) o G = H T S 0 G < 0: spontan process, irreversibel G = 0: jämvikt, reversibel
Repetition F10 Gibbs fri energi o G = H TS (definition) o En naturlig funktion av P och T Konstant P och T (andra huvudsatsen) o G = H T S 0 G < 0: spontan process, irreversibel G = 0: jämvikt, reversibel
Kapitel 6. Termokemi
 Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
Kapitel 6 Termokemi Kapitel 6 Innehåll 6.1 Energi och omvandling 6.2 Entalpi och kalorimetri 6.3 Hess lag 6.4 Standardbildningsentalpi 6.5 Energikällor 6.6 Förnyelsebara energikällor Copyright Cengage
KEMIOLYMPIADEN 2010 Uttagning
 KEMIOLYMPIADEN 2010 Uttagning 1 2009-10-14 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
KEMIOLYMPIADEN 2010 Uttagning 1 2009-10-14 Provet omfattar 8 uppgifter, till vilka du endast ska ge svar, samt 3 uppgifter, till vilka du ska ge fullständiga lösningar. Inga konstanter och atommassor ges
1. a) Förklara, genom användning av något lämpligt kemiskt argument, varför H 2 SeO 4 är en starkare syra än H 2 SeO 3.
 Lösning till tentamen 2008 12 15 för Grundläggande kemi 10 hp Sid 1(5) 1. a) Förklara, genom användning av något lämpligt kemiskt argument, varför H 2 SeO 4 är en starkare syra än H 2 SeO 3. b) Beräkna
Lösning till tentamen 2008 12 15 för Grundläggande kemi 10 hp Sid 1(5) 1. a) Förklara, genom användning av något lämpligt kemiskt argument, varför H 2 SeO 4 är en starkare syra än H 2 SeO 3. b) Beräkna
Löslighetsjämvikter - beräkningsexempel
 Löslighetsjämvikter - beräkningsexempel ph = ½(pK a1 + pk a2 ) A&J sid 456 Erodering av kalksten i surt regn Tandemalj (apa4t) och ph KEMA02 VT2012, Kemiska Ins4tu4onen LU /KEBergquist F6 : 1 Huvudreak4onsmetoden
Löslighetsjämvikter - beräkningsexempel ph = ½(pK a1 + pk a2 ) A&J sid 456 Erodering av kalksten i surt regn Tandemalj (apa4t) och ph KEMA02 VT2012, Kemiska Ins4tu4onen LU /KEBergquist F6 : 1 Huvudreak4onsmetoden
Sura och basiska ämnen Syror och baser. Kap 5:1-5:3, (kap 9)
 Sura och basiska ämnen Syror och baser Kap 5:1-5:3, (kap 9) Syror / sura lösningar En sur lösning - har överskott på vätejoner, H + (protoner) En syra: - smakar surt - färgar BTB gult - reagerar med oädla
Sura och basiska ämnen Syror och baser Kap 5:1-5:3, (kap 9) Syror / sura lösningar En sur lösning - har överskott på vätejoner, H + (protoner) En syra: - smakar surt - färgar BTB gult - reagerar med oädla
Repetition F4. Lunds universitet / Naturvetenskapliga fakulteten / Kemiska institutionen / KEMA00
 Repetition F4 VSEPR-modellen elektronarrangemang och geometrisk form Polära (dipoler) och opolära molekyler Valensbindningsteori σ-binding och π-bindning hybridisering Molekylorbitalteori F6 Gaser Materien
Repetition F4 VSEPR-modellen elektronarrangemang och geometrisk form Polära (dipoler) och opolära molekyler Valensbindningsteori σ-binding och π-bindning hybridisering Molekylorbitalteori F6 Gaser Materien
KEMI 5. KURSBEDÖMNING: Kursprov: 8 uppgifter varav eleven löser max. 7 Tre av åtta uppgifter är från SE max. poäng: 42 gräns för godkänd: 12
 KEMI 5 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al.: Kemi 5 Reaktioner och jämvikt All kursinfo (t. ex. lektionsanteckningar, eventuella övningsprov...) finns på Matteus.
KEMI 5 Saana Ruotsala saana.ruotsala@mattliden.fi Kursbok Kaila, Meriläinen et al.: Kemi 5 Reaktioner och jämvikt All kursinfo (t. ex. lektionsanteckningar, eventuella övningsprov...) finns på Matteus.
Gaser: ett av tre aggregationstillstånd hos ämnen. Flytande fas Gasfas
 Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
Kapitel 5 Gaser Kapitel 5 Innehåll 5.1 Tryck 5.2 Gaslagarna från Boyle, Charles och Avogadro 5.3 Den ideala gaslagen 5.4 Stökiometri för gasfasreaktioner 5.5 Daltons lag för partialtryck 5.6 Den kinetiska
KEM A02 Allmän- och oorganisk kemi. KINETIK 2(2) A: Kap
 KEM A02 Allmän- och oorganisk kemi KINETIK 2(2) A: Kap 14.6 14.16 14.6 Andra ordningens kinetik Typiskt för bimolekylära reaktioner EXEMPEL: 2 HI H 2 + I 2 v = k [HI] 2 Typiskt för 2:a ordningens reaktion:
KEM A02 Allmän- och oorganisk kemi KINETIK 2(2) A: Kap 14.6 14.16 14.6 Andra ordningens kinetik Typiskt för bimolekylära reaktioner EXEMPEL: 2 HI H 2 + I 2 v = k [HI] 2 Typiskt för 2:a ordningens reaktion:
UTTAGNING TILL KEMIOLYMPIADEN 2009
 UTTAGNING TILL KEMILYMPIADEN 2009 TERETISKT PRV 20090310 Provet omfattar 14 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell och formelsamling. Till uppgifterna 110 skall du endast ge svar.
UTTAGNING TILL KEMILYMPIADEN 2009 TERETISKT PRV 20090310 Provet omfattar 14 uppgifter Provtid: 180 minuter. Hjälpmedel: Miniräknare, tabell och formelsamling. Till uppgifterna 110 skall du endast ge svar.
Bestäm brombutans normala kokpunkt samt beräkna förångningsentalpin H vap och förångningsentropin
 Tentamen i kemisk termodynamik den 7 januari 2013 kl. 8.00 till 13.00 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer
Tentamen i kemisk termodynamik den 7 januari 2013 kl. 8.00 till 13.00 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer
Beräkna koncentrationen. Niklas Dahrén
 Beräkna koncentrationen Niklas Dahrén Uppgifter som jag går igenom i den här filmen: 1. Hur stor är koncentra0onen kaliumklorid i en 2,0 dm 3 lösning där substansmängden kaliumklorid är 0,25 mol? 2. 0,038
Beräkna koncentrationen Niklas Dahrén Uppgifter som jag går igenom i den här filmen: 1. Hur stor är koncentra0onen kaliumklorid i en 2,0 dm 3 lösning där substansmängden kaliumklorid är 0,25 mol? 2. 0,038
UTTAGNING TILL KEMIOLYMPIADEN 2001
 UTTAGNING TILL KEMIOLYMPIADEN 2001 TEORETISKT PROV 2001-04-03 Provet omfattar 6 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Du får poäng för korrekt löst deluppgift, även
UTTAGNING TILL KEMIOLYMPIADEN 2001 TEORETISKT PROV 2001-04-03 Provet omfattar 6 uppgifter, till vilka du ska ge fullständiga lösningar, om inte annat anges. Du får poäng för korrekt löst deluppgift, även
% Allmän oorganisk kemi
 Kalkvatten RGNISK Kalkvatten KEMI Koncentrerad svavelsyra % llmän oorganisk kemi Koncentrerad svavelsyra 614. Skriv formeln för magnesiumfosfat.* rmanganat 615. Skriv formeln för a) kalciumoxid b) magnesiumnitrid
Kalkvatten RGNISK Kalkvatten KEMI Koncentrerad svavelsyra % llmän oorganisk kemi Koncentrerad svavelsyra 614. Skriv formeln för magnesiumfosfat.* rmanganat 615. Skriv formeln för a) kalciumoxid b) magnesiumnitrid
UTTAGNING TILL KEMIOLYMPIADEN 2015 TEORETISKT PROV nr 2
 UTTAGNING TILL KEMILYMPIADEN 2015 TERETISKT PRV nr 2 Provdatum: tisdagen den 10 mars 2015 Provtid: 180 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Provet omfattar 14 uppgifter. Alla uppgifter
UTTAGNING TILL KEMILYMPIADEN 2015 TERETISKT PRV nr 2 Provdatum: tisdagen den 10 mars 2015 Provtid: 180 minuter. Hjälpmedel: Räknare, tabell- och formelsamling. Provet omfattar 14 uppgifter. Alla uppgifter
Ke2 forts jämvikt. Jämviktssystem i olika miljöer Kap 4
 Ke2 forts jämvikt Jämviktssystem i olika miljöer Kap 4 Buffertsystem (buffertlösningar) Motverkar förändringar av ph, håller ph konstant (står emot tillsatser av H + och OH - ) Består av ett jämviktssystem
Ke2 forts jämvikt Jämviktssystem i olika miljöer Kap 4 Buffertsystem (buffertlösningar) Motverkar förändringar av ph, håller ph konstant (står emot tillsatser av H + och OH - ) Består av ett jämviktssystem
Tentamen i Kemisk Termodynamik 2011-01-19 kl 13-18
 Tentamen i Kemisk Termodynamik 2011-01-19 kl 13-18 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer på varje blad! Alla
Tentamen i Kemisk Termodynamik 2011-01-19 kl 13-18 Hjälpmedel: Räknedosa, BETA och Formelsamling för kurserna i kemi vid KTH. Endast en uppgift per blad! Skriv namn och personnummer på varje blad! Alla
JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3)
 KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3) mer löslighetsprodukt! Repetition Henderson-Hasselbach ekvationen för beräkning av ph i buffert - OK att använda - viktigast
KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3) mer löslighetsprodukt! Repetition Henderson-Hasselbach ekvationen för beräkning av ph i buffert - OK att använda - viktigast
JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 2(2)
 KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 2(2) mer löslighetsprodukt! 12.9 The common ion effect utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många metalljoner
KEM A02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 2(2) mer löslighetsprodukt! 12.9 The common ion effect utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många metalljoner
Lärare: Jimmy Pettersson. Kol och kolföreningar
 Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
Lärare: Jimmy Pettersson Kol och kolföreningar Rent kol Grafit Den vanligaste formen av rent kol. Bindningar mellan de olika lagerna är svaga. Slits lätt som spetsen på blyertspennor som består av grafit.
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra KEMINS GRUNDER
 VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
VAD ÄR KEMI? Vetenskapen om olika ämnens: Egenskaper Uppbyggnad Reaktioner med varandra ANVÄNDNINGSOMRÅDEN Bakning Läkemedel Rengöring Plast GoreTex o.s.v. i all oändlighet ÄMNENS EGENSKAPER Utseende Hårdhet
