Varje injektionsflaska med pulver innehåller 0,9 mg kollagenas från clostridium histolyticum*.
|
|
|
- David Lindqvist
- för 7 år sedan
- Visningar:
Transkript
1 1. LÄKEMEDLETS NAMN Xiapex 0,9 mg pulver och vätska till injektionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska med pulver innehåller 0,9 mg kollagenas från clostridium histolyticum*. *En sammansättning av två kollagenasenzym som samuttryckts och skördats efter anaerob fermentering av en fenotypiskt utvald stam av bakterien Clostridium histolyticum. Hjälpämnen: Natrium injicerat per led: Metakarpofalangealleder (MCP-leder): 0,9 mg. Proximala interfalangealleder (PIP-leder): 0,7 mg. För fullständig förteckning över hjälpämnen, se avsnitt LÄKEMEDELSFORM Pulver och vätska till injektionsvätska, lösning. (Pulver för injektion) Pulvret är ett vitt frystorkat pulver. Lösningen är en klar, färglös lösning. 4. KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer Xiapex är indicerat för behandling av Dupuytrens kontraktur hos vuxna patienter med palpabel sträng. 4.2 Dosering och administreringssätt Xiapex ska administreras av läkare som har fått lämplig träning i korrekt administrering av produkten och med erfarenhet av diagnos och behandling av Dupuytrens sjukdom. Dosering Rekommenderad dos av Xiapex är 0,58 mg per injektion i en palpabel Dupuytrensträng. Den volym av rekonstituerad Xiapex som ska administreras i en Dupuytrensträng varierar beroende på vilken typ av led som behandlas (se tabell 1). Omkring 24 timmar efter injektionen kan man vid behov försöka extendera fingret för att rupturera strängen. Om man inte uppnår ett tillfredsställande resultat kan injektionen och fingerextensionsproceduren upprepas efter omkring 4 veckor. Injektion och fingerextensionsproceduren kan upprepas upp till 3 gånger per sträng med omkring 4 veckors mellanrum. Enbart en sträng ska behandlas åt gången. Om sjukdomen har orsakat flera kontrakturer måste behandlingen av varje sträng genomföras i turordning enligt läkarens beslut. Erfarenheter från kliniska prövningar med Xiapex är för närvarade begränsad till upp till 3 injektioner per sträng och upp till 8 injektioner totalt. 2
2 Patienter ska instrueras att återkomma till läkaren nästföljande dag för undersökning av den injicerade strängen och vid behov genomgå en fingerextensionsprocedur för att strängen ska rupturera. Särskilda populationer Äldre personer På grund av avsaknad av mätbar systemisk exponering av Xiapex är dosjustering inte nödvändig. Inga generella skillnader i säkerhet eller effekt har observerats mellan äldre och yngre patienter. Nedsatt leverfunktion På grund av avsaknad av mätbar systemisk exponering är dosjustering inte nödvändig. Nedsatt njurfunktion På grund av avsaknad av mätbar systemisk exponering är dosjustering inte nödvändig. Pediatrisk population Det finns ingen relevant användning av Xiapex i den pediatriska populationen i åldern 0 18 år för behandling av Dupuytrens kontraktur. Administreringssätt Intralesionell användning. Endast för engångsbruk. Volym för rekonstituering Xiapex får bara rekonstitueras med medföljande spädningsvätska och med den lämpliga volymen före användning: - För metakarpofalangealleder (MCP-leder); använd 0,39 ml spädningsvätska. - För proximala interfalangealleder (PIP-leder); använd 0,31 ml spädningsvätska (se tabell 1). Volym för injektion - För strängar som påverkar MCP-leder ska varje dos administreras i en injektionsvolym om 0,25 ml. - För strängar som påverkar PIP-leder ska varje dos administreras i en injektionsvolym om 0,20 ml. Tabell 1. Volymer för rekonstituering och administrering Led att behandla Vätskevolym för rekonstituering Injektionsvolym för att tillföra dosen 0,58 mg av Xiapex MCP-leder PIP-leder 0,39 ml 0,25 ml 0,31 ml 0,20 ml Observera att den injektionsvolym som krävs för att tillföra dosen 0,58 mg är mindre än den totala volymen spädningsvätska som används för rekonstitueringen. 3
3 Patienterna ska instrueras att: inte böja eller sträcka på fingrarna för att minska extravasering av Xiapex ut från strängen tills fingerextensionsproceduren är slutförd inte vid något tillfälle försöka rupturera den injicerade strängen själv hålla den injicerade handen i högläge så mycket som möjligt tills dagen efter fingerextensionsproceduren. I avsnitt 6.6 ges detaljerade anvisningar till läkaren för beredning av läkemedlet för injektion (rekonstituering). 4.3 Kontraindikationer Överkänslighet mot den aktiva substansen eller mot något hjälpämne. 4.4 Varningar och försiktighet Allergiska reaktioner I den dubbelblinda delen av de tre placebokontrollerade kliniska fas 3-studierna fick 17 % av de Xiapex-behandlade patienterna lindriga allergiska reaktioner (närmare bestämt pruritus). Även om inga svåra allergiska reaktioner observerades i Xiapex-studierna (t.ex. reaktioner som förknippas med nedsatt respiratorisk förmåga, hypotoni eller organpåverkan) måste den behandlande läkaren vara beredd på att omhänderta eventuella svåra allergiska reaktioner, lokala eller systemiska, däribland risken att anafylaxi uppträder efter injektionen. Även om kliniska data inte pekar på en ökad risk för allvarliga allergiska reaktioner vid upprepade injektioner kan man inte utesluta risken för sådana reaktioner efter upprepad användning. Senruptur eller annan allvarlig skada i den injicerade extremiteten Xiapex får bara injiceras i Dupuytrens sträng. Eftersom Xiapex lyserar kollagen måste man iaktta försiktighet för att undvika injicering i senor, nerver, blodkärl eller andra kollageninnehållande strukturer i handen. Injektion av Xiapex i kollageninnehållande strukturer kan orsaka skada på dessa strukturer inklusive permanent skada som senruptur eller ligamentskada. Vid injicering av en sträng som påverkar PIP-leden i lillfingret får kanylen inte föras in djupare än 2 3 mm och inte mer än 4 mm distalt om palmara fingervecket. Patienten bör instrueras att omedelbart kontakta läkaren om det är svårigheter att böja fingret efter att svullnaden har gått ner (symtom på senruptur). Patienter med Dupuytrens kontrakturer som sitter fast i huden kan löpa större risk att drabbas av hudlesioner på grund av den farmakologiska effekten av Xiapex och fingerextensionsproceduren på huden som täcker den behandlade strängen. Användning på patienter med koagulationsstörningar Xiapex måste användas med försiktighet på patienter som har koagulationsstörningar eller tar antikoagulantia. I de tre dubbelblinda, placebokontrollerade fas 3-studierna rapporterade 73 % av patienterna behandlade med Xiapex en ekkymos eller en kontusion och 38 % rapporterade en blödning vid. Effekt och säkerhet för Xiapex hos patienter som får antikoagulantia annat än upp till 150 mg acetylsalicylsyra per dag före administrering av Xiapex är inte kända. Användning av Xiapex hos patienter som har fått antikoagulantia (undantaget upp till 150 mg acetylsalicylsyra dagligen) inom 7 dagar före injektion av Xiapex rekommenderas inte. Immunogenicitet Liksom med alla icke-humana proteinläkemedel, kan patienter utveckla antikroppar mot det terapeutiska proteinet. Blodprover från patienter med Dupuytrens kontraktur analyserades i kliniska studier vid flera tidpunkter med avseende på antikroppar mot proteinkomponenterna i läkemedlet (AUX-I och AUX-II). Vid 30 dagar efter den första injektionen detekterades cirkulerande antikroppar mot AUX-I hos 92 % av patienterna och mot AUX-II hos 86 % av patienterna. Efter en tredje eller fjärde injektion hade alla försökspersoner utvecklat positiva antikroppar mot både AUX-I och AUX- II. Ingen uppenbar korrelation mellan antikroppsutveckling och klinisk respons eller oönskade 4
4 reaktioner observerades. Eftersom enzymerna i Xiapex har viss sekvenshomologi med humana matrixmetalloproteinaser (MMP:er) finns det en teoretisk möjlighet att antikroppar mot läkemedlet interfererar med humana MMP:er. Inga säkerhetsproblem som är relaterade till hämning av endogena MMP:er har observerats, i synnerhet inga oönskade händelser som tyder på utveckling eller försämring av autoimmuna sjukdomar eller utveckling av muskuloskeletalt syndrom (MSS). Även om det saknas klinisk evidens i nuvarande säkerhetsdata vad gäller utveckling av ett MSS efter administrering av Xiapex, kan risken inte uteslutas att ett sådant kan uppkomma. Om detta syndrom utvecklas skulle det uppstå progressivt och kännetecknas av följande tecken och symtom: artralgi, myalgi, ledstelhet, stela axlar, handödem, palmar fibros samt förtjockningar eller knutor i senorna. Långsiktig säkerhet Den långsiktiga säkerheten för Xiapex är inte fullständigt kartlagd. Inverkan av behandlingen med Xiapex på eventuella efterföljande kirurgiska ingrepp är inte känd. Hjälpämnen Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos och är således huvudsakligen natriumfritt. 4.5 Interaktioner med andra läkemedel och övriga interaktioner På grund av avsaknad av mätbar systemisk exponering har inga formella interaktionsstudier med Xiapex utförts. Även om det inte finns någon klinisk evidens på interaktion mellan tetracyklin-, antracyklin- /antrakinolonantibiotika eller antrakinonderivat och Xiapex, har sådana derivat visats hämma MMPmedierad nedbrytning av kollagen vid farmakologiskt relevanta koncentrationer in vitro. Därför rekommenderas inte användning av Xiapex för patienter som har fått tetracyklinantibiotika (t.ex. doxycyklin) inom 14 dagar före en injektion med Xiapex. 4.6 Fertilitet, graviditet och amning Graviditet och fertilitet Inga kliniska data på exponerade graviditeter finns tillgängliga för Xiapex. Djurstudier har inte pekat på direkta eller indirekta skadliga effekter vad gäller fertilitet, graviditet eller embryonal/fetal utveckling (se avsnitt 5.3). Studier av förlossningsarbete och postnatal utveckling på djur har inte utförts eftersom humana farmakokinetiska studier visar att nivåerna av Xiapex inte är mätbara i den systemiska cirkulationen efter en injektion i en Dupuytrensträng (se avsnitt 5.1). Patienter utvecklade antikroppar mot läkemedlet efter upprepad administrering och korsreaktiviteten mellan dessa och endogena MMP:er som är involverade i graviditet och under förlossningen kan inte uteslutas. Den potentiella risken för människa vid förlossning och postnatal utveckling är okänd. Därför rekommenderas inte användning av Xiapex vid graviditet och behandlingen bör skjutas upp till efter graviditeten. Amning Ingen effekt på det ammade spädbarnet förväntas eftersom den systemiska exponeringen av Xiapex hos den ammande kvinnan är försumbar. Xiapex kan användas under amning. 4.7 Effekter på förmågan att framföra fordon och använda maskiner Xiapex kan ha betydande inverkan på förmågan att framföra fordon och använda maskiner på grund av svullnaden och smärtan som kan försämra användandet av den behandlade handen. Även yrsel, parestesi, hypoestesi och huvudvärk, som också har rapporterats efter en injektion av Xiapex kan i mindre grad påverka förmågan att framföra fordon och använda maskiner. Patienten måste instrueras att undvika potentiellt farliga arbetsuppgifter så som att framföra fordon och använda maskiner tills dessa kan utföras på ett säkert sätt eller efter klartecken från läkaren. 5
5 4.8 Biverkningar Xiapex 0,58 mg studerades hos patienter med Dupuytrens kontraktur i tre randomiserade, dubbelblinda och placebokontrollerade studier. Populationen i den dubbelblinda studien bestod av 409 patienter varav 272 fick Xiapex 0,58 mg och 137 fick placebo. Medelåldern var 63 år (åldersintervall år) och 80 % av patienterna var män. De vanligast rapporterade oönskade reaktionerna under de kliniska studierna av Xiapex var lokala reaktioner vid, t.ex. perifert ödem (lokalt vid ), kontusion (inklusive ekkymos), blödning vid och smärta vid. Reaktioner vid var mycket vanligt och förekom hos de allra flesta av patienterna. De flesta reaktioner var lindriga till medelsvåra och hade i allmänhet avtagit inom 1 2 veckor efter injektionen. Allvarliga oönskade reaktioner relaterade till läkemedlet som rapporterades var senruptur (3 fall), tendonit (1 fall), annan ligamentskada (1 fall) och komplexa regionala smärtsyndrom (CRPS) (1 fall). I tabell 2 redovisas oönskade reaktioner sorterade efter systemorganklass och frekvens enligt följande indelning: mycket vanliga ( 1/10), vanliga ( 1/100 till <1/10) och mindre vanliga ( 1/1 000 till <1/100). Inom varje frekvensgrupp redovisas oönskade reaktioner efter fallande allvarlighetsgrad. De oönskade reaktioner som rapporterades från det kliniska programmet uppträdde under de dubbelblinda, placebokontrollerade fas 3-studierna. Tabell 2: Lista över oönskade reaktioner Systemorganklass Mycket vanliga Vanliga Mindre vanliga Infektioner och celluliter vid infestationer Blodet och lymfsystemet lymfadenopati smärtande lymfknutor trombocytopeni Immunsystemet överkänslighet Psykiska störningar Centrala och perifera nervsystemet Ögon parestesi hypoestesi brännande känsla yrsel huvudvärk desorientering agitation insomnia irritabilitet rastlöshet komplexa regionala smärtsyndrom (CRPS) monoplegi vasovagal synkope tremor ögonlocksödem Blodkärl Andningsvägar, bröstkorg och mediastinum hematom hypotoni dyspné hyperventilering Magtarmkanalen illamående diarré kräkningar smärta i den övre delen av buken 6
6 Hud och subkutan vävnad Muskuloskeletala systemet och bindväv Reproduktionsorgan och bröstkörtel Allmänna symtom och/eller symtom vid administreringsstället Undersökningar pruritus ekkymos smärta i extremiteterna perifert ödem* blödning vid smärta vid svullnad vid ömhet blodfyllda blåsor blåsor utslag erytem hyperhidros artralgi ledsvullnad myalgi smärta i armhålan inflammation inflammation vid svullnad erytem vid pruritus vid värmekänsla vid blåsor vid erytematöst utslag makulautslag eksem ansiktssvullnad hudsmärta hudavflagning hudlesion hudproblem sårskorpa missfärgad hud åtstramad hud axillär knöl smärta i bröstväggen ljumsksmärta ledkrepitation ledstelhet obehag i lemmarna muskelspasmer muskelsvaghet muskuloskeletalt obehag muskuloskeletal stelhet nacksmärta axelsmärta ömhet i brösten förstorade bröst lokal svullnad pyrexi smärta obehag trötthet värmekänsla influensaliknade sjukdom förlust av känsel vid fjällning vid missfärgning vid irritation vid knuta vid reaktion vid olustkänsla palpabel lymfknuta ökad nivå av alaninaminotransferas ökad nivå av aspartataminotransferas förhöjd kroppstemperatur Skador, förgiftningar och behandlingskomplikationer kontusion hudlaceration senruptur ligamentskada arm- eller benskada öppet sår upprivet sår/sårruptur * med perifert ödem menas bl.a. ödem vid och ödem. 7
7 4.9 Överdosering Administrering av Xiapex i doser som överskrider de rekommenderade förväntas åtföljas av en ökad förekomst av lokala reaktioner vid. I fall av överdos ska rutinmässig stödjande vård och symtomatisk behandling ges. 5. FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: Övriga medel för sjukdomar i rörelseapparaten Enzymer, ATC-kod: M09AB02 Xiapex är en frystorkad produkt för parenteral administrering som innehåller kollagenas från clostridium histolyticum bestående av två kollagenaser i en definierad masskvot. Dessa kollagenaser, här kallade AUX-I och AUX-II, är representativa för de två viktigaste kollagenasklasserna (Klass I och Klass II) som produceras av Clostridium histolyticum. AUX-I och AUX-II är enkla polypeptidkedjor bestående av omkring aminosyror i en känd sekvens med en molekylvikt på 114 kda respektive 113 kda enligt bestämning med masspektrometri. De båda polypeptiderna renas genom kromatografiska steg för separation och isolering av bioterapeutiska proteiner i syfte att skapa en konsekvent, väl karakteriserad och kontrollerad blandning av två kollagenaser. Eftersom kollagenlyseringen efter administrering av Xiapex är lokal och inte kräver eller leder till mätbara systemiska nivåer av AUX-I och AUX-II, kan den primära farmakodynamiska aktiviteten hos försökspersoner som får Xiapex inte utvärderas, varför dessa typer av studier inte har genomförts. Verkningsmekanism Kollagenaser är proteinaser som hydrolyserar kollagen under fysiologiska betingelser. Injektion av Xiapex i en Dupuytrensträng, som till största delen består av de interstitiella kollagentyperna I och III, orsakar en enzymatisk rupturering av strängen. Xiapex består av en blandning av clostridiekollagenaser av klass I (AUX-I) och klass II (AUX-II) i en definierad masskvot. De två klasserna av kollagenaser har en likartad men kompletterande substratspecificitet. Båda kollagenaserna ger en effektiv klyvning av interstitiellt kollagen, men på olika delar av molekylen. Dessutom föredrar de olika strukturer (trippelhelix kontra denaturerad eller klyvd). Tack vare dessa skillnader kan de båda klasserna av enzymerna bryta ner kollagen på ett komplementärt sätt. Klass I- kollagenaserna (α, β, γ och η) är produkter av colg-genen. De initierar kollagenhydrolys nära aminooch karboxiänden av trippelhelixdomänerna och genererar stora, proteolytiska fragment. Klass IIkollagenaserna (δ, ε och ζ) däremot är produkter av colh-genen. Deras initiala klyvningsställen finns inne i kollagenmolekylen och de genererar mindre kollagenfragment. Båda klasserna av kollagenaser kan med lätthet hydrolysera gelatin (denaturerat kollagen) och mindre kollagenpeptider, men klass II har högre affinitet för mindre kollagenfragment. Klass I-kollagenasen klyver olösligt trippelhelixkollagen med högre affinitet än klass II-kollagenasen. Tillsammans har dessa kollagenaser en bred hydrolytisk aktivitet mot kollagen. Kliniska resultat Effekten av Xiapex 0,58 mg utvärderades i två pivotala, randomiserade, dubbelblinda, placebokontrollerade studier CORD I (AUX-CC-857) och CORD II (AUX-CC-859) på vuxna patienter med Dupuytrens kontraktur. Vid studiestarten hade patienterna i de kliniska studierna: (1) en kontraktur i fingret med en palpabel sträng på minst ett finger (annat än tummen) mellan i en MCP-led eller i en PIP-led och (2) ett positivt table top test, dvs. oförmåga att samtidigt placera det påverkade fingret/de påverkade fingrarna och handflatan plant på en bordsskiva. Strängen som påverkade en utvald, primär led fick upp till 3 injektioner med 0,58 mg Xiapex eller placebo. En fingerextensionsprocedur utfördes vid behov omkring 24 timmar efter injektionen för att bidra till att strängen rupturerade. Injektionerna gavs med omkring 4 veckors mellanrum. 8
8 Det primära effektmåttet för varje studie bestod i att utvärdera andelen patienter som fick en reduktion av kontrakturen vid den utvalda primära leden (MCP eller PIP) till 5 eller mindre, omkring 4 veckor efter den sista injektionen av denna led. Andra effektmått var 50 % reduktion av graden av kontraktur, procentuell förändring av graden av kontraktur och förändring i rörelseomfång jämfört med baseline, samt försökspersonens allmänna bedömning av sin nöjdhet med behandlingen och läkarens allmänna bedömning av svårighetsgraden. Xiapex uppvisade en kliniskt signifikant fördel jämfört med placebo i den andel av patienterna som uppnådde det primära effektmåttet med reduktion av kontrakturen i alla behandlade leder till 5 eller mindre vid omkring 4 veckor efter den senaste injektionen (MCP plus PIP, enbart MCP, enbart PIP). För patienter som uppnådde en reduktion av kontrakturen i den utvalda leden på 5 eller mindre, krävdes i genomsnitt 1,5 injektioner för att åstadkomma detta i båda studierna. Xiapex uppvisade också en kliniskt signifikant fördel jämfört med placebo i fråga om att minska graden av kontraktur och ökade dels rörelseomfånget jämfört med baseline för alla behandlade leder (MCP plus PIP, enbart MCP, enbart PIP) och dels försökspersonens allmänna grad av nöjdhet med behandlingen. I tabell 3 redovisas de demografiska och initiala (baseline) egenskaperna för studiepopulationen. I tabell 4 5 redovisas resultaten för de viktigaste uppmätta effektmåtten i de två dubbelblinda, placebokontrollerade studierna CORD I (AUX-CC-857) och CORD II (AUX-CC-859). Tabell 3 Demografiska egenskaper och baseline-värden Dubbelblinda, placebokontrollerade fas 3-studier (CORD I, CORD II) Ålder (år) VARIABEL Xiapex (N=249) Placebo (N=125) Medel 62,7 64,2 Ålderskategori (år), n (%) Kön, n (%) < 45 9 (3,6) 5 (4,0) (13,2) 17 (13,6) (41,4) 44 (35,2) (33,0) 40 (32,0) (8,8) 19 (15,2) Man 210 (84,3) 91 (72,8) Kvinna 39 (15,7) 34 (27,2) Familjehistorik med Dupuytrens sjukdom, n (%) Ja 107 (43,0) 62 (49,6) Nej 142 (57,0) 63 (50,4) 9
9 Läkarens bedömning av svårighetsgraden vid baseline Lindrig 38 (15,4 %) 21 (16,8 %) Medelsvår 148 (59,9 %) 71 (56,8 %) Svår 61 (24,7 %) 33 (26,4 %) Saknas 1 2 (0,8 %) - OBS: innefattar alla patienter som har fått minst 1 injektion av det dubbelblinda studieläkemedlet (Xiapex 0,58 mg eller placebo). 1 Används inte för att beräkna läkarens bedömning av svårighetsgrad vid baseline den faktiska nämnaren N=247 användes. Tabell 4 Andel patienter som upplevt en reduktion av kontrakturen till 5 eller mindre (sista injektionen) BEHANDLADE CORD I CORD II PRIMÄRA LEDER Xiapex Placebo Xiapex Placebo N=203 c N=103 c N=45 N=21 Alla leder p-värde 64,0 % <0,001 6,8 % - 44,4 % <0,001 4,8 % - MCP-leder a N=133 N=69 N=20 N=11 p-värde PIP-leder b 76,7 % 7,2 % 65,0 % 9,1 % <0,001-0,003 - N=70 N=34 N=25 N=10 40,0 % 5,9 % 28,0 % 0,0 % p-värde <0,001-0,069 - a Metakarpofalangealleder b Proximala interfalangealleder c Två primära leder uteslöts från effektanalysen (en led i placebogruppen utvärderades inte, och en led i Xiapex-gruppen hade en initial kontraktur på 0 grader före behandlingen). Tabell 5 Genomsnittlig ökning av rörelseomfånget jämfört med baseline (sista injektionen) BEHANDLADE CORD I CORD II PRIMÄRA LEDER Xiapex Placebo Xiapex Placebo Alla leder N=203 c N=103 c N=45 N=21 Genomsnitt vid baseline (SD) Slutligt genomsnitt (SD) Genomsnittlig ökning (SD) 43,9 (20,1) 80,7 (19,0) 36,7 (21,0) 45,3 (18,7) 49,5 (22,1) 4,0 (14,8) 40,3 (15,2) 75,8 (17,7) 35,4 (17,8) 44,0 (16,5) 51,7 (19,6) 7,6 (14,9) 10
10 BEHANDLADE CORD I CORD II PRIMÄRA LEDER Xiapex Placebo Xiapex Placebo MCP-leder a N=133 N=69 N=20 N=11 Genomsnitt vid baseline (SD) Slutligt genomsnitt (SD) Genomsnittlig ökning (SD) 42,6 (20,0) 83,7 (15,7) 40,6 (20,0) 45,7 (19,2) 49,7 (21,1) 3,7 (12,6) 39,5 (11,8) 79,5 (11,1) 40,0 (13,5) 41,4 (20,8) 50,0 (21,5) 8,6 (14,7) PIP-leder b N=70 N=34 N=25 N=10 Genomsnitt vid baseline (SD) Slutligt genomsnitt (SD) Genomsnittlig ökning (SD) 46,4 (20,4) 74,9 (23,1) 29,0 (20,9) 44,4 (17,9) 49,1 (24,4) 4,7 (18,5) 41,0 (17,7) 72,8 (21,3) 31,8 (20,1) 47,0 (10,3) 53,5 (18,3) 6,5 (15,8) a Metakarpofalangealleder b Proximala interfalangealleder c Två primära leder uteslöts från effektanalysen (en led i placebogruppen utvärderades inte, och en led i Xiapex-gruppen hade en initial kontraktur på 0 grader före behandlingen) Alla p-värden var < 0,001 för alla jämförelser mellan Xiapex och placebo, förutom för PIP-leder i studien CORD II som inte var kvalificerade för statistisk analys på grund av en hierarkisk testprocedur. Den läkarbedömda förändringen i kontrakturens svårighetsgrad rapporterades som kraftigt förbättrad eller mycket förbättrad hos 86 % och 80 % av försökspersonerna i Xiapex-gruppen jämfört med 3 % och 5 % av försökspersonerna i placebogruppen i CORD I- respektive CORD II-studien (p<0,001). Baserat på en patientskattning av total nöjdhet med behandlingen rapporterade mer än 85 % av försökspersonerna i CORD I- och CORD II-studierna att de var antingen ganska nöjda eller mycket nöjda med sin behandling med Xiapex jämfört med omkring 30 % av de som behandlades med (p<0,001). Högre grad av patientnöjdhet kunde korreleras till förbättrat rörelseomfång (r=0,51, p<0,001). Eventuellt recidiv av kontraktur utvärderades i leder som uppnådde det primära effektmåttet, dvs. en reduktion av kontrakturen till 5 eller mindre. Recidiv definierades som en ökning av ledkontrakturen till minst 20 i närvaro av en palpabel sträng vid någon tidpunkt under den dubbelblinda fasen eller den öppna behandlingsfasen och som kvarstod vid den senast tillgängliga mätningen. I en poolad analys över de pivotala, dubbelblinda, placebokontrollerade och öppna fas 3-studierna fanns totalt 838 framgångsrikt behandlade leder. Av dessa hade 28 leder (7 MCP- och 21 PIP-leder) en återkommande kontraktur, vilket gav en recidivfrekvens på 3,3 % vid 12 månader efter att försökspersonerna hade uppnått klinisk framgång med Xiapex-behandlingen. Pediatrisk population Europeiska läkemedelsmyndigheten har avstått från kravet att skicka in studieresultat för Xiapex för alla grupper av den pediatriska populationen för behandling of Dupuytrens kontraktur (se avsnitt 4.2 för information om pediatrisk användning). 5.2 Farmakokinetiska egenskaper Absorption och distribution Efter administrering av en enstaka dos på 0,58 mg av Xiapex till 16 patienter med Dupuytrens kontraktur detekterades inga mätbara nivåer av Xiapex i plasma från 5 minuter upp till 30 dagar efter injektionen. Inga evidens har hittills framkommit om systemisk toxicitet i de kliniska studier som genomförts på Xiapex vid administrering genom lokal injektion i en Dupuytrens sträng. 11
11 Biotransformering och eliminering Inga metabolismstudier har utförts då Xiapex varken är substrat för cytokrom P450 eller något annat enzym som metaboliserar läkemedel och eftersom inga aktiva metaboliter förväntas. Inga formella studier av eliminering har utförts då det inte förekommer någon mätbar systemisk exponering efter en enstaka injektion med Xiapex. Särskilda grupper av försökspersoner Pediatrisk population Xiapex har inte studerats på barn i åldern 0 18 år och därför är heller inga farmakokinetiska data tillgängliga för denna population. På grund av avsaknad av mätbar systemisk exponering av Xiapex är dosjustering inte nödvändig för särskilda grupper av försökspersoner, t.ex. äldre personer, personer med nedsatt njur- eller leverfunktion, personer av ett visst kön eller av en viss etnisk härkomst. 5.3 Prekliniska säkerhetsuppgifter Karcinogenes, mutagenes, nedsatt fertilitet Standardmässiga, tvååriga bioanalyser på råtta har inte utförts med Xiapex. Därför är den karcinogena risken inte känd. Kollagenas från clostridium histolyticum hade ingen mutagen effekt på Salmonella typhimurium (AMES-test) eller klastogen effekt på varken en mikronukleär in vivo-assay på mus eller en kromosomal aberrationsassay in vitro på humana lymfocyter. När Xiapex gavs intravenöst varannan dag till han- och honråttor före kohabitation och under parning och implantation noterades inga effekter på brunstcykel, tubartransport, utveckling under och före implantation och/eller på libido eller epididymal spermiemognad vid intravenösa doser upp till 0,13 mg/dos (omkring 11 gånger den humana dosen baserat på mg/m 2 ). Inga oönskade reaktioner på tidig embryonal utveckling förekom hos råttorna (det vill säga inga evidens för teratogen effekt). Ingen systemisk toxicitet observerades i denna studie vid denna dosnivå. 6. FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen Pulver Sackaros Trometamol Saltsyra 2,4 % w/w (för justering av ph) Spädningsvätska Kalciumkloriddihydrat Natriumklorid Vatten för injektionsvätskor 6.2 Inkompatibiliteter I brist på kompatibilitetsstudier ska detta läkemedel inte blandas med andra läkemedel eller vätskor för rekonstituering. 12
12 6.3 Hållbarhet 2 år. Produkten bör användas omedelbart efter rekonstituering. Rekonstituerad Xiapex kan förvaras vid rumstemperatur (20 25 ºC) i upp till 1 timme eller i kyl 2 8 C i upp till 4 timmar före administrering. Om den rekonstituerade lösningen är kyld måste den ges tid att återta rumstemperatur (20 25 ºC) i omkring 15 minuter före användning. 6.4 Särskilda förvaringsanvisningar Förvars i kylskåp (2 8 ºC). Får inte frysas. Villkor för förvaring av det rekonstituerade läkemedlet beskrivs i avsnitt Förpackningstyp och innehåll Xiapex-pulvret tillhandahålls i en klar injektionsflaska av glas (3 ml, typ I-glas) med gummipropp, aluminiumförsegling och snäpplock (polypropen). Spädningsvätska: 3 ml spädningsvätska tillhandahålls i en klar injektionsflaska av glas (5 ml, typ I- glas) med gummipropp, aluminiumförsegling och snäpplock (polypropen). Förpackningen innehåller 1 injektionsflaska med pulver och 1 injektionsflaska med spädningsvätska. 6.6 Särskilda anvisningar för destruktion och annan hantering Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar. Ingående information om injektions- och fingerextensionsproceduren finns i bipacksedeln. Anvisningar om användning och hantering Beredning rekonstituering Injektionsflaskorna med Xiapex och med spädningsvätska för rekonstituering av lösning för injektion måste förvaras kallt. Före användning ska injektionsflaskan med Xiapex och injektionsflaskan med spädningsvätska för rekonstituering tas fram från kylskåpet och stå framme i rumstemperatur i minst 15 minuter men inte längre än 60 minuter. Rekonstitueringen ska ske med aseptisk teknik och enligt följande procedur: 1. Bekräfta vilken typ av led som ska behandlas (MCP eller PIP) eftersom volymen spädningsvätska som krävs för rekonstitueringen är beroende av ledtyp (PIP-leder kräver mindre injektionsvolym). 2. Ta av snäpplocken från båda injektionsflaskorna och torka av gummiproppen och de omgivande ytorna på injektionsflaskan med Xiapex och injektionsflaskan med spädningsvätska för rekonstituering med steril alkohol (inga andra antiseptika får användas). 13
13 3. Använd enbart den medföljande spädningsvätskan för rekonstituering eftersom den innehåller kalcium som krävs för aktiviteten hos Xiapex. Använd en steril spruta kalibrerad med 0,01 ml graderingar och dra upp lämplig volym av spädningsvätska för att kunna injicera följande volymer: 0,39 ml för strängar som påverkar en MCP-led 0,31 ml för strängar som påverkar en PIP-led. 4 Injicera spädningsvätskan långsamt längs sidorna på injektionsflaskan med det frystorkade Xiapex-pulvret. Vänd inte på injektionsflaskan eller skaka lösningen. Rotera lösningen långsamt för att säkerställa att allt frystorkat pulver har lösts upp. Ta bort och kassera sprutan och kanylen som användes för rekonstitueringen. 5. Inspektera lösningen visuellt för att kunna upptäcka eventuella partiklar och missfärgningar före administrering. Den rekonstituerade lösningen av Xiapex måste vara klar. Om lösningen innehåller partiklar, är grumlig eller missfärgad ska den inte användas för injektion. 7. INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Pfizer Limited Ramsgate Road Sandwich, Kent CT13 9NJ Storbritannien 8. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 9. DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE 10. DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN Information om detta läkemedel finns tillgänglig på Europeiska läkemedelsmyndighetens hemsida: 14
En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Comfora 595 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En filmdragerad tablett innehåller glukosaminsulfat-kaliumklorid motsvarande 595 mg glukosamin.
Behandling av akut interdigital nekrobacillos hos nötkreatur, s.k. Panaritium eller klövspaltsinflammation.
 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN NAXCEL 200 mg/ml injektionsvätska, suspension för nötkreatur 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv substans: Ceftiofur (som kristallinsk
1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN NAXCEL 200 mg/ml injektionsvätska, suspension för nötkreatur 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller: Aktiv substans: Ceftiofur (som kristallinsk
Om din behandling med Xiapex
 PATIENTINFORMATION PATIENTINFORMATION Om din behandling med Xiapex Dupuytrens kontraktur Dupuytrens kontraktur är en bindvävssjukdom som ibland även kallas vikingasjukan eftersom den är vanligare i Skandi
PATIENTINFORMATION PATIENTINFORMATION Om din behandling med Xiapex Dupuytrens kontraktur Dupuytrens kontraktur är en bindvävssjukdom som ibland även kallas vikingasjukan eftersom den är vanligare i Skandi
BILAGA 1 PRODUKTRESUMÉ
 BILAGA 1 PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Menveo Pulver och lösning till injektionsvätska, lösning Vaccin mot grupp A-, C-, W135- och Y-meningokockinfektion, konjugerat 2. KVALITATIV OCH KVANTITATIV
BILAGA 1 PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Menveo Pulver och lösning till injektionsvätska, lösning Vaccin mot grupp A-, C-, W135- och Y-meningokockinfektion, konjugerat 2. KVALITATIV OCH KVANTITATIV
4.1 Terapeutiska indikationer Typherix används för aktiv immunisering mot tyfoidfeber av vuxna och barn från 2 års ålder.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Typherix, injektionsvätska, lösning, förfylld spruta Polysackaridvaccin mot tyfoidfeber. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dos om 0,5 ml vaccin innehåller:
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Finacea 15 % gel. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Finacea 15 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra. Hjälpämnen med känd effekt: 1 mg bensoesyra/g gel 0,12 g propylenglykol/g
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Finacea 15 % gel 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g Finacea gel innehåller 150 mg azelainsyra. Hjälpämnen med känd effekt: 1 mg bensoesyra/g gel 0,12 g propylenglykol/g
Bilaga III Tillägg till relevanta avsnitt i Produktresumén och Bipacksedeln
 Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
Kommittén fann också att trimetazidin kan orsaka eller förvärra parkinsonsymtom (tremor, akinesi, hypertoni). Uppträdandet av motoriska störningar såsom parkinsonsymtom, restless leg-syndrom, tremor och
Om din behandling med Xiapex
 p a t i e n t i n f o r m a t i o n P a t i e n t i n f o r m a t i o n Om din behandling med Xiapex Dupuytrens kontraktur Dupuytrens kontraktur är en bindvävssjukdom som ibland även kallas vikingasjukan
p a t i e n t i n f o r m a t i o n P a t i e n t i n f o r m a t i o n Om din behandling med Xiapex Dupuytrens kontraktur Dupuytrens kontraktur är en bindvävssjukdom som ibland även kallas vikingasjukan
Denna information är avsedd för vårdpersonal.
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Loratadin Sandoz 10 mg munsönderfallande tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En munsönderfallande tablett innehåller 10
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Loratadin Sandoz 10 mg munsönderfallande tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En munsönderfallande tablett innehåller 10
4.1 Terapeutiska indikationer Lindrig och medelsvår ulcerös kolit. Proktit och proktosigmoidit.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pentasa 1 g rektalsuspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 ml innehåller 1 g mesalazin (5-aminosalicylsyra). Beträffande hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pentasa 1 g rektalsuspension 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 100 ml innehåller 1 g mesalazin (5-aminosalicylsyra). Beträffande hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM
Bilaga III. Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel
 Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
Bilaga III Ändringar i relevanta avsnitt av produktresumé, märkning och bipacksedel 20 PRODUKTRESUMÉ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Porcilis PCV M Hyo, injektionsvätska, emulsion för svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (2 ml) innehåller: Aktiva
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Porcilis PCV M Hyo, injektionsvätska, emulsion för svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (2 ml) innehåller: Aktiva
A/California/7/2009 (H1N1)-härstammande stam använd NYMC X-179A... 9 mikrogram HA**
 1. LÄKEMEDLETS NAMN INTANZA 9 mikrogram/stam, injektionsvätska, suspension Vaccin mot Influensa (spjälkat virus, inaktiverat) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Influensavirus, inaktiverat, spjälkat,
1. LÄKEMEDLETS NAMN INTANZA 9 mikrogram/stam, injektionsvätska, suspension Vaccin mot Influensa (spjälkat virus, inaktiverat) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Influensavirus, inaktiverat, spjälkat,
PRODUKTRESUMÉ. Koncentrationen av elekrolytjoner blir följande när båda dospåsarna lösts upp i 1 liter vatten:
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Movprep pulver till oral lösning, dospåsar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Innehållsämnena i Movprep tillhandahålls i två separata dospåsar. Dospåse A innehåller
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Movprep pulver till oral lösning, dospåsar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Innehållsämnena i Movprep tillhandahålls i två separata dospåsar. Dospåse A innehåller
PRODUKTRESUMÉ. Behandling av bakterieinfektioner orsakade av bakteriestammar som är känsliga för enrofloxacin.
 PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Fenoflox vet 100 mg/ml injektionsvätska, lösning för nöt och svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans:
PRODUKTRESUMÉ 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Fenoflox vet 100 mg/ml injektionsvätska, lösning för nöt och svin 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans:
PRODUKTRESUMÉ. Albumin Biotest 200 g/l är en lösning innehållande 200 g/l (20%) totalt protein av vilket minst 95% är humant albumin.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Albumin Biotest 200 g/l infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Humant albumin Albumin Biotest 200 g/l är en lösning innehållande 200 g/l
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Albumin Biotest 200 g/l infusionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Humant albumin Albumin Biotest 200 g/l är en lösning innehållande 200 g/l
Denna information är avsedd för vårdpersonal. Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare
 Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En endosbehållare (0,3 ml) innehåller
Denna information är avsedd för vårdpersonal. 1 LÄKEMEDLETS NAMN Voltaren Ophtha 1 mg/ml ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En endosbehållare (0,3 ml) innehåller
PRODUKTRESUMÉ. Donaxyl 10 mg vaginaltabletter är avsedda för behandling av bakteriell vaginos (se avsnitt 4.4).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Donaxyl 10 mg vaginaltabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje vaginaltablett innehåller 10 mg dekvaliniumklorid. För fullständig förteckning över hjälpämnen,
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Donaxyl 10 mg vaginaltabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje vaginaltablett innehåller 10 mg dekvaliniumklorid. För fullständig förteckning över hjälpämnen,
Hjälpämne: Natrium (som klorid och hydroxid); 0,8 1,6 mg/ml (35 70 mmol/l)
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vivaglobin, 160 mg/ml injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: humant normalt immunglobulin 160 mg* * motsvarar totalt proteininnehåll
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vivaglobin, 160 mg/ml injektionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: humant normalt immunglobulin 160 mg* * motsvarar totalt proteininnehåll
PRODUKTRESUMÉ. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 dos (=0,5 ml) innehåller: Aluminiumhydroxidhydrat motsvarande aluminium
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ditebooster injektionsvätska, suspension i förfylld spruta. Difteri och tetanusvaccin (adsorberad, reducerat innehåll av antigen). 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN ditebooster injektionsvätska, suspension i förfylld spruta. Difteri och tetanusvaccin (adsorberad, reducerat innehåll av antigen). 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (0,05 ml) innehåller budesonid 32 mikrogram respektive 64 mikrogram
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rhinocort Aqua 32 mikrogram/dos nässpray, suspension. Rhinocort Aqua 64 mikrogram/dos nässpray, suspension. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (0,05 ml)
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Rhinocort Aqua 32 mikrogram/dos nässpray, suspension. Rhinocort Aqua 64 mikrogram/dos nässpray, suspension. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En dos (0,05 ml)
Förpackningen är en flerdosbehållare. Se avsnitt 6.5 för antal doser per injektionsflaska.
 1. LÄKEMEDLETS NAMN Celvapan injektionsvätska, suspension Influensavaccin (H1N1)v (helvirus, verocellderiverat, inaktiverat) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Inaktiverat helvirusvaccin mot
1. LÄKEMEDLETS NAMN Celvapan injektionsvätska, suspension Influensavaccin (H1N1)v (helvirus, verocellderiverat, inaktiverat) 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Inaktiverat helvirusvaccin mot
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. TRISENOX 1 mg/ml, koncentrat till injektionsvätska, lösning Arseniktrioxid
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN TRISENOX 1 mg/ml, koncentrat till injektionsvätska, lösning Arseniktrioxid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. - Spara denna
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN TRISENOX 1 mg/ml, koncentrat till injektionsvätska, lösning Arseniktrioxid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. - Spara denna
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Recocam 20 mg/ml injektionsvätska, lösning, för nötkreatur, svin och häst 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller:
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Recocam 20 mg/ml injektionsvätska, lösning, för nötkreatur, svin och häst 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ml innehåller:
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Diabact UBT 50 mg tabletter.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Diabact UBT 50 mg tabletter. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 13 C-urea 50 mg, anrikad stabil isotop. För fullständig förteckning över
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Diabact UBT 50 mg tabletter. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller 13 C-urea 50 mg, anrikad stabil isotop. För fullständig förteckning över
BIPACKSEDEL INFORMATION TILL ANVÄNDAREN
 B. BIPACKSEDEL 39 BIPACKSEDEL INFORMATION TILL ANVÄNDAREN Focetria injektionsvätska, suspension Pandemiskt influensavaccin (H1N1) (ytantigen, inaktiverat, adjuvanterat) Läs noga igenom denna bipacksedel
B. BIPACKSEDEL 39 BIPACKSEDEL INFORMATION TILL ANVÄNDAREN Focetria injektionsvätska, suspension Pandemiskt influensavaccin (H1N1) (ytantigen, inaktiverat, adjuvanterat) Läs noga igenom denna bipacksedel
Sammanfattning av riskhanteringsplan (RMP) för Cerdelga (eliglustat)
 EMA/743948/2014 Sammanfattning av riskhanteringsplan (RMP) för Cerdelga (eliglustat) VI.2 Sektionerna av den offentliga sammanfattningen Detta är en sammanfattning av riskhanteringsplanen (RMP) för Cerdelga,
EMA/743948/2014 Sammanfattning av riskhanteringsplan (RMP) för Cerdelga (eliglustat) VI.2 Sektionerna av den offentliga sammanfattningen Detta är en sammanfattning av riskhanteringsplanen (RMP) för Cerdelga,
PRODUKTRESUMÉ. Poliovirus typ 1 (Brunhilde), typ 2 (MEF-1) och typ 3 (Saukett), förökat i Vero-celler, är renat och inaktiverat.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN VeroPol, injektionsvätska, lösning i förfylld spruta 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Per dos = 0,5 ml: Poliovirus typ 1, inaktiverat Poliovirus typ 2, inaktiverat
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN VeroPol, injektionsvätska, lösning i förfylld spruta 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Per dos = 0,5 ml: Poliovirus typ 1, inaktiverat Poliovirus typ 2, inaktiverat
Bipacksedel: Information till användaren
 Bipacksedel: Information till användaren Pregnyl 1 500 IE pulver och vätska till injektionsvätska, lösning Pregnyl 5 000 IE pulver och vätska till injektionsvätska, lösning humant koriongonadotropin Läs
Bipacksedel: Information till användaren Pregnyl 1 500 IE pulver och vätska till injektionsvätska, lösning Pregnyl 5 000 IE pulver och vätska till injektionsvätska, lösning humant koriongonadotropin Läs
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Myozyme 50 mg pulver till koncentrat till infusionsvätska, lösning alglukosidas alfa
 B. BIPACKSEDEL 24 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Myozyme 50 mg pulver till koncentrat till infusionsvätska, lösning alglukosidas alfa Läs noga igenom denna bipacksedel innan du börjar använda
B. BIPACKSEDEL 24 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Myozyme 50 mg pulver till koncentrat till infusionsvätska, lösning alglukosidas alfa Läs noga igenom denna bipacksedel innan du börjar använda
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Somavert 10 mg pulver och vätska till injektionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 10 mg pegvisomant.
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Somavert 10 mg pulver och vätska till injektionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska innehåller 10 mg pegvisomant.
PRODUKTRESUMÉ. 0009 mg i sugtabletter med honung-citronsmak. Triolif Mint sugtabletter är gröna, bikonvexa, cylinderformade och 19 mm i diameter
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Triolif Mint sugtabletter Triolif Apelsin sugtabletter Triolif Honung & Citron sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller: Lidokainhydroklorid
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Triolif Mint sugtabletter Triolif Apelsin sugtabletter Triolif Honung & Citron sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller: Lidokainhydroklorid
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1/19 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Eurican Herpes 205 pulver och vätska till injektionsvätska, emulsion 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans:
BILAGA I PRODUKTRESUMÉ 1/19 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Eurican Herpes 205 pulver och vätska till injektionsvätska, emulsion 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans:
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS AM imenrix pulver och vätska till injektionsvätska, lösning i förfylld spruta Vaccin mot grupp A-, C-, W135- och Y-meningokockinfektion, konjugerat 2. KVALITATIV
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS AM imenrix pulver och vätska till injektionsvätska, lösning i förfylld spruta Vaccin mot grupp A-, C-, W135- och Y-meningokockinfektion, konjugerat 2. KVALITATIV
4.3 Kontraindikationer Överkänslighet mot ketokonazol eller mot något hjälpämne som anges i avsnitt 6.1.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fungoral 20 mg/ml schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml schampo innehåller: Ketokonazol 20 mg. För fullständig förteckning över hjälpämnen, se avsnitt
Bipacksedel: Information till användaren Efedrin Stragen 3 mg/ml, injektionsvätska, lösning i förfylld spruta efedrinhydroklorid
 Bipacksedel: Information till användaren Efedrin Stragen 3 mg/ml, injektionsvätska, lösning i förfylld spruta efedrinhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel.
Bipacksedel: Information till användaren Efedrin Stragen 3 mg/ml, injektionsvätska, lösning i förfylld spruta efedrinhydroklorid Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel.
Xiapex (kollagenas, Clostridium histolyticum)
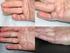 Xiapex (kollagenas, Clostridium histolyticum) Hälsoekonomiskt kunskapsunderlag Utvärderad indikation Xiapex är indicerat för behandling av Dupuytrens kontraktur hos vuxna patienter med palpabel sträng.
Xiapex (kollagenas, Clostridium histolyticum) Hälsoekonomiskt kunskapsunderlag Utvärderad indikation Xiapex är indicerat för behandling av Dupuytrens kontraktur hos vuxna patienter med palpabel sträng.
PRODUKTRESUMÉ. 600 mg brustablett innehåller 138,8 mg natrium, motsvarande 7% av WHOs högsta rekommenderat
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Acetylcystein Sandoz 200 mg brustabletter Acetylcystein Sandoz 600 mg brustabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En brustablett innehåller acetylcystein
PRODUKTRESUMÉ. Hjälpämne med känd effekt: sorbitol, flytande (icke-kristalliserande); 1 ml sirap innehåller 495,6 mg sorbitol (E 420).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Mucohelix, sirap 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml (1,18 g) Mucohelix innehåller 8,25 mg torrt extrakt av Hedera helix L. (murgröna), folium motsvarande
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Mucohelix, sirap 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml (1,18 g) Mucohelix innehåller 8,25 mg torrt extrakt av Hedera helix L. (murgröna), folium motsvarande
Delområden av en offentlig sammanfattning
 Pemetrexed STADA 25 mg/ml koncentrat till infusionsvätska, lösning 7.5.2015, Version V1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information
Pemetrexed STADA 25 mg/ml koncentrat till infusionsvätska, lösning 7.5.2015, Version V1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning VI.2.1 Information
0,5 mg: vita plana tabletter med brytskåra, diameter 7 mm. 1 mg: vita plana tabletter med brytskåra, diameter 7 mm, märkta phi beta 614.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fluscand 0,5 mg tabletter Fluscand 1 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller flunitrazepam 0,5 mg respektive 1 mg. Hjälpämne: Laktosmonohydrat
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Fluscand 0,5 mg tabletter Fluscand 1 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En tablett innehåller flunitrazepam 0,5 mg respektive 1 mg. Hjälpämne: Laktosmonohydrat
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Coxevac injektionsvätska, suspension för nötkreatur och get 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller Aktiv substans:
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Coxevac injektionsvätska, suspension för nötkreatur och get 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller Aktiv substans:
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller: Dextran 70 1,0 mg och hypromellos
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Tears Naturale 1 mg/ml + 3 mg/ml, ögondroppar, lösning, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml lösning innehåller: Dextran 70 1,0 mg och hypromellos
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Addaven innehåller: 1 ml 1 ampull (10 ml) Ferrikloridhexahydrat 0,54 mg 5,40
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Addaven koncentrat till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Addaven innehåller: 1 ml 1 ampull (10 ml) Ferrikloridhexahydrat 0,54 mg 5,40
Längre behandlingstid än 6 månader rekommenderas ej. Vissa före detta rökare kan dock behöva behandling längre för att inte återgå till rökning.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Nicorette 5 mg/16 timmar depotplåster Nicorette 10 mg/16 timmar depotplåster Nicorette 15 mg/16 timmar depotplåster Nicorette 5 mg/16 timmar + 10 mg/16 timmar + 15 mg/16
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Nicorette 5 mg/16 timmar depotplåster Nicorette 10 mg/16 timmar depotplåster Nicorette 15 mg/16 timmar depotplåster Nicorette 5 mg/16 timmar + 10 mg/16 timmar + 15 mg/16
PRODUKTRESUMÉ. Barn: Glukosamin Pharma Nord skall inte ges till barn och ungdomar under 18 år.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN INCURIN 1 mg tablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans: Östriol 1 mg/tablett För fullständig förteckning över
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN INCURIN 1 mg tablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Aktiv substans: Östriol 1 mg/tablett För fullständig förteckning över
OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING 2014-06-03 08.00-10.00
 Malmö högskola Hälsa och samhälle Utbildningsområde: Omvårdnad Kod nr: Tidpunkt för inlämning: OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING KURS OM121A, termin 2 2014-06-03 08.00-10.00 Hjälpmedel: Miniräknare, ej
Malmö högskola Hälsa och samhälle Utbildningsområde: Omvårdnad Kod nr: Tidpunkt för inlämning: OMTENTAMEN 2 I LÄKEMEDELSBERÄKNING KURS OM121A, termin 2 2014-06-03 08.00-10.00 Hjälpmedel: Miniräknare, ej
PRODUKTRESUMÉ. Vuxna och barn (från 12 år ): 2-4 tuggtabletter efter måltid och vid sänggående (högst fyra gånger per dygn).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Galieve Peppermint tuggtablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tuggtablett innehåller: Natriumalginat Natriumvätekarbonat Kalciumkarbonat 250 mg 133,5 mg
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Galieve Peppermint tuggtablett 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tuggtablett innehåller: Natriumalginat Natriumvätekarbonat Kalciumkarbonat 250 mg 133,5 mg
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN. Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna information, du kan behöva
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN Erbitux 2 mg/ml infusionsvätska, lösning Cetuximab Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Spara denna information, du kan behöva
1 LÄKEMEDLETS NAMN Atrovent, 0,25 mg/ml, lösning för nebulisator, endosbehållare Atrovent, 0,5 mg/ml, lösning för nebulisator, endosbehållare
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Atrovent, 0,25 mg/ml, lösning för nebulisator, endosbehållare Atrovent, 0,5 mg/ml, lösning för nebulisator, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Atrovent, 0,25 mg/ml, lösning för nebulisator, endosbehållare Atrovent, 0,5 mg/ml, lösning för nebulisator, endosbehållare 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1
Bipacksedel: Information till användaren
 Bipacksedel: Information till användaren Xylocain 5 mg/ml injektionsvätska, lösning Xylocain 10 mg/ml injektionsvätska, lösning Xylocain 20 mg/ml injektionsvätska, lösning Xylocain utan konserveringsmedel
Bipacksedel: Information till användaren Xylocain 5 mg/ml injektionsvätska, lösning Xylocain 10 mg/ml injektionsvätska, lösning Xylocain 20 mg/ml injektionsvätska, lösning Xylocain utan konserveringsmedel
Gul till brun viskös lösning med apelsinsmak. Partiklar från växtmaterial kan förekomma.
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml oral lösning innehåller 24,8 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
3 LÄKEMEDELSFORM Injektionsvätska, suspension, förfylld spruta Klar till något grumlig vätska med lite sediment som suspenderas vid omskakning.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Afluria injektionsvätska, suspension i förfylld spruta Vaccin mot influensa (spjälkat virus inaktiverat) 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Spjälkat influensavirus*
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Afluria injektionsvätska, suspension i förfylld spruta Vaccin mot influensa (spjälkat virus inaktiverat) 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Spjälkat influensavirus*
Bilaga III. Ändringar av relevanta avsnitt av produktresumén och bipacksedeln
 Bilaga III Ändringar av relevanta avsnitt av produktresumén och bipacksedeln Observera: De relevant avsnitten av produktresumé och bipacksedel är resultatet av referral-proceduren. Produktinformationen
Bilaga III Ändringar av relevanta avsnitt av produktresumén och bipacksedeln Observera: De relevant avsnitten av produktresumé och bipacksedel är resultatet av referral-proceduren. Produktinformationen
BILAGA 1 PRODUKTRESUMÉ
 BILAGA 1 PRODUKTRESUMÉ 1. VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN HESKA PERIOceutic Gel 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dosenhet innehåller: 2.1 Aktivt innehållsämne Doxycyklinhyklas, Ph.Eur.
BILAGA 1 PRODUKTRESUMÉ 1. VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN HESKA PERIOceutic Gel 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje dosenhet innehåller: 2.1 Aktivt innehållsämne Doxycyklinhyklas, Ph.Eur.
19.5.2015, Version 1.1 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 Oxycodone/Naloxone 5 mg/2,5 mg depottablett Oxycodone/Naloxone 10 mg/5 mg depottablett Oxycodone/Naloxone 20 mg/10 mg depottablett Oxycodone/Naloxone 40 mg/20 mg depottablett 19.5.2015, Version 1.1 OFFENTLIG
Oxycodone/Naloxone 5 mg/2,5 mg depottablett Oxycodone/Naloxone 10 mg/5 mg depottablett Oxycodone/Naloxone 20 mg/10 mg depottablett Oxycodone/Naloxone 40 mg/20 mg depottablett 19.5.2015, Version 1.1 OFFENTLIG
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
4.1 Terapeutiska indikationer Soluvit tillgodoser det dagliga behovet av vattenlösliga vitaminer vid intravenös nutrition.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Soluvit pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 flaska innehåller: Motsvarande: Tiaminnitrat 3,1 mg Tiamin (vitamin B 1 ) 2,5
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Soluvit pulver till infusionsvätska, lösning 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 flaska innehåller: Motsvarande: Tiaminnitrat 3,1 mg Tiamin (vitamin B 1 ) 2,5
Övergripande sammanfattning av den vetenskapliga utvärderingen av suppositorier som innehåller terpenderivat (se bilaga I)
 BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÅTERKALLANDE ELLER ÄNDRING AV RELEVANTA AVSNITT I PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL SOM TILLÄMPLIGT MED AVSEENDE PÅ ÅLDERSGRUPPEN FÖR DEN GODKÄNDA
BILAGA II EMA:S VETENSKAPLIGA SLUTSATSER OCH SKÄL TILL ÅTERKALLANDE ELLER ÄNDRING AV RELEVANTA AVSNITT I PRODUKTRESUMÉ, MÄRKNING OCH BIPACKSEDEL SOM TILLÄMPLIGT MED AVSEENDE PÅ ÅLDERSGRUPPEN FÖR DEN GODKÄNDA
Leflunomide STADA. Version, V1.0
 Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Leflunomide STADA Version, V1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Leflunomide STADA 10 mg filmdragerade tabletter Leflunomide STADA 20 mg filmdragerade
Hjälpämnen med känd effekt: Natrium: Varje brustablett innehåller 195,43 mg natrium (8,52 mmol natrium). Sackaros.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Acetylcystein Alternova 200 mg brustabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 brustablett innehåller acetylcystein 200 mg. Hjälpämnen med känd effekt: Natrium:
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Acetylcystein Alternova 200 mg brustabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 brustablett innehåller acetylcystein 200 mg. Hjälpämnen med känd effekt: Natrium:
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
ZOSTAVAX kan inte användas för att behandla befintlig bältros eller smärtan som associeras med befintlig bältros.
 BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN ZOSTAVAX Pulver och vätska till injektionsvätska, suspension i en förfylld spruta. Vaccin mot bältros ( herpes zoster), levande Läs noga igenom denna bipacksedel
BIPACKSEDEL: INFORMATION TILL ANVÄNDAREN ZOSTAVAX Pulver och vätska till injektionsvätska, suspension i en förfylld spruta. Vaccin mot bältros ( herpes zoster), levande Läs noga igenom denna bipacksedel
Zerbaxa. ceftolozan / tazobaktam. version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 EMA/513109/2015 Zerbaxa ceftolozan / tazobaktam version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen
EMA/513109/2015 Zerbaxa ceftolozan / tazobaktam version 1.2 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av en offentlig sammanfattning Detta är en sammanfattning av riskhanteringsplanen
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glucosine 625 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller glukosaminsulfat-natriumklorid-komplex motsvarande 625 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glucosine 625 mg filmdragerade tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller glukosaminsulfat-natriumklorid-komplex motsvarande 625 mg glukosamin
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Spironolakton Pfizer 25 mg tabletter Spironolakton Pfizer 50 mg tabletter Spironolakton Pfizer 100 mg tabletter
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Spironolakton Pfizer 25 mg tabletter Spironolakton Pfizer 50 mg tabletter Spironolakton Pfizer 100 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Spironolakton
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Spironolakton Pfizer 25 mg tabletter Spironolakton Pfizer 50 mg tabletter Spironolakton Pfizer 100 mg tabletter 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Spironolakton
BIPACKSEDEL. Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst
 BIPACKSEDEL Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
BIPACKSEDEL Dinalgen vet 150 mg/ml injektionsvätska, lösning, för nöt, svin och häst 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND
PRODUKTRESUMÉ. Ett gram ögonsalva innehåller fusidinsyrahemihydrat motsvarande fusidinsyra 10 mg.
 1 LÄKEMEDLETS NAMN Fucithalmic 1% ögonsalva PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram ögonsalva innehåller fusidinsyrahemihydrat motsvarande fusidinsyra 10 mg. Hjälpämne med känd
1 LÄKEMEDLETS NAMN Fucithalmic 1% ögonsalva PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Ett gram ögonsalva innehåller fusidinsyrahemihydrat motsvarande fusidinsyra 10 mg. Hjälpämne med känd
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg benzydaminhydroklorid motsvarande 2,68 mg benzydamin.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zyx apelsin & honung 3 mg sugtablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg benzydaminhydroklorid motsvarande 2,68 mg benzydamin. Hjälpämnen
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Zyx apelsin & honung 3 mg sugtablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg benzydaminhydroklorid motsvarande 2,68 mg benzydamin. Hjälpämnen
Risk Vad är känt Förebyggande möjligheter
 VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Hereditärt angioödem (HAE) är en sällsynt ärftlig sjukdom som karakteriseras av återkommande episoder av anhopning
VI.2 VI.2.1 Delområden av en offentlig sammanfattning Information om sjukdomsförekomst Hereditärt angioödem (HAE) är en sällsynt ärftlig sjukdom som karakteriseras av återkommande episoder av anhopning
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
BILAGA I PRODUKTRESUMÉ 1 Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera
PRODUKTRESUMÉ. 1 LÄKEMEDLETS NAMN Healip 10 % kräm. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram kräm innehåller 100 mg dokosanol.
 1 LÄKEMEDLETS NAMN Healip 10 % kräm PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram kräm innehåller 100 mg dokosanol. Hjälpämne: 50 mg propylenglykol per gram kräm För fullständig förteckning
1 LÄKEMEDLETS NAMN Healip 10 % kräm PRODUKTRESUMÉ 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram kräm innehåller 100 mg dokosanol. Hjälpämne: 50 mg propylenglykol per gram kräm För fullständig förteckning
4.1 Terapeutiska indikationer Behandling av seborroisk dermatit i hårbotten och pityriasis capitis (mjällbildning).
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ketoconazol Actavis 20 mg/g schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g schampo innehåller ketokonazol 20 mg För fullständig förteckning över hjälpämnen, se
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Ketoconazol Actavis 20 mg/g schampo 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g schampo innehåller ketokonazol 20 mg För fullständig förteckning över hjälpämnen, se
Hjälpämnen med känd effekt: Metylhydroxibensoat (E218): 0,72-1,44 mg (4-8 puffar) och etanol: mg (4-8 puffar)
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Coldamin 1,5 mg/ml munhålespray, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 puff av sprayen innehåller cirka 0.27 mg bensydaminhydroklorid 1 ml av sprayen innehåller
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Coldamin 1,5 mg/ml munhålespray, lösning. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 puff av sprayen innehåller cirka 0.27 mg bensydaminhydroklorid 1 ml av sprayen innehåller
Sammanfattning av riskhanteringsplanen för Cosentyx (sekukinumab)
 EMA/775515/2014 Sammanfattning av riskhanteringsplanen för Cosentyx (sekukinumab) Detta är en sammanfattning av riskhanteringsplanen för Cosentyx som beskriver åtgärder som ska vidtas för att säkerställa
EMA/775515/2014 Sammanfattning av riskhanteringsplanen för Cosentyx (sekukinumab) Detta är en sammanfattning av riskhanteringsplanen för Cosentyx som beskriver åtgärder som ska vidtas för att säkerställa
BILAGA III ÄNDRINGAR I PRODUKTRESUMÉ OCH BIPACKSEDEL
 BILAGA III ÄNDRINGAR I PRODUKTRESUMÉ OCH BIPACKSEDEL 1 ÄNDRINGAR SOM KOMMER ATT INFÖRAS I RELEVANTA AVSNITT AV PRODUKTRESUMÉN FÖR LÄKEMEDEL INNEHÅLLANDE MOXIFLOXACIN Följande text ska införas (nya avsnitt
BILAGA III ÄNDRINGAR I PRODUKTRESUMÉ OCH BIPACKSEDEL 1 ÄNDRINGAR SOM KOMMER ATT INFÖRAS I RELEVANTA AVSNITT AV PRODUKTRESUMÉN FÖR LÄKEMEDEL INNEHÅLLANDE MOXIFLOXACIN Följande text ska införas (nya avsnitt
Huddesinfektion i syfte att avdöda mikroorganismer samt förebygga infektion och/eller kolonisation.
 PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Hibiscrub 40 mg/ml kutan lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan lösning innehåller: klorhexidindiglukonat 40 mg. För fullständig förteckning
PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Hibiscrub 40 mg/ml kutan lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml kutan lösning innehåller: klorhexidindiglukonat 40 mg. För fullständig förteckning
KOGENATE Bayer 250 IE pulver och vätska till injektionsvätska, lösning.
 1. LÄKEMEDLETS NAMN KOGENATE Bayer 250 IE pulver och vätska till injektionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 2.1 Allmän beskrivning Varje injektionsflaska innehåller nominellt
1. LÄKEMEDLETS NAMN KOGENATE Bayer 250 IE pulver och vätska till injektionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 2.1 Allmän beskrivning Varje injektionsflaska innehåller nominellt
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1/31 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Meloxivet 0,5 mg/ml oral suspension för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans: Meloxikam
BILAGA I PRODUKTRESUMÉ 1/31 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Meloxivet 0,5 mg/ml oral suspension för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 ml innehåller: Aktiv substans: Meloxikam
PRODUKTRESUMÉ. Kutan behandling av acne vulgaris när komedoner, papler och pustler förekommer (se avsnitt 5.1).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Epiduo 0,1% / 2,5% gel 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller: Adapalen 1 mg (0,1%) 25 mg (2,5%) Hjälpämne: Propylenglykol. För fullständig förteckning
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Epiduo 0,1% / 2,5% gel 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g gel innehåller: Adapalen 1 mg (0,1%) 25 mg (2,5%) Hjälpämne: Propylenglykol. För fullständig förteckning
PATIENTINFORMATION FRÅN SANOFI GENZYME. Information till dig som blivit ordinerad Aubagio (teriflunomid)
 PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad Aubagio (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
PATIENTINFORMATION FRÅN SANOFI GENZYME Information till dig som blivit ordinerad Aubagio (teriflunomid) 1 Vad är multipel skleros? Denna information är avsedd för dig som har skovvis förlöpande multipel
Bipacksedel: Information till användaren
 Bipacksedel: Information till användaren Emerade 150 mikrogram injektionsvätska, lösning i förfylld injektionspenna Emerade 300 mikrogram injektionsvätska, lösning i förfylld injektionspenna Emerade 500
Bipacksedel: Information till användaren Emerade 150 mikrogram injektionsvätska, lösning i förfylld injektionspenna Emerade 300 mikrogram injektionsvätska, lösning i förfylld injektionspenna Emerade 500
OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN
 LOSATRIX 12,5 MG FILMDRAGERADE TABLETTER Datum: 8.9.2015, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
LOSATRIX 12,5 MG FILMDRAGERADE TABLETTER Datum: 8.9.2015, Version 1.0 OFFENTLIG SAMMANFATTNING AV RISKHANTERINGSPLANEN VI.2 Delområden av den offentliga sammanfattningen VI.2.1 Information om sjukdomsförekomst
BIPACKSEDEL. Versican Plus Bb Oral frystorkat pulver och vätska till oral suspension för hund
 BIPACKSEDEL Versican Plus Bb Oral frystorkat pulver och vätska till oral suspension för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN
BIPACKSEDEL Versican Plus Bb Oral frystorkat pulver och vätska till oral suspension för hund 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN
Ambirix är avsett till icke immuna barn och ungdomar från 1 till och med 15 års ålder för skydd mot hepatit A- och hepatit B-infektion.
 1. LÄKEMEDLETS NAMN Ambirix, injektionsvätska Hepatit A- (inaktiverat) och hepatit B- (rdna) vaccin (adsorberat). 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 dos (1 ml) innehåller: Hepatit A-virus (inaktiverat)
1. LÄKEMEDLETS NAMN Ambirix, injektionsvätska Hepatit A- (inaktiverat) och hepatit B- (rdna) vaccin (adsorberat). 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 dos (1 ml) innehåller: Hepatit A-virus (inaktiverat)
BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL. Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid
 BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer
BILAGA III RELEVANTA AVSNITT AV PRODUKTRESUMÉ OCH BIPACKSEDEL Anm.: Dessa ändringar av produktresumén och bipacksedeln gäller vid tidpunkten för kommissionens beslut. Efter kommissionens beslut kommer
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Xiapex 0,9 mg pulver och vätska till injektionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska med pulver innehåller 0,9
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN Xiapex 0,9 mg pulver och vätska till injektionsvätska, lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje injektionsflaska med pulver innehåller 0,9
För användning på hud. Krämen appliceras med ett rent finger på det påverkade hudområdet.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectatone 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectatone kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol. För fullständig
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Vectatone 1 % kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 gram Vectatone kräm innehåller 10 mg penciklovir. Hjälpämnen med känd effekt: cetostearylalkohol. För fullständig
Hjälpämnen med känd effekt: Laktosmonohydrat motsvarande mg vattenfri laktos per tablett.
 1. LÄKEMEDLETS NAMN Lyngonia, filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje filmdragerad tablett innehåller: 361 509 mg extrakt (som torrt extrakt) från Arctostaphylos uva-ursi
1. LÄKEMEDLETS NAMN Lyngonia, filmdragerade tabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje filmdragerad tablett innehåller: 361 509 mg extrakt (som torrt extrakt) från Arctostaphylos uva-ursi
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Glukosamin Pharma Nord 400 mg, hårda kapslar 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller glukosaminsulfat-kaliumkloridkomplex motsvarande 400 mg glukosamin
BIPACKSEDEL FÖR Procamidor vet. 20 mg/ml injektionsvätska, lösning
 BIPACKSEDEL FÖR Procamidor vet. 20 mg/ml injektionsvätska, lösning Läkemedelsverket 2013-11-07 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN
BIPACKSEDEL FÖR Procamidor vet. 20 mg/ml injektionsvätska, lösning Läkemedelsverket 2013-11-07 1. NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN
Till dig som behandlas med PLENADREN (hydrokortisontabletter med modifierad frisättning)
 Till dig som behandlas med PLENADREN (hydrokortisontabletter med modifierad frisättning) Information om ersättningsbehandling med hydrokortison vid binjurebarksvikt. VIKTIGT Den här guiden ersätter inte
Till dig som behandlas med PLENADREN (hydrokortisontabletter med modifierad frisättning) Information om ersättningsbehandling med hydrokortison vid binjurebarksvikt. VIKTIGT Den här guiden ersätter inte
Bipacksedel: Information till patienten
 Bipacksedel: Information till patienten Otezla 10 mg filmdragerade tabletter Otezla 20 mg filmdragerade tabletter Otezla 30 mg filmdragerade tabletter apremilast Detta läkemedel är föremål för utökad övervakning.
Bipacksedel: Information till patienten Otezla 10 mg filmdragerade tabletter Otezla 20 mg filmdragerade tabletter Otezla 30 mg filmdragerade tabletter apremilast Detta läkemedel är föremål för utökad övervakning.
KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Echinagard, sugtabletter 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 sugtablett innehåller 88,5 mg torkad pressaft från Echinacea purpurea (L.) Moench (röd solhatt)
Varje ml oral lösning innehåller 100 mg deferipron (25 g deferipron i 250 ml och 50 g deferipron i 500 ml).
 1. LÄKEMEDLETS NAMN Ferriprox 100 mg/ml oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml oral lösning innehåller 100 mg deferipron (25 g deferipron i 250 ml och 50 g deferipron i 500
1. LÄKEMEDLETS NAMN Ferriprox 100 mg/ml oral lösning 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje ml oral lösning innehåller 100 mg deferipron (25 g deferipron i 250 ml och 50 g deferipron i 500
Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat, cetostearylalkohol, propylenglykol.
 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Karbamid Evolan 50 mg/g kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g kräm innehåller karbamid (urea) 50 mg. Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat,
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Karbamid Evolan 50 mg/g kräm 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 g kräm innehåller karbamid (urea) 50 mg. Hjälpämnen med känd effekt Etylparahydroxibensoat, metylparahydroxibensoat,
PRODUKTRESUMÉ. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller 250 mg Saccharomyces boulardii stam CNCM I-745 (frystorkad).
 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Precosa 250 mg hårda kapslar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller 250 mg Saccharomyces boulardii stam CNCM I-745 (frystorkad). Hjälpämne med
PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Precosa 250 mg hårda kapslar 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 kapsel innehåller 250 mg Saccharomyces boulardii stam CNCM I-745 (frystorkad). Hjälpämne med
Bipacksedel: Information till användaren. Vexol 10 mg/ml ögondroppar, suspension rimexolon
 Bipacksedel: Information till användaren Vexol 10 mg/ml ögondroppar, suspension rimexolon Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig
Bipacksedel: Information till användaren Vexol 10 mg/ml ögondroppar, suspension rimexolon Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig
BILAGA I PRODUKTRESUMÉ
 BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Versican Plus DHPPi frystorkat pulver och vätska till injektionsvätska, suspension, för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
BILAGA I PRODUKTRESUMÉ 1 1. DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN Versican Plus DHPPi frystorkat pulver och vätska till injektionsvätska, suspension, för hund 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
